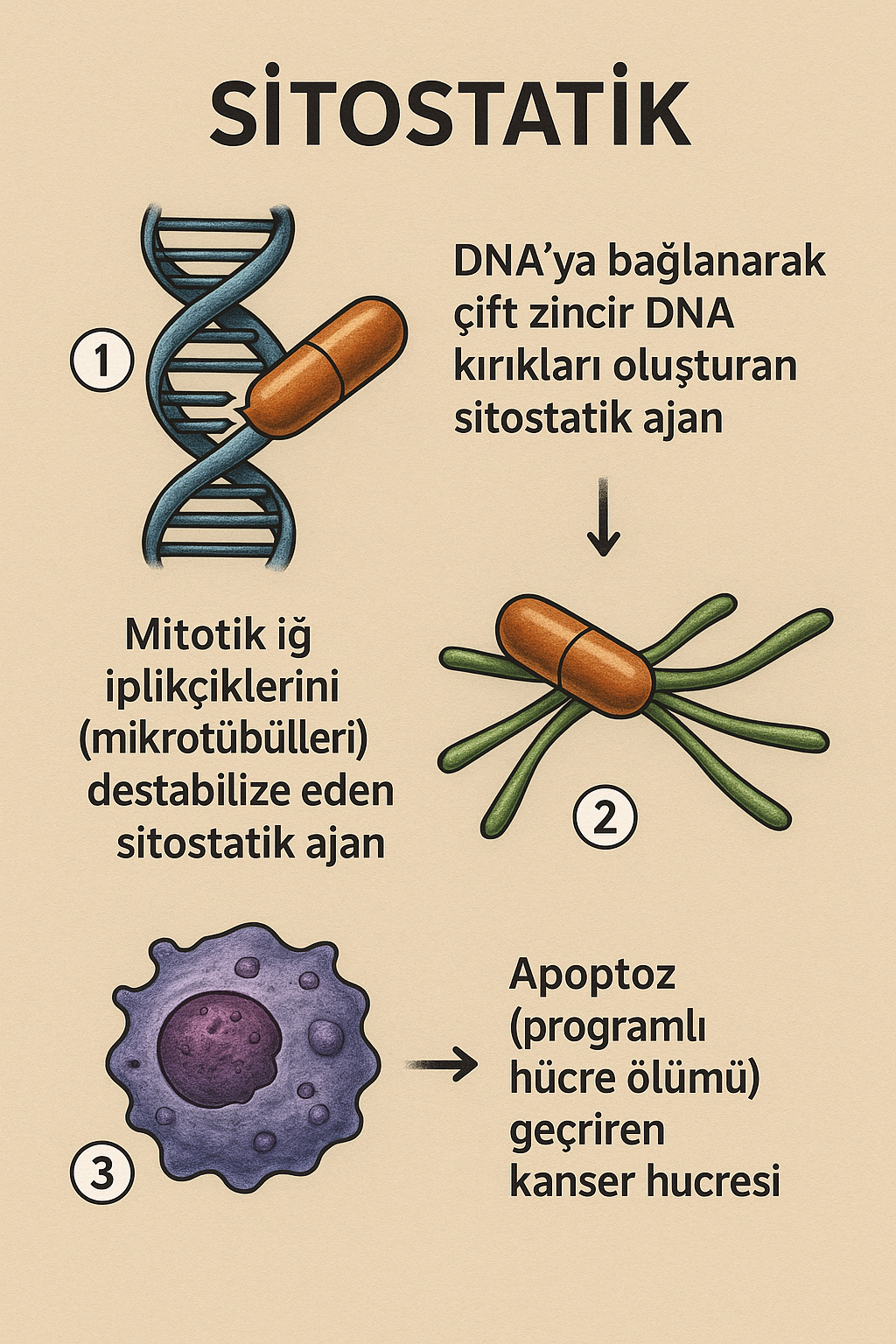
1. Başlangıç: Savaşın Gölgesinde Bir Tesadüf (1917–1940)
Sitostatiklerin keşfi, klasik anlamda laboratuvar çalışmalarıyla değil, savaşın acımasız tesadüfleriyle başlamıştır. I. Dünya Savaşı sırasında 1917’de Belçika’nın Ypres kentinde kullanılan mustard gazı (hardal gazı; sülfür mustard), düşman askerlerinin derisinde kabarcıklar, akciğerlerinde ise ölümcül ödemlere neden olmuştu. Ancak tıbbi çevreler asıl şaşırtıcı bilgiyi yıllar sonra fark edecekti: Bu gazdan etkilenen askerlerde lenf nodlarının küçüldüğü ve kemik iliğinde ciddi baskılanma görüldüğü tespit edildi.
Bu gözlem, 1940’ların başında II. Dünya Savaşı döneminde Amerikalı farmakologlar Louis Goodman ve Alfred Gilman tarafından yeniden gündeme getirildi. Yale Üniversitesi’nde çalışan bu iki bilim insanı, mustard gazının bu sıra dışı etkisinin kan hücrelerini baskılamasından kaynaklandığını düşünerek, bu bileşiğin kimyasal olarak değiştirilmiş bir formu olan nitrogen mustard üzerine çalışmalar başlattılar. Bu maddeyi, hayvan modellerinde lenfoma hücrelerine karşı denediler ve başarılı sonuçlar elde ettiler.
Ancak en dramatik deney, 1942 yılında Hartford Hastanesi’nde gerçekleştirildi. Adı gizli tutulan ve ileri evre lenfoma tanısı almış bir hastaya intravenöz olarak nitrogen mustard uygulanmış, sonuçlar o dönemin bilim dünyasında sarsıcı etki yaratmıştı: Tümör gerilemişti. Bu olay, kemoterapötik sitostatiklerin modern tarihindeki ilk klinik uygulama olarak kabul edilir.
II. Dünya Savaşı sonrası dönemde ABD’de kurulan National Cancer Institute (NCI), bu ilk başarıdan yola çıkarak sistematik bir anti-kanser madde araştırma programı başlattı. Bu dönemde biyokimyanın hızla gelişmesi, DNA ve RNA sentezine dair bilgilerle birleşerek yeni bir ilaç sınıfının doğmasını sağladı: Antimetabolitler.
1948 yılında Sidney Farber adlı Amerikalı bir pediatrist, çocukluk çağı lösemilerinde, folik asit antagonistleri kullanmayı önerdi. Bu deneysel ilaç, aminopterin, DNA sentezi için gerekli olan folat metabolizmasını bloke ederek lösemik hücrelerin bölünmesini durduruyordu. Farber’in Boston Children’s Hospital’da yaptığı bu çalışmalar, akut lösemi tedavisinde antimetabolitlerin etkili olabileceğini gösterdi. Bu başarının ardından, 1950’li yıllarda metotreksat geliştirilmiş ve klinik kullanımda yerini almıştır.
3. Doğal Kaynaklara Yöneliş: Bitkiler, Bakteriler ve Toprak (1955–1975)
1950’lerin sonlarından itibaren araştırmacılar dikkatlerini doğadaki potansiyel anti-kanser ajanlara çevirdiler. Bu kapsamda toprak bakterilerinden elde edilen antibiyotiklerin bazı türlerinin yalnızca bakterileri değil, aynı zamanda kanser hücrelerini de öldürebildiği keşfedildi.
- Actinomycin D, 1954 yılında Selman Waksman’ın öğrencileri tarafından izole edildi ve DNA’ya bağlanarak transkripsiyonu inhibe ettiği gösterildi.
- 1960’larda doksorubisin ve daunorubisin, Streptomyces türü bakterilerden elde edildi ve hızla klinik kemoterapide yer buldu.
Aynı dönemde bitkisel alkaloidler, özellikle Madagaskar pervinkası (Catharanthus roseus) üzerine yapılan etnobotanik araştırmalar sayesinde keşfedildi. 1958 yılında Kanada’da Robert Noble ve Charles Beer tarafından izole edilen vinkristin ve vinblastin, mitotik iğ aparatını bozarak hücre bölünmesini durduruyordu. Bu ilaçlar, özellikle hematolojik kanserlerin tedavisinde devrim yarattı.
4. İnorganik Kimyanın Zaferi: Platin Türevleri (1965–1980)
1965 yılında Michigan Üniversitesi’nde çalışmakta olan biyofizikçi Barnett Rosenberg, elektrotlarla elektrik alanı altında bakteriyel hücre bölünmesi üzerine çalışırken, elektrottan salınan platin iyonlarının bakterilerin bölünmesini durdurduğunu fark etti. Bu gözlem, daha sonra sisplatin adıyla bilinen ilacın geliştirilmesine yol açtı.
Sisplatin, DNA zincirleri arasında çapraz bağlar oluşturarak replikasyonu engellemekteydi. 1978 yılında FDA onayı alarak testis kanseri, over kanseri ve mesane kanseri tedavisinde kullanılmaya başlandı. Bu ilaç, özellikle metastatik testis kanserinde neredeyse %90’lara varan kür sağlama oranı ile kemoterapinin en büyük başarılarından biri kabul edilir.
5. Modern Dönem: Hedefe Yönelik Tedavilere Geçiş (1990–Günümüz)
1990’lardan itibaren klasik sitostatiklerin yerini giderek hedefe yönelik tedaviler ve immünoterapötik ajanlar almaya başlamış olsa da, sitostatikler hâlâ pek çok kemoterapi rejiminin temel taşıdır. Bu dönemde:
- Daha az toksik, daha seçici sitostatikler geliştirilmeye çalışılmış,
- Kombinasyon kemoterapileri standardize edilmiş,
- Farmakogenetik analizlerle kişiselleştirilmiş doz ayarlamaları mümkün hale gelmiştir.
Ayrıca liposomal taşıyıcılar, nanoparçacık sistemleri ve konjugat ilaçlar gibi modern farmasötik teknolojilerle sitostatiklerin hedefe yönelimi artırılmış ve sistemik toksisiteleri azaltılmaya çalışılmıştır.
2000’li ve 2010’lu yıllar, klasik sitostatik anlayışının yeniden şekillendiği, hücresel hedeflere ve bireyselleştirilmiş tedavi yaklaşımlarına odaklanan bir paradigma değişimine sahne olmuştur. Ancak bu dönem yalnızca “hedefe yönelik” ve “biyolojik” ajanların yükselişi ile değil, klasik sitostatik ilaçların farmakodinamiklerinin yeniden tanımlanması, ilaç taşıyıcı sistemlerdeki yenilikler, farmakogenetik uygulamalar, kombinasyon rejimlerinin rafine edilmesi ve sitotoksik-immünoterapi hibrit yaklaşımlarının gelişmesiyle de karakterize edilir.
Aşağıda, 2000’li ve 2010’lu yıllarda öne çıkan ve sitostatik ilaçların kullanımını doğrudan etkileyen gelişmeler ayrıntılı ve kronolojik olarak sunulmuştur:
6. 2000’li Yıllarda Öne Çıkan Gelişmeler
6.1. Farmakogenetik Devrim: Uygun Hastaya, Uygun Doz
2000’li yılların başında farmakogenetik (bireysel genetik varyasyonlara dayalı tedavi planlaması), sitostatik ilaçların toksisitesini ve etkinliğini öngörmek açısından önemli bir araç hâline gelmiştir. Özellikle aşağıdaki sitostatik ajanlar için genetik polimorfizm testleri klinik pratiğe girmiştir:
- 5-Fluorourasil (5-FU):
DPD (dihidropirimidin dehidrogenaz) gen mutasyonları, bu ilacın toksik birikimine yol açabileceğinden, DPYD genotiplemesi önerilmiştir.
- Irinotekan:
UGT1A1 genindeki **28 polimorfizmi, ilacın metabolizmasını etkiler ve özellikle nötropeni riskini artırır. Bu nedenle UGT1A1 gen analizi doz ayarlaması için önemli hâle gelmiştir.
Bu gelişmeler, “herkese aynı kemoterapi” anlayışının yerine, kişiselleştirilmiş sitostatik doz ayarlaması dönemini başlatmıştır.
6.2. Liposomal ve Nanopartikül Taşıyıcı Sistemler
2000’li yılların ortalarında, sitostatiklerin hedef dışı toksisitesini azaltmak ve biyoyararlanımlarını artırmak amacıyla taşıyıcı sistemlerde büyük yenilikler yaşanmıştır. Bu alandaki en dikkat çekici gelişme:
- Lipozomal doksorubisin (Doxil®, Caelyx®):
Polietilen glikol (PEG) ile kaplanmış lipozomal yapılar, ilacın dolaşım süresini uzatırken, tümör vaskülarizasyonuna geçişini kolaylaştırarak sağlıklı dokulara olan toksisitesini azaltmıştır (özellikle kardiyotoksisite).
Bu teknoloji, sitostatik ajanların hedefli taşınması açısından ilk somut örnek olarak tarihe geçmiştir.
6.3. Kombinasyonların Yeniden Tasarımı
Klasik sitostatiklerin birbirleriyle ve biyolojik ajanlarla rasyonel kombinasyonları 2000’li yıllarda sistematikleşmiştir. Örnekler:
- FOLFOX (5-FU + Lökoverin + Oksaliplatin): Kolorektal kanser tedavisinde standartlaştırılmıştır.
- CHOP + Rituksimab: Non-Hodgkin lenfomada, sitostatik rejime biyolojik ajan entegre edilmiştir.
Bu dönemde monoterapiden çoklu tedavi stratejilerine geçiş, sitostatiklerin yalnızca destekleyici değil, merkezî tedavi ajanı olmaya devam etmesini sağlamıştır.
7. 2010’lu Yıllarda Öne Çıkan Gelişmeler
7.1. İmmüno-sitotoksik Hibrit Yaklaşımlar
2010’lu yıllarda, klasik sitostatiklerin immün sistemle olan etkileşimi üzerine yapılan çalışmalar, bu ajanların yalnızca hücre öldürücü değil, aynı zamanda immunojenik hücre ölümü (ICD) indükleyebileceğini göstermiştir.
- Antrasiklinler (ör. doksorubisin) ve oksaliplatin, tümör hücresinin immün sistem tarafından tanınmasına olanak sağlayan DAMP (damage-associated molecular patterns) salınımını uyarır.
- Bu durum, sitostatiklerle PD-1/PD-L1 blokajları gibi immünoterapötik ajanların senkronize kullanımı fikrini doğurmuştur.
Bu hibrit yaklaşım, günümüzde halen yürütülmekte olan çok sayıda klinik faz çalışmasının temelini oluşturur.
7.2. Antibody-Drug Conjugates (ADC): Sitostatiklerin Akıllı Hâli
Bu on yıl içinde, monoklonal antikorlar ile sitostatik ajanların birleştirilmesiyle oluşturulan ADC (antikor-ilaç konjugatları), klasik sitostatiklere yeni bir hayat kazandırmıştır.
- Trastuzumab emtansin (T-DM1): HER2+ meme kanserinde kullanılan bu ADC, trastuzumab’a bağlı toksik bir sitostatik olan DM1‘i tümör hücresine spesifik olarak ulaştırır.
- Brentuximab vedotin: CD30 pozitif Hodgkin lenfoma ve anaplastik lenfomalarda kullanılır.
Bu stratejiyle sitostatik ilaçlar, “akıllı taşıyıcılarla” hedefe yönlendirilerek sistemik toksisite azaltılmış, etkinlik artırılmıştır.
7.3. Sitotoksiklerin İkinci Baharı: Yeniden Dozlama Stratejileri
2010’lu yıllarda, düşük doz, metronomik kemoterapi kavramı gelişmiştir. Bu yaklaşımda:
- Sitostatikler düşük dozda, sürekli veya kısa aralıklarla verilir.
- Amaç tümör anjiyogenezini baskılamak, bağışıklık sistemini modüle etmek ve kemoterapiye direnç gelişimini azaltmaktır.
Bu yöntem, özellikle yaşlı veya çoklu komorbid hastalarda klasik yüksek doz kemoterapilerin tolere edilemediği durumlarda yeni bir umut olarak öne çıkmıştır.
7.4. Sitostatiklerin Mikrobiyota ile Etkileşimi
Bu dönemde bazı sitostatiklerin, bağırsak mikrobiyotasını değiştirdiği ve bunun hem tedavi etkinliğini hem de toksisite profilini etkilediği gösterilmiştir. Örneğin:
- Siklofosfamid, belirli bakterilerin translokasyonunu uyararak tümörle ilişkili immün yanıtı artırabilir.
- Oksaliplatin’in nörotoksisitesinin mikrobiyota modülasyonu ile azaltılabileceği saptanmıştır.
Bu gelişmeler, onko-mikrobiyom kavramının doğmasına yol açmıştır.
8. COVID-19 Pandemisi ve Kemoterapi: Direnç, Gecikme ve Dönüşüm (2020–2021)
COVID-19 pandemisi, sitostatik kemoterapi uygulamalarını doğrudan etkileyen ilk büyük global olay olmuştur:
- Bağışıklık baskılayıcı etkileri nedeniyle sitostatik alan hastalar SARS-CoV-2 enfeksiyonuna karşı daha duyarlı bulunmuştur.
- Bu nedenle kemoterapi rejimlerinde geçici doz azaltmaları, rejim değişiklikleri ve hatta tedavi ertelemeleri yaşanmıştır.
- Aynı zamanda evde uygulanabilecek oral sitostatiklerin önemi artmış, örneğin kapesitabin gibi ajanlara geçiş hızlanmıştır.
Bunun sonucunda, özellikle onkohematoloji alanında tedavi algoritmaları daha bireysel risk değerlendirmesi esasına göre güncellenmiştir.
8.1. Yapay Zekâ ve Sistem Biyolojisi: Sitostatik Kombinasyonların Yeniden Tanımlanması (2021–2023)
Geleneksel olarak ampirik şekilde oluşturulan kemoterapi kombinasyonları, 2020’li yıllarda yapay zekâ algoritmaları ve sistem biyolojisi modelleri ile yeniden tasarlanmaya başlanmıştır:
- Deep learning modelleri, tümörün mutasyon profiline göre en uygun sitostatik kombinasyonu tahmin edebilir hâle gelmiştir.
- MIT ve Broad Institute tarafından geliştirilen algoritmalar, yüzlerce sitostatik ve hedefe yönelik ajan kombinasyonunu in silico tarayarak en etkin eşleşmeleri belirleyebilmektedir.
Bu gelişme, rasyonel ve kişiselleştirilmiş kemoterapi dönemi için yeni bir sayfa açmıştır.
8.3. Organ-on-Chip Teknolojisi: Sitostatiklerin Hücre Dışı Etkilerinin Modelleştirilmesi (2021–2024)
Laboratuvar ortamında geliştirilen “organ-on-chip” sistemleri, sitostatik ilaçların yalnızca hücre düzeyindeki değil, organ ve mikroçevre düzeyindeki etkilerini de simüle etmeye olanak tanımıştır:
- Özellikle karaciğer ve bağırsak çipleri, sitostatik hepatotoksisite ve mukozit riskini daha önceden tespit etmede kullanılmaya başlanmıştır.
- Tümör mikroçevresiyle etkileşim, artık yalnızca hayvan modelleri ile değil, bu mikrokanallı sistemlerle daha hızlı ve etik olarak test edilebilmektedir.
Bu teknoloji, sitostatik dozlarının bireysel farklılıklara göre daha rafine ayarlanmasının önünü açmıştır.
8.4. Mikrobiyota–Kemoterapi Etkileşiminin Klinik Uygulamaya Girişi (2022–günümüz)
Daha önce deneysel düzeyde bilinen mikrobiyota–sitostatik etkileşimleri, 2020’li yıllarda klinik kararları etkileyen biyobelirteç düzeyine ulaşmıştır:
- Özellikle floropirimidin ve irinotekan kullanan hastalarda, belirli bakteriyel türlerin (örneğin Enterococcus faecalis, Clostridium scindens) kemoterapi toksisitesini artırabildiği gösterilmiştir.
- Klinik protokollerde, kemoterapi öncesinde fekal mikrobiyota profili analiz edilerek doz ayarlama veya probiyotik/prebiyotik destek planlanması önerilmeye başlanmıştır.
Bu gelişmeler, onkolojide “onko-mikrobiyom” kavramının tedavi algoritmalarına entegrasyonunu başlatmıştır.
8.5. Sitotoksik İmmünojenik Ajanslar ve Yeni Nesil Antibody-Drug Conjugates (ADC) (2022–2025)
2020’li yılların en heyecan verici gelişmelerinden biri, sitostatik ajanların immünojenik hücre ölümü potansiyelinin patentli teknolojilere dönüşmesidir:
- Trastuzumab derukstekan (Enhertu®) gibi yeni nesil ADC’ler, HER2+ kanserlerde klasik sitotoksik ajanı hedefli olarak taşırken aynı zamanda immün aktivasyonu da tetiklemektedir.
- DS-8201, geleneksel sitostatikten daha düşük dozda dahi etkili olabilen yüksek “bystander effect” gösteren yeni nesil linker teknolojisine sahip bir ajandır.
- İmmünojenik ölümün hedeflenmesi, artık yalnızca bağışıklık sistemini değil, tümör mikroçevresini de yeniden yapılandırmak anlamına gelmektedir.
8.6. Sentetik Biyoloji ve Sitostatik Kodlayan Mikroorganizmalar (2023–günümüz)
Sentetik biyoloji alanındaki çığır açıcı gelişmelerle birlikte, sitotoksik ajanları in vivo sentezleyen genetik olarak modifiye edilmiş bakteriler üzerine klinik öncesi çalışmalar başlatılmıştır:
- E. coli Nissle 1917 gibi probiyotik şasiler, genetik olarak programlanarak tümör bölgesinde lokal sitostatik üretimi yapılabilmektedir.
- Bu yöntemle sistemik toksisite minimuma indirilirken, tümör lokalitesine etkili kemoterapi sağlanabilmektedir.
Henüz faz I aşamasında olmakla birlikte, bu teknolojiler, sitostatiklerin gelecekte “biyolojik olarak kodlanmış ilaçlar” hâline gelmesinin öncülüdür.