- doğal immun sistemi hücreleri tarafından algılanan bir yabancı maddeyi algıladıktan sonra;
-mediator ların salınımı, diğer iltihap hücrelerini uyarma gerçekleşir.
-vasodilatation ve perme yeteneği artımı sayesinde kolaylaşır.
-dendritik hücreler ek olarak antijeni alır ve lenf düğümlerindeki t hücreleri aktive edilir ve immun bir cevabın oluşumu sağlanır.
Kompleman sistemi
Sinonim: Komplement sistemi, tamamlayıcı sistem, complement system, Komplementsystem
spesifik olmayan savunma sisteminin bir parçasıdır.
-20 den fazla çeşit protein katılır.
aktive olma;
-klasik yol; immun komplex sayesinde.
-lektin yolu; uyarıcı tarafından lektin ile yükleme.
alternatif yol; devamlı kompleman aktive olursa, düzenleyici protein kendi hücresini kontrol eder, yani durdurur.
fonksiyon;
-patojenlerin sindirilmesi tam anlamıyla aktive olur.
-opsonisierung, phagozyt sayesinde alım kolaylaşır.
-iltihaplanmalar, kompleman sisteminin ürettiği yarık üretimi , iltihap hücrelerini cezbeder.
Antikor
1. Etimoloji ve kavramsal çerçeve
“Antikor” terimi, tarihsel olarak antikorp, anticorps biçimlerinden türemiştir. Fransızca anti (“karşı”) ve corps (“vücut, gövde”) birleşimi anticorps, “vücuda karşı” ya da daha teknik anlamıyla “vücuda zarar veren yapılara karşı oluşan madde” anlamını taşır. Bu terim, Türkçeye antikor olarak, Almancaya Antikörper, İngilizceye ise antibody (anti + body) şeklinde geçmiştir.
“İmmünoglobulin” ise daha betimleyici, biyokimyasal bir addır:
- İmmüno-: Bağışıklık sistemi ile ilişkili,
- Globulin: Serum protein fraksiyonlarından birini oluşturan, küresel yapıdaki (globüler) proteinler.
Dolayısıyla antikor, proteinin işlevine atıf yaparken; immünoglobulin, proteinin yapısal ve biyokimyasal niteliğini vurgular. Klinik pratikte ikisi çoğu zaman eş anlamlı kullanılır; ancak bağışıklık sistemindeki bazı immünoglobulinlerin antijen bağlama işlevi bozulmuş veya “işlevsiz” olabilir. Örneğin bir immünositomada üretilen monoklonal immünoglobulinler, yapısal olarak immünoglobulin olmakla birlikte tam işlevli “antikor” gibi davranmayabilir.
Serum protein elektroforezinde immünoglobulinlerin büyük kısmı γ (gamma) globulin fraksiyonunda yer alır. “Gamma globulin” teriminin kökeni de buradan gelir; immünoglobulinler, elektroforetik hareketliliklerine göre albumin, α, β ve γ globulinler arasında γ fraksiyonunda yoğun olarak bulunur.
2. Tarihsel perspektif: Antikor kavramının doğuşu
- ve 20. yüzyılın başlarında seroloji deneyleri, bazı serumların belirli toksinleri ya da bakterileri nötralize edebildiğini ortaya koydu. Paul Ehrlich’in “yan-zincir (side-chain) teorisi”, hücrelerin yüzeyindeki reseptörlerin (yan zincirlerin) antijenle etkileşime girip, ardından seruma salındığını öne sürerek antikor kavramının teorik temelini attı.
1950’ler ve 1960’larda
- Gerald Edelman ve
- Rodney Porter,
bağımsız çalışmalarla antikor molekülünün temel yapısını çözdüler: iki ağır zincir ve iki hafif zincirden oluşan, disülfit bağlarıyla bir arada tutulan Y-şeklinde bir glikoprotein. Bu yapının aydınlatılması, değişken (V) ve sabit (C) bölgelerin ayrımını ve antijen bağlama bölgelerinin konumunu netleştirdi.
1975’te Köhler ve Milstein, tek bir B hücresinden türetilen, özdeş antikor molekülleri üreten monoklonal antikor teknolojisini geliştirdiler. Bu buluş, antikorların sadece fizyolojik bir savunma aracı değil, aynı zamanda tanı ve tedavide güçlü biyoteknolojik araçlar olduğunu gösterdi.
3. Temel tanım: Antikor nedir?
Antikorlar, ya da biyokimyasal adıyla immünoglobulinler,
- B lenfositlerinden köken alan plazma hücreleri tarafından sentezlenen,
- glikoprotein yapısında,
- özgül olarak antijen adı verilen yabancı moleküllere bağlanabilen,
- adaptif (edinilmiş) bağışıklık sisteminin merkezi efektör molekülleridir.
Bu antijenler; bakteri, virüs, parazit, mantar, toksin ya da vücudun kendi yapıları (otoantijenler) olabilir. Antikorlar, antijene bağlanarak onu doğrudan nötralize eder, fagositozu kolaylaştırır, kompleman sistemini aktive eder ve hücresel efektör mekanizmaları (örneğin NK hücreleri aracılığıyla antikora bağlı hücre aracılı sitotoksisite) tetikler.
4. Moleküler yapı: Y-şeklindeki glikoprotein
4.1. Ağır ve hafif zincirler
Klasik bir antikor molekülü:
- İki özdeş ağır (heavy, H) zincir
- İki özdeş hafif (light, L) zincir
olmak üzere toplam dört polipeptit zincirinden oluşur. Bu zincirler:
- Disülfit bağları (–S–S–)
- Hidrofobik etkileşimler
- İyonik ve hidrojen bağları
ile bir arada tutulur ve antikora karakteristik Y şeklini kazandırır.
Her zincir:
- Bir değişken (V: variable) bölge,
- Bir veya daha fazla sabit (C: constant) bölge
içerir.
Hafif zincirler:
- 1 değişken (VL) + 1 sabit (CL) bölge
Ağır zincirler: - 1 değişken (VH) + 3 veya 4 sabit (CH1, CH2, CH3, bazı izotiplerde CH4) bölge içerir.
Her bir ağır zincirin değişken bölgesi yaklaşık 110 amino asit kadardır; hafif zincirin değişken ve sabit bölgeleri de benzer uzunluktadır. Ağır zincirin sabit bölgesi ise izotipe bağlı olarak yaklaşık 330–440 amino asit içerir.
4.2. Fab ve Fc bölgeleri
Antikor molekülü fonksiyonel olarak üç ana parçaya ayrılabilir:
- Fab (Fragment antigen-binding):
Y-şeklindeki molekülün “kolları“dır. Her Fab parçası:- Bir VH + bir CH1 (ağır zincirden)
- Bir VL + bir CL (hafif zincirden)
içerir. Antijen bağlama bölgesi (paratop), Fab fragmanının uç kısmında VH–VL çiftinin oluşturduğu bölgede yer alır.
- Fc (Fragment crystallizable):
Y-şeklindeki molekülün “gövdesi“dir. Ağır zincirlerin sabit bölgelerinden (CH2, CH3 ± CH4) oluşur. Fc kısmı,- Kompleman proteinlerine,
- Fç reseptörlerini taşıyan fagositlere, NK hücrelerine ve diğer bağışıklık hücrelerine
- Hinge (menteşe) bölgesi:
Fab ile Fc arasında yer alan, esneklik sağlayan kısa bir peptit segmenttir. Bu bölge sayesinde antikor, antijenlere farklı açılarda bağlanabilecek şekilde “kollarını” oynatabilir.
4.3. Değişken bölge ve özgüllük
Değişken bölgelerde, özellikle Tamamlayıcı Belirleyici Bölgeler (CDR1, CDR2, CDR3) olarak adlandırılan kısa segmentler, antijenin belirli bir epitopu ile yüksek özgüllükte bağlanmayı sağlar. Her antikor klonu için bu bölgelerin aminoasit dizilimi benzersizdir; bu da muazzam bir antikor çeşitliliği doğurur.
5. Hafif zincirler: κ ve λ ve klinik önemi
İnsanlarda iki tür hafif zincir bulunur:
- κ (kappa)
- λ (lambda)
Her antikor molekülü ya iki κ ya da iki λ hafif zincir taşır; aynı antikor içinde κ ve λ birlikte bulunmaz. Normal koşullarda kanda belirli bir κ/λ oranı (yaklaşık 1–2 civarında, laboratuvara göre değişen referans aralığıyla) gözlenir.
5.1. Serbest hafif zincirler ve monoklonal gammopatiler
Plazma hücrelerinin neoplastik çoğalmasına yol açan hastalıklarda:
- Multipl miyelom,
- Waldenström makroglobulinemisi,
- Bazı B hücreli lenfomalar,
tek bir klona ait immünoglobulin ya da hafif zincir aşırı üretilir. Bu durumda:
- Serum ve/veya idrarda serbest hafif zincirler (çoğunlukla “Bence Jones proteinleri” olarak) artar.
- Serum serbest hafif zincir testi, kappa ve lambda serbest hafif zincir düzeylerini ve κ/λ oranını ölçerek monoklonal hafif zincir üretimini ortaya koyar.
Bu artışlar böbreklerde birikerek:
- Hafif zincir birikim hastalığı,
- AL tipi amiloidoz (hafif zincir kaynaklı amiloid birikimi),
gibi durumlara yol açabilir ve böbrek, kalp gibi organlarda fonksiyon bozukluğu meydana getirebilir.
Burada altı çizilmesi gereken nokta şudur:
“Hafif zincir antikoru”, klasik anlamda ayrı bir antikor sınıfı değildir; ancak hafif zincirlerin serbest hale geçmesi, monoklonal proliferasyonun önemli bir biyobelirteci ve patojenik bir faktördür.
6. Nanobody’ler ve tek alanlı antikorlar: Kavram karmaşasını düzeltmek
Metinde geçen “hafif zincir antikorları” ifadesi, modern biyoteknoloji literatüründe sıklıkla tek alanlı antikorlar (single-domain antibodies) ve özellikle nanobody kavramıyla karışır.
Gerçekte:
- Nanobody’ler, devegillerde (lama, alpaka, deve) bulunan, yalnızca ağır zincir taşıyan antikorlardan (heavy-chain only antibodies) türetilen tek değişken alanlı (VHH) antikor fragmanlarıdır.
- Köpekbalıkları gibi bazı kıkırdaklı balıklarda da ağır zincir ağırlıklı özel antikor sınıfları (örneğin IgNAR) vardır.
Bu moleküller:
- Klasik IgG’den çok daha küçük,
- Tek bir değişken domen (tek “bağlanma modülü”) içeren,
- Doku penetrasyonu iyi,
- Rekombinant olarak kolay üretilebilen
özgül bağlanma molekülleridir. Bunlara literatürde “single-domain antibody”, “VHH antibody” veya popüler adıyla “nanobody” denir; ancak bunlar “hafif zincir” değil, ağır zincir kaynaklı domenlerdir.
Dolayısıyla:
- İnsandaki klasik antikorlar iki ağır + iki hafif zincir içerir.
- Nanobody’ler, belirli türlerde bulunan ağır zincirli antikorların tek değişken bölgesidir.
Bu ayrım, kavramsal netlik açısından önemlidir.
7. İmmünoglobulin sınıfları: IgG, IgA, IgM, IgD, IgE
İnsan immünoglobulinlerinin ağır zincir sabit regiõesundaki yapısal farklılıklar, beş ana izotipi oluşturur:
- IgG (γ ağır zincir)
- IgA (α ağır zincir)
- IgM (µ ağır zincir)
- IgD (δ ağır zincir)
- IgE (ε ağır zincir)
7.1. IgG
- Serumdaki en bol immünoglobulindir.
- Plasentadan aktif transportla fetüse geçen tek antikor sınıfıdır; böylece fetüse ve yenidoğana pasif bağışıklık sağlar.
- Opsonizasyon, nötralizasyon ve kompleman aktivasyonu gibi işlevlerde çok etkilidir.
- Birkaç alt sınıfa ayrılır (IgG1, IgG2, IgG3, IgG4); her birinin kompleman aktivasyonu, reseptör afinitesi ve antijen tipine göre farklı rolleri vardır.
7.2. IgA
- Serumda monomer, mukozal yüzeylerde (solunum, gastrointestinal, genitoüriner mukozalar) ve sekresyonlarda (tükürük, gözyaşı, anne sütü) çoğunlukla dimer formundadır.
- “Sekretuvar IgA”, mukozal epitelden geçerken eklenen sekretuvar bileşen sayesinde proteolitik yıkıma dirençlidir.
- Mukoza bariyerinde patojenlerin adezyonunu engelleyerek ilk savunma hattı rolü oynar.
- Anne sütüyle bebeğe geçen IgA, özellikle yenidoğanın gastrointestinal sistemini korur.
7.3. IgM
- B hücrelerinin yüzeyinde monomer olarak,
- Serumda ise çoğunlukla pentamer olarak bulunur.
- Birincil immün yanıtta ilk üretilen immünoglobulindir.
- Pentamerik yapısı sayesinde kompleman sistemini güçlü biçimde aktive eder.
7.4. IgD
- B hücrelerinin yüzeyinde, IgM ile birlikte reseptör olarak bulunur.
- Serum düzeyleri düşüktür.
- B hücresi aktivasyonunda ve tolerans mekanizmalarında rol oynadığı düşünülmektedir.
7.5. IgE
- Serumda konsantrasyonu düşük olmasına rağmen biyolojik etkisi son derece güçlüdür.
- Mast hücreleri ve bazofiller üzerindeki Fcε reseptörlerine bağlanır; antijenle çapraz bağlandığında bu hücrelerden histamin vb. mediyatörlerin salınmasına yol açar.
- Bu mekanizma,
- Alerjik reaksiyonların (tip I hipersensitivite)
- Helmint gibi makroparazitlere karşı savunmanın
temelini oluşturur.
8. Genetik ve moleküler temel: V(D)J rekombinasyonu ve çeşitlilik
Her antikorun özgüllüğünü belirleyen değişken bölge, somatik gen yeniden düzenlenmesi ile oluşur:
- Hafif zincir genleri: V (variable), J (joining) segmentleri
- Ağır zincir genleri: V, D (diversity), J segmentleri
B lenfosit gelişimi sırasında:
- RAG1 ve RAG2 enzimleri, V, D, J segmentlerini DNA düzeyinde kesip birleştirerek benzersiz bir V(D)J kombinasyonu oluşturur.
- Ek olarak, bağlantı bölgelerinde nükleotid eklenmesi/çıkarılması (junctional diversity) ile çeşitlilik katlanarak artar.
- Antijenle karşılaşma sonrası germinal merkezlerde somatik hipermutasyon ve afinite maturasyonu gerçekleşir; bu sayede antijenine daha sıkı bağlanan B klonları seçilir.
- Aynı V bölgesi, farklı ağır zincir sabit bölgeleri ile eşleşerek sınıf değişimi (class switch recombination) yapabilir (örneğin IgM → IgG, IgA, IgE). Bu süreç, AID (Activation-Induced Cytidine Deaminase) gibi enzimler aracılığıyla yürütülür.
Sonuçta tek bir organizma, teorik olarak milyonlarca farklı antikor özgüllüğü üretebilecek kapasiteye sahip olur.
9. Evrimsel bakış: Antikorların kökeni
Adaptif bağışıklık ve immünoglobulin benzeri reseptörler, özellikle çeneli omurgalılarda (gnathostomata) gelişmiştir.
- Bu grupta klasik V(D)J rekombinasyonuna dayalı immunoglobulin sistemi bulunur.
- Çenesiz omurgalılarda (agnatha) ise, immünoglobulin yerine “variable lymphocyte receptor (VLR)” adı verilen, farklı bir çeşitlilik mekanizmasına dayanan reseptörler geliştirilmiştir.
Devegiller ve kıkırdaklı balıklar gibi bazı türlerde ortaya çıkan:
- Yalnız ağır zincirli antikorlar,
- Özgün ağır zincir izotipleri (örneğin IgNAR),
immunoglobulin süper ailesinin evrimsel esnekliğini ve tekrar tekrar “yeniden keşfedilmiş” özgül antijen tanıma çözümlerini göstermektedir. Buna karşın, temel immunoglobulin domeni (Ig domain) mimarisi son derece korunmuş olup nöronal adezyon molekülleri gibi bağışıklık dışı proteinlerde de kullanılır.
10. B hücresi yanıtı: Üretim ve hafıza
10.1. Antijenle ilk karşılaşma
Bir antijen vücuda girdiğinde:
- Antijen, antijen sunan hücreler (dendritik hücreler, makrofajlar) tarafından işlenir ve MHC molekülleriyle T yardımcı hücrelere sunulur.
- Bu süreçte T bağımlı antijenler için B hücre aktivasyonu, T yardımcı hücrelerden gelen sitokinler ve kostimülasyonla güçlenir.
- Antijenle özgül B hücreleri, lenfoid organlarda (lenf nodu, dalak) aktive olur.
10.2. Plazma hücresi ve bellek B hücresi
Aktive olan B hücreleri:
- Kısa ömürlü veya uzun ömürlü plazma hücrelerine farklılaşarak büyük miktarda antikor üretir,
- Aynı zamanda bellek B hücreleri oluşturarak uzun süreli bağışıklığın temelini atar.
İlk antijen karşılaşmasında IgM ağırlıklı bir yanıt gözlenirken, daha sonraki yanıtlar:
- Daha hızlıdır,
- Afinite olarak daha güçlü antikorlardan oluşur,
- Genellikle IgG, IgA veya IgE izotipleri baskındır.
Bu fark, primer ve sekonder immün yanıt ayrımının temelini oluşturur.
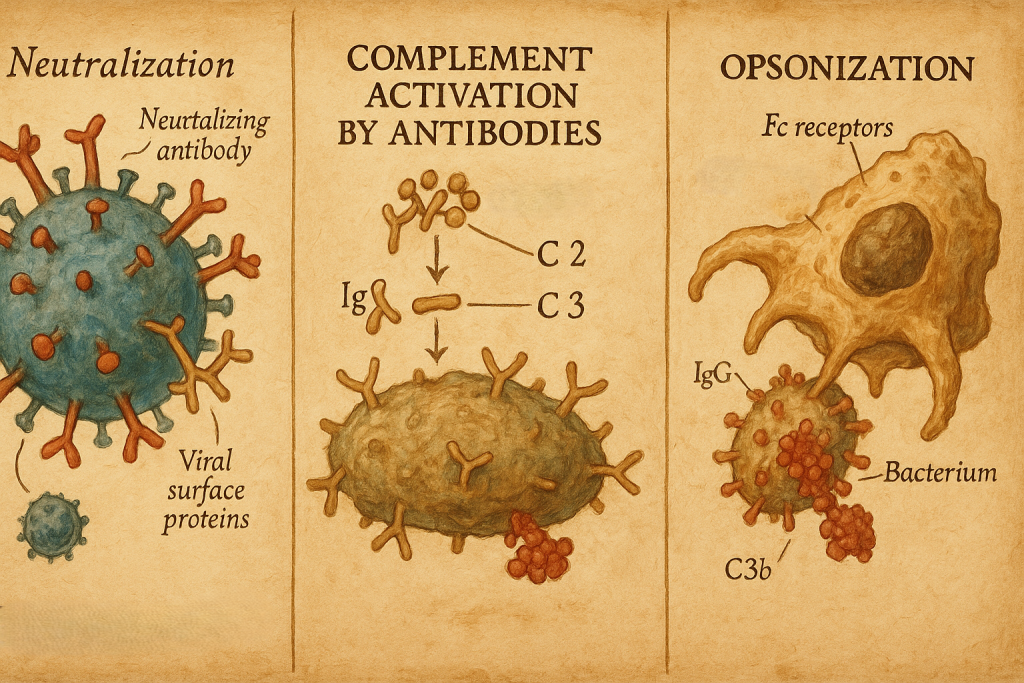
11. Antikorların biyolojik işlevleri
Antikorlar antijenlere bağlanarak bir dizi efektör mekanizmayı tetikler:
- Nötralizasyon
- Virüslerin hücre reseptörlerine bağlanmasını engeller,
- Bakteriyel toksinleri nötralize eder.
- Opsonizasyon
- Antikorla kaplanmış patojenler, makrofaj ve nötrofillerdeki Fc reseptörleri tarafından daha kolay tanınır ve fagosite edilir.
- Kompleman aktivasyonu
- Özellikle IgM ve bazı IgG alt tipleri, klasik kompleman yolunu aktive ederek:
- Patojenlerin lizisini,
- Opsonizasyonu,
- İnflamatuvar hücrelerin çekilmesini sağlar.
- Özellikle IgM ve bazı IgG alt tipleri, klasik kompleman yolunu aktive ederek:
- Antikora bağlı hücresel sitotoksisite (ADCC)
- NK hücreleri ve bazı efektör hücreler, hedef hücre üzerindeki antikora bağlanarak sitotoksik yanıt oluşturur.
- İmmün kompleks oluşumu
- Çözünür antijenlerle kompleks oluşturan antikorlar, antijenlerin uzaklaştırılmasını kolaylaştırır; ancak fazlalığı patolojik kompleks birikimlerine (örneğin bazı vaskülit ve glomerülonefritlerde) yol açabilir.
12. Klinik uygulamalar ve laboratuvar değerlendirmeleri
12.1. Serum protein elektroforezi ve immünoglobulin düzeyleri
- Serum protein elektroforezi, albumin ile α, β, γ globulin fraksiyonlarını ayırt etmeye yarar.
- γ fraksiyonundaki artış genellikle immünoglobulin artışını (poli- veya monoklonal gammopati) düşündürür.
- Toplam IgG, IgA, IgM düzeyleri, bağışıklık fonksiyonu, immün yetmezlikler ve kronik inflamatuvar durumların değerlendirilmesinde kullanılır.
12.2. Monoklonal gammopatiler
- Multipl miyelom,
- MGUS (Monoclonal Gammopathy of Undetermined Significance),
- Waldenström makroglobulinemisi gibi hastalıklarda tek klonal bir immünoglobulin veya hafif zincir artışı söz konusudur.
- Serum ve idrarda immünofiksasyon elektroforezi, serbest hafif zincir analizi ve κ/λ oranı tanı ve takibi yönlendirir.
12.3. İmmün yetmezlikler
Bazı primer immün yetmezliklerde:
- Toplam immünoglobulin düzeyleri düşük olabilir (örneğin X’e bağlı agammaglobulinemi, yaygın değişken immün yetmezlik – CVID).
- Selektif IgA eksikliği, toplumda en sık görülen primer immün yetmezliklerden biridir ve mukozal savunma defektine yol açar.
Bu hastalarda tekrarlayan enfeksiyonlar ve bazı otoimmün ya da allerjik tablolar sık görülür.
12.4. Otoimmün hastalıklar ve otoantikorlar
Antikorlar, bazen vücudun kendi yapılarını hedef alan otoantikorlar haline gelebilir:
- Romatoid faktör, anti-CCP,
- ANA, anti-dsDNA,
- Anti-TPO gibi otoantikorlar,
otoimmün hastalıkların tanısında önemli biyobelirteçlerdir.
12.5. Terapötik immünoglobulin ve monoklonal antikorlar
- İntravenöz immünoglobulin (IVIG) tedavisi, primer ve sekonder immün yetmezliklerde eksik antikor yanıtını desteklemek için kullanılır; ayrıca bazı otoimmün ve inflamatuvar hastalıklarda immün modülasyon amacıyla da uygulanır.
- Rekombinant monoklonal antikorlar, onkoloji (örneğin lenfomalar, solid tümörler), romatoloji (örneğin TNF inhibitörleri), nöroimmün hastalıklar ve enfeksiyon hastalıklarında hedefe yönelik tedavilerin merkezinde yer alır.
- Bispesifik antikorlar ve antikor-parça temelli ilaçlar (Fab fragmanları, nanobody’ler vb.), farmakokinetik ve hedefleme özellikleri açısından giderek daha stratejik araçlara dönüşmüştür.
13. Maternal-fetal ve neonatal bağışıklık
- IgG, plasentadaki Fc reseptörleri aracılığıyla anneden fetüse aktif olarak taşınır. Bu sayede fetüs, anne tarafından karşılaşılmış patojenlere karşı hazır antikorlarla doğar.
- Doğumdan sonra anne sütüyle geçen sekretuvar IgA, özellikle gastrointestinal mukozayı korur ve yenidoğanın enfeksiyonlara karşı savunmasını güçlendirir.
Bu mekanizmalar, bağışıklık sisteminin henüz tam olgunlaşmadığı erken yaşam döneminde pasif bağışıklığı sağlar.
14. Patolojik boyut: Alerji, immün yetmezlik ve amiloidoz
- Alerjik hastalıklarda, IgE aracılı mast hücre degranülasyonu, rinitten astıma ve anafilaksiye kadar geniş bir yelpazede klinik tablolara neden olur.
- İmmün yetmezliklerde, uygun immünoglobulin yanıtının olmaması tekrarlayan enfeksiyonlar ve bazı maligniteler için zemin hazırlar.
- Amiloidozda, özellikle hafif zincir kaynaklı AL amiloidoz, dokularda fibriller birikim oluşturarak kalp, böbrek ve periferik sinir sisteminde ağır hasara yol açabilir.
- İmmün kompleks hastalıkları, antijen–antikor komplekslerinin damar duvarları veya glomerüllerde birikmesi sonucu vaskülit ve glomerülonefrit gibi klinik tablolara yol açabilir.
Bu örnekler, antikorların yalnızca koruyucu değil, aynı zamanda patojenik roller de üstlenebileceğini gösterir.
Keşif
20. yüzyılın başında, Berlin’de çalışan genç bir patolog olan Paul Ehrlich, boyalarla deneyler yaparak hücreleri renklendirmeyi seviyordu. Bir yandan da zihninde giderek netleşen bir fikri vardı: Eğer bazı kimyasal maddeler belirli hücre yapılarına seçici olarak bağlanabiliyorsa, neden aynı prensip enfeksiyon etkenleri için de geçerli olmasın? Bu düşünce onu, daha sonra “antikor” ve “sihirli mermi (magic bullet)” kavramlarına götürecek olan yan-zincir teorisine hazırlıyordu.
Ehrlich, Metchnikoff ve bağışıklık biliminin doğuşu
Ehrlich, difteri ve tetanoz gibi hastalıklara karşı serum tedavileri üzerinde çalışan Emil von Behring ile aynı dönemde çalışıyordu. Behring’in “antitoksin” serumları klinikte hayat kurtarırken, Ehrlich bu antitoksinlerin hücre düzeyinde nasıl ortaya çıktığını anlamaya odaklandı. 1897 civarında formüle ettiği yan-zincir teorisi, hücre yüzeyinde “yan zincir” dediği reseptörlerin bulunduğunu, toksinlerin (antijenlerin) bu reseptörlere bağlandığını, hücrenin de kendini korumak için bu reseptörlerden fazladan üretip seruma saldığını öne sürüyordu. Bu seruma salınan reseptörler, bugün antikor dediğimiz moleküllerin kavramsal karşılığıydı.
Bu sırada, Rus kökenli zoolog Élie Metchnikoff, bütünüyle başka bir cepheden bağışıklık sorununa yaklaşıyordu. O, vücut savunmasının merkezine hücreleri –özellikle fagositleri– yerleştiren fagositik teoriyi savunuyordu. Deniz canlılarından böceklere kadar pek çok tür üzerinde yaptığı karşılaştırmalı çalışmalarla, fagositozun enfeksiyonla savaşta temel bir olay olduğunu gösteriyordu.
Bu iki bakış açısı –Ehrlich’in “humoral” antikor merkezli yaklaşımı ve Metchnikoff’un “hücresel” fagosit teorisi– o dönemde sert tartışmalara yol açmış olsa da, bugün biliyoruz ki her ikisi de doğrudur ve birbirini tamamlar: Hücreler antikor üretir, antikorlar ise sıvı fazda patojenleri nötralize eder ve fagositozu kolaylaştırır. 1908’de Nobel Fizyoloji veya Tıp Ödülünün Metchnikoff ve Ehrlich’e birlikte verilmesi, bağışıklığın bu iki yüzünün de bilimsel meşruiyet kazandığı anı simgeler.
Antikorun görünmeyen molekülden somut yapıya dönüşmesi
20. yüzyılın ilk yarısında antikorlar hâlâ “serumdaki görünmez koruyucu faktörler” olarak algılanıyordu. Karl Landsteiner, küçük kimyasal haptenlerle yaptığı deneylerle antikor özgüllüğünün inanılmaz inceliğini, neredeyse atom düzeyinde farkları seçebildiğini gösterdi. Michael Heidelberger ve Oswald Avery gibi araştırmacılar, antikorların gerçekten protein olduklarını nicel kimyasal analizlerle ortaya koydular.
1940’larda Arne Tiselius ve Elvin Kabat, serum proteinlerini elektroforez ile ayırdıklarında, antikorların büyük ölçüde gamma globulin fraksiyonunda yoğunlaştığını gösterdiler; “γ-globulin” ve “immünoglobulin” kavramlarının klinikte yerleşmesinde bu çalışmaların payı büyüktü.
Asıl büyük sıçrama ise 1950–1960’lı yıllarda geldi. Gerald Edelman ve Rodney Porter, farklı proteolitik enzimler ve kimyasal indirgeme yöntemleri kullanarak antikor molekülünü parçalara ayırdılar. Bu parçaların bir kısmı antijene bağlanma özelliğini korurken, bir kısmı kristalleşme eğilimi gösteriyordu. Böylece Fab (antijen bağlayan) ve Fc (kristallenebilir, efektör) fragmanları tanımlandı; disülfit bağlarıyla birbirine bağlanan iki ağır ve iki hafif zincirden oluşan Y-şekilli yapı deneysel olarak doğrulandı. Bu çalışmalar, antikor mimarisinin modern anlamda anlaşılmasının temelini oluşturdu ve 1972’de Edelman ve Porter’a Nobel Ödülü kazandırdı.
Bu dönem aynı zamanda, multipl miyelomlu hastaların serumlarında bulunan tek tip, anormal immünoglobulinlerin –paraproteinlerin– antikor yapısını incelemek için benzersiz bir model olduğunun anlaşıldığı dönemdi. Hastaların serumunda tek bir klona ait homojen antikor bulunduğu için, bu molekülü saflaştırmak ve değişken/sabit bölgeleri, ağır/hafif zincir ilişkilerini çözümlemek çok daha kolaydı. Paraproteinler, antijen bağlama bölgelerinin çeşitliliğini ve özgüllüğünü anlamak için adeta bir “doğal monoklonal antikor kütüphanesi” işlevi gördü.
Kohler, Milstein, Jerne ve hibridoma devrimi
1970’lere gelindiğinde, antikorun yapısı artık iyi tanımlanmıştı; ancak en büyük pratik sorun devam ediyordu: Belirli bir antijene özgü, tek klondan gelen (monoklonal) antikorları, sınırsız ve standartlaştırılmış şekilde üretmek mümkün değildi. Fareleri immunize edip serum toplamak, hep çok sayıda farklı B hücresinin ürünü olan poliklonal karışımlar veriyor; bunlar deneysel olarak kullanışlı olsa da tanısal ve terapötik amaçlar için yeterli homojenlik ve sürdürülebilirlik sağlamıyordu.
İşte bu noktada, 1975 yılında, Cambridge’de çalışan Georges Köhler ve César Milstein, çığır açan bir fikirle ortaya çıktılar. Bir yanda, belirli bir antijene karşı özgül antikor üreten fakat kültürde sınırlı ömürlü olan B lenfositleri vardı. Diğer yanda, sonsuz bölünebilen ama antikor üretmeyen miyelom hücreleri. Eğer bu iki hücre birleştirilirse, ortaya hem ölümsüz hem de tek bir özgüllükte antikor üreten bir hücre hattı çıkabilirdiç
Bu füzyon hücrelerine hibridoma adı verildi; terimi, daha sonra Leonard Herzenberg’in kullandığı bilinir. Hibridomalar:
- Farede belirli bir antijenle immunizasyon sonrası seçilmiş B hücrelerinden türediği için tek bir epitopa özgül,
- Miyelom bileşeni sayesinde kültürde süresiz çoğalabilen,
hücresel “antikor fabrikaları” idi. Böylece ilk kez monoklonal antikorlar endüstriyel ölçekte, standartlaştırılmış, saf ve teorik olarak sınırsız miktarda üretilebilir hale geldi. Bu buluşun bağışıklık bilimi ve tıptaki etkisi o kadar büyüktü ki, Köhler ve Milstein, bu alana teorik katkılar yapan Niels K. Jerne ile birlikte 1984’te Nobel Fizyoloji veya Tıp Ödülü’nü aldılar.
Başlangıçta bu monoklonal antikorlar daha çok:
- Hücre yüzeyi belirteçlerini tanımlamak,
- Lenfosit alt gruplarını ayırt etmek,
- Moleküler hedefleri işaretlemek
gibi temel araştırma amaçları için kullanıldı. Ancak kısa sürede tanı kitleri, görüntüleme ajanları ve terapötik moleküller için de ideal adaylar oldukları anlaşıldı.
Gregory Winter ve antikor mühendisliğinin doğuşu
Hibridoma teknolojisinin ilk nesil ürünleri, çoğunlukla tamamen fare kökenli antikorlardı. Bunlar insan hastalara verildiğinde, insan bağışıklık sistemi bu antikorları “yabancı protein” olarak tanıyıp anti-fare antikorlar geliştirebiliyor, bu da tedavinin etkinliğini azaltıyor ve yan etkilere yol açıyordu.
1980’lerin ortasında, Cambridge’de yine Milstein’in yakın çevresinde çalışan Gregory Winter, bu sorunu çözmek için protein mühendisliğini devreye soktu. Fikir basit, uygulaması son derece sofistikeydi: Fare monoklonal antikorun antijen bağlayan değişken bölgelerini koruyup, geriye kalan sabit bölgeleri insan immünoglobulin dizileriyle değiştirmek. Böylece antikor molekülünün büyük kısmı “insan” olacak, yalnızca antijen özgüllüğünü belirleyen küçük bir fare segmenti kalacaktı.
Bu yaklaşım, önce kimerik, sonra daha da ileri gidilerek humanize antikorların geliştirilmesini sağladı. Humanize antikorlar:
- İmmünojeniteleri belirgin şekilde azalmış,
- Dolaşımda kalış süreleri uzamış,
- Tekrarlayan dozlara daha uygun
hale geldiler. Özellikle enfeksiyon hastalıkları, otoimmün bozukluklar ve kanser için tasarlanan monoklonal antikorların klinik kullanımının önünü açan kritik adım buydu. Gregory Winter, bu alanı daha da ileri götürerek faj display ile tamamen insan antikor kütüphanelerinden özgül antikor seçimi tekniklerini geliştirdi; bu çalışmalar, 2018’de Nobel Kimya Ödülü ile ödüllendirildi.
Bu süreçte ortaya çıkan antikorlardan bazıları –örneğin TNF-α’ya karşı geliştirilen adalimumab gibi– hem romatolojik hastalıkların hem de farmasötik pazarın gidişatını değiştiren “blokbuster” ilaçlar haline geldi.
Antikorlar klinikte: Pasif immünizasyondan hedefe yönelik terapilere
Antikorların klinik kullanımı, aslında çok daha eskiye, Behring’in antitoksin serumlarına kadar gider; bu, modern anlamda pasif immünizasyonun başlangıcıdır. Günümüzde de:
- Tetanoz toksoidine maruziyet,
- Kuduz temas profilaksisi,
- Hepatit B’ye maruziyet,
gibi durumlarda immünoglobulin preparatları, hızlı ama geçici koruma sağlamak için kullanılır. Bu ürünler, çoklu donör serumlarından saflaştırılmış poliklonal antikor karışımlarıdır.
Monoklonal antikor çağıyla beraber, antikorlar artık yalnızca “koruyucu” değil, aynı zamanda hassas cerrah gibi davranan terapötik ajanlara dönüştüler. Romatoid artrit, psöriazis, inflamatuar bağırsak hastalığı, multipl skleroz gibi otoimmün ve inflamatuar hastalıklarda:
- TNF-α, IL-6, IL-17 gibi sitokinlere,
- CD20 gibi B hücre yüzey belirteçlerine,
- Adhezyon moleküllerine
karşı geliştirilen monoklonal antikorlar, hastalığın seyrini kökten değiştirebildi.
Kanserle savaşta antikor devrimi: checkpointler, ADC’ler, bispesifikler
Onkolojide antikor temelli tedaviler birkaç dalga halinde ortaya çıktı:
- Hedefe yönelik klasik antikorlar
HER2-pozitif meme kanserinde trastuzumab gibi antikorlar, tümör hücresi üzerindeki özgül reseptörleri bloke ederek hücre proliferasyonunu durdurur ve immün efektör mekanizmalarını harekete geçirir. - İmmün kontrol noktası (checkpoint) inhibitörleri
CTLA-4, PD-1, PD-L1 gibi molekülleri hedefleyen antikorlar, T hücrelerinin üzerindeki “frenleri” kaldırarak, tümöre karşı bağışıklık yanıtını yeniden etkinleştirir. Bu grup ajanlar, melanomdan akciğer kanserine, mesane kanserinden pek çok solid tümöre kadar onkoloji pratiğini köklü biçimde değiştirdi; immünoterapinin simgesi haline geldi. - Antikor–ilaç konjugatları (ADC)
Burada antikor, kemoterapi alanında bir “güdümlü füze” gibi kullanılır: Antikor, yalnızca tümör hücresindeki hedef reseptöre bağlanır; bu antikora kimyasal bağla eklenmiş sitotoksik ilaç içeri girer ve tümör hücresini içeriden öldürür. Trastuzumab emtansine veya trastuzumab derukstekan gibi örnekler, özellikle meme kanseri alanında güçlü klinik sonuçlar göstermiştir. Güncel çalışmalar, bispesifik ADC’ler ile hem tümör seçiciliğini artırmayı hem de direnç mekanizmalarını aşmayı hedeflemektedir. - Bispesifik antikorlar
Bu antikorlar, bir koluyla tümör hücresindeki antijene, diğer koluyla T hücrelerindeki CD3 gibi moleküllere bağlanarak iki hücreyi fiziksel olarak yakınlaştırır ve T hücresinin tümörü öldürmesini tetikler. Hem hematolojik neoplazilerde hem de solid tümörlerde bispesifik antikorların sayısı hızla artmaktadır.
Antikorlar yalnız başına değil, CAR-T hücreleri gibi ileri hücre tedavilerinin tasarımında da merkezî rol oynar; çünkü CAR reseptörlerinin antijen tanıyan kısmı, antikorların tek zincirli değişken fragmanlarından (scFv) türetilir. Böylece antikor teknolojisi, hücresel immünoterapinin mimarisine de damgasını vurmuş olur.
Güncel ufuklar: tam insan antikor kütüphaneleri, mRNA ve yapay zekâ destekli tasarım
- yüzyılda antikor geliştirme alanındaki yenilikler, hikâyeyi daha da ileri taşıyor:
- Faj display ve buna benzer görüntüleme (display) teknolojileri, geniş insan antikor kütüphanelerinden “en uygun” bağlayıcıların seçilmesine olanak tanıyor.
- Tamamen insanlaştırılmış veya “fully human” antikorlar, immünojeniteyi daha da azaltarak kronik kullanıma daha uygun hale geliyor.
- Kombinasyon tedavileri, monoklonal antikorları kontrol noktası inhibitörleri, küçük moleküller, CAR-T hücreleri veya radyonüklidlerle birleştirerek daha kalıcı yanıtlar elde etmeye çalışıyor.
- Yeni nesil bispesifik antikorlar ve bispesifik ADC’ler, tek seferde birden fazla hedefi vurarak tümör heterojenliğini aşmaya, aynı zamanda toksisiteyi sınırlamaya aday görünüyor.
- Büyük farmasötik ve biyoteknoloji şirketleri, bispesifik ve yeni nesil antikorlar etrafında milyar dolarlık iş birlikleri kurarak, antikorların ilaç geliştirme dünyasındaki merkezî konumunu daha da güçlendiriyor.
Bugün, Ehrlich’in “sihirli mermi” diye hayal ettiği şey, aslında onlarca farklı antikor sınıfı, yüzlerce onaylı ve aday molekül, karmaşık kombinasyon protokolleri ve kişiselleştirilmiş tedavi stratejileri halinde karşımızda duruyor.
Bir yüzyıl önce mikroskop başında düşündüğü “belirli bir kimyasalın belirli bir hücreyi seçerek vurabileceği” fikri, önce yan-zincir teorisiyle kağıda döküldü; sonra Edelman ve Porter’ın deney tüplerinde somut bir Y’ye dönüştü; Milstein ve Köhler’in hücre kültürlerinde ölümsüzleşti; Winter’ın laboratuvarında insanlaştırıldı ve fajların üzerinde yeniden yazıldı. Bugün ise aynı temel prensip, tetanoz immün globulini enjektöründen, checkpoint inhibitörü infüzyon setine, bispesifik ADC taşıyan damardan ve CAR-T hücresinin yüzeyindeki scFv’den, farklı ama akraba dillerle konuşmaya devam ediyor.
İleri Okuma
- Landsteiner, K. (1933). The Specificity of Serological Reactions. Harvard University Press.
- Tiselius, A., & Kabat, E. A. (1939). An Electrophoretic Study of Immune Sera and Purified Antibody Preparations. Journal of Experimental Medicine, 69, 119–131.
- Heidelberger, M., & Avery, O. T. (1940’lar). The Soluble Specific Substance of Pneumococcus. Journal of Experimental Medicine, çeşitli makaleler dizisi.
- Porter, R. R. (1959). The Hydrolysis of Rabbit Gamma-Globulin and Antibodies with Crystalline Papain. Biochemical Journal, 73, 119–126.
- Edelman, G. M. (1959). Protein Chemistry of Antibodies. Chemical Reviews, 59, 549–569.
- Edelman, G. M., & Gally, J. A. (1962). The Nature of Bence Jones Proteins and Their Relationship to Light Chains of Gamma-Globulins. Journal of Experimental Medicine, 116, 207–227.
- Milstein, C., & Edelman, G. M. (1965). The Covalent Structure of Immunoglobulins. Science, 150, 905–909.
- Kabat, E. A., & Wu, T. T. (1971). Variability in Antibody Complementarity-Determining Regions. Journal of Biological Chemistry, 246, 4461–4476.
- Jerne, N. K. (1974). Towards a Network Theory of the Immune System. Annales d’Immunologie, 125C, 373–389.
- Köhler, G., & Milstein, C. (1975). Continuous Cultures of Fused Cells Secreting Antibody of Predefined Specificity. Nature, 256, 495–497.
- Tonegawa, S. (1976). Somatic Generation of Antibody Diversity. Nature, 259, 593–597.
- Alt, F. W., et al. (1982). V(D)J Recombination in B Cells. Science, 218, 675–679.
- Morrison, S. L., Johnson, M. J., Herzenberg, L. A., & Oi, V. T. (1984). Chimeric Human–Mouse Antibodies. Proceedings of the National Academy of Sciences, 81, 6851–6855.
- Jones, P. T., et al. (1986). Replacing the Complementarity-Determining Regions of a Human Antibody with Those from a Mouse. Nature, 321, 522–525.
- Riechmann, L., Clark, M., Waldmann, H., & Winter, G. (1988). Humanization of Monoclonal Antibodies. Nature, 332, 323–327.
- McCafferty, J., et al. (1990). Phage Display of Peptide Libraries. Nature, 348, 552–554.
- Hamers-Casterman, C., et al. (1993). Naturally Occurring Antibodies with Heavy-Chain Only. Nature, 363, 446–448.
- Reichert, J. M. (2005). Monoclonal Antibody Successes in the Clinic. Nature Biotechnology, 23, 1073–1078.
- Carter, P. J. (2006). Potent Antibody Therapeutics. Nature Reviews Immunology, 6, 343–357.
- Chames, P., et al. (2009). Therapeutic Antibodies: Successes, Limitations, and Future Hopes. British Journal of Pharmacology, 157, 220–233.
- Hodi, F. S., et al. (2010). Anti–CTLA-4 Antibody Therapy in Melanoma. New England Journal of Medicine, 363, 711–723.
- Slamon, D. J., et al. (2011). Trastuzumab Emtansine in HER2-Positive Cancer. Journal of Clinical Oncology, 29, 398–405.
- Topalian, S. L., et al. (2012). Safety, Activity, and Immune Correlates of Anti–PD-1 Antibody in Cancer. New England Journal of Medicine, 366, 2443–2454.
- Muyldermans, S. (2013). Nanobodies: Natural Single-Domain Antibodies. Annual Review of Biochemistry, 82, 775–797.
- Drake, P. M., et al. (2014). Antibody–Drug Conjugates: Harnessing Antibodies for Drug Delivery. Nature Reviews Drug Discovery, 13, 933–946.
- Kontermann, R. E., & Brinkmann, U. (2015). Bispecific Antibodies. Drug Discovery Today, 20, 838–847.
- Sharma, P., & Allison, J. P. (2015). The Future of Immune Checkpoint Therapy. Science, 348, 56–61.
- Pardi, N., et al. (2018). mRNA Vaccines and Antibody Responses. Nature Reviews Immunology, 18, 261–280.
- Cao, Y., et al. (2020). De Novo Design of Antibody Binding Using Deep Learning. Nature, 580, 561–566.
- Liu, L., et al. (2022). AI-Based Antibody Discovery Pipelines. Nature Biotechnology, 40, 1273–1285.
Kaynakça:
- Janeway CA Jr, Travers P, Walport M, et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
- Murphy K, Weaver C. Janeway’s Immunobiology. 9th edition. New York: Garland Science; 2017.
- Katzmann, J. A., Dispenzieri, A., Kyle, R. A., Snyder, M. R., Plevak, M. F., Larson, D. R., … & Rajkumar, S. V. (2005). Elimination of the need for urine studies in the screening algorithm for monoclonal gammopathies by using serum immunofixation and free light chain assays. Mayo Clinic Proceedings, 80(12), 1575-1578.
- Bradwell, A. R., Carr-Smith, H. D., Mead, G. P., Tang, L. X., Showell, P. J., Drayson, M. T., & Drew, R. (2001). Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clinical chemistry, 47(4), 673-680.
Lenf dolaşımı
Lenf Sıvısının Dolaşımı ve Lenfatik Sistem Damarlarının Morfolojik Özellikleri
Lenf sıvısı, dokular arası boşluklardan (interstisyel aralıklar) kaynaklanan ve plazma benzeri bir içerikle zenginleşmiş, hücrelerarası sıvıdan türeyen renksiz bir sıvıdır. Vücutta homeostazın korunması, bağışıklık hücrelerinin taşınması ve dokular arasında sıvı dengesi sağlanmasında temel bir rol oynayan lenf sıvısı, karmaşık fakat düzenli bir dolaşım ağı içerisinde hareket eder. Bu dolaşım ağına lenfatik sistem adı verilir ve sistem, kılcal lenf damarları ile başlar, giderek kalınlaşan damarlarla devam eder ve nihayetinde iki ana kanal aracılığıyla venöz dolaşıma katılır.
Lenfatik dolaşımın başlangıç noktası olan kılcal lenf damarları (vas capillare lymphaticum), histolojik olarak kendilerine özgü birkaç belirgin özelliğe sahiptir. Bu damarlar, klasik kan kapillerlerinden farklı olarak hem yapısal hem de işlevsel bakımdan adaptif özellikler taşır. Duvarları:
- Kiremit tarzında (imbrike dizilimli), çok katlı gibi görünen ama gerçekte tek katlı ve yassı (skuamöz) endotelyal hücrelerden oluşur. Bu hücreler, birbirlerine sıkı bağlantılarla değil, üst üste binerek gevşek bir bağlantı sistemi kurar; bu sayede yüksek geçirgenlik sağlanır.
- Bazal lamina (bazal membran) ya hiç yoktur ya da oldukça parçalı ve disorganize haldedir. Bu özellik, büyük moleküllerin ve hatta hücrelerin bile bu damarlar aracılığıyla lenf sistemine girmesine olanak tanır.
- Ayrıca, bu kılcal damarların çevresi, ankor proteinlerle çevredeki bağ dokusuna sabitlenmiştir. Bu yapılar, doku içi basınç arttığında damarların açık kalmasını sağlar ve sıvının içeri dolmasını kolaylaştırır.
Kılcal lenf damarlarında toplanan lenf sıvısı, daha büyük çaplı prekollektör ve kolektör lenf damarlarına doğru yönlendirilir. Bu damarlar, duvar yapılarında düz kas lifleri içerir ve içlerinde valv adı verilen tek yönlü kapakçıklarla geri akımı engeller. Son olarak, lenf sistemi iki ana terminal kanalda sonlanır:
- Ductus thoracicus sinister (Torakal kanal – sol lenfatik kanal): Vücuttaki en büyük lenf damarıdır. Diyaframın altından, cisterna chyli’den (şilöz sisterna) başlar ve toraks boyunca yukarı doğru ilerleyerek sol vena subclavia ile sol vena jugularis interna’nın birleştiği açıya (angulus venosus sinister) dökülür. Görevi, alt ekstremitelerden, abdomen ve toraksın sol yarısından, sol kol ve baş-boyun bölgesinden gelen lenf sıvısını sistemik dolaşıma taşımaktır.
- Ductus thoracicus dexter (Sağ lenfatik kanal): Çok daha kısa olan bu kanal, yalnızca sağ kol, sağ hemitoraks ve baş-boyun bölgesinin sağ yarısının lenfini drene eder. Bu kanal, genellikle sağ vena subclavia ile sağ vena jugularis interna’nın birleştiği noktaya (angulus venosus dexter) açılır.
Bu iki kanal aracılığıyla lenf sıvısı nihayet venöz sistemle birleşir ve böylece dolaşıma katılmış olur. Bu bağlantı noktaları anatomik olarak hem yüksek hacimli sıvı geçişini mümkün kılar hem de immün sistem elemanlarının etkin taşınmasını sağlar.
Keşif
Antik Dönem Gözlemleri (M.Ö. 5. yy – M.S. 2. yy)
Lenf sistemi kavramı doğrudan tanımlanmamış olsa da, antik hekimler lenf sıvısına benzer yapıları gözlemlemişti. Hipokratçı tıp geleneğinde geçen “safra”, “balgam” ve “kan” gibi vücut sıvılarına dair kuramlar, bugünkü anlamda lenf sıvısını tanımasa da, onun fizyolojik etkilerini sezgisel biçimde içermekteydi.
- Hippokrates (M.Ö. 5. yy): “Beyaz kan” benzeri bir sıvının varlığından söz eder. Ancak lenf sistemine özgü damarlar tanımlanmaz.
- Galen (M.S. 2. yy): Mezenterde (bağırsak askısı) beyazımsı damar yapılar gözlemlemiş ve bunları lacteales (süt damarları) olarak tanımlamıştır. Bunları damar (ven) olarak kabul etmiştir. Lenf sıvısının özel bir dolaşım ağı olduğu henüz bilinmiyordu.
Ortaçağ ve Arap Tıbbı (8.–13. yy)
İslam tıbbı geleneğinde Galen’in otoriteryen konumu nedeniyle lenf sistemine dair yeni tanımlamalar yapılmamış; Galen’in mezenterik “süt damarları” kavramı uzun süre sorgulanmadan aktarılmıştır. Lenf damarları özgül olarak ayırt edilmemiştir.
Rönesans ve Lenf Damarlarının Keşfi (17. yy)
- yüzyılda, anatomi alanındaki gelişmelerle birlikte lenfatik sistem de bilimsel bir yapıya bürünmeye başladı. Bu dönem, lenf damarlarının ve özellikle torakal kanalın keşfi açısından son derece kritiktir.
- Gaspare Aselli (1581–1626): 1622 yılında, bir köpek üzerinde canlı diseksiyon yaparken mezenterik bölgede beyazımsı, sıvı dolu küçük damarlar fark etti. Bu yapılar daha önce Galen tarafından da tanımlanmıştı, ancak Aselli, bunların bağırsaklardan kaynaklanan ve “chylus” (şil) adını verdiği bir sıvı taşıdığını gösterdi. Bu damarlar daha sonra “vasa lactea” (şil damarları) olarak adlandırıldı. 1627 yılında ölümünden sonra yayımlanan eseri: “De lactibus sive lacteis venis” (Lacteal damarlar üzerine).
- Jean Pecquet (1622–1674): 1651 yılında, chylus’un sadece bağırsaklardan gelmediğini, bu sıvının vücutta özel bir kanal aracılığıyla taşındığını ve bu kanalın sonunda sol vena subclavia ile birleştiğini gösterdi.
Bu yapıyı “receptaculum chyli” (bugünkü adıyla cisterna chyli) olarak adlandırdı ve bu yapıdan çıkan ana lenf kanalını keşfetti. Bu kanal daha sonra ductus thoracicus (torakal kanal) olarak isimlendirildi.
Pecquet’nin bu keşfi, lenf sıvısının bağırsaklardan sonra sistemik dolaşıma nasıl geçtiğini açıklayan ilk bilimsel modeldir. Eseri: “Experimenta nova anatomica” (1651). - Thomas Bartholin (1616–1680): Danimarkalı anatomist Bartholin, 1652 yılında insan vücudunda sistemik bir lenfatik damar ağı bulunduğunu ayrıntılı biçimde ortaya koydu.
İlk defa lenf damarlarının genel bir dolaşım sistemi oluşturduğunu savundu. Ayrıca “lenfa” terimini modern anlamda kullanan ilk bilim insanlarından biridir. 1653 tarihli eseri: “Vasa lymphatica” - Olaus Rudbeck (1630–1702): İsveçli bir anatomist olan Rudbeck de, aynı dönemde lenf damarlarını tanımladı ve bu konuda Bartholin ile neredeyse eş zamanlı çalışmalar yaptı. Aralarındaki öncelik tartışmaları bilim tarihinde meşhurdur.
18.–19. Yüzyıl: Sistematik Anatomiye Geçiş
Lenfatik sistemin organizasyonu, dallanması ve terminal bağlantıları (örneğin duktus torasikus’un açıldığı venöz açı) bu yüzyıllarda kadavra diseksiyonları ve damar enjeksiyon teknikleriyle detaylı biçimde haritalandırıldı. Ayrıca:
- Ductus thoracicus dexter’in (sağ lenfatik kanal) varlığı, 18. yüzyıl ortalarında doğrulandı. Ancak bu kanal, sol torakal kanala kıyasla daha kısa ve değişken bir yapıya sahip olduğu için uzun süre dikkatten kaçmıştır.
20. Yüzyıldan Günümüze: Fonksiyonel ve Klinik Açılım
- Lenf damarlarının kapakçıkları, mikroskopik tekniklerle daha net biçimde görüntülendi.
- Lenfödem, lenf nodu biyopsileri, sentinel lenf nodu haritalaması ve lenfatik görüntüleme (lenfosintigrafi, MR lenfografi) gibi yöntemlerle klinik anlamda sistemin önemi arttı.
- Moleküler düzeyde, lenfanjiyogenez süreçleri (VEGF-C, Prox-1 gibi genetik düzenleyiciler) ortaya kondu.
- Lenfatik sistemin merkezi sinir sistemiyle olan ilişkisi (meningeal lenfatik damarlar) ise 2015 sonrası dönemde keşfedildi ve hâlen aktif araştırma konusudur.
İleri Okuma
- Aselli, G. (1627). De lactibus sive lacteis venis. Milano: Apud Ioannem Baptistam Bidellium.
- Pecquet, J. (1651). Experimenta nova anatomica, quibus incognitum chyliferum vas detegitur. Paris: Cramoisy.
- Bartholin, T. (1653). Vasa lymphatica nova in homine inventa. Hafniae (Copenhagen): Typis Melchioris Martzan.
- Rudbeck, O. (1653). Nova exercitatio anatomica, exhibens ductus hepaticos aquosos et vasa glandularum serosa. Upsaliae: Typis Johannis Janssonii.
- Sappey, M. P. C. (1874). Traité d’anatomie descriptive. Tome II: Angéiologie. Paris: Delahaye.
- Sabin, F. R. (1902). On the origin of the lymphatic system from the veins, and the development of the lymph hearts and thoracic duct in the pig. American Journal of Anatomy, 1(3), 367–389.
- Kinmonth, J. B. (1952). The lymphangiogram in cancer of the vulva. British Journal of Surgery, 40(164), 1–15.
- Louveau, A., Smirnov, I., Keyes, T. J., Eccles, J. D., Rouhani, S. J., Peske, J. D., Derecki, N. C., Castle, D., Mandell, J. W., Lee, K. S., Harris, T. H., Kipnis, J. (2015). Structural and functional features of central nervous system lymphatic vessels. Nature, 523(7560), 337–341.
Lenf sistemi
Lenfatik sistem, dolaşım fizyolojisinin “geri dönüş hattı” ile adaptif ve doğuştan bağışıklığın “gözetim ağı”nı aynı anatomo-fonksiyonel çatı altında birleştiren, damarlar, sıvı (lenf), lenfoid organlar ve dağınık lenfoid dokulardan oluşan bir sistemdir. Hem interstisyel sıvı homeostazını ve makromolekül geri kazanımını sağlar, hem de antijenlerin doku-lenf-lenf düğümü ekseninde örneklenmesini mümkün kılar; ayrıca ince bağırsakta emilen diyet lipitlerini şil (chyle) formunda sistemik dolaşıma taşır. Bu üç eksen—sıvı dengesi, immün gözetim ve lipid taşınması—lenfatik sistemin biyolojisini ve klinik önemini belirleyen ana temalardır.
1) Etimolojik köken ve kavramsal çerçeve
“Lenf” sözcüğü Latince lympha kökünden gelir; bu kök, “berrak su, kaynak suyu” anlam alanına sahiptir ve sıvının saydam, düşük hücre-protein içeriğine vurgu yapar. Modern Avrupa dillerindeki lymph/lymphe/lympha biçimleri bu kökten türemiştir. “Lenfatik” ise aynı kökün “-aticus”/“-atic” türetme ekiyle “lenfe ilişkin” anlam kazanmış biçimidir. Türkçedeki kullanım, bilimsel terminolojinin tarihsel aktarımı üzerinden yerleşmiş olup, lenf sıvısının özellikle erken fazda interstisyel kökenli, çoğu zaman berrak görünümünü ve doku aralığından toplanan “kaynak suyu benzeri” akışkan niteliğini kavramsallaştırır.
Kavram düzeyinde lenfatik sistem, iki klasik şemaya oturur:
- Kapalı uçlu kılcal emilim ağı (interstisyelden lenfe geçiş)
- Valvüllü toplayıcı damarlar ve düğümler üzerinden tek yönlü iletim (lenften venöz dolaşıma dönüş)
Bu şema, kan dolaşımından farklı olarak bir “kalp” pompasına sahip olmadan da akışın sürdürülebilmesini açıklamak zorundadır; dolayısıyla lenfatik sistemin fizyolojisi, damar duvarının aktif kasılma yeteneği, kapakçıklar, çevre kas pompası, solunum basınç değişimleri ve doku mekanik kuvvetleri üzerine kurulur.
2) Tarihsel gelişim: anatomi, fizyoloji ve immünolojinin kesişiminde
Lenfatik sistemin tarihsel serüveni, üç farklı gözlem hattının birleşmesiyle olgunlaşmıştır:
- Makroskopik anatomi: sütümsü bağırsak lenfi (şil) ve mezenterik damarların görünürlüğü
- Mikro-dolaşım fizyolojisi: kapiller filtrasyon-reabsorpsiyon dengesi ve interstisyel proteinlerin geri taşınması gerekliliği
- Bağışıklık bilimi: lenf düğümlerinin “antijen-lenfosit karşılaşma odası” olarak işlevi
Erken anatomistler, özellikle ince bağırsak villuslarında yağlı öğün sonrası belirginleşen laktealler (bağırsak lenf kılcalları) üzerinden şilin taşınmasını fark ederek lenfatik damarların varlığını kan damarlarından bağımsız bir ağ olarak kavramsallaştırdılar. Ardından lenf düğümlerinin sistematik diseksiyonlarla haritalanması, lenf akımının belirli “istasyonlarda” süzüldüğünü ve bu istasyonların klinikte büyüyebildiğini (enfeksiyon, malignite, granülomatöz hastalık) ortaya koydu.
- yüzyılın ikinci yarısında ise iki sıçrama belirleyici oldu:
- Kapiller değişim modelleri (özellikle Starling prensibinin modern revizyonları): interstisyel sıvının yalnızca venöz uçtan geri emilimle açıklanamayacağı; protein ve sıvının önemli bölümünün lenfatik yolla geri döndüğü fikri güçlendi.
- Hücresel-moleküler immünoloji: lenf düğümü mikro-mimarisi (korteks, parakorteks, medulla), antijen sunan hücrelerin göçü, T-B hücre etkileşimleri, germinal merkez yanıtları ve lenfosit dolaşımının seçiciliği (adresinleme/homing) netleşti.
Bu dönemde lenfatik sistem, “pasif drenaj” yaklaşımından çıkarak, aktif, düzenleyici ve adaptif bir biyolojik sistem olarak ele alınmaya başladı.
3) Evrimsel biyolojik bağlam: neden ayrı bir lenfatik sistem?
Evrimsel açıdan lenfatik sistemin varlığı, çok hücreli organizmalarda üç temel zorunluluğa yanıt verir:
- Makromolekül geri kazanımı ve doku şişmesini önleme
Kapillerlerden interstisyuma geçen albumin ve diğer proteinler, onkotik basınç nedeniyle dokuda su tutma eğilimindedir. Bu proteinlerin geri dönüşü olmasaydı, doku ödemi kronikleşir ve difüzyon mesafeleri artarak oksijen-besin değişimi bozulurdu. Lenfatik sistem, interstisyel proteinleri ve fazla sıvıyı “toplayıp” venöz dolaşıma iade ederek doku mimarisini korur. - Doku-bağışıklık arayüzünde gözetim
Dokuya giren mikroorganizma parçaları, tümör antijenleri ya da hasar ilişkili moleküller (tehlike sinyalleri) lenfle lenf düğümüne taşınır; burada adaptif bağışıklığın yüksek özgüllükteki hücreleriyle karşılaşır. Bu “merkezileştirme”, büyük bir vücutta antijen-lenfosit karşılaşmasının olasılığını dramatik biçimde artırır. - Enerji yoğun lipid taşınması
Diyet trigliseritlerinin şilomikronlar halinde lenf yoluyla taşınması, portal ven üzerinden doğrudan karaciğere gitmekten farklı bir fizyolojik rota sağlar; bu rota, lipidlerin kademeli ve sistemik dağılımına imkân tanır.
Bu üç zorunluluk, lenfatik sistemi yalnızca “ikincil bir dolaşım” değil, dolaşım-immünoloji-metabolizma kesişiminde evrimsel olarak seçilmiş bir çözüm haline getirir.
4) Güncel bilimsel anlayış: sistemin bileşenleri ve organizasyonu
4.1 Lenf sıvısı: kompozisyon ve dinamikler
Lenf, başlangıçta interstisyel sıvının bir devamıdır; bu nedenle erken fazda genellikle berraktır. Toplayıcı ağ içinde ilerledikçe:
- Proteinler (albumin başta olmak üzere),
- Hücresel artıklar,
- Bağışıklık hücreleri (özellikle lenfositler, dendritik hücreler),
- Lipitler (bağırsak kaynaklı şilomikronlar)
eklenir. İnce bağırsaktan gelen lenf, lipid içeriği nedeniyle belirgin sütümsü görünüm alır ve “şil” olarak adlandırılır.
Lenf oluşumu, mikrodolaşımın filtrasyon dengesiyle ilişkilidir: arteriyel kapiller uçta hidrostatik basınçla interstisyuma sıvı filtrasyonu artar; venöz uçta geri emilim kısmen olsa da, modern fizyoloji lenfatik drenajın interstisyel sıvı dengesinde vazgeçilmez olduğunu vurgular. Bu çerçevede lenfatik sistem, “fazla” değil “zorunlu” bir geri kazanım hattıdır.
4.2 Lenfatik kapillerler: giriş kapısı
Lenfatik kapillerler, kan kapillerlerine kıyasla şu özelliklerle ayrılır:
- Kör uçlu başlar; bu sayede doku aralığından sıvı toplayan bir “giriş” ağı kurar.
- Endotel hücre bağlantıları, interstisyel basınç artışıyla açılıp kapanabilen “mikro-valf” benzeri davranış gösterebilir; böylece büyük moleküller ve hatta hücreler lenfatik lümene girebilir.
- Bazal membran düzeni ve çevre ankraj yapıları, doku gerilimi arttığında lümenin açık kalmasına katkı sağlar.
Bu yapı, lenfatik kapillerleri “yüksek geçirgen giriş kanalı” haline getirir; protein ve hücresel parçacık taşınabilmesi klinikte de önemlidir (örneğin inflamasyonda doku debrisinin temizlenmesi).
4.3 Prekollektörler ve kollektörler: iletim ve pompalama
Kapillerler, prekollektör ve ardından kollektör (toplayıcı) lenf damarlarına boşalır. Toplayıcı damarların ayırt edici yönleri:
- Kapakçıklar: Akımı tek yönlü kılar, reflüyü önler.
- Düz kas tabakası ve segmental pompa birimleri: Kapakçıklar arasındaki segmentler (lenfanjionlar) ritmik kasılarak lenfi ileri iter.
- Ekstrinsik pompa katkısı: iskelet kası hareketi, arter nabzı, solunumla torasik basınç değişimi.
Bu nedenle lenf akımı, “pasif süzülme” olmaktan ziyade, damar duvarı aktivitesi ve çevresel mekaniklerle sürdürülür.
4.4 Ana lenf kanalları ve venöz dönüş
Lenfatik akım nihayetinde iki büyük kanala bağlanır:
- Ductus thoracicus (torasik kanal): Genellikle vücudun büyük bölümünün (alt ekstremiteler, abdomen, sol toraks, sol üst ekstremite ve sol baş-boyun) lenfini taşır ve sıklıkla sol venöz açıya (sol internal juguler ve sol subklavyen ven birleşimi) dökülür. Alt uçta cisterna chyli ile ilişkisi klasik anatomik şemada önemli yer tutar.
- Sağ lenfatik kanal: Sağ baş-boyun, sağ üst ekstremite ve sağ toraksın bir kısmını drene ederek sağ venöz açıya boşalır.
Bu son birleşme noktası, lenfatik sistemin dolaşım sistemine entegrasyonunu tamamlar ve lenf ile taşınan proteinlerin, hücrelerin ve lipidlerin sistemik dolaşıma katılımını sağlar.
5) Lenfoid organlar: primer ve sekonder organizasyon
Lenfoid organlar işlevsel olarak iki ana sınıfa ayrılır: primer (birincil) ve sekonder (ikincil).
5.1 Primer lenfoid organlar: üretim ve eğitim
Kemik iliği
Kemik iliği, hematopoiezin merkezi olarak eritrositler, lökositler ve trombositlerin üretim yeridir. Lenfosit biyolojisi açısından:
- B lenfositleri kemik iliğinde gelişir; antijen reseptör repertuvarı oluşturulur ve kendi antijenlerine aşırı reaktif klonlar tolerans mekanizmalarıyla elimine edilir ya da işlevsizleştirilir.
- T lenfositleri ise kemik iliğinde köken alır ancak olgunlaşma ve seçilim için timusa göç eder.
Kırmızı ve sarı iliğin dağılımı, yaşa ve fizyolojik gereksinime bağlıdır; kırmızı ilik hematopoetik kapasitenin daha yüksek olduğu dokudur, sarı ilik ise yağ içeriği yüksek olup belirli koşullarda hematopoetik aktivite artışıyla yeniden dönüşüm gösterebilir.
Timus
Timus, T hücrelerinin “immünolojik eğitim” organıdır. Burada iki seçilim ekseni belirleyicidir:
- Pozitif seçilim: T hücrelerinin kendi MHC moleküllerini tanıyabilme yeterliliği kazanması gerekir.
- Negatif seçilim: Kendi doku antijenlerine yüksek afiniteyle bağlanan klonlar elimine edilir; böylece otoimmünite riski azaltılır.
Timus histolojisi, kabaca korteks (daha yoğun ve olgunlaşmamış timositler) ile medulla (daha olgun hücreler, antijen sunan hücreler ve toleransın derinleştiği mikroçevre) ayrımıyla açıklanır. Timusun çocukluk ve ergenlikte belirgin, ileri yaşlarda involüsyona eğilimli olması, T hücre repertuvar dinamikleri ve yaşlanma immünolojisi açısından anlamlıdır.
5.2 Sekonder lenfoid organlar: karşılaşma, aktivasyon ve yanıtın örgütlenmesi
Lenf düğümleri
Lenf düğümleri, afferent lenf damarlarıyla gelen lenfi süzer ve antijenleri bağışıklık hücreleriyle buluşturur. Mikro-mimari üç ana bölgeye ayrılır:
- Korteks: B hücre folikülleri; antijenik uyarıyla germinal merkez yanıtı gelişebilir.
- Parakorteks: T hücre ağırlıklı alan; dendritik hücrelerin T hücrelerine antijen sunumu burada yoğunlaşır.
- Medulla: Plazma hücreleri ve makrofajlar dahil, filtrasyon ve efektör yanıtın belirli bileşenleri.
Antijen sunumu sonrasında B hücreleri proliferasyon, sınıf değişimi ve afinite olgunlaşması süreçlerine girebilir; T hücreleri de alt tiplere farklılaşarak (yardımcı, sitotoksik vb.) efektör işlevler kazanır. Aktivasyonun ardından olgun lenfositler efferent lenf damarlarıyla çıkar, büyük venöz dolaşıma katılır ve hedef dokulara yönlenir.
Lenf düğümleri vücutta kümeler halinde dağılır; servikal, aksiller ve inguinal bölgeler sıklıkla palpabl iken mediastinal veya abdominal düğümler gibi derin gruplar rutin muayenede elle değerlendirilemez. Enfeksiyon, malignite veya granülomatöz süreçler gibi durumlarda reaktif hiperplazi ya da infiltrasyon nedeniyle büyüyebilirler; bu klinik bulgu, lokalizasyon ve eşlik eden semptomlarla birlikte tanısal değerlendirmenin temel taşlarındandır.
Dalak
Dalak, lenf düğümünden farklı olarak “lenf”i değil, doğrudan kanı filtreleyen en büyük sekonder lenfoid organdır. Yapısı iki ana bölmeye ayrılır:
- Kırmızı pulpa: yaşlanan veya deformabilitesi azalan eritrositlerin süzülmesi ve yıkımı; ayrıca belirli kan hücrelerinin depolanması işlevleri.
- Beyaz pulpa: lenfoid dokunun arteriyolleri çevreleyen organizasyonu; T hücre ağırlıklı periarteriolar lenfoid kılıf ve B hücre bölgeleriyle adaptif yanıtın düzenlendiği alan.
Dalak, kapsüllü bakterilere karşı immün savunmada klinik olarak kritik önem taşır; bu, dalak fonksiyon kaybı olan bireylerde enfeksiyon risk paternlerinin değişmesiyle somutlaşır.
Mukoza ile ilişkili lenfoid doku (MALT)
MALT, epitel bariyerlerinin altında dağınık veya organize lenfoid yapılardan oluşur ve vücudun dış ortamla en geniş temas yüzeylerinde (solunum ve sindirim yolları başta olmak üzere) immün gözetimi sağlar. Bunun alt başlıkları arasında:
- GALT (barsak ilişkili lenfoid doku): Peyer plakları gibi organize foliküler yapılar; bağırsak antijenlerinin örneklenmesi ve IgA ağırlıklı yanıtların örgütlenmesi.
- Nazofaringeal lenfoid doku: Bademcikler ve ilişkili yapılar; solunum yoluyla gelen antijenlerin erken karşılandığı bölgeler.
MALT’ın özgünlüğü, çevresel antijen yükünün yüksek olduğu bu bölgelerde “tolerans ile yanıt” arasındaki hassas dengeyi yönetebilmesidir; aşırı yanıt inflamasyon ve doku hasarına, yetersiz yanıt ise enfeksiyonlara yatkınlığa yol açabilir.
6) Lenfosit dolaşımı ve antijen sunumu: biyolojik lojistik
Bağışıklık yanıtının verimliliği, antijenlerin uygun “örnekleme merkezine” taşınmasına ve nadir antijen özgüllüğündeki lenfositlerin bu antijenlerle karşılaşmasına bağlıdır. Lenfatik sistem bu lojistiği sağlar:
- Periferik dokularda dendritik hücreler antijen alır, olgunlaşır ve lenfatik kapillerlere girerek lenf düğümüne göç eder.
- Lenf düğümünde T hücreleri, dendritik hücrelerin sunduğu peptid-MHC kompleksleriyle karşılaşır; yeterli kostimülasyon ve sitokin ortamında aktive olur.
- B hücreleri, antijeni doğrudan bağlayabilir veya foliküler dendritik hücre ağları üzerinden antijenle karşılaşarak germinal merkez yanıtına girebilir.
Bu süreçler yalnızca “aktivasyon” değil, yanıtın kalitesi (antikor sınıf değişimi, afinite olgunlaşması, bellek oluşumu) açısından da belirleyicidir. Lenfatik sistemin anatomik düzeni, immunolojinin “rastlantısal karşılaşma” problemini biyolojik olarak çözen altyapıdır.
7) Lipid taşınması: şil ve laktel ekseni
İnce bağırsakta emilen uzun zincirli yağ asitleri ve monogliseridler enterositlerde yeniden trigliseride çevrilir ve şilomikron formunda paketlenir. Şilomikronlar kapiller kan dolaşımına doğrudan geçmek yerine çoğunlukla lakteallere alınır ve lenf yoluyla torasik kanal üzerinden sistemik dolaşıma katılır. Bu mekanizma:
- lipidlerin yüksek hacimli partiküller halinde taşınmasına,
- postprandiyal lipemi dinamiklerinin düzenlenmesine,
- bazı lipofilik moleküllerin (belirli ilaçlar dahil) emilim paternlerine
katkı sağlar.
Şil akımının bozulması klinikte şilotoraks veya şilöz asit gibi tablolarla önem kazanır; bu tablolar lenfatik anatomiyi ve basınç ilişkilerini doğrudan gündeme getirir.
8) Klinik korelasyonlar: bozulma paternleri ve tanısal yaklaşımın ilkeleri
Lenfatik sistem bozuklukları genellikle üç ana klinik eksende belirginleşir:
8.1 Lenfödem: drenaj yetersizliği
Lenf akımının yetersizliği, interstisyel protein birikimi ve kronik inflamatuvar-fibrotik doku değişiklikleriyle giden lenfödem tablosuna yol açabilir. Primer (gelişimsel) veya sekonder (cerrahi, radyoterapi, enfeksiyon, tümör infiltrasyonu) nedenlerle ortaya çıkabilir. Klinik olarak erken dönemde yumuşak çukurlaşan ödem daha belirgin iken, kronikleşme ile fibrozis ve cilt değişiklikleri gelişebilir.
8.2 Lenfadenopati: immün aktivasyon veya infiltrasyon göstergesi
Lenf düğümü büyümesi, reaktif hiperplazi (enfeksiyonlar), granülomatöz hastalıklar veya malign infiltrasyon gibi farklı patofizyolojileri yansıtabilir. Değerlendirmede anatomik dağılım, süre, sistemik belirtiler ve eşlik eden enfeksiyon odağı gibi parametreler klinik akıl yürütmenin temelini oluşturur.
8.3 Lenfatik yayılım ve metastaz biyolojisi
Birçok solid tümör, lenfatik ağ üzerinden bölgesel lenf düğümlerine yayılım gösterebilir. Bu olgu, “sentinel lenf düğümü” kavramını ve cerrahi-onkolojik evreleme yaklaşımlarını doğurmuştur. Lenfatik damarların tümör mikroçevresiyle ilişkisi, anjiyogenez/lenfanjiyogenez dinamikleri ve immün kaçış mekanizmaları modern onkolojinin aktif araştırma alanlarıdır.
Tanısal araçlar arasında ultrasonografi, kesitsel görüntüleme, belirli durumlarda lenfatik haritalama yöntemleri ve histopatolojik değerlendirme yer alır; hangi aracın seçileceği klinik senaryoya ve sorulan soruya göre belirlenir.
9) Lenfatik sistemin bütüncül yorumu: doku homeostazının “üçlü ekseni”
Lenfatik sistemin ansiklopedik bir çerçevede en ayırt edici niteliği, tek bir işlevle sınırlı olmamasıdır. Doku homeostazını üç yönden aynı anda sürdürür:
- Sıvı-protein geri kazanımı ile mekanik ve kimyasal denge,
- Antijen örnekleme ve hücresel trafik ile immün denge,
- Lipid taşınması ile metabolik denge.
Bu üç eksen, anatomik olarak aynı damar-düğüm-kanal mimarisi içinde yürütülür; dolayısıyla lenfatik sistem bozuklukları çoğu zaman yalnızca “ödem” ya da yalnızca “immün yetmezlik” olarak değil, bu eksenlerin bileşimindeki kaymalar olarak değerlendirilmelidir.
Keşif
Antik Çağlarda Gizemli Sıvılar ve Bezler
İnsan bedeninin gizemli ikinci dolaşım sistemi olan lenf sisteminin öyküsü, antik çağlarda meraklı gözlemcilerin ilk ipuçlarını fark etmesiyle başlar. MÖ 5. yüzyılda yaşamış Hipokrat, vücuttaki bezeleri inceleyerek bunların içinde akıcı bir sıvı bulunduğunu belirtmiş ve bu sıvıya “ikhor” adını vermişti. Hipokrat’ın “Peri Adenon” (Bezler Üzerine) adlı eserinde, koltuk altı, boyun, kasık ve mezenter bölgelerindeki lenf bezelerinden söz edilir. O dönemde bunlar, vücut dokularından emilen ve damarlarda dolaşan farklı bir sıvının varlığına işaret ediyordu. Yine de antik Yunan tıbbında bu yapıların işlevi tam anlaşılamamış, sadece vücudun savunmasız bölgelerini destekleyen süngerimsi yapılar olarak tanımlanmıştı.
MÖ 4. yüzyılda Aristoteles, hayvanları incelerken renksiz bir sıvı taşıyan ince damarcıklar gördüğünü kaydetti. Kan damarı veya sinir olmayan, ikisinin arasında bir doğaya sahip bu “liflerin” içinde akan renksiz sıvıya Aristoteles “sanies” (temiz akıntı) adını verdi. Aslında bu, kan dolaşımından ayrı bir akışkanın varlığını sezdiriyordu. Fakat Aristoteles ve çağdaşları, bu damarcıkların görevini çözemeden bırakmak zorunda kaldılar.
Antik dünyanın bir diğer tıp merkezi olan İskenderiye Okulu’nda da benzer meraklar yeşerdi. Rivayete göre, MÖ 3. yüzyılda İskenderiye’de hekim Erasistratos, genç bir keçi üzerinde yaptığı deneyde hayvanın karın arterlerini kestiğinde içlerinin süt gibi beyaz bir sıvıyla dolduğunu gözlemlemişti. Bu olgu büyük şaşkınlık yarattı; çünkü damarlardan akan bu “sütümsü sıvı” neydi? Erasistratos bunu yanlışlıkla atardamarlarda oluşan bir tür besleyici özsu sanmıştı. Aslında ilk kez bağırsaklardaki şilus denen yağlı lenf sıvısının damarlarda görülmesiydi, ancak o dönem bu bulgu doğru yorumlanamadı.
Roma dönemi hekimi Galen (MS 2. yüzyıl), çağının en etkili anatomi ve fizyoloji otoritesi olarak bu gizemli sistem hakkında kendi teorilerini geliştirdi. Galen, diseksiyonlar yaparak mezenterik (bağırsak çevresi) bezeleri, dalak, pankreas ve timus gibi organları tanımladı. Fakat Galen’in fizyoloji kuramı, bedenin besleyici sıvısının (“şilöz” sıvının) bağırsaklardan portal ven yolu ile karaciğere taşındığı ve orada kana dönüştürüldüğü yönündeydi. Galen bu sürece “anadosis” adını vermiş, yani şilusun karaciğere çıktığı bir dolaşım tarif etmişti. Ona göre bağırsaklarda emilen besinler iki yolla hedefe gidiyordu: Birincisi, bağırsaktan karaciğere giden küçük damarlar (şilusu taşıdığı sanılan portal ven dalları); ikincisi de dokulara dağılan normal kan akışı. Böylece Galen, damarlarda dolaşan sıvının iki çeşidi olduğundan bahsetmişti: Biri süt beyazı, diğeri saydam. Ne var ki Galen bu iki sıvının farklı damar ağlarında taşındığını kavrayamamış, bağırsaktan gelen sütümsü sıvıyı yine damar sisteminin (venlerin) bir parçası sanmıştı.
Rufus gibi bazı Roma dönemi hekimleri de koltuk altı ve kasık bölgelerindeki bezeleri tanımlamış, Ephesuslu Rufus örneğin dalak ve lenf düğümlerini yazmıştır. Yüzyıllar sonra 7. yüzyılda Aeginalı Paulos, ilk tonsillektomiyi (bademcik ameliyatı) gerçekleştirirken boyundaki iltihaplı lenf bezlerini tarif etmiştir. Bu, hastalık halinde lenf düğümlerinin şişebildiğinin kadim bir gözlemiydi.
Orta Çağ boyunca anatomi bilgisinde büyük ilerlemeler olmadı. İslam dünyasında İbni Sina (Avicenna) gibi hekimler, daha ziyade antik kaynakları derleyip yorumladılar. Ancak İbni Sina “El-Kanun” eserinde elefantiyazis (fil hastalığı) denilen fil bacağı gibi şişen uzuvları anlatırken, bu durumun sıcak iklimlerde ve doğuda daha sık görüldüğünü vurgulamıştı. Parazitlerin neden olduğu lenf damar tıkanıklığına bağlı bu hastalık o dönemde gizemliydi; İbni Sina bunun nemli bölgelerdeki “şehreyn” adlı kurtçuklardan olabileceğini öngörüyordu. Yani lenf sisteminin hastalıkları, sebebi anlaşılamasa da gözlemleniyordu.
Galen’in otoritesi ve kilisenin dogmaları nedeniyle, yaklaşık 1500 yıl boyunca anatomi eğitiminde büyük değişimler olmadı. Lenf sistemi de bu nedenle antik yanlış anlamalarla kaldı; bezeler ve damarlardaki renksiz sıvı konusu aydınlatılamadı. Ta ki Rönesans’a kadar, lenf sistemi tıbbın esrarengiz ve anlaşılması güç bir yönü olarak kaldı.
Rönesans Dönemi: Yeniden Doğuş ve İlk Farkındalıklar
- ve 16. yüzyıllarda Avrupa’da Rönesans ile birlikte bilim ve sanatta bir yeniden doğuş yaşandı. Andreas Vesalius 1543’te ünlü eseri “De Humani Corporis Fabrica”’yı yayımlayarak anatomi çalışmalarında devrim yarattı. Vesalius, insan kadavrası üzerinde sistematik disseksiyonlar yapıp Galen’in hayvanlardan aktardığı yanlışların çoğunu düzeltti. Ancak karın bölgesindeki damarları tarif ederken kendisi de kısmen Galen’in izinden gitmiş ve lenf sistemi konusunda yeni bir şey ortaya koyamamıştı. Çünkü lenf damarları, kan dolu damarlara kıyasla kadavralarda neredeyse görünmezdi. Yine de Vesalius’un cesur bilimsel yaklaşımı, Galen’in yıkılmaz sanılan duvarlarını çatlatmaya başlamıştı.
Bu dönemde kan dolaşımı kavramı da hızla evrim geçiriyordu. 1550’lerde İspanyol hekim Michael Servetus ve İtalyan anatomist Realdo Colombo, Galen’in yanlış anladığı akciğer dolaşımını tarif ederek kanın kalpten akciğerlere gidip oksijenlenerek geri döndüğünü gösterdiler. 16. yüzyılın sonlarında Andrea Cesalpino, ilk defa kan dolaşımından bahsederken “sirkülasyon” terimini kullandı ve kalbi dolaşımın merkezi olarak vurguladı. Kan dolaşımının kalp merkezli anlaşılması, ileride lenf sisteminin de ayrı bir dolaşım olarak görülmesinin önünü açacaktı. Artık bedenin sıvıları konusunda hepatosentrik (karaciğer merkezli) model terk edilip kardiyosentrik (kalp merkezli) modele geçiliyordu. Bu zihniyet değişimi, lenf damarlarının da bağımsız bir sistem olabileceği fikrine zemin hazırlıyordu.
- yüzyılda anatomistler vücuttaki bezeleri ve damarları daha dikkatle incelemeye başladılar. Nicolaus Massa adında Venedikli bir hekim 1536’da yayınladığı anatomi kitabında, böbrek diseksiyonları yaparken “venae chilis” diye bir damardan söz etti. Latince “vena chilus”, o devirde “süt damarı” anlamında kullanılıyordu. Gerçekte kastettiği, o zamanlar yanlışlıkla böbrekten karaciğere giden bir damar zannedilen alt ana toplardamardı (vena cava). Yani henüz lenf damarları kavramı netleşmemiş, “chilus” (şilus) terimi kafaları karıştırıyordu. Yine de bu ifadeler, vücutta kan dışındaki süt görünümünde bir sıvıyı taşıyan yapılara dair ilk sezgilerdendi.
Rönesans’ın belki de en önemli erken keşiflerinden biri, Bartolomeo Eustachi tarafından gerçekleştirildi. 1563 yılında Eustachi, bir at üzerinde çalışırken göğüs boşluğunda beyazımsı bir damar tespit etti. Bu bulguyu “vena alba thoracis” (göğsün beyaz damarı) olarak tanımladı ve çizimlerini hazırladı. Eustachi’nin çizimleri, o dönem pek ilgi görmedi ve unutuldu; ta ki 17. yüzyılın ortalarında yeniden keşfedilip anlaşılana kadar. Aslında Eustachi’nin gördüğü, lenf sisteminin ana kanalı olan ductus thoracicus (göğüs kanalı) idi. Fakat Eustachi’nin eseri uzun süre tozlu raflarda kaldığından, bu keşif tıp camiasında hemen yayılmadı.
Rönesans’ın bir başka önemli figürü, Padova’da ders veren Hieronymus Fabricius (Fabricius ab Aquapendente) idi. Fabricius, 16. yüzyıl sonlarında kuş embriyolarını incelerken, kuşlarda kloakanın üzerinde bir kese keşfetti. Bu organa sonradan “Fabricius’un bursası” denilecekti. Fabricius, bu kesenin işlevini yanlış yorumlayarak horozun tohum sıvısını depolayan bir yapı olduğunu sandı. Oysa bu bursa, kuşlarda lenf sistemiyle ilişkili çok önemli bir organdı; bağışıklık hücrelerinin olgunlaştığı yerdi. Fabricius bu bulgusunu 1621’de yayınladı, fakat gerçeği anlamak için bilimin 20. yüzyılı beklemesi gerekecekti. Nitekim 1950’lerde Bruce Glick adında bir araştırmacı, Fabricius’un bursasının aslında B lenfositlerinin gelişim merkezi olduğunu ortaya koyarak (adı “Bursa”dan gelen B hücreleri), tarihi bir yanılgıyı düzeltmiştir.
Sonuç olarak, Rönesans boyunca anatomistler vücudun karmaşık yapısını çözmeye hevesliydi. Kan dolaşımı kavramı netleşirken, lenf sistemi henüz gölgede kalmış, ancak bazı tuhaf gözlemler defterlere girmeye başlamıştı. Beyazımsı süt gibi sıvılar, tuhaf bezeler ve bilinmeyen kanallar… Hepsi merak uyandırıyor, bilim insanlarını çözülmesi gereken bir bilmece gibi kışkırtıyordu. Bu bilmecenin çözülmesi için asıl patlama ise 17. yüzyılda gelecekti.
17. Yüzyıl: Lenf Sisteminin Altın Çağı
1600’lü yıllar, lenf sisteminin gizeminin hızla çözülmeye başladığı, adeta altın çağ olarak anılabilir. Bu yüzyılın başında anatomistler, Galen’in asırlardır süren otoritesini yıkmış, insan vücudunu yeni gözlerle incelemeye koyulmuşlardı. Kan dolaşımının keşfi bile henüz tazeydi: William Harvey, 1628’de yayımladığı eserle kanın kalpten vücuda pompalanıp geri döndüğünü kanıtlamış, tıp dünyasını sarsmıştı. Ancak Harvey bile, lenf dolaşımı konusunda eski inançlardan tam kopamamıştı. Kan dolaşımını keşfettiği yıl, Fransa’da ve İtalya’da başka bir önemli keşfin temelleri atılıyordu: Lenf damarlarının bulunması.
Gaspare Aselli, bir İtalyan cerrah ve anatomist, 1622 yılının bir yaz günü belki de tarihin en şanslı hatalarından birini yaptı. Besili bir köpeği ameliyat masasına yatırmış, sinir sistemini incelemek üzere göğüs ve karın bölgesini açmıştı. Aselli, vagus sinirinin seyrini takip etmek isterken, bağırsağın üzerindeki ince zar içinde bembeyaz parıldayan kılcal şeritler fark etti. İlk başta bunları sinir zannetti; zira sinirler de beyaz renklidir. Fakat dikkatle bakınca bu “ince ve güzel beyaz şeritlerin” içlerinde süt gibi bir sıvı aktığını gördü. Hayret ve heyecan içinde, köpeği besleyip tekrar disekte ettiğinde aynı beyaz sıvının sadece beslenmiş hayvanlarda göründüğünü, aç hayvanlarda bu damarların sönük kaldığını anladı. Aselli, damar sistemi ve sinirlerden başka, dördüncü bir dolaşım sistemi keşfettiğine inandı. 1627’de ölümünden kısa süre sonra yayımlanan “De Lactibus sive Lacteis Venis” (“Süt Damarları Üzerine”) adlı eserinde buluşunu dünyaya duyurdu. Bu yeni damarlara, içlerindeki sıvının rengine binaen “vena lactea” (lakteal damarlar, yani süt damarları) adını verdi. Aynı zamanda kan taşımadıkları için onlara “vena alba” (beyaz damarlar) demeyi de uygun görmüştü. Aselli’nin çizimleri dönemine göre olağanüstü güzellikte, renkli resimlerdi; beyaz lenf damarlarını kırmızı ve mavi kan damarlarının yanında göstermişti.
Ne var ki Aselli, Galen’in öğretilerinden tam kurtulamadığından, bu süt beyazı şilus sıvısının nihayetinde pankreasta toplandığını ve oradan yine karaciğere gidip kan yapımına katkı verdiğini düşündü. Yani buluşunun devrimci niteliğine rağmen, şilusun bağımsız bir dolaşım yapıp yapmadığı konusunda tereddüt etti. Yine de Aselli’nin “şilöz damarları” görmesi, bilimin zihnine şüphe tohumlarını ekmişti: Belki de vücutta kan dolaşımı dışında ayrı bir sıvı ağı vardı.
Aselli’nin bulgusundan kısa süre sonra, Fransa’da bilim meraklısı bir soylu olan Peiresc, bu “beyaz damarların” insanda da görülüp görülemeyeceğini merak etti. 1628’de idam edilmiş bir mahkûmun cesedini, ölümünden iki saat sonra inceleyerek bağırsak mezenterinde aynı beyaz damarlardan izler saptadı. Böylece lakteal damarların insanda da var olduğu doğrulandı. Ancak o zamanın bilgisiyle, bu damarların nereye gittiği hala muammaydı. Hatta Peiresc’in arkadaşı, filozof Pierre Gassendi, şilusun safra kanalından (koledok) karaciğere gittiğini bile öne sürdü. Yani hâlâ “şilus nereye akıyor?” sorusu ortadaydı.
Bu sırada, William Harvey kan dolaşımını ilan etmiş olsa da, lenf dolaşımı keşiflerini yeterince önemsememişti. Harvey, Aselli’nin lakteallerini duymuştu ancak bağırsaktan kana besin taşınması işini yine portal toplardamara bağlamaya devam etti. Hatta lacteal damarların, besinlerin taşınması için fazla karmakarışık ve yaygın olduğunu, bu kadar çok damarın sadece besin taşımak için var olamayacağını iddia etti. Belki de Harvey, bir hesaplama yaparak eğer bu damarlardaki tüm şilus kana karışsaydı, karaciğerin her gün aşırı miktarda kan üretmesi gerekeceğini düşünmüş ve bu yüzden şilusun varış yerinin farklı olabileceğine inanmamıştı. İronik olarak, kan dolaşımının keşfinde Galen’i rakamlarla çürüten Harvey, lenf meselesinde “fazla hesaplama” yaparak yanıldı.
1640’lara gelindiğinde, lenf sistemi bulmacasının parçaları yavaş yavaş bir araya gelmeye başladı. Padova’da çalışan anatomist Johann Georg Wirsung (daha çok pankreas kanalı ile tanınır) ve Johann Vesling, insan bedeni üzerinde lakteal damarları çizdiler. 1647’de Vesling, “Syntagma Anatomicum” adlı eserinde insan mezenterindeki lakteal damarların ayrıntılı resimlerini yayımladı. Yine de bu damarların nihai rotasını o da çizememiş, göğüs boşluğunda kaybettikleri izi sürememişti. Vesling, öğrencisi Thomas Bartholin’e bu gözlemlerinden bahsederek genç anatomistin merakını ateşlemişti.
Jean Pecquet adlı bir Fransız tıp adamı, lenf sisteminin sır kapısını aralayan kilit ismi oldu. 1651’de Pecquet, “Experimenta Nova Anatomica” (Yeni Anatomik Deneyler) başlıklı eserini bastı. Bu çalışmada Pecquet, köpekler üzerinde deneylerle şilusun karaciğere gitmediğini, aksine göğüs boşluğunda özel bir kesede biriktiğini buldu. Bağırsaklardaki lakteal damarları takip ederek onların karnın derinlerinde bir torbaya –bugün “Pecquet’nin kesesi” veya “cisterna chyli (şilus haznesi)” dediğimiz yapıya– açıldığını keşfetti. Bu kese, tüm sütümsü şilusu topluyor ve oradan yukarı doğru uzanan bir kanalla (göğüs kanalı, ductus thoracicus) şilusu boyundaki bir toplardamara iletiyordu. Pecquet, bu göğüs kanalının üzerinde küçük kapakçıklar olduğunu da fark etti; lenfin tek yönde akmasını sağlayan valfler. Sonunda Pecquet şunu ispat etti: Bağırsaklardan gelen şilöz lenf, karaciğere değil, doğrudan büyük kan dolaşımına katılıyordu. Boyundaki sol köprücük altı toplardamarına dökülen lenf, böylece kana karışıyordu. Pecquet’nin bu buluşu, yüzyıllık bir yanılgıyı ortadan kaldırdı ve lenf damarlarının dolaşım sistemine paralel ama ayrı bir kanal olduğunu ilk kez gösterdi.
Pecquet göğüs kanalını ve şilus kesesini tanımlarken, Hollandalı anatomist Jan Van Horne da 1652’de yayımladığı bir çalışmada, bu kanalın içindeki kapakçıkları tasvir etti. Lenf damarlarının içinde, tıpkı damarlardaki gibi tek yönlü kapakçıklar olduğu böylece anlaşılmaya başlandı.
Lenf sisteminin keşfinde kilit rol oynayan bir diğer isim, Danimarkalı bilim insanı Thomas Bartholin idi. Bartholin, anatomist bir aileden geliyordu (babası da ünlü bir anatomistti) ve Kopenhag’da çalışıyordu. 1652’de Bartholin, “De lacteis thoracicis” (Göğüsteki Süt Damarları Üzerine) adlı ilk kitabını yayımladı. Başlangıçta hocası Vesling’in çizdiği lakteal damarları yineledi ve Galen’in görüşlerine tamamen karşı çıkmadı. Fakat Bartholin durmadı; hayvanlar ve insanlar üzerinde yeni diseksiyonlar yaparak bağırsaklar dışında da benzer damarlara rastladı. Karaciğerden çıkan su gibi duru bir sıvı içeren ince damarlar tespit etti. 1653’e gelindiğinde, ikinci eserini yayınladı: “Vasa Lymphatica in Animantibus” (Canlılarda Lenf Damarları). Bu kitapta Bartholin, bağırsaktan gelen süt beyazı şilus ile diğer organlardan gelen saydam renkte sıvıyı taşıyan damarları birbirinden ayırt etti. Karaciğerden çıkan berrak sıvıyı taşıyan damarlara “aquaeous ducti” (su gibi sıvı taşıyan kanallar) derken, genel olarak vücuttaki berrak sıvı taşıyan yeni damarlara Latince “vasa lymphatica” adını verdi. Lympha, Romalıların berrak su perisi anlamında kullandığı bir kelimeydi; tertemiz su kaynaklarına atfen. Bartholin bu terimi seçerek, keşfettiği damarların içindeki sıvının saf su gibi olduğunu vurguladı. Böylece tarihte ilk defa “lenf damarları” kavramsal olarak tanımlandı ve isimlendirildi. Bartholin ayrıca çok nüktedan bir başlıkla, Galen’in “şilus karaciğere gider” fikrini toprağa gömdüğünü ilan etti: Kitabının bir bölümünü “lenf damarları keşfedildikten sonra karaciğerin cenaze töreni” olarak nitelendirdi. Bu esprili ifade, aslında tıp dünyasında bir devrin kapandığını, karaciğer merkezli beslenme teorisinin öldüğünü gösteriyordu.
Bartholin’in çalışmalarına neredeyse eş zamanlı olarak, İsveç’te genç bir bilim insanı olan Olaus (Olof) Rudbeck de lenf sırlarını çözmekteydi. Rudbeck, 1652 yılında henüz 22 yaşındayken İsveç Kraliçesi Christina’nın huzurunda küçük hayvanlar üzerinde diseksiyonlar yaptı. Bağırsaklardaki lakteal damarları ve bunların kan dolaşımına bağlantısını tespit etti. Damarların üzerine bağlar atarak akış yönünü gözlemledi; lenfin hep tek yöne, kalbe doğru aktığını gösterdi. Karaciğerin de su gibi bir lenf ürettiğini ve bunun göğüs kanalına boşaldığını ispatladı. Rudbeck bulgularını 1653’te “Nova Exercitatio Anatomica” adlı eserinde yayımladı. Eserin uzun adı, Bartholin’inkine benzer şekilde, karaciğerden gelen sulu damarlardan ve bezelerin su kanallarından bahsediyordu. Rudbeck de karaciğerden çıkan lenf damarlarına “aquosus” (su taşıyan) demişti. Hatta akciğer ve böbreklerde de benzer ince lenf damarlarını not etmişti. Ancak Rudbeck’in talihsizliği, Bartholin’den az farkla geride kalmasıydı; Bartholin 1653’te çoktan lenf sistemini duyurmuştu. Rudbeck, kendi önceliğini savunmak için öfkeliydi. 1654’te Bartholin’e suçlayıcı bir mektup yazdı ve keşfin asıl sahibinin kendisi olduğunu iddia etti. 1659’da yayınlanan bir kitapta Bartholin, Pecquet ve Rudbeck’in makaleleri birlikte basıldı, ancak kimin önceliği olduğu tartışması o dönemde sonuçsuz kaldı. Tarih bugün her ikisini de lenf sisteminin ortak kaşifleri olarak anar; biri Kuzey’de, diğeri Güney’de aynı gerçeği bağımsız olarak ortaya çıkarmışlardı.
Bu keşif yarışı döneminde, İngiltere’de de hareketlenmeler vardı. Francis Glisson, 1654’te “Anatomia Hepatis” (Karaciğer Anatomisi) adlı eserinde öğrencisi George Joyliffe ile birlikte lenf damarlarından bahsetti. Glisson, lenf damarlarının anatomisini kitabının sonuna ekleyerek, bu bulgunun ne kadar yeni ve önemli olduğunu vurgulayan bir alt başlık koydu. Glisson ve Joyliffe, karaciğerdeki lenf kanallarının varlığını kendilerinin keşfettiğini öne sürerek Bartholin ve Pecquet’in hakkına da ortak çıkmaya çalıştılar. Bu da döneminin bir başka öncelik tartışmasıydı. Ancak Bartholin’in işi o kadar sağlamdı ki, Glisson’ın iddiaları fazla ses getirmedi.
Bartholin’in öğrencilerinden biri olan ünlü Danimarkalı Niels Stensen (Latince adıyla Nicolaus Steno), lenf sistemi araştırmalarına ayrı bir renk kattı. Stensen, 1660’larda anatomik keşifleriyle tanınıyordu (örneğin çene altı tükürük bezi kanalı olan “Stensen kanalı”nı bulmuştu). 1662’de Bartholin’e yazdığı bir mektupta, köpeklerde yaptığı deneylerden söz etti: Göğüs kanalı ile diğer lenf damarlarının sol köprücük altı toplardamarına valfli biçimde birleştiğini anlatıyordu. Yani lenf sıvısının boyunda kana karıştığı noktayı ayrıntılı tarif etti. 1675’te de Jan Swammerdam ile birlikte “Lymphaticorum Varietas” adlı bir makale yayımlayarak, farklı hayvanlarda lenf damarlarının dağılımını karşılaştırdı. Stensen’in çalışmaları, lenf sisteminin evrenselliğini (farklı türlerde de bulunduğunu) ve yapısının detaylarını ortaya koyuyordu.
Tüm bu keşiflerle heyecanlanan dönemin insanları, lenf dolaşımını görselleştirmeyi de denediler. İtalyan cerrah Giovanni Guglielmo Riva, 1600’lerin ortasında tam boy bir insan figürü üzerine kan ve lenf damarlarını gösteren yağlı boya tablolar yaptı. “Microcosmo” adını verdiği bir tabloda insanı bir mikrokozmos olarak resmetmiş, kırmızı kan damarları yanında beyaz lenf damarlarını tüm bedene yayılmış halde çizmeyi başarmıştı. Bir başka tablosunda karaciğerin hem kan hem lenf dolaşımını doğru biçimde betimledi. Her ne kadar Riva bulgularını resmi bir yayında toplamasa da, bu tablolar lenf sisteminin görsel olarak anlaşılmasında önemli bir ilk adım oldu.
- yüzyılın sonuna gelindiğinde, lenf sistemi büyük ölçüde kabullenilmiş bir gerçek haline geldi. Fakat herkes aynı görüşte değildi. Paris’te ünlü anatomi profesörü Jean Riolan, yeni keşiflere şüpheyle yaklaşıyor ve Galen’in otoritesine bağlı kalmak istiyordu. Riolan, lakteal damarların ve lenf sisteminin o kadar önemli olmadığını, bunların aslında eski teorilerle açıklanabileceğini savundu. Hatta Flandre’lı ilginç bir anatomist olan Louis De Bils, 1692’de ölümünden sonra yayınlanan kitabında lenf sıvısının tam tersi yönde, merkezden periferiye aktığını iddia eden tuhaf bir teori öne sürdü. De Bils, cesetleri bozulmadan koruma tekniğiyle ünlenmiş biriydi ve sıra dışı fikirleri de dikkat çekiyordu. Ancak lenf akışının periferik yönde olduğu fikri bilim çevresinde hemen eleştirildi ve ciddiye alınmadı.
Sonuç olarak 17. yüzyıl, lenf sisteminin bağımsız bir dolaşım ağı olduğunun anlaşıldığı, büyük keşiflerin ve heyecanlı tartışmaların yaşandığı bir dönem oldu. Şilöz damarlar olarak başlayan serüven, lenf damarları adıyla bilinen bir sisteme dönüştü. Artık anatomi kitapları, kalpten pompalanan kan dolaşımının yanı sıra, dokulardan süzülen berrak bir sıvıyı geri taşıyan ikinci bir dolaşım sistemi olduğunu kabul ediyordu. Bilimin merak meşalesi, bir sonraki yüzyılda bu yeni sistemin derinliklerine inmeye hazırlanıyordu.
18. Yüzyıl: Aydınlanma ve Gelişen Anlayış
- yüzyıla gelindiğinde, lenf sistemi hakkında temel gerçekler kabul görmüş, ancak ayrıntıları hala keşfedilmeyi bekliyordu. Aydınlanma çağı ile birlikte bilim ve tekniğin ilerlemesi, lenf damarlarının inceliklerini anlamaya yardımcı oldu. Bu dönemde araştırmacılar, lenf damarlarının neden bu kadar zor göründüğünü sorgulayarak, teknik engelleri aşmanın yollarını bulmaya odaklandılar. Gerçekten de kadavralarda lenf damarlarını ortaya çıkarmak zorlu bir işti: Çoğu zaman içleri boştur, duvarları şeffaftır ve toplardamar ya da sinirlerle kolayca karışırlar. Bu problemi çözmek için parlak bir fikir geliştirildi: Merkür (cıva) enjeksiyonu.
Daha 17. yüzyılın sonlarında Hollandalı cerrah Anton Nuck, cıva gibi akışkan ve parlak bir maddeyi lenf damarlarına enjekte edip damarların seyrini görünür kılmayı denemişti. Nuck, 1691’de “Adenographia Curiosa” adlı eserinde lenf sistemini cıva ile doldurarak elde ettiği harika çizimler yayımladı. Cıvanın gümüş parlaklığı, normalde görünmez olan lenf ağını kadavralarda bir harita gibi ortaya çıkarıyordu. Bu yöntem, 18. yüzyılda birçok anatomi meraklısı tarafından benimsendi.
1700’lerin başında, Amsterdam’da ünlü anatomi koleksiyonlarıyla tanınan Frederik Ruysch, lenf damarlarındaki kapakçıkların işlevine dair önemli açıklamalar yaptı. Ruysch, daha önce Jan Van Horne’un tarif ettiği valflerin lenf sıvısının tek yönlü akışını garantilediğini gösterdi. Böylece lenf akımının neden hep kalbe doğru olduğu anlaşıldı: Kapakçıklar geriye kaçışı engelliyordu. Ruysch’un incelikle hazırladığı anatomik preparatlar, cam kavanozlarda sakladığı ve kralların bile görmeye geldiği ünlü koleksiyonunda sergileniyordu. Ziyaretçiler, insan bedenindeki bu ikinci damar ağının inceliklerine hayran kalıyordu.
Bu dönemde lenf sisteminin fizyolojisi de sorgulanmaya başlandı. Lenf damarları nereden başlar, içindeki sıvı nereden gelir soruları, mikro düzeyde inceleme ihtiyacını doğurdu. İtalyan doktor Marcello Malpighi, 17. yüzyıl sonunda mikroskopla kılcal damarları keşfetmişti (kan kılcal damarlarını ilk gören oydu). Kanın atardamarlardan toplardamarlara kılcallarla geçtiği anlaşıldıktan sonra, “doku arası sıvı” kavramı doğdu. 18. yüzyılda bilim insanları, işte bu doku arası sıvının bir kısmının lenf damarlarına girdiğini düşünmeye başladılar. Yani lenf, kanın süzülen kısmından oluşuyor olabilirdi. Bu düşünce, ileride Starling yasalarıyla doğrulanacaktı ama 18. yüzyılda henüz bir hipotezdi.
İskoçya’da William Hunter ve kardeşi John Hunter, lenf sistemine merak saran öncü fizyologlar oldular. William Hunter, 1750’lerde yaptığı çalışmalarla özellikle besin emilimi konusunda devrim yarattı: Bağırsaklardaki yağların doğrudan lakteal lenf damarlarıyla emilip kana karıştığını gösterdi. O zamana kadar çoğu hekim, besinlerin bağırsaklardan portal venle karaciğere gittiğini sanıyordu. Hunter ise şilus taşıyan lakteallerin bu işte esas rolü oynadığını kanıtladı. 1754’te Londra’da Kraliyet Cemiyeti’ne sunduğu bulgular, lenf sisteminin beslenmede merkezi bir rolü olduğunu ortaya koydu. Bu büyük iddia, Edinburgh’da çalışan Alexander Monro (secundus) adlı genç bir anatomi profesörünü kızdırdı. Monro, kendi tezinde benzer fikirleri daha önce dile getirdiğini, Hunter’ın aslında onun keşiflerini sahiplenip yayınladığını iddia etti. Bu Hunter-Monro tartışması, bilim tarihinde ünlüdür. Gazeteler ve dergiler üzerinden yıllarca süren bir atışmaya dönüştü. Sonunda, 1750’lerin başında Hunter’ın ders notlarında lenf fonksiyonundan bahsettiğini kanıtlayan belgeler bulundu da, önceliğin Hunter’da olduğu anlaşıldı. Bu tartışma, lenf sisteminin önemine dair bir farkındalık yaratmış; hem Londra hem Edinburgh’da herkesin bu gizemli damarları konuşmasına yol açmıştı.
1760’larda İngiltere’de bir başka önemli araştırmacı, William Hewson, lenf sistemi üzerinde derinlemesine çalışmalar yaptı. Hewson, balıklar, kuşlar ve memeliler dahil birçok canlıyı inceledi ve lenf düğümlerinin balıklarda olmadığını, kuşlarda az sayıda bulunduğunu, memelilerde ise bolca olduğunu not etti. Bu gözlem, lenf sisteminin evrimsel bir perspektifini sunuyordu: Gelişmiş canlılarda daha karmaşık bir lenf ağı vardı. Hewson ayrıca, lenf düğümleri ve timusun işlevine dair önemli bir fikir ortaya attı: Bu organlar, lenf sıvısına “küçük tanecikler” ekliyordu. Bu tanecikler, modern terminolojiyle lenfositlere tekabül eden hücrelerdi. Yani Hewson, lenf sıvısının içinde dolaşan hücreleri fark etmiş ve bunların bu organlardan kaynaklandığını sezmişti. 1769’da Royal Society, William Hewson’ı bu parlak çalışmaları nedeniyle Copley Madalyası ile ödüllendirdi. Lenf damarlarını balıklarda ortaya koyduğu ve kan hücrelerinin yapısını açıkladığı çalışmaları, ona dönemin en büyük bilimsel onurunu kazandırdı.
Aynı dönemde John Hunter, abisi William ve dostları Hewson ve William Cruikshank ile birlikte hayvan deneyleri yaparak lenf sistemini anlamaya çalışıyordu. John Hunter, kan damarlarının yeni oluşumunu (anjiyogenez) da incelemişti; dolayısıyla damarsal sistemlere özel bir ilgisi vardı. Hunter, cerrah kimliğiyle pratikte de lenf yollarını önemsiyordu; örneğin enfeksiyonların lenf yoluyla yayılabileceğini gözlemlemişti. 1780’lerde Hunter ve Cruikshank birlikte çalışırken, Cruikshank kendi başına önemli bir eser kaleme aldı. William Cruikshank, 1786’da “İnsan Vücudunun Emilim Damarlarının Anatomisi” adlı kitabını yayınladı. Bu kitap, lenf sistemi üzerine o güne dek yazılmış en kapsamlı eserlerden biriydi. Cruikshank, lenf damarlarının insan vücudundaki dağılımını çizimlerle gösterdi ve hatta bir kadavrada memeden koltuk altı lenf düğümlerine giden lenf yollarını cıva ile doldurarak resmetti. Bu, meme kanserinin lenf yoluyla yayılması gibi kavramların çok önceden sezgisel olarak fark edildiğini gösterir. Cruikshank ayrıca lenf sıvısının içerdiği tanecikli yapıları (lenfositleri) net bir dille tarif etti; böylece Hewson’ın “kürelecikleri” somutlaşmış oldu.
- yüzyıl boyunca, sadece Britanya’da değil, Avrupa’nın dört bir yanında bilim insanları lenf sistemiyle ilgili ayrıntılı çalışmalar yaptılar. İtalya’da Paolo Mascagni’nin hocası Felice Fontana, lenf düğümlerini ve damarlarını araştırmış; Giovanni Bianchi, Giuseppe Prati, Gaetano Zumbo gibi araştırmacılar lakteal damarlar üzerine tezler yazmıştı. Almanya’da Christian Ludwig ve Samuel Sömmering gibi anatomistler, lenf sistemini tanımlayıcı eserler yayınladılar. John Sheldon adlı bir İngiliz cerrah, 1784’te “Emici Sisteminin Tarihi” diye bir kitap yazarak lenf damarlarının keşif öyküsünü ve kendi dönemine kadar yapılanları derledi. Bu eser, lenf sisteminin tarihine dair ilk derli toplu anlatılardandı ve dönemin meraklı okurlarına hitap ediyordu. Görülebileceği gibi, lenf sistemi artık tıbbın yerleşik bir parçası olarak kabul ediliyor, ancak gizeminin çözülmesi için emek harcanmaya devam ediliyordu.
Tüm bu çalışmaların zirveye ulaştığı an, Paolo Mascagni adında genç bir İtalyan anatominin sahneye çıkmasıyla geldi. Mascagni, 1770’lerde tıp eğitimini alırken lenf sistemine tutkuyla bağlandı. O dönemde lenf damarlarını kadavrada geniş kapsamlı izlemek hâlâ zordu. Mascagni, keskin zekâsı ve becerikli elleriyle bu sorunu yenmeye karar verdi. Cam tüplerden oluşan özel bir enjektör tasarladı; ucunu iğne gibi inceltti ve dik açıyla bükerek en zor köşelere ulaşabilecek bir alet yaptı. Bu alet sayesinde, cıvayı çok yavaş ve kontrollü biçimde en ince lenf kılcallarına bile enjekte edebiliyordu. Mascagni, Floransa ve Siena’da tam üç yüzün üzerinde kadavrayı bu yöntemle inceledi. Aylar süren zahmetli çalışmaları sonucunda, insan bedenindeki neredeyse tüm lenf ağını ortaya çıkarmayı başardı. Sonuçlarını önce 1784’te bir ön rapor olarak Paris Bilimler Akademisi’ne sundu ve birincilik ödülü kazandı. Ardından 1787’de devasa boyutta bir atlas şeklinde yayınladı: “Vasorum Lymphaticorum Corporis Humani Historia et Ichnographia” (İnsan Vücudunun Lenf Damarlarının Tarihi ve Tasviri). Bu eser, 41 adet büyük boy bakır gravür plakadan oluşuyordu ve her plakada insanın farklı bölgelerindeki lenf sistemi tüm detaylarıyla çizilmişti. Mascagni’nin çizimleri o kadar etkileyiciydi ki, Avrupa’nın dört bir yanında anatomi çevrelerinde hayranlık uyandırdı. Kısa sürede Mascagni “anatominin prensi” olarak anılmaya başladı.
Mascagni’nin atlası, lenf sistemi bilgisini bir sanat eserine dönüştürdü. Damarların gidiş yönlerini oklarla, bezeleri net kontürlerle gösterdi. Ayrıca Mascagni, bu atlasında sadece anatomiyi çizmekle kalmadı, bazı yenilikçi gözlemlerini de ekledi. Örneğin, beyin zarlarında (dura mater) lenf damarları olabileceğini belirtti ve buna dair çizimler yaptı. O dönem kimse beynin zarlarında lenf damarı olduğuna inanmıyordu; Mascagni’nin bu öngörüsü ancak 2010’larda modern bilim tarafından doğrulanabildi. Yine Mascagni, lenf düğümlerinin iç yapısını inceleyerek onları cıva yerine tutkalla enjekte etti; böylece sertleştirip kesitler aldı. Düğümlerin de damarlandığını, fakat cıvanın bu damarlara geçmediğini görerek, lenf düğümlerinin lenf sıvısını süzüp değiştiren filtreler olduğunu söyledi. Hatta lenf sıvısının, geçtiği organa ve kişinin yaşına göre bile farklılık gösterdiğini vurguladı. Bu, lenfin statik bir sıvı değil, dinamik bir bileşim olduğunu ilk dile getiren açıklamalardandı.
Mascagni, çağdaşı bazı bilim insanlarının hatalarını da düzeltti. Örneğin genç yaşta ölen bir Charles Darwin (ünlü Darwin’in amcası) doktora tezinde “lenf damarlarının bazen ters yönde akabileceği” gibi bir fikir öne sürmüştü. Erasmus Darwin (Charles’ın dedesi) bu tezi İngilizce’ye çevirip 1780’de yayımlamıştı. Mascagni, Darwin’in bu iddiasını deneylerle çürüttü ve lenf damarlarında geriye doğru bir akış olamayacağını, kapakçıkların bunu engellediğini kesin biçimde gösterdi. Bu tartışma, bilim dünyasında geleneksel düşünceye körü körüne bağlanılmaması gerektiğini, deney ve gözlemin esas olduğunu vurgulayan güzel bir örnek oldu.
Mascagni’nin ardından da lenf sistemi araştırmaları sürdü. Onun öğrencisi Regolo Lippi, 1800’lerin başında lenf ve toplardamarlar arasında mikroskopik düzeyde bağlantılar olabileceğini öne sürerek, lenf sıvısının bazı ufak damlacıklarla doğrudan kana sızdığını iddia etti. Yine 19. yüzyıl başlarında Vincenzo Fohmann, Mascagni gibi cıva enjekte ederek en küçük lenf kılcallarını bile ortaya koymaya çalıştı. Fohmann özellikle lenf sistemi ile toplardamarlar arasındaki bağlantıları araştırdı ve bazı preparatlar hazırladı. Bu preparatlar, uzun yıllar müzelerde sergilenerek sonraki bilim insanlarına ilham verdi.
- yüzyılın sonunda artık anatomi kitaplarında lenf sistemi bölümü kapsamlı yer almaya başlamıştı. Lenf damarlarının bağırsak villuslarından başladığı, tüm vücudu sardığı, sonunda göğüs kanalıyla kana karıştığı çizimler ve tariflerle sabitti. Üstelik lenf düğümlerinin varlığı ve görevi de yavaş yavaş anlaşılmaktaydı. Fakat lenf sisteminin tam işlevi –örneğin bağışıklıkla ilişkisi– henüz tam açıklığa kavuşmuş değildi. 19. yüzyılla birlikte mikroskoplar güçlenecek, fizyoloji ve patoloji bilimleri doğacak ve lenf sisteminin sırrının kalan kısmı çözülmeye başlayacaktı.
19. Yüzyıl: Mikroskobik Keşifler ve Bağışıklık Sisteminin Doğuşu
- yüzyıl, bilimin mikro düzeye indiği, hücrelerin ve mikropların keşfedildiği bir dönemdi. Bu yüzyılda lenf sistemi araştırmaları da makroskopik anatomi safhasından mikroskopik ve işlevsel inceleme safhasına geçiş yaptı. Artık mesele sadece “lenf damarları nerededir?” değil, “lenf sistemi ne işe yarar, sıvısı ve hücreleri neler yapar?” sorularıydı.
1800’lerin hemen başında anatomistler, lenf damarlarının embriyoda nasıl oluştuğunu tartışıyordu. Kimileri lenf damarlarının bağımsız kanallar olarak mezenkimden oluştuğunu öne sürerken, kimileri de kan damarlarından tomurcuklandığını düşünüyordu. Bu tartışma, ileride Florence Sabin’in çalışmalarıyla çözülecekti ama henüz ortada net bir cevap yoktu.
Mikroskop altındaki ilk büyük bulgulardan biri, lenf sıvısının hücresel içeriği oldu. 19. yüzyılın başlarında kanın içindeki akyuvarlar zaten keşfedilmişti (1810’larda hekim William Hewson’un bulguları o zaman anlaşılmasa da sonraki nesil akyuvarları tanımladı). Alman bilim insanı Theodor Schwann ve Matthias Schleiden hücre teorisini 1830’larda ortaya koyarken, kan ve lenf gibi sıvıların da hücreler içerdiğini biliyorlardı. Virchow gibi patologlar, inflamasyonlu (iltihaplı) lenf düğümlerini inceleyip içlerinde bolca akyuvar (lenfosit) gördüler. Bu nedenle lenf düğümlerinin bir tür hücre fabrikası gibi çalıştığı fikri benimsendi. 1840’larda Virchow, kan kanserlerinden birine “lenfatik lösemi” adını verdi; çünkü kanda gördüğü anormal beyaz hücrelerin lenf sisteminden kaynaklandığını düşünüyordu. Yine Virchow, bazı kanserlerin boyundaki lenf düğümüne sıçramasını gözlemleyip, sol köprücük üstü lenf düğümünün şişmesinin mide kanseri belirtisi olabileceğini kaydetti (bu bulgu daha sonra “Virchow nodülü” olarak anıldı). Bütün bunlar lenf sisteminin hastalıklarla ilişkisini ortaya koyuyordu: Hem kanser yayılımında, hem kan hastalıklarında, hem enfeksiyonlarda lenf düğümleri kritik rol oynuyordu.
1832 yılında İngiliz hekim Thomas Hodgkin, lenf düğümlerini tutan garip bir hastalığı tanımladı. Boyundaki, koltukaltındaki bezeler kocaman şişiyor, hastalar zayıf düşüyordu. Hodgkin bu tabloyu ayrıntılı raporladı; ileride bu hastalığa onun adı verildi (Hodgkin lenfoması). Hodgkin’in keşfi, lenf sisteminin de kendine özgü hastalıkları olabileceğini gösterdi. Lenf bezlerinin sadece vücudun tepki veren pasif parçaları değil, bizzat hastalık odağı olabileceği anlaşıldı. Bu, lenf sistemi üzerine ilgiyi artırdı.
- yüzyılın belki de en büyük bilim devrimlerinden biri, mikrop teorisinin gelişmesiydi. 1870’lerde Pasteur ve Koch, hastalıkların mikroorganizmalardan kaynaklandığını gösterdiler. Bu, lenf sisteminin savunmadaki rolünü aydınlatmaya başladı: Enfeksiyon kapıldığında, ilk şişen yerler lenf düğümleriydi (örneğin boğaz enfeksiyonunda boyun bezeleri, veba gibi hastalıklarda kasık bezeleri şişer). Patologlar artık bu şiş bezeleri mikroskopla kesip içinde mikropları, cerahat hücrelerini görebiliyordu. Lenf düğümleri, bedenin karakolları gibiydi; mikroplar burada tutuluyor, asker hücreler (akyuvarlar) burada çoğalıyordu.
Lenf sistemiyle ilgili bir başka gizem de, antik çağdan beri bilinen fil hastalığının sebebiydi. 19. yüzyılda Patrick Manson adında bir İngiliz hekim, Çin’de çalışırken elefantiyazis vakalarını inceledi ve hastaların kanında ipliksi parazitler fark etti. 1877’de Manson, sivrisineklerin ısırdığı insanlarda bu parazitlerin lenf kanallarına yerleşerek tıkanıklık yaptığını keşfetti. Sonunda fil hastalığının etkeni filaria kurtçuğu ve taşıyıcısı sivrisinek olarak bulundu. Bu büyük keşif, lenf damarlarının tıkandığında neler olabileceğini gösterdi: Sıvı akamazsa, ilgili organ şişer ve şekli bozulurdu. Lenf akımı, vücut sıvı dengesinde hayatiydi.
O yıllarda fizyoloji alanında da önemli ilerlemeler oldu. 1858’de Fransız fizyolog Claude Bernard, vücudun “milieu intérieur” (iç ortam) kavramını ortaya attı. Bernard, hücrelerin sabit bir iç ortamda yaşaması gerektiğini, bu iç ortamın kan ve doku sıvılarından oluştuğunu söyledi. Lenf sıvısı işte bu iç ortamın bir parçasıydı ve Bernard bunu sezgisel olarak anlamıştı. 1890’lara gelindiğinde İngiliz fizyolog Ernest Starling, kılcal damarlardan sıvı geçişini açıklayan yasalarını yayımladı. Starling’e göre, kan basıncı kılcal damarın başında plazmayı dokuya süzüyordu, ama kılcalın sonunda ozmotik basınçla sıvının çoğu geri emiliyordu. Yine de tüm sıvı geri dönmüyor, bir kısmı doku aralarında kalıyordu; işte bu kalan sıvı, lenf kapillerleri tarafından emilip dolaşıma iade ediliyordu. Starling’in bu hesaplamaları, lenf oluşumunun temel mekanizmasını matematiksel bir temele oturttu. Artık lenf; kapalı damar sisteminden sızan, hücreler arası boşluğu yıkayan ve sonra kendi özel kanallarıyla geri dönen bir arınma ve denge sıvısı olarak anlaşılıyordu.
- yüzyıl boyunca lenf sisteminin anatomisi de daha da detaylandırıldı. Alman anatomist Friedrich von Recklinghausen, 1862’de mezenterik lenf damarlarının uçlarında küçük açıklıklar (stomata) olduğunu keşfetti. Bu açıklıklar, lenf kapillerlerinin başlangıcında hücreler arasından sıvı almasını sağlayan mini kapılardı. Böylece lenf damarlarının “uçlarının kapalı bir boru değil, emici birer ağız” olduğu anlaşıldı. İtalyan bilim insanı Giuseppe Bizzozero, dalakta ve lenf düğümlerinde “retiküler hücreler” ve “dev hücreler” tarif etti; yani lenfatik organların dokusunu çözmeye başladı. 1880’lerde Rus biyolog İlya Meçnikov, denizyıldızı larvalarında yabancı partikülleri içine alıp yok eden hücreler gözlemledi. Bu hücrelere fagosit adını verdi. Sonra memelilerde beyaz kan hücrelerinin (özellikle lenf düğümlerindeki makrofajların) aynı işi yaptığını fark etti. Bu, bağışıklık sisteminin hücresel kolunun anlaşılmasıydı ve lenf sistemi bu olayın merkezindeydi.
Yüzyılın sonunda, bağışıklık bilimi (immünoloji) bağımsız bir disiplin olarak doğduğunda, lenf bezleri ve lenfositler onun baş aktörleri haline gelmişti. 1890’larda Paul Ehrlich antikor kavramını geliştirdiğinde, o antikorları üreten B hücrelerinin aslında lenf düğümlerinde olgunlaştığı ortaya çıkacaktı. Fakat o zaman için mekanizma meçhuldü; sadece lenf sistemi vücudun savunmasında kilit rol oynuyor denebilirdi.
Özetle 19. yüzyıl, lenf sisteminin bir filtre ve savunma sistemi olarak anlaşılmaya başlandığı, fizyolojik rolünün çözüldüğü, patolojik durumlarının tanımlandığı bir dönem oldu. Anatomi artık lenf damarlarının haritasını tamamlamış, fizyoloji lenf akımının kaynak ve amaçlarını açıklamış, patoloji ise lenf sisteminin hastalıklarını ve bağışıklık yanıtındaki önemini ortaya koymuştu. Ancak hala bilinmeyenler vardı: Lenf damarları nasıl gelişiyordu? Moleküler düzeyde nasıl kontrol ediliyordu? 20. yüzyıl, işte bu kalan soruların peşine düşecekti.
20. Yüzyıl: Moleküler Düzeyde Anlayış ve Yeni Kavramlar
- yüzyıla girildiğinde, lenf sistemi hakkındaki temel anatomik ve fizyolojik bilgiler yerine oturmuştu. Bu yüzyılın ilk yarısında bilim insanları, lenf sistemini daha derinlemesine, hücresel ve gelişimsel düzeyde incelemeye başladılar. Ayrıca teknolojik gelişmeler sayesinde lenf damarlarının görüntülenmesi ve klinik uygulamaları gündeme geldi.
1902 yılında Amerikalı araştırmacı Florence R. Sabin, uzun zamandır süregelen “lenf damarları nasıl oluşur?” tartışmasına netlik kazandırdı. Sabin, domuz embriyolarını dilimler halinde kesip mikroskop altında boyayarak inceledi. Erken embriyonik dönemde, büyük toplardamarlardan tomurcuklanan ince kanallar gördü. Bu kanalcıklar, büyüyüp lenf damarlarına dönüşüyordu. Yani Sabin’e göre, lenf sistemi embriyonik gelişimde toplardamarlardan çıkarak oluşuyordu. Bu keşif, lenf damarlarının kökenine dair doğru teoriyi kanıtladı ve Sabin’i tarihin önemli kadın bilimcileri arasına soktu. O dönem Sabin’in bulgularına alternatif görüşler de savunuldu (mesela Huntington ve McClure adlı iki bilim insanı lenf damarlarının bağımsız mezenkimal yarıklardan oluştuğunu iddia ediyordu), ancak zaman Sabin’i haklı çıkardı.
- yüzyılın başlarında immünoloji hızla ilerlerken, lenf düğümleri ve dalak gibi lenfoid organların işlevi netleşti: Lenfositler denilen özel akyuvarlar buralarda gelişiyor, çoğalıyor ve vücudu mikroplara karşı koruyordu. Özellikle 1960’larda B hücresi ve T hücresi kavramları ortaya atıldığında, B harfinin Fabricius bursasından geldiği; T harfinin ise timustan (lenf sisteminin bir organı) geldiği anlaşıldı. Yani bağışıklık sisteminin iki ana aktörü, isimlerini doğrudan lenfatik yapılardan almıştı. 1973’te Ralph Steinman adlı araştırmacı, lenf düğümlerinde “dendritik hücre” adını verdiği yeni bir hücre tipi keşfetti; bunun vücuda giren mikropları diğer bağışıklık hücrelerine tanıtan hücre olduğu anlaşıldı. Bu ve benzeri keşiflerle lenf düğümleri, bağışıklık yanıtının düzenlendiği komuta merkezleri olarak iyice önem kazandı.
Teknolojik açıdan, görüntüleme teknikleri lenf sistemine uyarlanmaya başladı. 20. yüzyıl ortalarında radyoloji ilerlerken, İngiliz cerrah Norman Bethune ve daha sonra Dr. Kinmonth, lenf damarlarına kontrast madde verip röntgen çekme fikrini hayata geçirdiler. 1952’de Kinmonth, ayağın lenf damarına özel bir boya enjekte ederek çektiği X-ray filminde, bacak boyunca uzanan lenf damarlarını siyah beyaz izlemeyi başardı. Bu yöntem lenfanjiyografi olarak tıp literatürüne girdi ve ilk defa yaşayan bir insanda lenf sistemi damarları görüntülenebilmiş oldu. Lenfanjiyografi, lenf tıkanıklıklarının ve kanser yayılımlarının tanısında devrim yarattı; çünkü artık doktorlar tümör hücrelerinin hangi lenf düğümüne kadar ilerlediğini haritalayabiliyordu.
Lenf sistemiyle ilgili cerrahi yaklaşımlar da gelişti. Örneğin kanser cerrahisinde, tümörün yakındaki sentinel (nöbetçi) lenf düğümünü bulup çıkarmak önemli hale geldi. 1990’larda geliştirilip rutine giren sentinel lenf düğümü biyopsisi tekniği, aslında lenf yollarının düzenli haritasına dayanıyordu: Tümör hücreleri önce en yakın lenf düğümüne gider, sonra sıradakine. Bu konsept, lenf sisteminin öngörülebilir yol haritaları sunduğunu gösterdi ve binlerce hastanın gereksiz büyük ameliyatlardan korunmasını sağladı.
- yüzyılın ikinci yarısında bilim insanları lenf damarlarını sadece anatomi ve görüntüleme ile değil, moleküler düzeyde de mercek altına aldılar. Doku boyama tekniklerinin gelişmesiyle, lenf damarlarına özgü yapılar arandı. 1980’lerde elektron mikroskobuyla lenfatik kapakçıkların ultrastrüktürü çözüldü; kaslı lenf damarlarının periyodik kasılmalarla lenfı ileri pompaladığı gözlendi. 1990’lara gelindiğinde, genetik ve hücre biyolojisi alanındaki ilerlemeler, lenf damarlarına özel proteinlerin ve genlerin keşfini mümkün kıldı.
1995 yılında Finlandiyalı bilim insanı Kari Alitalo ve ekibi, VEGF-C adlı bir büyüme faktörünü tanımladılar. Bu molekülün özellikle lenfatik endotelyum için bir büyüme sinyali olduğu anlaşıldı. Kısa süre sonra VEGF-C’nin reseptörü olan VEGFR-3 adlı alıcının, gelişim sırasında kan damarı endotellerinden lenf damarı endotellerine dönüşümde kritik rol oynadığı keşfedildi. Bu keşifler, lenfanjiyogenez (lenf damarı oluşumu) alanını doğurdu. Artık araştırmacılar deney hayvanlarında yeni lenf damarları oluşturabiliyor veya tam tersine, lenf damarlarını devre dışı bırakabiliyordu. Bu da tıpta yeni umutlar anlamına geliyordu: Kanser metastazını engellemek için tümörün lenf damarı oluşturmasını önlemek veya lenf ödemi tedavisi için yeni lenf damarları büyütmek gibi fikirler, somut araştırma konularına dönüştü.
Moleküler çalışmalardaki bir diğer adım, lenf damarlarına özgü işaretleyici proteinlerin belirlenmesiydi. 2000’lerin başında bilim insanları, lenf damarı endotel hücrelerinde bolca bulunan PROX1, Podoplanin (D2-40) ve LYVE-1 gibi moleküller tespit ettiler. Bu sayede artık mikroskop altında bir damar görüldüğünde, özel boyalarla onun lenf damarı mı yoksa kan damarı mı olduğu anlaşılabiliyordu. Bu, hem araştırmada hem patologların işinde devrim yarattı; zira önceden lenf kılcalları ile kan kılcallarını ayırt etmek çok zordu.
Lenf sistemi, on yıllardır bilinse de, 20. yüzyılın sonlarına kadar genelde “unutulmuş bir dolaşım” muamelesi görmüştü. Oysa modern tıp, lenf damarlarının kritik rollerini hatırlamak zorunda kaldı. Özellikle kanser sahasında: Tümörlerin yayılma yollarından biri lenfatik sistemdi. Meme kanseri, melanoma gibi kanserlerde, kanser hücreleri önce yakın lenf düğümlerine sıçrar oradan vücuda dağılır. Bu yüzden 1970’lerden itibaren onkologlar lenf düğümlerine çok önem vermeye başladılar. Kanser cerrahisinde tümörle birlikte bölgesel lenf bezelerinin de çıkarılması standart hale geldi. Patologlar, ameliyatla alınan lenf düğümlerini didik didik inceleyip içinde mikroskobik tümör var mı bakmaya koyuldular. Lenf düğümüne sıçramış bir kanser, vücuda yayılma potansiyeli taşıyordu ve tedavide daha agresif yaklaşmak gerekirdi. İşte bu klinik ihtiyaçlar, lenf sistemi bilgisini uygulamaya dökerek çok sayıda hayat kurtardı.
Diğer yandan, lenfödem gibi lenf sistemi hastalıklarına yönelik yeni tedaviler geliştirildi. Kronik lenfödem (genellikle kanser ameliyatı sonrası koldaki veya bacakdaki şişlik), yaşam kalitesini düşüren bir sorundu. 20. yüzyılın sonunda cerrahlar, mikroskobik tekniklerle lenf damarlarını toplardamarlara dikerek (lenfovenöz anastomoz) ödemi azaltma operasyonları yapmaya başladı. Ayrıca hasarlı lenf yollarını onarmak veya lenf düğümü nakletmek gibi yenilikçi cerrahi yöntemler denendi. Bütün bunlar, lenf sisteminin ihmal edilemeyecek kadar önemli olduğunu bir kez daha gösteriyordu.
21. Yüzyıl: Çağdaş Keşifler ve Süregelen Merak
İçinde bulunduğumuz yüzyıl, lenf sistemi araştırmalarında bile hala şaşırtıcı keşiflerin mümkün olduğunu bize gösterdi. Yüzyıllardır anatominin en iyi bilindiği düşünülen yerlerinde bile lenf sistemiyle ilgili yeni yapılar bulunabildi. Bu durum, bilimin bitmeyen bir merak yolculuğu olduğunun kanıtı niteliğindedir.
2015 yılında, Virginia Üniversitesi’nden Jonathan Kipnis ve ekibi, farelerde beynin zarları içinde daha önce fark edilmemiş lenf damarları keşfettiklerini duyurdular. Bu meningeal (beyin zarı) lenfatik damarları, beyin-omurilik sıvısını drenaj eden, başın derinindeki lenf düğümlerine bağlanan ince damarlardı. Aynı yıl Finlandiya’dan Kari Alitalo’nun grubu da benzer yapıları insan kadavralarında görüntülemeyi başardı. Bu buluş, bilim dünyasında heyecanla karşılandı: Onca yıl “beyinde lenfatik sistem yok” diye öğretilmiş, oysa aslında kafatasının içinden lenf akışı gerçekleşiyormuş! İlginç olan şu ki, Paolo Mascagni 1787’deki atlasında insan dura mater’inde olası lenf damarları çizmişti, ancak sonraki anatomistler bunu görmezden gelmişti. Yüzyıllar sonra Mascagni’nin önsezisi doğrulanmış oldu. Beyin gibi mahrem bir bölgede bile lenf sisteminin bulunması, nörolojik hastalıklardan Alzheimer’a kadar pek çok konuya yeni bir bakış açısı getirdi. Beynin bir “temizlik” sistemi olduğu, atık maddelerin bu meninks lenfatikleriyle uzaklaştırılabileceği anlaşıldı.
Beynin temizlik mekanizmasıyla ilgili bir diğer çarpıcı kavram, “glimfatik sistem” adıyla 2012’de ortaya atıldı. Danimarkalı bilim insanı Maiken Nedergaard, beyinde uykuda iken beyin omurilik sıvısının adeta bir dalga gibi beynin içinden geçtiğini ve atıkları süpürdüğünü keşfetti. Bu süreçte beyin destek hücreleri (glialar) aktif rol aldığı için buna glia + lenfatik kelimelerinin birleşimi olan “glymphatic” (glimfatik) sistem denildi. Glimfatik sistem, geleneksel lenf damarlarından biraz farklı çalışsa da, nihayetinde atık sıvıyı beyinden dışarı meninkslerdeki lenf damarlarına yönlendiriyordu. Bu buluşlar, uyku esnasında beynimizin adeta bulaşık makinesi gibi kendini yıkadığını ve lenfatik sistemin bu temizliğin ayrılmaz bir parçası olduğunu ortaya koydu. Alzheimer hastalığı gibi durumlarda bu glimfatik akımın bozulduğu ve beynin toksik protein biriktirdiği düşünülüyor. Dolayısıyla günümüz araştırmalarında lenf sistemi, nörolojik hastalıklardan psikiyatriye kadar yepyeni alanlarda söz sahibi olmaya başladı.
Modern teknolojiler, lenf sistemine hiç olmadığı kadar ayrıntılı bakabilmemizi sağlıyor. Örneğin yakın dönemde geliştirilen yüksek çözünürlüklü 3D görüntüleme yöntemleri sayesinde, araştırmacılar lenf damarlarını üç boyutlu olarak dokular içinde canlandırabiliyorlar. 2000’lerde İtalyan bilim insanı Leonardo Comparini, karaciğerin lenf damarlarını üç boyutlu rekonstruksiyonlarla inceleyerek, bu organın lenf ağıyla kan damarlarının ilişkisini detaylandırdı. Lenf damarlarının kimi segmentlerinde kas tabakası varken, bazılarında olmadığı; düz kasların helikal dizilimlerle pompa görevi yaptığı Comparini’nin çalışmalarında gösterildi. Günümüzde benzer teknikler, tüm organların lenf haritalarını çıkarmak için kullanılıyor.
Çağdaş araştırmalar, lenf sisteminin hastalıklarla ilişkisi üzerine de yoğunlaşıyor. Örneğin, uzun yıllar lenf damarlarının gözde olmadığı sanılırdı; ancak yakın zamanda göz küresinin iç sıvısını boşaltan Schlemm kanalı adlı yapının aslında bir tür lenfatik kanal olduğu anlaşıldı. Bu, glokom (göz tansiyonu) hastalığının tedavisine yeni yaklaşımlar getirdi, çünkü glokomda bu kanalın tıkanması basıncı yükseltiyor. Yine obezite araştırmalarında, yağ dokusunun lenf akımını bozarak ödem ve iltihaplanmaya yol açtığı bulundu; obez insanların lenfatikleri yetersiz kalabiliyor ve bu bir kısır döngü yaratıyor.
Kanser araştırmalarında, tümörlerin salgıladığı lenfanjiyogenik faktörler keşfedildi. Yani bir tümör, yayılmak için çevresine yeni lenf damarları filizlendiriyor; tıpkı kan damarları filizlendirip beslenmesi gibi. Bu yüzden kanser tedavisinde anti-anjiyojenik (damar oluşumunu engelleyen) ilaçlar yanında anti-lenfanjiyojenik stratejiler de gündeme geldi. Örneğin hayvan deneylerinde, VEGF-C sinyalini engelleyerek tümörlerin lenf yolu ile metastaz yapması azaltıldı. Belki gelecekte kanser, lenf yolu inşa etmeden önce durdurulabilecek.
Lenf sistemi aynı zamanda çeşitli bağışıklık terapileri için de hedef oluyor. Kanser immunoterapisinde, hastanın T hücrelerini güçlendirmek ve yönlendirmek için lenf düğümlerine özel ilaç taşıyıcıları geliştiriliyor. Aşı teknolojilerinde, aşının aktif parçacıklarının doğrudan lenf düğümlerine gitmesi, daha güçlü bağışıklık yanıtı oluşturuyor. Nanoparçacıklarla lenf düğümüne ilaç veya antigen taşımak, çağdaş biyomedikal araştırmaların gözde konularından.
Kliniğe dönersek, lenf sistemi hastalıklarının yönetimi de ilerledi. Örneğin lenfödem tedavisinde, 21. yüzyılda gen tedavisi denemeleri başladı: VEGF-C genini problemli bölgeye vererek orada yeni lenf damarı oluşumunu tetiklemek hedefleniyor. Bazı ilk denemelerde, kol ya da bacak lenfödemi olan hastalarda bu genin eklenmesi kısmi iyileşme sağladı. Yine lenf düğümü nakilleri, mikrocerrahiyle sağlıklı lenf düğümlerinin hasarlı bölgeye taşınması şeklinde uygulamaya girdi ve umut vaat ediyor.
Görüldüğü gibi, antik çağlardan beri merak edilen lenf sistemi, hala modern bilimin aktif bir araştırma alanı. Günümüzde laboratuvarlar, lenfatik damarların kök hücrelerle yeniden üretilmesi, lenfatik pompaların yapay olarak kontrolü, veya lenf sıvısının analiz edilerek hastalık teşhisi için kullanılabilmesi gibi yenilikçi projeler üzerinde çalışıyor.
Bu bitmeyen keşif yolculuğunda, insanlık lenf sistemine bakışında tam bir daire çizmiştir denebilir. Hipokrat ve Aristoteles zamanında belirsiz bir merak konusu olan “berrak sıvı”, şimdi moleküllerine kadar analiz edilebilen bir araştırma nesnesi. Ancak her cevap, yeni sorular getirmeye devam ediyor. Lenf sistemi; vücudun sıvı dengesinin koruyucusu, besin emiliminin aracısı, bağışıklık ordusunun yolları ve hastalıkların gizli taşıyıcısı olarak çok yönlü bir aktör.
Bilimsel merak ve entelektüel ilerleme duygusu, lenf sisteminin keşif hikayesinin her sayfasında hissediliyor. Antik hekimlerin anlam veremediği bezeler, Rönesans araştırmacılarının sabırla izini sürdüğü süt damlacıkları, 17. yüzyıl dâhilerinin göz kamaştırıcı buluşları, 18. yüzyılın titiz haritalamaları, 19. yüzyılın mikroskobik aydınlanmaları ve 20.-21. yüzyılların moleküler devrimleri… Her nesil, bir öncekinin mirasını devralıp üstüne koyarak ilerledi. Bu süreçte kimi zaman tesadüfler, kimi zaman inatçı rekabetler, kimi zaman da iş birliği destanları yaşandı.
Lenf sisteminin öyküsü, tıbbın ve bilimin bir serüven romanı gibidir. İlk sayfalarda sisler içinde kalan bir gizem, sayfalar ilerledikçe çözülür; fakat roman hiçbir zaman tam olarak bitmez, çünkü son bölümde yeni bir bilmecenin ipuçları belirir. Bugün hala lenf sisteminin tam olarak çözülmemiş yönleri var ve bilim insanları merakla bu sırların peşinde koşuyor. Gelecekte belki de vücudun bu “unutulmuş dolaşımı” bize bambaşka sürprizler sunacak.
İşte bu yüzden, lenf sistemi keşfinin hikayesi sadece geçmişte kalan bir tarih değil, devam eden bir macera olarak tüm heyecanıyla sürmektedir.
İleri Okuma
Aselli, G. (1627) De lactibus sive lacteis venis. Mediolani.
Peyer, J. C. (1677) Exercitatio anatomico-medica de glandulis intestinorum. Schaffhausen.
Starling, E. H. (1896) On the absorption of fluids from the connective tissue spaces. Journal of Physiology, 19, 312–326.
Sabin, F. R. (1902) On the origin of the lymphatic system from the veins and the development of the lymph hearts and thoracic duct in the pig. American Journal of Anatomy, 1, 367–389.
Gowans, J. L. (1959) The recirculation of lymphocytes from blood to lymph in the rat. Journal of Physiology, 146, 54–69.
Miller, J. F. A. P. (1961) Immunological function of the thymus. The Lancet, 278, 748–749.
Földi, M., Földi, E. (1989) Földi’s Textbook of Lymphology. Urban & Fischer, München/Jena.
Weissleder, H., Schuchhardt, C. (2001) Lymphedema: Diagnosis and Therapy. Viavital Verlag, Köln.
Alitalo, K. (2011) The lymphatic vasculature in disease. Nature Medicine, 17, 1371–1380.
Aspelund, A., Robciuc, M. R., Karaman, S., Makinen, T., Alitalo, K. (2016) Lymphatic system in cardiovascular medicine. Circulation Research, 118, 515–530.
Mortimer, P. S., Rockson, S. G. (2014) New developments in clinical aspects of lymphatic disease. Journal of Clinical Investigation, 124, 915–921.
Levick, J. R., Michel, C. C. (2010) Microvascular fluid exchange and the revised Starling principle. Cardiovascular Research, 87, 198–210.
Lenfatik drenaj
- Lenf, vücut dokularından lenf kılcal damarları tarafından boşaltılır, daha sonra lenfatik damarlar ve ikincil lenfatik organlarda dolaşır.
- Lenf, torasik kanal ve sağ lenfatik kanal yoluyla kan dolaşımına yeniden girer.
- Şil (lenf ve trigliseridler) sindirim sırasında bağırsaktan alınır ve torasik kanal yoluyla venöz sisteme boşaltılması için taşınır.
- Torasik kanal: sağ kol, göğüs kafesinin sağ tarafı ve sağ baş ve boyun bölgesi dışındaki tüm vücut bölümlerinden lenf sıvısını boşaltır
- Cysterna chyli: diyaframın sol krusuna yakın uzanan genişlemiş bir lenfatik kese, Torasik kanalın ortaya çıktığı yer
- Torasik kanal sisterna chyli’den devam eder, arka mediastenden (torasik aort solunda) yükselir ve sol venöz arkın içine boşalır (sol subklavyen ven ile sol iç juguler ven birleşimi)
- Drenler 4 litreye kadar lenf / gün
- Sağ lenfatik kanal: sağ koldan, toraksın sağ tarafından ve sağ baş ve boyun bölgesinden lenf sıvısını tahliye eder. Sağ subklavyen gövde, sağ bronkomediastinal gövde ve sağ juguler gövdenin birleşim yerinden başlar ve sağ venöz ark içine boşalır (sağ subklavyen ven ile sağ iç juguler ven birleşimi)
- Torasik kanal, lenfatik bir yapıdır. Karından başlarve venöz sistemde drenaj için toraks boyunca ilerler. Beraber şil olarak adlandırılan hem emülsifiye edilmiş yağ hem de lenf taşır. Lenfatik kanalların, özellikle torasik kanalın yaralanması şilotoraksa neden olur.
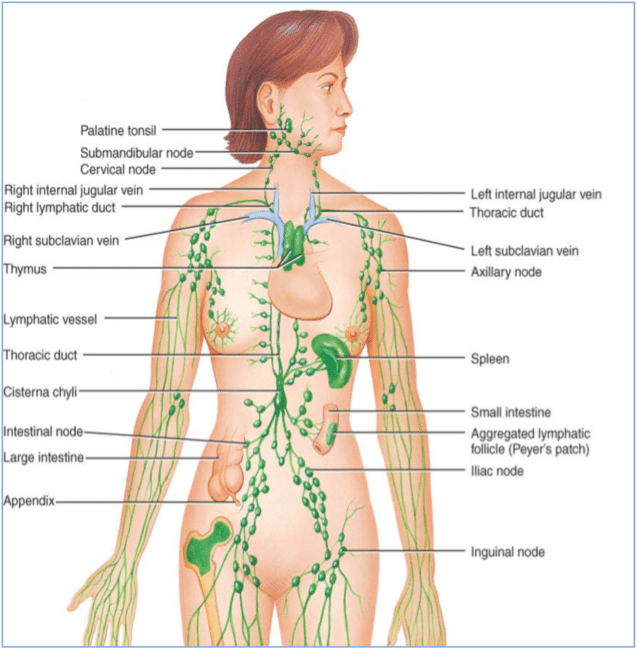
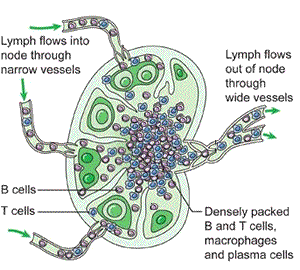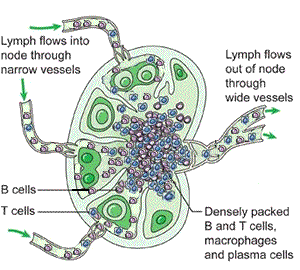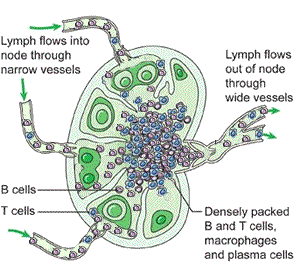
doğal öldürücü hücre
-viral enfeksiyon veya tümör de önemli rol oynar.
-cytotoxik özelliğe sahiptir.
-antijen algılayamaz veya antijen hafızası yoktur.
-mhc 1 komplex eksikliğinde tepkimeye girer.
th hücreleri
t lymphocyt lerin alt koludur.
-toksik faaliyeti yoktur .sadece fagositoz yapabilir.
-cd4 reseptörünü tanıma
-iki çeşiti vardır:
th1:öncelikle makrophaglarla etkileşime geçer. onlarla kurduğu temas ile zytokin(örneğin; ınterferon) salgılar.
th2:b hücreleri aktive etmesi için önemlidir. antikor üretimini arttırır.
Tc hücreleri
(bkz: t lymphocyt) lerin koludur.
-sitoplazmada bulduğu mikropları öldürür.
-cd8 reseptörlerini tanıma.
-mhc 1 komplexi tanıma. bunlar çekirdekli hücreler tarafından yapılır.
-yabancı hücreleri parçalar.
Capsula interna
İç kapsül. (bkz: capsula) (bkz: interna)
- İç kapsül, serebrumun (telensefalon) bir parçasıdır. İçte Nucleus caudatus ve talamus, dışta putamen ve pallidum ile sınırlıdır.
Dahili kapsül, afferent ve efferent beyaz cevher çıkıntı liflerinin bir konsantrasyonunu içeren derin bir subkortikal yapıdır. Anatomik olarak, bu hem motor hem de duyusal projeksiyon liflerinin yüksek konsantrasyonu nedeniyle önemli bir alandır. - Afferent lifler talamusun hücre gövdelerinden kortekse geçer ve efferent lifler korteksin hücre gövdelerinden orta beynin serebral sapına geçer.
- İç kapsülden gelen lifler korona radiataya katkıda bulunur.
- İç kapsül beyaz maddeden oluşur ve serebral korteksten pons, medulla oblongata ve medulla spinalise kadar bazı önemli lif bağlantılarını içerir.
Anatomi
İç kapsül beş parçadan oluşur. Bunlar iç kapsül 1,2’nin ön uzuv, genu, arka uzuv, retrolentiform ve sublentiform parçalarıdır:
- Ön uzuv (anterior crus)
- Medialde kaudat nükleusun başı ile lateralde lentiform nukleus arasında yer alır.
- Ön talamik radyasyon ve frontopontin lifleri içerir
- Genu
- Lentiform çekirdeğin apeksinin medialinde yer alır
- Kortikonükleer lifler içerir (önceden kortikobulbar lifler olarak adlandırılır)
- Arka uzuv (posterior crus)
- Medialde talamus ile lateralde lentiform nükleus arasında yer alır.
- Arka ekstremitenin ön üçte ikisinde uzanan kortikospinal lifler
- Önden arkaya doğru lifler: kol, el, gövde, bacak, perine
- Ventral posterior talamik çekirdekten gelen somatosensör lifleri içeren orta talamik radyasyon
- Retrolentiform parçası
- Lentiform çekirdeğin arkasında bulunur
- Genikülokalkarin veya optik radyasyon(lateral genikulat çekirdekten)
- Kortikopontin lifleri (parietopontin ve oksiptopontin lifleri)
- Sublentiform parçası
- Lentiform çekirdeğin altında bulunur
- Işitsel radyasyonlar (medial genikulat çekirdekten)
- Temporopontin lifleri
Kan temini
- İç kapsülün kanlanması değişkendir, ancak genellikle orta serebral arter ve ön serebral arterin küçük perforan dallarından gelir.
- Bunlar sırasıyla lateral lentikülostriat arterleri ve Heubner’in rekürren arterini içerir.
- Ayrıca, iç karotid arterden gelen ön koroid arter, iç kapsülün arka uzvu ve retrolentiform kısmını besler.
radyografik özellikler
BT
- insular korteks seviyesindeki aksiyal görüntülerde en iyi şekilde değerlendirilir
- çevreleyen bazal gangliyon yapılarına nispeten hipodens görünür
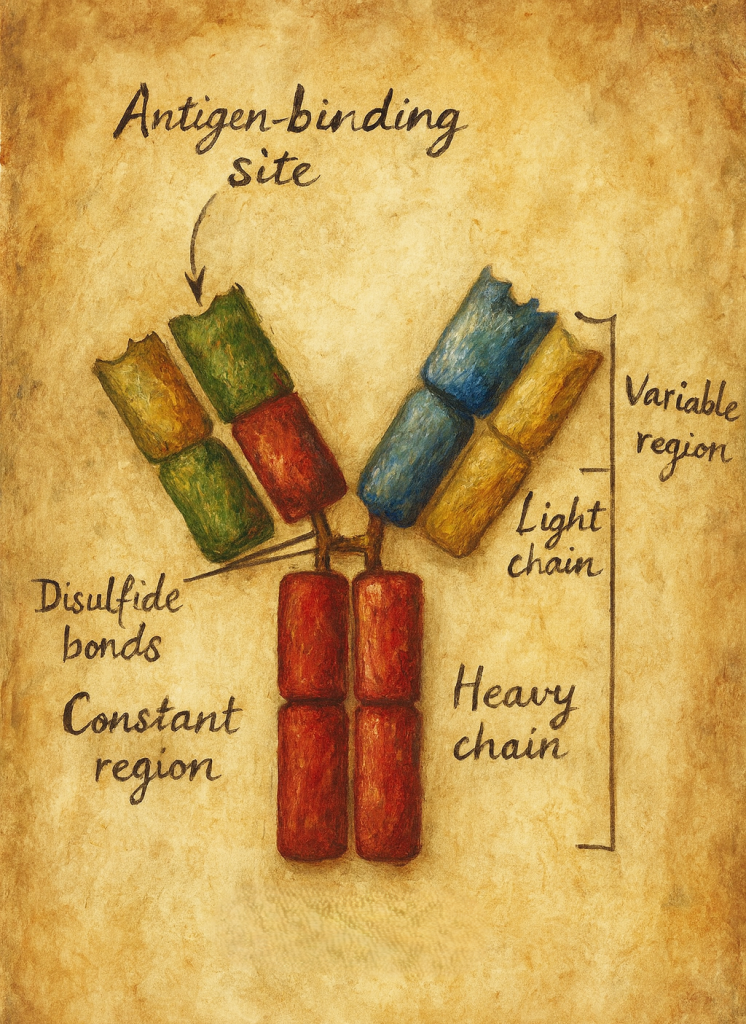
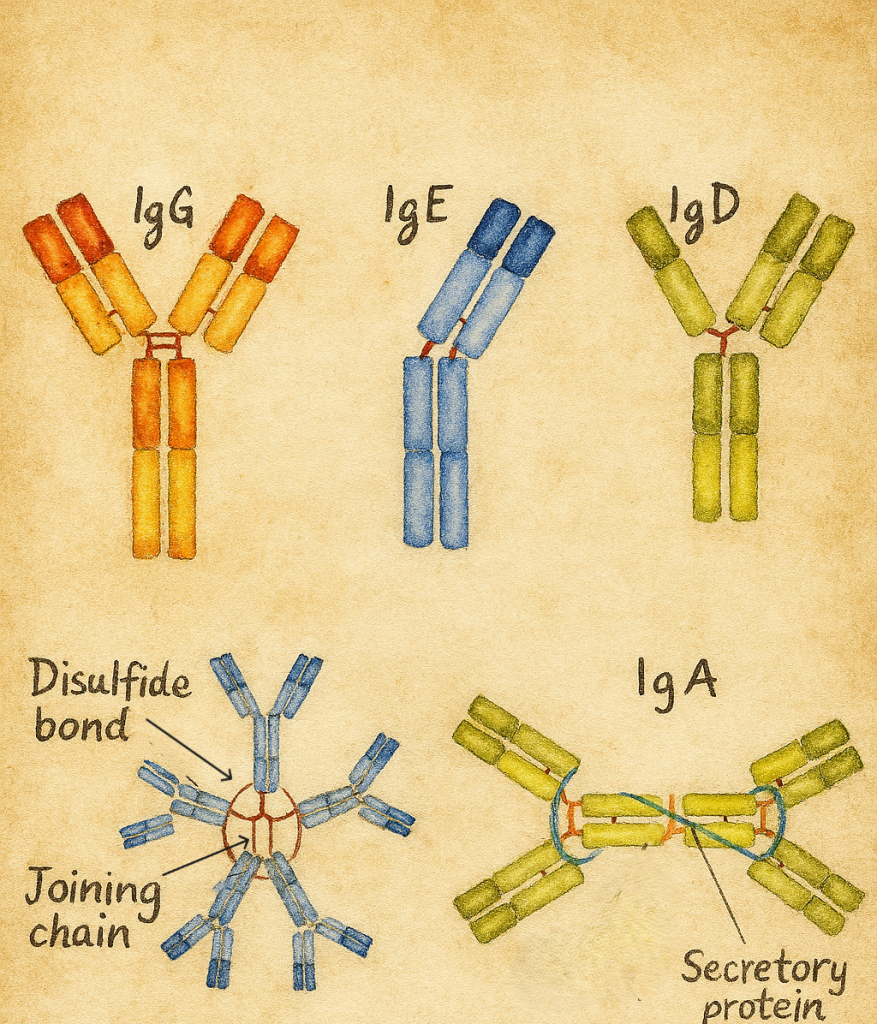
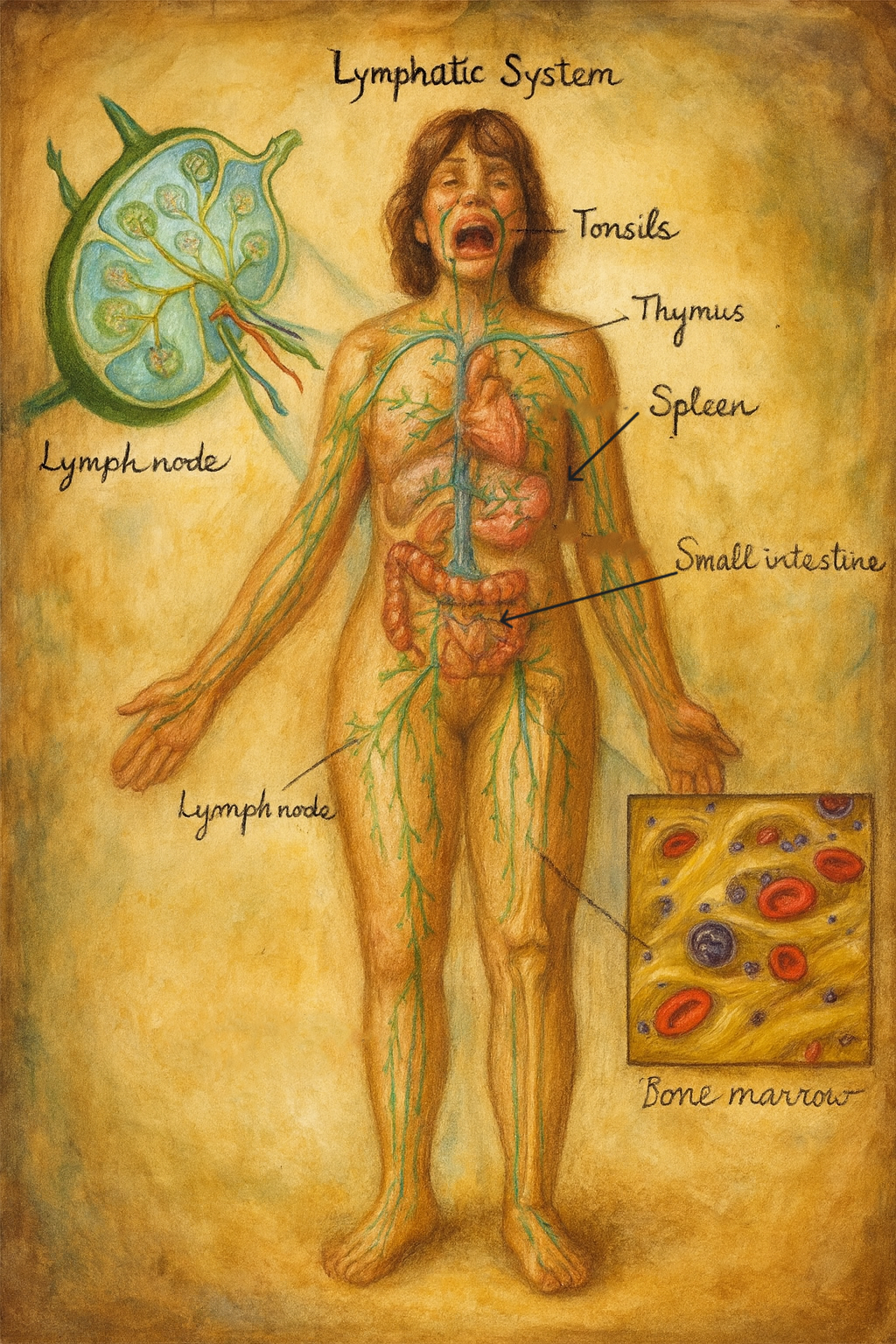
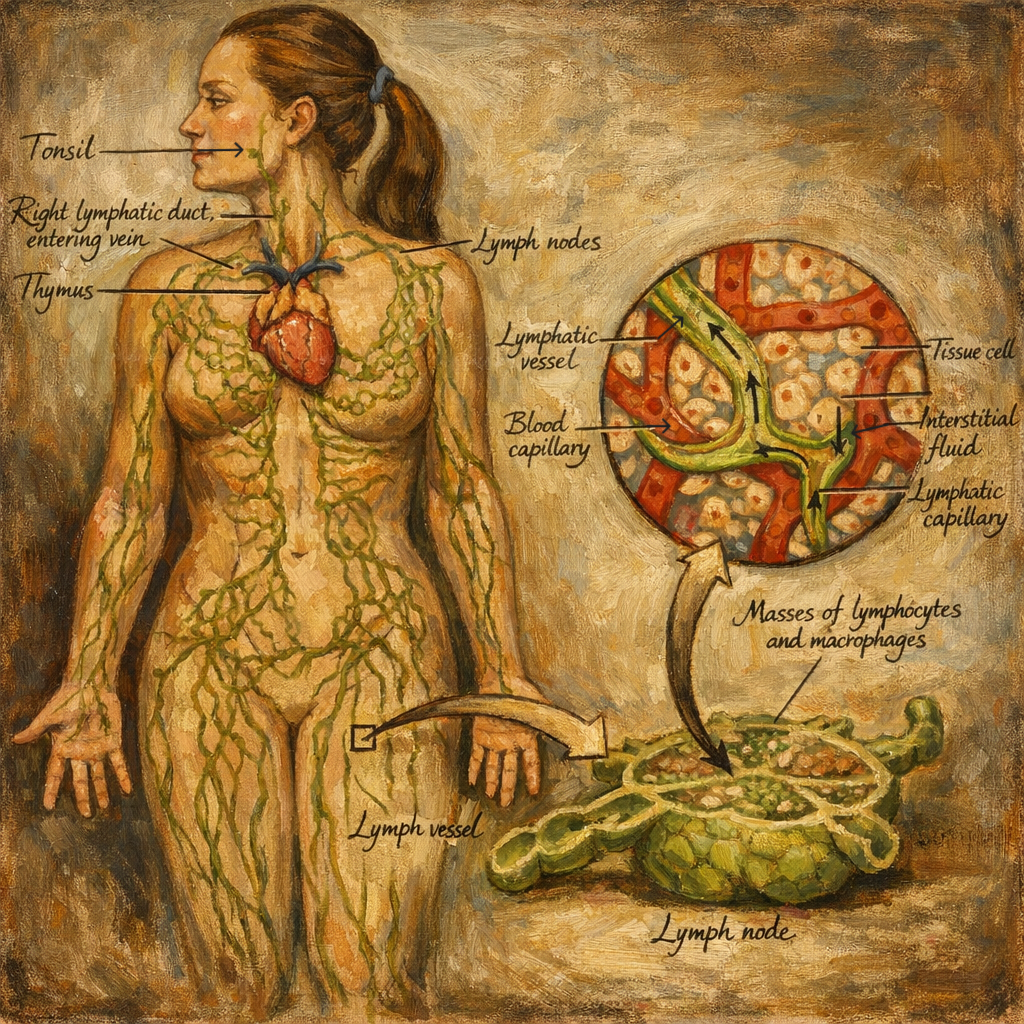
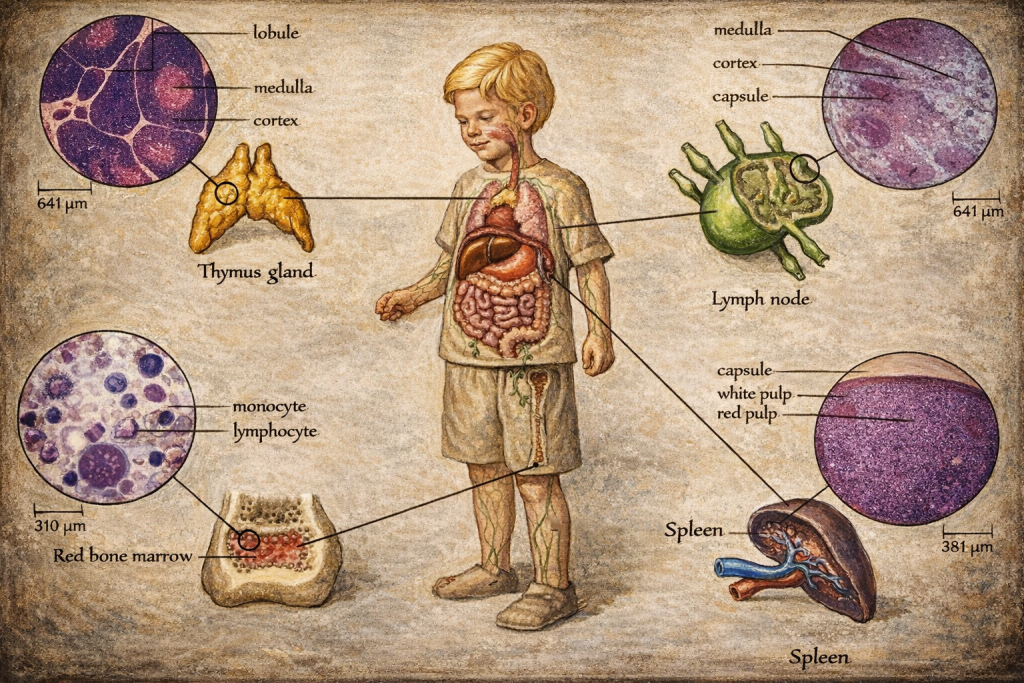
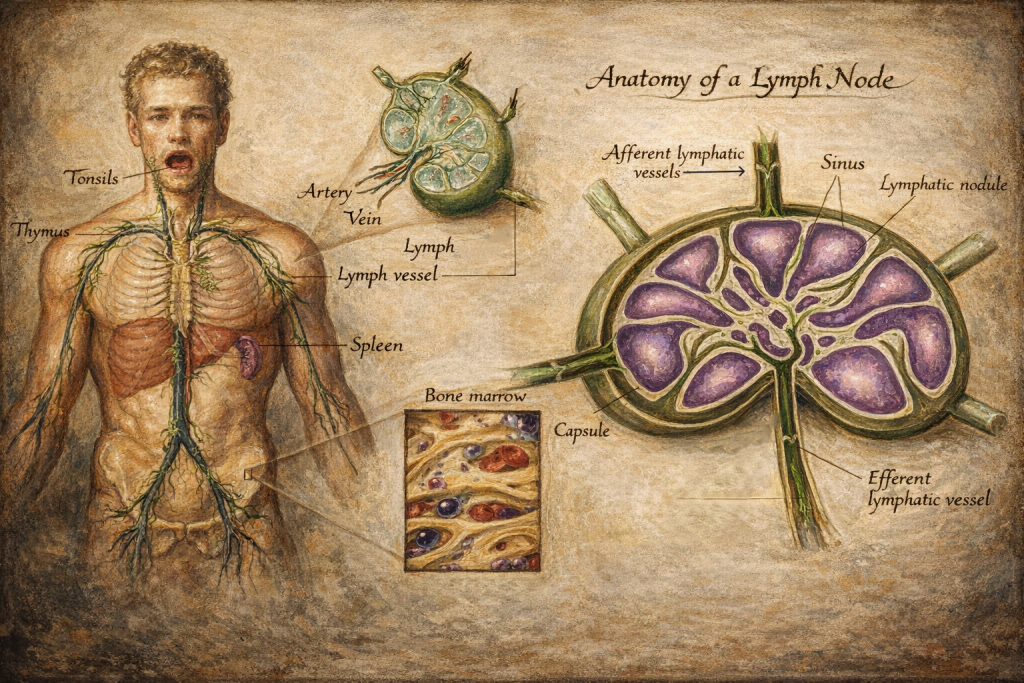

Yorum yazabilmek için oturum açmalısınız.