- İSİ diyede kısaltılır.
- Prothrombin Ratio(PR) ‘un Sınıflandırılması için WHO tarafından yapılmış parametredir.
- ISI<1 Reaksiyon zayıf.
- ISI=1 Reaksiyon WHO-thromboplastini ile aynı aktivitededir.
- ISI>1 Reaksiyon WHO-thromboplastininden yüksektir.
Tıp terimleri sözlüğü


Quick Test olarak da bilinen Protrombin Zamanı (PT) Testi, hematolojide kan pıhtılaşmasının dışsal yolunu değerlendiren hayati bir tanı aracıdır. 1935 yılında Amerikalı hekim ve kimyager Armand James Quick tarafından tanıtılan bu test, kanın pıhtılaşma eğilimini, pıhtılaşma faktörlerinin işlevselliğini ve karaciğerin bu faktörleri üretme yeteneğini değerlendirir.
18 Temmuz 1894’te Wisconsin, Theresa’da doğan ve 26 Ocak 1978’de ölen Armand James Quick, pıhtılaşma araştırmalarına önemli katkılarda bulunmuştur. PT Testi’ni geliştirmesi, karmaşık pıhtılaşma mekanizmalarının anlaşılması için temel oluşturmuş, pıhtılaşma bozukluklarının tedavisine ve antikoagülan tedavinin izlenmesine yardımcı olmuştur.
Mekanizma ve Bileşenler
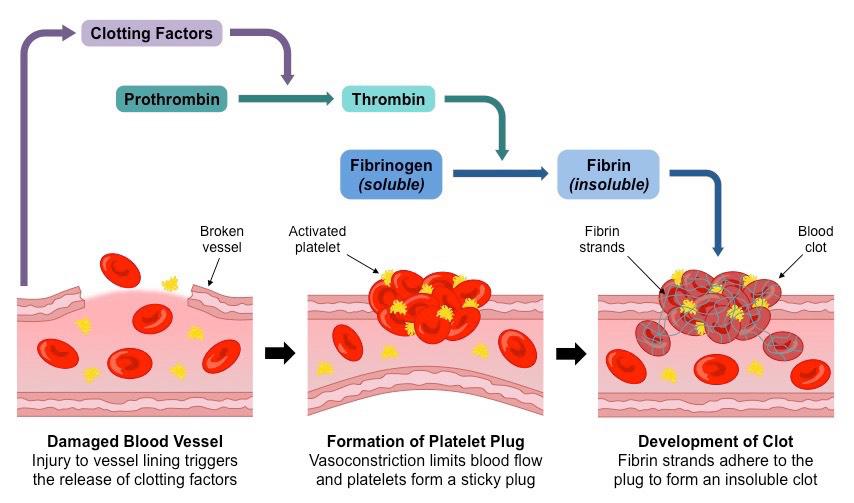
PT Testi, kanın pıhtılaşması için gereken süreyi, ekstrinsik pıhtılaşma yolunu başlatarak ölçer. Bu işlem, sitratlı kana doku tromboplastini (PL + TF) ve kalsiyum iyonları eklemeyi, esas olarak K vitaminine bağlı olan ve karaciğerde sentezlenen Faktör II (Protrombin), VII, IX ve X gibi pıhtılaşma faktörlerini aktive etmeyi içerir.
Önem ve Referans Aralığı
Normal koşullar altında, PT Testi pıhtılaşma süresi, yüzde olarak ifade edilen 10 ila 16 saniye arasındadır (%70–120, standart olarak %100). Bu değerlerdeki değişiklikler, K vitamini eksikliği, karaciğer disfonksiyonu veya Marcoumar gibi antikoagülan ilaçların etkileri gibi durumları gösterebilir.
Cerrahi Sonuçlar
Hızlı değerle ifade edilen PT Testi, ameliyattan önce pıhtılaşma durumunu değerlendirmede çok önemlidir. Çoğu cerrahi prosedür için genellikle %50-70’lik bir Hızlı değer yeterlidir ve kanama risklerini en aza indirmek için yeterli pıhtılaşma faktörü aktivitesini gösterir. Belirli eşikler cerrahi türüne, hastanın sağlığına ve Uluslararası Normalleştirilmiş Oran (INR) gibi ek testlere bağlıdır.
Modern Gelişmeler
Modern test metodolojileri, antikoagülan etkilerini nötralize etmek ve heparin tedavisi gören hastalarda doğruluğu sağlamak için heparin bağlayıcıların dahil edilmesini içerir.
Zorluklar ve INR’nin Tanıtımı
Tromboplastin kaynakları, ekipman ve tekniklerdeki farklılıklardan kaynaklanan laboratuvarlar arası PT Test sonuçlarındaki değişkenlik, Dünya Sağlık Örgütü (WHO) tarafından 1983’te Uluslararası Normalleştirilmiş Oran’ın (INR) tanıtılmasına yol açtı. INR, klinik uygulamada antikoagülan tedavisinin izlenmesi için çok önemli olan standart bir raporlama sistemi sağlar.
Protrombin zamanı (PT), kanın pıhtılaşması için geçen süreyi ölçen ve özellikle dışsal ve ortak pıhtılaşma yollarının işlevini değerlendiren bir kan testidir. Faktör I (fibrinojen), faktör II (protrombin), faktör V, faktör VII ve faktör X gibi faktörleri değerlendirir.
1935 – Armand Quick Tarafından PT’nin Tanıtılması
Armand J. Quick, 1935 yılında kan pıhtılaşma mekanizmalarını ve kanama bozukluklarını incelerken protrombin zamanı (PT) testini geliştirdi. Keşfi, pıhtılaşma sürecinin sistematik bir şekilde incelenmesi ve hemofili ve obstrüktif sarılık gibi durumlarda gözlemlenen kan pıhtılaşmasındaki eksiklikler tarafından yönlendirildi.
20. yüzyılın başlarında, kan pıhtılaşması temel terimlerle anlaşılmıştı, ancak pıhtılaşmada rol oynayan mekanizmalar ve belirli faktörler iyi karakterize edilmemişti. Quick ve çağdaşları, özellikle trombinin öncüsü olarak tanımlanan bir plazma proteini olan protrombinin pıhtı oluşumundaki rolüyle ilgileniyorlardı.
Quick, çeşitli patolojik durumlarda kanın pıhtılaşma sürelerini incelemek için deneyler yürüttü. – Karaciğer hastalığı olan hastalarda uzamış pıhtılaşma süreleri fark etti ve bu da onu, karaciğerin pıhtılaşma faktörlerini sentezlemedeki rolü göz önüne alındığında, bu hastaların protrombin üretiminde eksiklikler olduğu hipotezini ortaya atmaya yöneltti.
Quick, plazmaya tromboplastin (pıhtılaşma faktörleri içeren bir doku özütü) ve kalsiyum ekleyerek pıhtılaşmayı değerlendirmek için bir yöntem geliştirdi ve ardından bir pıhtının oluşması için gereken süreyi ölçtü. Bu süreç, pıhtılaşmanın dışsal yolunu taklit etti. Sağlıklı bireylerde ve pıhtılaşma bozukluğu şüphesi olan hastalarda pıhtılaşma sürelerini karşılaştırarak, testin protrombin ve diğer ilgili faktörlerdeki eksikliklere duyarlı olduğunu belirledi.
Quick, PT testini klinik vakalara uyguladı ve özellikle sarılık (K vitamini eksikliğine bağlı) ve hemofili olmak üzere koagülopatileri tanımlamada yararlı olduğunu gösterdi.
Quick bulgularını 1935’te Journal of Biological Chemistry dergisinde yayınlayarak PT testini bir tanı aracı olarak belirledi. Çalışmaları pıhtılaşma bozukluklarını anlamak ve teşhis etmek ve antikoagülan tedavinin etkilerini izlemek için bir çerçeve sağladı.
Reaktif standardizasyonu Quick’in zamanında önemli bir zorluktu. Tromboplastin preparatlarının değişkenliği, PT sonuçlarının başlangıçta laboratuvarlar arasında karşılaştırılabilir olmadığı anlamına geliyordu. Quick’in pıhtılaşma kademesindeki belirli adımları izole etme yaklaşımı, protrombinle ilgili eksikliklere odaklanmasını ve kan pıhtılaşma sorunları için hedefli tanıya öncülük etmesini sağladı.
1953 – Oral Antikoagülanlar İçin Modifikasyon
1970’ler – Standardize Kontrollerin Tanıtımı
1983 – Uluslararası Normalleştirilmiş Oranın (INR) Geliştirilmesi
1990’lar – PT Testinin Otomasyonu
2000’ler – İleri Klinik Uygulamalarda PT
2010’lar – Kişiselleştirilmiş Tıpta PT
Günümüz – Küresel Sağlıkta PT
İngilizcede; zaman demektir.


Dabi + -gatran (Trombin engelleyici son ek)

Dabigatran oral bir antikoagülan ilaçtır, yani kanın pıhtılaşmasını önlemek için kullanılır. Doğrudan bir trombin inhibitörüdür ve yaygın olarak Pradaxa ticari adı altında pazarlanmaktadır.
Bir ön ilaç olan dabigatran eteksilat, aktif formu olan dabigatrana metabolize edilir. Dabigatran, pıhtılaşma kaskadında önemli bir protein olan trombini doğrudan inhibe ederek kan pıhtılarının oluşumunu engeller.
Doz, endikasyona ve böbrek fonksiyonu gibi spesifik hasta faktörlerine bağlı olarak değişebilir. Hastalar, uygun dozla ilgili doktor reçetesine ve tavsiyelerine kesinlikle uymalıdır.
Dabigatranın varfarin gibi geleneksel antikoagülanlara göre en büyük avantajlarından biri, etkinliğini izlemek için düzenli kan testi gerektirmemesidir. Bununla birlikte, dabigatran esas olarak böbrekler tarafından atıldığı için böbrek fonksiyonunun farkında olmak çok önemlidir.
Dabigatran, atriyal fibrilasyonu (AF) olan hastalarda kan pıhtılarının önlenmesi için onaylanan ilk oral antikoagülan ilaçtır (OAD). 2010 yılında FDA tarafından, 2011 yılında ise Avrupa İlaç Ajansı (EMA) tarafından onaylanmıştır.
Dabigatran, Boehringer Ingelheim tarafından geliştirildi ve Pradaxa markası altında pazarlanıyor. Doğrudan bir trombin inhibitörüdür, yani kanın pıhtılaşmasında önemli bir rol oynayan bir protein olan trombinin etkisini doğrudan bloke ederek çalışır.
Dabigatran kan pıhtılarını önlemede çok etkili bir ilaçtır. Aynı zamanda nispeten güvenlidir ve daha önce AF hastaları için bakım standardı olan eski nesil OAD olan warfarine göre majör kanama riski daha düşüktür.
Tarihsel Anekdotlar


Thromboembolik komplikasyonlara ve kalp yetmezliğine yol açabilir.Çünkü yüksek frekanslarda kalp akut veya uzun vadeli olarak hasar alabilir.
60 atış/dakika altındaki kalp frekansı.
Low molecular weight heparin de ise sıklığı %1’den azdır.
Heparin Tedavisine başladıktan 2-3 gün içinde Trombosit sayısı %50’den fazla düşer.
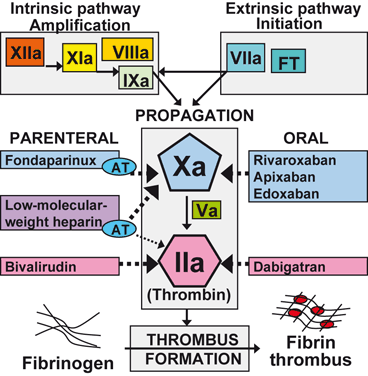
Düşük moleküler ağırlıklı heparinler (DMAH), fraksiyone edilmemiş heparinin (FMH) kimyasal veya enzimatik depolimerizasyonuyla elde edilen, ortalama molekül kütlesi yaklaşık 3.000–6.000 Da arasında değişen antitrombotik ajanlardır. Ürünler, üretim süreçlerine bağlı olarak farklı oligosakkarit dağılımlarına ve anti-Xa/anti-IIa aktivite oranlarına sahiptir. Klinik pratikte en sık kullanılan temsilciler arasında enoksaparin, dalteparin, tinzaparin, nadroparin, bemiparin, reviparin ve sertoparin yer alır. Her bir preparat biyobenzer değildir; dolayısıyla değişim (“switching”) farmakokinetik/-dinamik farklar doğurabilir.
DMAH’lerin antikoagülan etkisi, özgül pentasakkarit dizisinin antitrombin (AT) ile yüksek afiniteyle bağlanmasına dayanır. AT aktivasyonu, başta faktör Xa olmak üzere serin proteaz koagülasyon faktörlerinin inhibisyonunu hızlandırır. FMH’ye kıyasla DMAH’ler trombin (faktör IIa) üzerinde daha zayıf, faktör Xa üzerinde ise daha belirgin inhibisyon oluşturur; tipik anti-Xa/anti-IIa oranı yaklaşık 2:1 ile 4:1 arasındadır (preparata özgü değişkenlik gösterir). Daha düşük nonspesifik protein bağlanması, daha az endotel/makrofaj etkileşimi ve düşük plazma proteinlerine bağlanma, doz-yanıt ilişkisinin daha öngörülebilir olmasını sağlar.
Uygulama tekniği: Subkutan enjeksiyon abdominal duvar, uyluk veya üst kolun yağ dokusuna, genellikle 90° açıyla, rotasyon prensibiyle yapılır. İM uygulamadan kaçınılır. Önceden doldurulmuş şırıngalardaki hava kabarcığı dışarı atılmamalıdır.
Gastrointestinal ve genitoüriner kanserlerde mukozal kanama yatkınlığı göz önüne alınarak DMAH sıklıkla tercih edilir. Metastatik hastalık, trombositopeni, kemoterapiyle etkileşimler ve kateter varlığı karar verme sürecini etkiler. Tedavi süresi tipik olarak en az 3–6 aydır; aktif kanser varlığında daha uzun süreler gündeme gelir.
Önceden doldurulmuş şırıngalar oda sıcaklığında veya üretici önerilerine göre saklanır; dondurulmamalı ve aşırı ısıdan korunmalıdır. Son kullanma tarihi ve ambalaj bütünlüğü her uygulamada kontrol edilmelidir.
Düşük moleküler ağırlıklı heparinlerin (DMAH) öyküsü, yalnızca bir ilacın doğuşu değil; biyokimyanın, endüstriyel farmasötiklerin, klinik metodolojinin ve hasta güvenliğinin bir asır boyunca nasıl birlikte evrildiğinin vazgeçilmez bir panoramasıdır. Anlatı, 20. yüzyılın başlarında pıhtılaşmanın sırlarını aralayan birkaç meraklı bilim insanıyla başlar; 1970’ler ile 1980’lerin başında şekillenen “pentasakkarit çağında” keskinleşir; 1990’larda klinik kılavuzları dönüştürür; 2000’ler ve 2010’larda tedarik zinciri ve kalite dersleriyle sarsılır; 2020’lerde ise immün-tromboz ve sentez biyoteknolojisiyle yeni bir bilimsel ufka açılır.
1916’da Baltimore’da Jay McLean ve danışmanı William Howell’ın damar içi pıhtılaşma ile ilişkili “karaciğer kaynaklı” etkin maddeleri ayırma çabaları, heparin denen, şaşırtıcı biçimde pıhtılaşmayı engelleyen bir polisakkarit karışımını gündeme getirdi. Kısa zamanda Toronto’da Charles Best ve Stockholm’de Erik Jorpes’in katkılarıyla heparin saflaştırma, standardizasyon ve üretim adımları biçimlendi; heparin, 1930’lardan itibaren klinik araca dönüştü. 1970’lere gelindiğinde Londra’da Vijay Kakkar, düşük doz heparinin ameliyat sonrası venöz tromboembolizmi önlemede sistematik kullanımını yaygınlaştırarak heparini “profilaksinin dili” hâline getirdi. Bu sahne, DMAH fikrinin filizleneceği zemini hazırladı: heparin heterojen, uzun zincirli ve izlem gerektiren bir moleküldü; acaba daha kısa, daha öngörülebilir fraksiyonlarla aynı fayda, daha az zahmetle elde edilebilir miydi?
1976’da Londra’dan Johnson ve çalışma arkadaşlarının yayımladığı erken bir dizi çalışma, heparinin anti-Xa etkisinin alt birimlerine ayrıldığında nasıl farklılaştığını göstererek “düşük moleküler ağırlık” yaklaşımını bilimsel sahneye taşıdı. Aynı dönemde üç bağımsız ekip, heparinin antitrombin ile sıkı bağ kuran belirli bir yapısal motif taşıdığını saptadı. Uppsala’da Ulf Lindahl’ın ekibi ve Milano’da Bo Casu’nun ekibi, antitrombinin yüksek afiniteyle tanıdığı bölgenin bir pentasakkarit dizisi olduğunu kimyasal olarak ayıkladı; bu dizideki kritik “3-O-sülfatlanmış glukozamin” işaret taşı niteliğindeydi. Paris’te Choay grubundan Pierre Petitou ve meslektaşları, 1983’te bu pentasakkarit dizisini organik sentezle üretmeyi başararak, heparin evreninde “doğal karışım” çağından “tasarlanmış diziler” çağına kapı araladı. Aynı yıllarda S. T. Olson ve diğerleri antitrombinin konformasyon değişikliklerini berraklaştırırken, Hemker ve çalışma arkadaşları anti-Xa ve anti-IIa etkinliğin zincir uzunluğu ve bağlanma dinamikleriyle ilişkisini klinik farmakolojiye tercüme ediyordu. Kısa zincirlerin (DMAH) anti-Xa ağırlıklı, daha öngörülebilir ve subkutan uygulanabilir profili, klinik açısından cezbediciydi.
Bilimsel motifler, endüstrinin reaktörlerinde şekil buldu. Heparinin “daha küçük, daha ayarlanmış” fragmanlara dönüştürülmesi için farklı depolimerizasyon yolları geliştirildi:
Bu kimyasal ve enzimatik yollar, 1980’lerin ortasından 1990’lara uzanan süreçte dalteparin (KabiVitrum/İsveç), enoksaparin ve nadroparin (Choay/Sanofi/Fransa), tinzaparin (LEO Pharma/Danimarka) gibi markalaşmış DMAH’leri kliniğe taşıdı. Ulla Hedner gibi klinik farmakologlar, yeni fraksiyonların antitrombotik etkinlik ve güvenlilik profilini titizlikle haritaladı. Her bir DMAH, üretim yöntemi ve oligosakkarit dağılımına bağlı “parmak izi”ne sahipti; bu nedenle “aynı sınıf”ın ilaçları biyobenzer değil, yakın akraba fakat farklı bireyler gibiydi.
1980’lerin başından itibaren, günlük tek doz subkutan tedaviyle venöz tromboembolizm (VTE) tedavisi ve profilaksisinin hastane dışına da taşınabildiği gösterildi. 1990’larda, ortopedik ve abdominal cerrahi sonrası profilakside DMAH’ler standartları yeniden tanımladı; aynı dönemde dalteparin ve enoksaparin, akut koroner sendromlarda (özellikle NSTEMI/unstabil anjina) “antitrombotik omurganın” önemli bir parçası hâline geldi. Kanser ilişkili trombozda ise rekürrens ve kanama dengesini gözeten çalışmalar, DMAH’leri uzun süreli tedavinin güvenilir seçenekleri arasına yerleştirdi. Klinik metodoloji olgunlaştıkça, anti-Xa/anti-IIa oranı, biyoyararlanım ve yarılanma ömrü gibi farmakolojik nüanslar sonuç odaklı uç noktalarla (DVT/PE rekürrensi, majör kanama, mortalite) bağlandı; kılavuzlar, “rutin aPTT izlemi gerektirmeyen, öngörülebilir antikoagülasyon” fikrini temel kabul etti.
2008’de heparin tedarik zincirinde ortaya çıkan “aşırı sülfatlanmış kondroitin sülfat” kontaminasyonu, yalnızca farmakoekonomi ve tedarik yönetimi açısından değil, karmaşık biyolojik ilaçlar için analitik standardizasyon ve düzenleyici gözetimin güçlendirilmesi açısından da kalıcı bir dönüm noktası oldu. Bu tecrübe, DMAH’lerin yapısal mikroheterojenitesini çözümlemeye yönelik ileri spektrometri ve NMR tabanlı platformların, farmakope tanımları ve karşılaştırılabilirlik kılavuzlarıyla birlikte gelişmesini hızlandırdı.
1983’te pentasakkarit dizisinin sentezlenmesi, daha sonra fondaparinuks gibi saf, tek moleküllü anti-Xa ajanlarının önünü açtı; bu ajanlar DMAH değilse de DMAH’lerin keşif hattının “tasarım ilacı”na evrilen kolunu temsil etti. 2000’lerden sonra kemo-enzimatik yaklaşımlar, glikozaminoglikan biyosentez enzimlerini kullanarak “sentetik DMAH” olasılığını laboratuvar gerçekliğine yaklaştırdı. Amaç, doğal kaynak bağımlılığını azaltırken, antikoagülasyonun yanında inflamasyon, kemokin etkileşimi ve doku onarımı gibi pleyotropik etkileri de incelikle ayarlayabilmekti.
COVID-19 pandemisiyle birlikte immünotromboz, nötrofil ekstrasellüler tuzakları (NET’ler) ve endotelyal glikokaliks hasarı ekseninde heparinlerin antikoagülan ötesi rolleri yeniden gündeme geldi. DMAH’lerin anti-inflamatuvar ve antiviral bağlamda dolaylı etkileri, sepsisten ARDS’ye uzanan geniş bir zeminde tartışıldı. Aynı dönemde heparine bağlı trombositopeni (HIT) patobiyolojisi—platelet faktör 4 (PF4) ile polianyon etkileşiminin incelikleri—daha yüksek çözünürlükte haritalandı; DMAH’lerin HIT riskini FMH’ye göre azaltan yapısal nedenleri daha iyi anlaşılır oldu. Obezite, gebelik ve böbrek yetersizliği gibi özel popülasyonlarda anti-Xa izlemi, bireyselleştirilmiş dozlama ve gerçek yaşam verileri, “bir sınıf-çok fenotip” gerçeğini kuvvetlendirdi.
Bu hikâyenin kaşifleri tek bir laboratuvara sığmaz. Baltimore’da McLean ve Howell ile başlayan çizgi, Toronto’da Best, Stockholm’de Jorpes ve Uppsala’da Lindahl ile kimyasal-biyokimyasal derinliğe kavuştu. Milano’da Casu’nun yapısal çözümlemeleri, Paris’te Choay ekibinden Petitou’nun sentetik sıçramasıyla birleşti. Londra’da Johnson ve Kakkar, klinik metodolojiyi ve düşük molekül fikrini sivriltti. İsveç’te KabiVitrum (daha sonra Sobi çizgisi) dalteparinin, Danimarka’da LEO Pharma tinzaparin’in yolunu açarken; Fransa’da Choay/Sanofi damarı enoksaparin ve nadroparin ile sınıfın küresel erişimini genişletti. Bu harita, yapı-işlev şifresinin çözümünü endüstriyel ölçek ve klinik ispatla kaynaştıran bir ağdır.
Güncel araştırmalar üç eksende yoğunlaşıyor:
Yorum yazabilmek için oturum açmalısınız.