- Sinonim : kardiyovasküler sistem, circulatory system, cardiovascular system, Blutkreislauf veya Kreislauf, die Blutbahn, Blutgefäßsystem
- Maddelerin vücuttaki dolaşımını sağlayan organ sistemidir.

Nefes
Aramice naphşā/npheşā נפשא, Akadca napāşu soluk alma → Arapça nafas نفس [#nfs faˁal ] soluk
- Havanın akciğerlere alınıp verilme işlemidir
- Aerobik organizmalar enerji açığa çıkarabilmek için solunum yoluyla oksijene ihtiyaç duyar. Nefes almak vücudun ihtiyacı olan oksijenin alınıp karbondioksidin atıldığı tek işlemdir. Gaz değişimi, akciğer alveolleri ve akciğer kılcal damarlarındaki kan arasında, gazların pasif difüzyonuyla meydana gelir. Kandaki çözünmüş gazlar, kalbin kanı pompalamasıyla dolaşım sistemi yoluyla tüm vücuda yayılır.
- Normal fizyolojik sınırlar içerisindeki nefes almanın tıbbi terimi öpnedir.Karbondioksidin atılımına ek olarak nefes almayla vücuttan su da atılır. Alveollerden difüzyona uğrayan su sebebiyle nefes %100 nem içerir.
- Nefes alma frekansı dakikada 5-36 kez gerçekleşmelidir.

Solunum fizyolojisi
- İnsanlar vücuda O2’yi almak ve CO2’yi vücuttan atmak için nefes alırlar.
- Solunum, kandaki gaz konsantrasyonlarını ölçen reseptörler aracılığıyla merkezi olarak kontrol edilir. Yüksek CO2 içeriği en güçlü solunum uyarısına neden olur.
- Yetişkinlerde normal solunum hızı 12-15/dk civarındadır ve her nefeste yaklaşık 500 ml hava solunur ve verilir (tidal hacim = 7-8 ml x kg vücut ağırlığı).
- Spontan solunum ile diyaframın ve interkostal kasların kasılması toraksın genişlemesine neden olur, bu da negatif bir basınç oluşturur ve hava akciğerlere akar.
- İnspiratuar gaz akışına spontan solunum, yani negatif intratorasik basınç neden olur. Soluduğunuz hava burun boşluğundan (ısındığı, nemlendirildiği ve temizlendiği yer), boğazdan ve sesi geliştirmek ve solunum yollarını ve yemek yollarını ayırmak için kullanılan gırtlaktan geçer.
- Solunum havası daha sonra sağ ve sol ana bronş yoluyla trakeya, daha küçük bronşlara, bronşiyollere ve son olarak gaz değişiminin gerçekleştiği alveollere ulaşır. Hava yollarının gaz değişiminin olmadığı hava ileten kısmına ölü boşluk denir ve ml cinsinden vücut ağırlığının yaklaşık iki katıdır (ölü boşluk = kg vücut ağırlığı × 2).
- Solunum gazları, kan ve alveolar hava arasındaki kısmi basınç farkı temelinde değiştirilir (ilgili ortamdaki gazın basıncı; partiküller, denge sağlanana kadar yüksek kısmi basıncı olan bölmeden düşük olana geçer) . Venöz kandaki O2 kısmi basıncı yaklaşık 40 mmHg ve alveollerde 105 mmHg’dir. Bu nedenle alveollerden kana bir gaz akışı vardır. Arteriyel kandaki O2 kısmi basıncı daha sonra 100 mmHg civarındadır. CO2 durumunda, akış ters yönde davranır.

Direnç (Resistance)
Direnç terimi, inspirasyon ve ekspirasyon sırasında hava yollarının hava akımına karşı gösterdiği direnci tanımlar. Direnç esas olarak bronşların genişliğine bağlıdır. Bronşların lümeni ne kadar genişse, nefes almak o kadar kolay olur (ince pipete karşı kalın pipete). Bir astım krizi bronşları daraltır ve böylece dirençte büyük bir artış olur. Daha fazla çalışma gerektirdiği için nefes almak zorlaşır. Obstrüktif ventilasyon bozuklukları direncin artmasına neden olur.
Uyumluluk (Compliance)
Uyum terimi, akciğerlerin uzayabilirliğinin bir ölçüsüdür. Uyum ne kadar büyük olursa, akciğerleri şişirmek için o kadar az basınç gerekir. Uyum, hava yollarının genişliğine değil, akciğerlerin gerilebilir kısımlarının (alveoller ve iskele) özelliklerine bağlıdır. Akciğerler şişirilirse, başlangıçta zordur – bir balonda olduğu gibi – sonra hafifler ve akciğerler (balon) aşırı gerildiğinde tekrar ağırlaşır. Dolayısıyla nefes almanın kolay olduğu alan en fazla uyuma sahiptir. “Ağır” alanlara geçiş, üst ve alt bükülme noktası olarak adlandırılır. Pnömonide, akciğerin tek tek bölümleri daha az esnek hale gelir, bu nedenle akciğerler daha az elastik hale gelir – komplians azalır. Bu nedenle havalandırma, havayı akciğerlere zorlamak için daha fazla basınç gerektirir.
Fizyolojik ve mekanik solunum arasındaki fark
Fizyolojik spontan solunum ile mekanik ventilasyon arasındaki en önemli fark, mekanik ventilasyon ile solunum gazının pozitif basınçla akciğerlere zorlanması ve hastanın genellikle sırt üstü yatmasıdır. Mekanik ventilasyon hastanın solunum kaslarını rahatlatır, ancak genellikle dolaşım sistemi üzerinde güçlü bir etkisi vardır.
Mekanik ventilasyonun yan etkileri
Kan dolaşım sistemi
Pozitif intratorasik basınç, kalbe giden venöz dönüş akışını azaltır (ön yükü düşürür) ve dolayısıyla kalp debisinde, kan basıncında ve organlara giden kan akışında azalma olur. Bu, örn. böbrek kan akışının azalmasına neden olur, bu nedenle diürez azalır. Azalan venöz dönüş, kan basıncında bir düşüşe yol açar, bu nedenle hastaların sıklıkla sıvılara ve katekolaminlere ihtiyacı vardır. Şiddetli kardiyak yetmezliğin varlığında, ön yükün bu şekilde düşürülmesi, kardiyak rahatlamaya ve dolayısıyla sıklıkla klinik tabloda bir iyileşmeye yol açar.

Pulmoner yan etkiler
- Alveollerdeki aşırı basınç onları aşırı gerer, bu da mikro yaralanmalara (ventilatör kaynaklı akciğer hasarı) ve mediatörlerin (ayrıca sistemik) salınımına yol açar. Ventilasyon basıncı ne kadar yüksekse (yaklaşık 30 – 35 cm H2O’dan), akciğer hasarı riski o kadar fazladır.
- Entübasyon, hastayı, ekspirasyon sonunda (PEEP) akciğerlerde doğal bir artık basıncı korumak için gırtlağı kullanma olasılığından mahrum eder. Bu nedenle alveollerin ekspiratuar çökmesi meydana gelir. Sonuç olarak, pulmoner şant artmaya devam eder ve oluşan kesme kuvvetleri nedeniyle alveoller hasar görür (çökmüş alveoller inspirasyon sırasında açılır, ancak ekspirasyon sırasında tekrar çöker).
- Hastanın sırtüstü pozisyonu, daha az havalandırılan akciğer alanlarının oluşmasına yol açar, Örn; omurgaya yakın bağımlı akciğer alanlarında bazal ve böylece ventilasyon-perfüzyon oranını değiştirmek için. Bu değişiklikler intrapulmoner şantta bir artışa yol açar, bu nedenle kanın bir kısmı oksijen almaz.
- Havalandırılmamış alveollerin (atelektazi) perfüzyonundan veya perfüze olmayan akciğer alanlarının havalandırılmasından bir şant ortaya çıkar. Nazal solunum olmaması nedeniyle solunan hava yeterince nemlendirilmez ve solunum yolunun mukoza zarı kurur. Bu, havalandırma sisteminin inspiratuar koluna entegre edilmiş nemlendiriciler tarafından telafi edilir. Yetersiz nemlendirme, mukosiliyer klirensi kötüleştirir.
- Bozulmuş öksürük refleksi ile birlikte, bozulmuş mukosiliyer klirens, solunum yolu enfeksiyonlarının oluşumunu teşvik eder.
İntraserebral basınç (ICP) üzerindeki etkiler
Artan intratorasik basınç, kalbe venöz dönüş akışını azaltır, bu da ICP’de bir artışa neden olabilir. Artış ne kadar büyükse, ortalama intratorasik basınç ve akciğerlerin kompliyansı o kadar büyük olur. ARDS’de akciğerler daha sert olduğu için yüksek intrapulmoner ventilasyon basıncının intratorasik basınca geçişi daha az olur. Bu, artan PEEP’nin ARDS hastalarında ICP üzerinde, en azından 10 mbar civarında PEEP değerlerine kadar hemen hemen hiçbir etkisinin olmadığı anlamına gelir.
PEEP
- PEEP terimi, ‘Pozitif Ekspirasyon Sonu Basıncı ( Positive End-Expiratory Pressure )’ anlamına gelir, yani ekspirasyonun sonunda akciğerlerde hala pozitif bir basınç olduğunu ifade eder. Bu basınç korunmazsa alveoller çöker. Alveoli, şişirilmiş bir balona benzer şekilde hayal edilebilir. İlk başta biraz şişirilene kadar zordur, sonra kolaydır (= daha düşük bükülme noktası).
- Havayı tekrar dışarı bırakırsanız, şişirmek için tekrar çaba göstermeniz gerekir. Ancak, hala biraz şişirilmiş olacak kadar (bükülme noktasının üzerinde) yeterli havayı bırakırsanız, tekrar şişirmek için çok daha az basınca ihtiyacınız olur. Normal şartlar altında, akciğerlerdeki PEEP, gırtlak (ekspiratuar sonunda vokal kordların kapanması) tarafından korunur ve böylece alveolar kollaps önlenir. Entübe hastalarda translaringeal tüp nedeniyle bu mümkün değildir ve yapay PEEP uygulanmadıkça alveolar kollaps meydana gelir.
- Alveolar kollaps, yalnızca akciğerleri havalandırmak için daha fazla basınca ihtiyaç duyulduğu anlamına gelmez; Alveollerin tamamen çökmesi ve yeniden açılması, duvarlarına doğrudan zarar verir.
- 5 cm H2O’nun altındaki PEEP klinik olarak etkisizdir ve bundan kaçınılmalıdır. Akciğerlere ventilasyondan mümkün olduğunca az zarar vermek için ventilasyon basıncı bu nedenle iki bükülme noktası arasında olmalıdır (= ekspiratuar kollaps ve inspiratuar aşırı şişirmenin önlenmesi). Solunum gazlarının difüzyonunu engelleyen akciğer hastalıkları (pnömoni, ARDS vb.) kompliyansı da azalttığından, PEEP seviyesinin gerekli inspiratuar oksijen konsantrasyonuna (FiO2) ayarlanması mantıklıdır.

| FiO2 % | PEEP cm H2O |
| 30 – 40 | 5 |
| 40 – 50 | 8 |
| 50 – 60 | 10 |
| 70 – 80 | 10-14 |
| 90 | 14-18 |
| 100 | 18-24 |
Kim solunum yardımcılarına / havalandırmaya ihtiyaç duyar?
Artık vücutlarına yeterli oksijen sağlayamayan ve CO2’yi ortadan kaldıramayan hastalar, nefes almayı tamamen devralmak için desteğe veya ventilatöre ihtiyaç duyar. Bu solunum yetmezliğinin nedenleri çeşitlidir (solunum regülasyonunun merkezi bozukluğu, pnömoni, bronş tıkanıklığı vb.) ve semptomatik olarak tedavi edilmelidir. Solunum yetmezliğini tanımak esastır. Aşağıdaki parametreler, mekanik solunum cihazları kullanma ihtiyacı hakkında bilgi sağlayabilir:
- Solunum hızı >40 / dak veya <8 / dak
- Siyanoz
- O2 uygulanmasına rağmen paO2<50 mmHg veya paCO2 > 80 mmHg
- Hava yolu tıkanıklığı (stridor, bronkospazm)
- Koruyucu refleks eksikliği
- invers nefes
- Agonal nefes
Maske ile nefes
Hastaları ventilasyon maskesi ve resüsitasyon torbasıyla ventile etmek, her tıp uzmanının ustalaşması gereken temel bir beceridir. Acil bir durumda, genellikle hastalara oksijen vermenin tek yolu budur.

Endikasyon
Ventilasyon gerektiren tüm hastalar için temel önlem.
Avantaj
Hızlı bir şekilde kullanılabilir ve uygulanması nispeten kolaydır.
Dezavantaj
Etkili maske ventilasyonu, zor koşullar altında bile ancak düzenli eğitim ile mümkündür. Ancak, herhangi bir aspirasyon koruması sağlamaz.
Komplikasyon
Yanlış maske duruşu ve yüksek ventilasyon basınçları midenin aşırı şişmesine neden olur. Bu, havalandırmayı kötüleştiren yükseltilmiş bir diyaframa yol açar. Ayrıca yüksek karın içi basıncı aspirasyon riskini artırır.

Uygulama
- Hastanın hava yolları Esmarch tutuşu ile hastanın kafası gerilir ve gerekirse protezler emilerek çıkarılır ve C kulp kullanılarak ventilasyon maskesi hastanın yüzüne yerleştirilir.
- Resüsitatör, serbest solunum yollarını korurken (alt çeneyi C-tutamakla öne doğru çeker) yaklaşık 10-15 kez / dak. nefesle göğüs kafesi biraz yükselir ve alçalır.
- Hava yollarının açık tutulması bir Guedel veya Wendl tüpü ile kolaylaştırılabilir. Her ikisi de üst solunum yolunun çökmesini önler, ancak aspirasyona karşı koruma sağlamaz!

- Guedel tüpü, dışbükey tarafı aşağı gelecek şekilde ağza yerleştirilir ve daha sonra dış ucu hala dişlerin önünde olacak şekilde döndürülür.
- Wendl tüpü kaygandır ve daha büyük burun deliğinden boğaza doğru itilir (dikkat: kanama riski!).
- Inspiratuar oksijen konsantrasyonunu artırmak için, resüsitasyon cihazına (rezervuara) oksijen bağlamayı unutmayınız,

Non-invaziv ventilasyon (HF-CPAP)
- Non-invaziv ventilasyon, ventilasyon için hastaya herhangi bir tüp veya trakeostom sokulmadığı anlamına gelir. Hasta, sıkıca oturan bir burun veya yüz maskesi veya sıkıca oturan bir kask aracılığıyla ventilatör tarafından desteklenir.
- Prensip olarak, her türlü ventilasyon (kontrollü, yardımlı, CPAP) invaziv olmayan şekilde de uygulanabilir (= endotrakeal tüp olmadan). Ancak, non-invaziv ventilasyon herhangi bir aspirasyon koruması sağlamadığından ve uyanık hastalar genellikle kontrollü ventilasyon biçimlerini tolere edemediğinden, non-invaziv ventilasyon genellikle yalnızca yüksek akışlı CPAP (Hf-CPAP) veya basınç destekli ventilasyon ile birlikte ( PSV veya artırılmış spontan ventilasyon) kullanılır.
- Yüksek akışlı sürekli pozitif hava yolu basıncı (Hf-CPAP) ventilasyonu ile hastaların yüksek inspiratuar solunum gazı akışı (akış) ile sabit pozitif basınç seviyesinde spontan olarak nefes alması sağlanır. Bu, hem inhalasyon hem de ekshalasyon sırasında akciğerlerdeki basıncın her zaman pozitif (PEEP) olduğu anlamına gelir. Bu alveolar kollapsı önler, havalandırılmayan akciğer alanları tekrar havalandırılır ve gaz değişimi düzelir. Non-invaziv ventilasyon, hastanın solunum işini azaltır, ancak tamamen yerine geçmez.

Endikasyon
Non-invaziv ventilasyon, spontan solunum yapan, uyanık ve solunum desteğine ihtiyaç duyan ancak solunum kasları henüz tam olarak tükenmemiş (örn. KOAH, pulmoner ödem, ekstübasyon sonrası) hastalarda kullanılır.
Avantajlar
Genellikle güçlü bir sedasyon veya analjezi ve invaziv müdahale (entübasyon) gerekli değildir.
Dezavantaj
Hastalar yeterince spontan nefes almalı, koruyucu refleksleri korunmalıdır. Bazı hastalar maske veya kaskı tolere etmez.
Komplikasyonlar
Non-invaziv ventilasyondan kaynaklanan komplikasyonlar nadirdir. Bununla birlikte, kusmaya ve asidik mide suyunun aspirasyonuna neden olan gastrik insuflasyon meydana gelebilir.
Uygulamak
- Öncelikle hastalara ne yapacakları ve ne bekleyecekleri anlatılır (maske veya kask rahatsızlık verirse, dirence karşı ekshalasyon gerekir).
- HF CPAP cihazının solunum gazı akışı ayarlanır (akış yaklaşık 40 l / dak, FiO2 gerektiği gibi, PEEP 5 – 8). Maske hastanın yüzüne sıkıca yerleştirilir veya kask takılır. Solunum yetmezliği HF-CPAP altında kötüleşmeye devam ederse veya dekompanse solunum yetmezliği düzelmezse, hasta invaziv olarak ventile edilmelidir.

İnvaziv ventilasyon
İnvaziv ventilasyonda hasta bir hortum (tüp) veya hava yolunu güvenceye almak için başka yollarla (trakeostoma, laringeal maske vb.) ventile edilir. Kullanılan ventilasyon modları kontrol edilebilir veya desteklenebilir. Non-invaziv ventilasyondan temel fark, hava yollarının güvenli olmasıdır (hastalar aspire edemez ve nispeten yüksek ventilasyon basınçları kullanılabilir).
Entübasyon
Hava yolunu güvence altına almanın en yaygın yöntemi endotrakeal entübasyondur. Ağız veya burundan (orotrakeal / nazotrakeal) trakeaya hastanın havalandırıldığı bir ventilasyon tüpü sokulur.
Larenks maskesi
Endikasyon
Laringeal maske, aç hastalarda ve kısa müdahalelerde (2 saat) anestezide kullanılır. Laringeal maske gırtlağa zarar vermediği için hastanın aspirasyon riski düşük olmalıdır.
Aspirasyona karşı mutlak koruma sağlar. Hastanın endotrakeal olarak entübe edilebileceği laringeal maskeler de vardır (örn. Fastrach).

Avantajlar
Laringeal maskenin kullanımı kolaydır, daha az invazivdir ve yaralanma riski düşüktür.

Dezavantaj
Laringeal maske aspirasyona karşı mutlak koruma sağlamaz ve ventilasyon sadece nispeten düşük ventilasyon basıncı ile gerçekleştirilebilir.
Komplikasyonlar
Laringeal maske ile ilgili en yaygın sorun, sıkı oturmaması ve solunum gazının dışarı sızmasıdır.
Uygulamak
- Hasta entübasyon yapılacakmış gibi pozisyon verilir ve ağız açılır.
- Laringeal maske, distal açıklık larinksin önünde durana kadar kör bir şekilde damak boyunca boğaza sokulur (birçok farklı varyant vardır!).
- Şimdi gırtlak maskesinin hava yastığı şişirilir (bastırmaya gerek yok, kendisini konumlandırır) ve hasta gırtlak maskesi aracılığıyla havalandırılır.
Gelişmeler
- Klasik laringeal maskenin piyasaya sürülmesinden bu yana, daha kolay yerleştirme, daha iyi oturma ve daha iyi aspirasyon koruması sunan çok sayıda geliştirilmiş versiyon geliştirilmiştir. Örneğin, I-Gel® Laringeal maskenin şişirilebilir bir manşeti yoktur, bunun yerine gırtlak girişini çevreleyen şekilli bir jel yastığı vardır.
- Ek olarak, maskeye, örneğin üzerine bir mide tüpünün yerleştirildiği ve maskenin yerleştirildiği bir emme kanalı entegre edilmiştir, bu şekilde mide rahatlatılabilir (www.i-gel.com).

Özofago-trakeal kombinasyon tüpü
Endikasyon
Acil bir durumda, eğer endotrakeal entübasyon uygulanamıyorsa, alternatiftir.
Avantajlar
- Kombinasyon tüpü (Frass tüpü), kör olarak veya bir laringoskop yardımıyla yerleştirilebilen çift lümenli bir tüptür.
- Vakaların %98’inde kombi tüp yemek borusunda durur, ancak hasta hem yemek borusu hem de soluk borusu pozisyonunda ventile edilebilir.
- Kombine tüp nispeten iyi aspirasyon koruması sağlar ve 37 Fr SA (= standart boyut) ve 41 Fr olmak üzere iki boyutta mevcuttur.

Dezavantaj
Kombinasyon tüpü nispeten sert ve kalındır (özellikle 41-Fr modeli), bu nedenle farinks-maksofarenks bölgesindeki mukoza zarında yaralanmalar mümkündür.
Komplikasyonlar
Larinks ve farinks yaralanmaları, tüp konumunu doğrulamada zorluklar (kombinasyon tüpü genellikle başlangıçta çok derine yerleştirilir, bu nedenle ventilasyon mümkün değilse 2 – 3 cm geri çekin!).
Uygulamak
- Kombi tüp çift lümenli bir tüptür, yani iki ayrı tüpten oluşur.
- Kombinasyon tüpü, laringoskopla veya laringoskop olmadan hastanın dili boyunca düz bir şekilde yerleştirilir ve işaret üst çene diş sırasına veya üst alveolar çıkıntıya ulaşana kadar ileri doğru itilir.
- Şimdi hem proksimal orofaringeal balon hem de distal kaf belirtilen hacimlere şişirilir ve hasta ilk önce tüpün daha uzun, mavi ucu aracılığıyla ventile edilir.
- Aynı zamanda akciğerler havalandırılıp havalandırılmadığını görmek için oskülte edilir. Akciğerlerden bir solunum sesi duyulabiliyorsa, tüp yemek borusundadır (neredeyse her zaman!) Ve solunan hava gırtlağın önündeki deliklerden soluk borusuna akar (gırtlak maskesine benzer; supraglottik olarak adlandırılır).
- Distal manşet yemek borusunu kapatır ve büyük orofaringeal balon ağız boşluğunu kapatır, böylece hava sadece akciğerlere girebilir. Bu tüp lümeni yoluyla ventilasyon mümkün değilse, kombinasyon tüpü genellikle çok derindir (2 – 3 cm geri çekilir!) Veya kazara trakeaya yerleştirilmiştir. Bu durumda, normal bir endotrakeal tüp gibi ventilasyon için kombi tüpün daha kısa, şeffaf lümeni kullanılır.
Gırtlak tüpü
Endikasyon
Laringeal tüp, endotrakeal entübasyona nispeten yeni bir alternatiftir, esas olarak acil tıpta kullanılır ve basit ve güvenli kullanımı nedeniyle sağlık görevlileri tarafından da kullanılabilir.

Avantajlar
Laringeal tüpün kullanımı nispeten kolaydır ve yaralanma riski düşüktür.
Dezavantaj
Laringeal tüp, laringeal maske gibi aspirasyona karşı mutlak koruma sağlamaz.
Komplikasyonlar
Mukozal yaralanmalar, yetersiz havalandırma ve yetersiz mide içeriğinin aspirasyonu.
Uygulama
- Laringeal tüp genellikle siyah işaret dişlerin üst sırasına (alveolar çıkıntı) ulaşana kadar kör olarak yerleştirilir. Daha sonra iki balon şişirilir (iki balon birbirine bağlanır ve aynı anda bir besleme hattı ile şişirilir) ve hasta gırtlak tüpünden havalandırılır.
- Laringeal tüp neredeyse her zaman yemek borusunda durur.
- Kombinasyon tüpünde olduğu gibi, iki bloke balon havayı supraglottikten akciğerlere yönlendirir.
- Ventilasyon sırasında akciğerlerden solunum sesi duyulmuyorsa, tüp yanlış konumlandırılmıştır; Bu durumda laringeal tüpün tamamen çıkarılması ve yeniden takılması önerilir.
- Standart gırtlak tüpü mideyi boşaltmak için kullanılamaz. Ancak bu arada mide sondasının yerleştirilmesini sağlayan başka bir model (laringeal tüp S II) vardır.
Koniyotomi ve trakeotomi
- Sıradan insanlar tarafından ‘trakeal insizyonlar’ olarak bilinen müdahaleler, krikotirotomi ve trakeotomi, hava yolunu güvenceye almak için iki invaziv yöntemdir.
- Krikotirotomi, yani ligamentum conicum’un (krikotiroidum) bölünmesi, tanımı gereği gırtlakta kesildiği için aslında trakeada bir kesi değildir. Bu yöntem sadece acil durumlar için uygundur ve daha uzun ventilasyon tedavisi için düzenli bir trakeotomiye dönüştürülmelidir.
- Trakeotomi, çok deneyimli cerrahlar tarafından, acil durumlarda bile, ancak çoğunlukla iyi düzenlenmiş koşullar altında elektif olarak gerçekleştirilir.
Krikotirotomi
Endikasyon
Krikotirotomi, entübasyon veya hava yolunu güvenceye almak için supraglottik yöntemler (laringeal maske, kombinasyon tüpü vb.) başarısız olursa hava yolu tıkandığında kullanılır – sadece “havalandırma yapamıyor – entübe edilemiyor” acil durumlarda son çare olarak kullanılır.
Avantajlar
Krikotirotomi nispeten hızlı bir şekilde gerçekleştirilebilir ve alt hava yollarına doğrudan erişim sağlar. Bununla birlikte, özellikle entübe edilmesi zor olan hastalarda bağın tanımlanması genellikle zordur.
Dezavantaj
Krikotirotomi invaziv bir prosedürdür ve tamamen geçici bir çözümdür, çünkü krikotirotomi gırtlağa zarar verebilir.
Komplikasyonlar
Doğrudan damar yaralanması, aşırı kanamaya (esas olarak tiroid damarları) neden olabilir ve gırtlakta hasara neden olabilir. Bununla birlikte, bir felaket durumunda, krikotirotomi her zaman denenmelidir, aksi takdirde ölümcül sonuç çok olasıdır.
Uygulama
- Baş kuvvetli bir şekilde hiperekstansiyondadır ve gırtlak palpe edilir. Yukarıdan: tiroid kıkırdağı – konik bağ – krikoid kıkırdak – trakeal parantez.
- Deri ve ligamentum conicum bistüri ile kesilir (tercihen çapraz, sonra yara kendi kendine açılır) ve birkaç mm derinlikte gırtlağa ulaşılır.
- Artık hastanın havalandırıldığı nefes borusuna ince bir tüp yerleştirilebilir. Kompresyon ile kanama durdurulur. Krikotirotomiyi açık tutmak ve tükenmez kalemle üflemek gibi sıradan basında yer alan prosedürler, uydurma hikayelerdir ve işe yaramaz!
Periferik Venöz Kateter
Periferik venöz kateterler (PVC’ler), genellikle ön kol veya eldeki periferik venlere yerleştirilen küçük, esnek tüplerdir. İlaç, sıvı ve kan ürünlerinin verilmesi ve kan örneklerinin alınması için klinik ortamlarda yaygın olarak kullanılırlar.

Merkezi Venöz Kateterlerle (CVC’ler) Karşılaştırma:
PVC’ler, merkezi venöz kateterlerden birkaç önemli açıdan farklıdır:
- Yerleştirme Yeri: PVC’ler periferik venlere yerleştirilirken, CVC’ler internal juguler, subklavian veya femoral venler gibi daha büyük merkezi venlere yerleştirilir.
- Kullanım Süresi: PVC’ler genellikle flebit ve infiltrasyon riskinin daha yüksek olması nedeniyle genellikle 72-96 saate kadar kısa süreli kullanım için tasarlanmıştır. Bunun aksine, CVC’ler haftalarca ila aylarca süren uzun süreli erişim için tasarlanmıştır.
- Endikasyonlar: PVC’ler tahriş etmeyen ilaçların ve sıvıların uygulanması için uygundur. CVC’ler vezikant ilaçların, parenteral beslenmenin veya uzun süreli intravenöz tedavinin gerekli olduğu durumlarda tercih edilir.
- Yerleştirme Prosedürü: PVC’lerin yerleştirilmesi, görüntüleme rehberliği olmadan yatak başında gerçekleştirilebilen daha basit bir prosedürdür. Bunun aksine, CVC yerleştirme daha karmaşıktır ve genellikle doğru yerleştirmeyi sağlamak için ultrason veya floroskopi gibi görüntüleme tekniklerini gerektirir.
Bu ayrımları anlamak, uygun vasküler erişim cihazını seçmek, böylece hasta bakımını optimize etmek ve olası komplikasyonları en aza indirmek için çok önemlidir.
Periferik venöz kateterler (PVC’ler), yaygın olarak Abbocath®, Braunüle®, Flexüle®, Venflon® ve Viggo® gibi ticari adlarla bilinir ve intravenöz erişim için kullanılan temel tıbbi cihazlardır. İlaçların, sıvıların ve kan ürünlerinin verilmesini ve kan örneklerinin toplanmasını kolaylaştırırlar.
Yaygın Yerleştirme Yerleri:
PVC’ler çeşitli periferik venlere yerleştirilebilir ve her birinin kendine özgü avantajları ve hususları vardır:
- Antekubital Fossa (Dirsek Damarı): Ortanca kübital ven belirgindir ve kolayca erişilebilirdir, bu da onu hızlı infüzyonlar için uygun hale getirir. Ancak dirsek eklemine yakın konumu, kol hareketinden dolayı kateterin yer değiştirmesi riskini artırır.
- Dorsal El Damarları: Elin dorsal venöz ağı yüzeysel ve erişilebilirdir, ancak bu damarların daha küçük boyutu akış hızını sınırlayabilir ve flebit riskini artırabilir.
- Ön Kol Damarları: Sefalik, bazilik ve median antebrakiyal damarlar gibi damarlar, eklem hareketinden kaynaklanan tıkanma riskini azaltarak erişilebilirlik ve hasta konforu arasında bir denge sunar.
Kateter Boyutları ve Renk Kodlaması:
PVC’ler çeşitli ölçü boyutlarında mevcuttur ve her biri kolay tanımlama için renk kodludur. Ölçü numarası, kateterin çapıyla ters orantılıdır; daha küçük bir ölçü numarası daha büyük bir çapı gösterir ve daha yüksek akış hızlarına olanak tanır.
| Ölçü (G) | Renk | Dış Çap (mm) | Akış Hızı (mL/dak) | Yaygın Kullanımlar |
|---|---|---|---|---|
| 14 | Turuncu | 2,10 | 240 | Hızlı sıvı replasmanı, travma, büyük cerrahi |
| 16 | Gri | 1,70 | 180 | Kan nakli, büyük hacimli infüzyonlar |
| 18 | Yeşil | 1,30 | 90 | Rutin infüzyonlar, kan nakli |
| 20 | Pembe | 1,00 | 60 | Rutin infüzyonlar, ilaçlar |
| 22 | Mavi | 0,85 | 36 | Pediatrik ve yaşlı hastalar, küçük damarlar |
| 24 | Sarı | 0,70 | 20 | Yenidoğan, pediatrik ve kırılgan damarlar |
Not: Akış hızları yaklaşık değerlerdir ve kateter uzunluğuna ve üretici özelliklerine göre değişiklik gösterebilir.

Vasküler Erişimi Sağlama Prosedürü:
Hazırlık:
- IV erişim endikasyonunu doğrulayın ve bilgilendirilmiş onam alın.
- El hijyeni sağlayın ve uygun boyutta kateter, antiseptik solüsyon, eldiven, turnike ve pansuman malzemeleri dahil olmak üzere gerekli ekipmanı birleştirin.
Yer Seçimi:
- Damar boyutu, durumu ve tedavi türü gibi faktörleri göz önünde bulundurarak uygun bir damar seçin.
- Enfeksiyon, flebit veya önceki kateterizasyon komplikasyonları belirtileri olan bölgelerden kaçının.
Yer Hazırlığı:
- Damarı tıkamak için seçilen yerleştirme yerinin üzerine bir turnike uygulayın. – Enfeksiyon riskini azaltmak için bölgeyi antiseptik bir solüsyonla temizleyin ve tamamen kurumasını bekleyin.
Kateter Yerleştirme:
- Steril eldivenler giyin ve kateteri ambalajından çıkarın.
- Damarın sabitlenmesi için, yerleştirme yerinin altındaki cildi nazikçe gerginleştirin.
- Kateter iğnesini, venöz girişi gösteren kan geri tepmesi görülene kadar 10-30 derecelik bir açıyla yukarı doğru yerleştirin.
- Açıyı düşürün ve kateteri hafifçe ilerletin, böylece kanülün damar lümeninde olduğundan emin olun.
İlerletme ve Sabitleme:
- İğneyi sabit tutun ve iğneyi çekerken kateter kanülünü damara ilerletin.
- Turnikeyi serbest bırakın ve kan sızıntısını en aza indirmek için kateter ucunun üzerine baskı uygulayın.
- Kateter göbeğini gerektiği gibi IV uygulama setine veya tuzlu su kilidine bağlayın.
- Kateteri yerinden çıkmasını önlemek için uygun bir pansumanla sabitleyin.
Yerleştirme Sonrası Bakım:
- Yerleştirme yerini kateter yerleştirme tarihi ve saati ile etiketleyin.
- Enfeksiyon, infiltrasyon veya flebit belirtileri açısından yeri düzenli olarak izleyin.
- Kateteri kurumsal protokollere göre veya komplikasyonlar ortaya çıkarsa değiştirin.
Periferik venöz kateterizasyonla ilişkili komplikasyonları en aza indirmek için aseptik tekniklere ve uygun prosedür adımlarına uymak çok önemlidir.
Keşif
Periferik venöz kateterizasyonun (PVC) tarihi, erken başlangıcından modern yeniliklere kadar intravenöz (IV) tedavide önemli tıbbi gelişmeleri yansıtır.
Antik Temeller
- MÖ 4. Yüzyıl – Hipokrat Yazıları:
- Veneseksiyon (kan alma) tekniklerinin erken tanımları, vasküler anatomiyi anlamak için temel oluşturdu.
- Damarlar, terapötik müdahaleler için yollar olarak kabul edildi, ancak sıvı uygulaması için hiçbir cihaz mevcut değildi.
17. Yüzyıl – İlk IV Uygulaması
- 1665 – Christopher Wren:
- İngiliz bilim adamı ve hekim, bir tüy kalem ve mesane kullanarak bir köpeğin damarına şarap ve afyon enjekte ederek kaydedilen ilk IV deneylerinden birini gerçekleştirdi.
- Bu deney, damarlara doğrudan sıvı uygulaması için erişilebileceğini gösterdi.
- 1667 – Jean-Baptiste Denis:
- Hayvan kanı kullanarak ilk insan IV transfüzyonlarından birini gerçekleştirdi. Bu, kan transfüzyonu deneylerinde tartışmalı bir dönemi işaret etti ancak venöz erişimin potansiyelini vurguladı.
19. Yüzyıl – Klinik Gelişmeler
- 1831 – Thomas Latta:
- İskoç bir doktor, kolera hastalarını intravenöz olarak tuzlu su uygulayarak başarıyla tedavi etti. Bu, IV sıvılarının en erken terapötik kullanımlarından biriydi ve hastalık yönetiminde hidrasyonun rolünü fark etti.
- 1850’ler – Geliştirilmiş İğneler ve Şırıngalar:
- Charles Gabriel Pravaz ve Alexander Wood, hassas IV iletimi sağlayan hipodermik iğneleri bağımsız olarak icat ettiler. Ancak, bunlar sürekli infüzyonlardan ziyade öncelikli olarak enjeksiyonlar için kullanılıyordu.
20. Yüzyıl – Modern PVC Gelişimi
- 1900’ler – Sterilizasyonda İlerlemeler:
- Joseph Lister tarafından sterilizasyon tekniklerinin geliştirilmesi enfeksiyon oranlarını önemli ölçüde azaltarak venöz erişimi daha güvenli hale getirdi.
- Cam şırıngalar ve yeniden kullanılabilir iğneler standart araçlar haline geldi.
- 1940’lar – Tek Kullanımlık PVC Kateterler:
- II. Dünya Savaşı sırasında, hızlı ve güvenli IV sıvı uygulamasına duyulan ihtiyaç kateter tasarımında yeniliklere yol açtı.
- Polivinil klorür gibi plastik malzemeler tanıtıldı, kateterler tek kullanımlık hale getirildi ve enfeksiyon riskleri azaltıldı.
- 1950’ler – Renk Kodlu Ölçüm Sistemi:
- Kateter ölçüm cihazları için standart renk kodlaması, tanımlamayı basitleştirmek ve belirli klinik senaryolar için uygun seçimi sağlamak amacıyla tanıtıldı.
- 1960’lar – Poliüretan ve Teflon’un Tanıtımı:
- Teflon gibi esnek, biyouyumlu malzemeler hasta konforunu artırdı ve tromboflebit gibi komplikasyonları azalttı. – Venflon® ve Abbocath® gibi markalar ticari pazarda lider olarak ortaya çıktı.
- 1970’ler – Güvenlik Özellikleri:
- İğne batması yaralanmalarını önlemek için güvenlik mühendisliği yapılmış kateterlerin geliştirilmesi bir öncelik haline geldi.
- Şirketler geri çekilebilir iğneleri ve koruma mekanizmalarını kateter tasarımlarına dahil etmeye başladı.
21. Yüzyıl – Teknolojik Yenilikler
- 2000’ler – Kapalı Sistem Tasarımları:
- Kapalı sistem kateterlerin tanıtımı kan maruziyetini en aza indirdi, kontaminasyon risklerini azalttı ve sağlık hizmeti sağlayıcıları için güvenliği artırdı.
- Gelişmiş Malzemeler ve Kaplamalar:
- Antimikrobiyal kaplamaların (örn. klorheksidin ve gümüş) kullanımı kateterle ilişkili enfeksiyonları azaltmaya yardımcı oldu.
- Geliştirilmiş biyouyumlu malzemeler uzun ömürlülüğü artırdı ve komplikasyonları azalttı.
- IV Yerleştirme İçin Taşınabilir Ultrason:
- Taşınabilir ultrason makinelerinin yaygın olarak benimsenmesi, özellikle zor venöz erişimi olan hastalarda başarılı ven kanülasyon oranlarını iyileştirdi.
Modern Tıp Üzerindeki Etkisi
PVC’lerin evrimi, malzeme bilimi, mühendislik ve tıbbi yeniliğin entegrasyonunu yansıtır. Periferik venöz kateterler artık klinik bakımda vazgeçilmezdir, IV tedavisi için güvenli, etkili ve çok yönlü bir yöntem sunar ve acil ve rutin tıbbi müdahalelerde önemli bir rol oynar.
İleri Okuma
- Wren, C. (1665). Experiments and Observations. Philosophical Transactions of the Royal Society.
- Latta, T. (1831). Saline Injections in Cholera. The Lancet.
- Wood, A. (1853). Hypodermic Syringe and Its Applications. Edinburgh Medical Journal.
- Lister, J. (1867). On the Antiseptic Principle in Surgery. The Lancet.
- Kuhn, J. J. (1950). Development of Plastic Intravenous Catheters. Annals of Surgery.
- Peripherer Venenkatheter – Wikipedia. Retrieved from https://de.wikipedia.org/wiki/Peripherer_Venenkatheter
- Central Venous Catheter vs. Peripheral – This vs. That. Retrieved from https://thisvsthat.io/central-venous-catheter-vs-peripheral
- Intravenöser Zugang – Venenverweilkanüle legen – praktischArzt. Retrieved from https://www.praktischarzt.de/behandlung/intravenoeser-zugang/
- Central Venous Catheters: Which, When and How – Oxford Academic. Retrieved from https://academic.oup.com/bjr/article/96/1151/20220894/7498972
- Peripheral IV — Peripheral Intravenous Catheter (PIVC) – Cleveland Clinic. Retrieved from https://my.clevelandclinic.org/health/treatments/24930-peripheral-iv
- Peripheral Intravenous Access (IV) – Technique and Overview. The Procedure Guide. https://theprocedureguide.com/peripheral-intravenous-access-iv-technique-and-overview/
- Guide to IV Catheter Sizes: Gauge, Diameter, Length, Flow Rate. CIA Medical. https://www.ciamedical.com/insights/iv-catheter-sizes/
- Peripheral venous catheter. Wikipedia. https://en.wikipedia.org/wiki/Peripheral_venous_catheter
- How To Do Peripheral Vein Cannulation. MSD Manual Professional Edition. https://www.msdmanuals.com/professional/critical-care-medicine/how-to-do-peripheral-vascular-procedures/how-to-do-peripheral-vein-cannulation
Exposure
- İngilzcede;
- Açıkta bırakma, maruz kalma
- (radyoloji) x ışını şutlama.
- (Nükleer Bilimler) Işınlama,maruz bırakma,poz, ışınlanma
Disability
- İngilizcede; sakatlık, yetersizlik, kısıtlılık.
rationalis
- Latincede; bir nedene ait olma, nedenli.
- ratio kelimesinden gelmiştir.
rational
- rationalis kelimesinden gelmektedir.
- Anlamları;
- Akıl sahibi.
- Kulağa mantıklı gelen, absürd olmayan.
Alyuvar çökelme hızı
Eritrosit Sedimantasyon Hızı (ESR), kırmızı kan hücrelerinin (eritrositlerin) belirli bir süre boyunca (genellikle bir saat) kan içeren bir test tüpünün dibine çökme hızını ölçmek için kullanılan yaygın ve basit bir kan testidir. Test genellikle vücuttaki enflamasyonun bir göstergesi olarak kullanılır ve enfeksiyonlar, otoimmün hastalıklar ve kanserler dahil olmak üzere çeşitli durumlar için teşhis sürecinin bir parçasıdır.
ESR Testinin Prensibi
Test, iltihap nedeniyle kanda fibrinojen gibi belirli proteinler yükseldiğinde kırmızı kan hücrelerinin bir araya toplanma ve tüpün dibine daha hızlı düşme eğiliminde olması prensibine göre çalışır. Kırmızı kan hücrelerinin bir saat içinde tüpte düştüğü mesafe milimetre cinsinden ölçülür ve iltihap seviyesinin kabaca tahmin edilmesini sağlar.
- Yüksek ESR**: Kırmızı kan hücrelerinin daha hızlı çökelmesi daha yüksek iltihap seviyelerine işaret edebilir.
- Düşük ESR**: Daha yavaş bir sedimantasyon hızı tipik olarak daha az iltihap olduğunu veya hiç olmadığını gösterir.
**ESR Testi Neden Yapılır?
Doktorlar, bir hastada iltihap veya enfeksiyon içeren durumlar olduğundan şüphelendiklerinde ESR testi isterler. Test tek başına tanı koydurucu olmasa da, aşağıdakiler gibi çeşitli durumların teşhisinde ve izlenmesinde yardımcı olur:
- İnflamatuar Bağırsak Hastalığı (IBD)**: Crohn hastalığı ve ülseratif kolit.
- Otoimmün Bozukluklar: Lupus ve romatoid artrit gibi.
- Kronik Enfeksiyonlar: Tüberküloz veya kemik enfeksiyonları gibi.
- Kanserler**: Özellikle *kemik iliğini* veya bağışıklık sistemini etkileyenler.
- Kawasaki Hastalığı**: Özellikle çocuklarda, ESR koroner arterleri etkileyen iltihaplanmayı izlemek için kullanılabilir.
Ek olarak, ESR, bu koşullar için bir tedavinin ne kadar iyi çalıştığını izlemek için kullanılabilir, çünkü ESR’nin azalması iltihabın kontrol altına alındığını gösterebilir.
ESR Test Sonuçlarını Anlamak
Normal ESR Seviyeleri:
- Erkekler**: ≤ 15 mm/saat.
- Kadınlar: ≤ 20 mm/saat.
- Çocuklar**: ≤ 10 mm/saat.
- Yenidoğanlar**: 0-2 mm/saat.
- Yaşlı yetişkinler: Normal aralık yaşla birlikte artma eğilimindedir. Erkekler için ESR yaş/2 ve kadınlar için yaş + 10/2 olarak hesaplanabilir.
Yükselmiş ESR:
- Yüksek ESR ne anlama gelir? **Normalden daha yüksek bir ESR, vücutta iltihaplı bir süreç olduğunu gösterir. Bunun nedeni enfeksiyonlar, otoimmün bozukluklar, kanserler ve kronik hastalıklar olabilir.
Yüksek ESR’ye Yol Açan Durumlar
Çeşitli enfeksiyonlar ve tıbbi durumlar ESR’de artışa neden olabilir:
- Sistemik Enfeksiyonlar**: Tüm vücudu etkileyen enfeksiyonlar.
- Osteomiyelit**: Kemik enfeksiyonları.
- Endokardit: Kalp odacıklarının ve kapakçıklarının iç zarının enfeksiyonu.
- Romatizmal Ateş: Streptokok enfeksiyonundan sonra gelişebilen iltihaplı bir hastalık.
- Erysipelas: Sistemik iltihaplanmaya neden olabilen bir deri enfeksiyonu.
- Tüberküloz: Esas olarak akciğerleri etkileyen ancak tüm vücuda yayılabilen ciddi bir enfeksiyon.
- Otoimmün hastalıklar: Romatoid artrit, lupus ve temporal arterit gibi.
- Kanserler**: Özellikle kan hücrelerini ve bağışıklık sistemini etkileyen *lenfoma*, *lösemi* ve multipl miyelom.
- Kronik iltihap: Polimiyalji romatika ve vaskülit gibi durumlar.
- Diğer durumlar**: ESR hamilelik, anemi veya tiroid hastalığında da yükselebilir.
**ESR 40 Yüksek Sayılır mı?
- ESR ≥ 40 mm/saat** yüksek kabul edilir ve tipik olarak önemli bir iltihabın varlığına işaret eder. Örneğin, tamamlanmamış Kawasaki hastalığında ESR’nin 40 mm/saat’in üzerinde olması, koroner arter tutulumuna işaret ettiğinden ekokardiyogram dahil olmak üzere ileri laboratuvar incelemelerine devam edilmesi için bir göstergedir.
- ESR ≥ 100 mm/saat** genellikle şiddetli enflamasyon veya anjit (kan damarlarının enflamasyonu) belirtisidir ve vaskülit veya sistemik bir enfeksiyon gibi altta yatan daha ciddi durumlara işaret edebilir.
Düşük ESR:
- Düşük ESR** genellikle daha az endişe vericidir ve ciddi bir duruma işaret etmeyebilir. Bu durum polisitemi, lökositoz ve bazı kan bozuklukları ile ilişkili olabilir. Çok düşük bir ESR, orak hücreli anemi veya konjestif kalp yetmezliği gibi durumlara işaret edebilir.
Özel Hususlar
- Kadınlarda ESR: ESR, muhtemelen hormonal farklılıklar ve fibrinojen seviyelerindeki dalgalanmalar nedeniyle kadınlarda doğal olarak erkeklerden daha yüksektir. ESR ayrıca yaşla birlikte ve hamilelik sırasında artma eğilimindedir.
- Yaşın Etkisi**: İnsanlar yaşlandıkça, ESR’nin normal aralığı artar, bu nedenle ESR için yaşa göre ayarlanmış hesaplamalar genellikle yaşlı yetişkinlerde kullanılır.

Tedavi ve Yönetim
Yüksek ESR’nin yönetimi, altta yatan iltihaplanma nedeninin tedavi edilmesine bağlıdır. Enflamasyonu ele alarak ESR’yi düşürmeye yardımcı olabilecek adımlar şunlardır:
İlaçlar:
- Anti-enflamatuar ilaçlar**: Non-steroid anti-inflamatuar ilaçlar (NSAID’ler) veya kortikosteroidler.
- Antibiyotikler**: Enflamasyona katkıda bulunan enfeksiyonlar için.
- İmmünosupresif ilaçlar**: Otoimmün durumlar için.
Yaşam Tarzı Ayarlamaları:
- Egzersiz**: Düzenli fiziksel aktivite kronik enflamasyonu azaltmaya yardımcı olabilir.
- Sağlıklı Beslenme**: Anti-enflamatuar gıdalar (meyveler, sebzeler, tam tahıllar ve sağlıklı yağlar gibi) açısından zengin bir diyet ESR’yi düşürmeye yardımcı olabilir.
- Kilo Yönetimi**: Fazla kiloları vermek iltihaplanma seviyelerini düşürmeye yardımcı olabilir.
- Hidrasyon ve Hijyen**: Susuz kalmamak ve temiz bir ortam sağlamak gibi iyi sağlık alışkanlıklarını sürdürmek enfeksiyon riskini azaltabilir.
Keşif
Sedimantasyona İlişkin İlk Gözlemler (19. Yüzyılın Sonları)
- 1897: Polonyalı bir doktor olan Edmund Faustyn Biernacki ilk kez kırmızı kan hücrelerinin sedimantasyon hızı ile hastalık durumları arasındaki ilişkiye dikkat çekti. Kan hücrelerinin sağlıklı bireylerde, iltihaplı durumları olanlara kıyasla farklı oranlarda çöktüğünü gözlemledi.
Westergren Yönteminin Geliştirilmesi (1921)
- 1921: İsveçli bir doktor olan Dr. Alf Westergren ESR testini geliştirerek uzun, dereceli bir tüpte kırmızı kan hücrelerinin sedimantasyonunu ölçmek için standart bir yöntem oluşturdu. Westergren yöntemi** olarak adlandırılan bu yöntem, enflamatuar durumları tespit etmedeki doğruluğu nedeniyle yaygın olarak benimsenmiştir.
Erken Klinik Uygulamalar (1920’ler-1930’lar)
- 1920’ler ve 1930’lar boyunca ESR, romatoid artrit, tüberküloz ve romatizmal ateşin teşhisinde ve izlenmesinde rutin bir test haline geldi. Enflamasyon ve hastalık aktivitesinin basit, düşük maliyetli bir göstergesi olarak kabul edilmiştir.
Otoimmün Hastalıklarda ESR’nin Tanınması (1950’ler)
- 1950s: ESR, özellikle romatolojide lupus ve vaskülit gibi sistemik otoimmün hastalıkların teşhisinde ve izlenmesinde kullanılmaya başlandı.
Laboratuvar Tıbbında Yaygın Kabul (1970’ler)
- 1970’lerde ESR testi, enflamatuar hastalıkları, enfeksiyonları ve kanserleri değerlendirmek için laboratuvar panellerinin standart bir parçası haline geldi. İnflamatuar bağırsak hastalığı (IBD)** ve polimiyalji romatika gibi kronik durumların izlenmesindeki rolü sağlamlaştı.
Otomatik ESR Ölçümünün Tanıtımı (1980’ler)
- 1980s: Klinik laboratuvarlarda verimliliği, standardizasyonu ve doğruluğu artıran ESR ölçümü için otomatik makineler tanıtıldı. Bu makineler manuel tekniklerle ilişkili değişkenliği azaltmıştır.
Yaşa ve Cinsiyete Özel Referans Değerler (1990’lar)
- 1990s: Araştırmacılar, ESR’nin yaşla birlikte doğal olarak arttığını ve erkeklerle kadınlar arasında farklılık gösterdiğini kabul ederek ESR için yaşa ve cinsiyete özgü referans aralıkları oluşturdular. Bu güncellenmiş aralıklar tanısal doğruluğun geliştirilmesine yardımcı olmuştur.
Kawasaki Hastalığı Teşhisinde Rolü (2000’ler)
- 2000s: ESR, C-reaktif protein (CRP) ile birlikte, çocuklarda Kawasaki hastalığının teşhisinde, özellikle de koroner arter tutulumunun belirlenmesinde anahtar belirteçler haline gelmiştir.
Diğer İnflamatuar Belirteçlerle Karşılaştırma (2000’ler-Günümüz)
- 2000’lerden günümüze**: ESR testi, *C-reaktif protein (CRP)* ve prokalsitonin gibi diğer enflamasyon belirteçleriyle karşılaştırılmaya devam etti, ancak basitliği, maliyet etkinliği ve kronik enflamatuar durumları yansıtma yeteneği nedeniyle yaygın olarak kullanılmaya devam etti.
İleri Okuma
- Biernacki, E. (1897). “Observations on the Sedimentation of Erythrocytes in Various Disease States.” Archiv für Experimentelle Pathologie und Pharmakologie, 4(5), 603-612.
- Westergren, A. (1921). “The Technique of the Erythrocyte Sedimentation Rate Test.” Scandinavian Journal of Clinical & Laboratory Investigation, 3(2), 86-89.
- Sox, H. C., Liang, M. H. (1986). “The erythrocyte sedimentation rate: Guidelines for rational use.” Annals of Internal Medicine, 104(4), 515-523.
- Saadeh, C. (1998). “The erythrocyte sedimentation rate: Old and new clinical applications.” Southwestern Medical Review, 3, 1-4.
- Gabriel, S. E., et al. (1999). “Use of Erythrocyte Sedimentation Rate and C-Reactive Protein to Monitor Inflammatory Disease.” Rheumatology (Oxford), 38(10), 978-981.
- Brigden, M. L. (1999). “The erythrocyte sedimentation rate: Still a helpful test when used judiciously.” Postgraduate Medicine, 105(5), 123-131.
- Carter, M. J., Lobo, A. J., & Travis, S. P. L. (2004). “Guidelines for the management of inflammatory bowel disease in adults.” Gut, 53(Suppl 5), v1-v16.
- Paediatric Rheumatology International Trials Organisation (PRINTO). (2013). “Classification criteria for Kawasaki disease.” Annals of the Rheumatic Diseases, 72(6), 944-950.
Granülopoez
- Sinonim: Granulocytopoiesi, Granulopoiesis, Granulopoese
- Hematopoez‘in bir kısmıdır.

- Olgunlaşma sırasında, hücreler kendi adlarına sahip birkaç karakteristik morfolojik aşamadan geçer. Artan hücre olgunluğu sırasına göre aşağıdaki seriler ortaya çıkar:
- Hemositoblast
- Miyeloblast
- Promiyelosit
- Miyelosit
- Metamiyelosit
- Çubuk çekirdekli granülosit
- Nötrofil granülosit
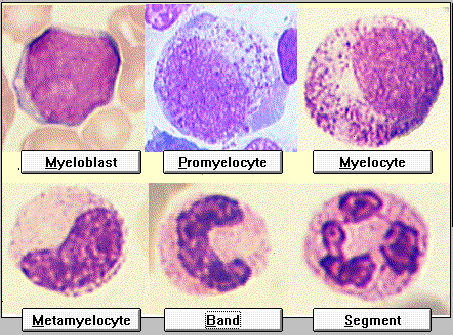

Klinik
Granüpopoez bozuklukları disgranülopoez olarak adlandırılır. Kantitatif olarak iki yöne ayrılır:
- Granülositopeni: granülosit eksikliği
- Granülositoz: artan granülosit sayısı
B semptomları
1. Kavramsal Çerçeve ve Giriş
“B semptomları” terimi, özellikle Hodgkin lenfoma (HL) ve Hodgkin dışı lenfomaların (non-Hodgkin lenfoma, NHL) evreleme ve prognostik değerlendirmesinde kullanılan, özgül bir sistemik belirti triadını ifade eder: açıklanamayan ateş, sırılsıklam gece terlemeleri ve anlamlı istemsiz kilo kaybı. Bu semptomların birlikte ele alınması ve “B” harfi ile işaretlenmesi, lenfomanın yalnızca anatomik yayılımını değil, aynı zamanda organizma düzeyindeki sistemik yanıtı yansıtması açısından tarihsel ve klinik bakımdan özel bir yere sahiptir.
- “B semptomları”, ateş >38 °C, sırılsıklam gece terlemeleri ve 6 ay içinde vücut ağırlığının >%10’luk istemsiz kaybını içeren, standardize edilmiş bir sistemik belirti üçlüsüdür.
- Bu kavram, 1971’de geliştirilen Ann Arbor evreleme sistemi ile lenfoma evrelemesine girmiş, “A” ve “B” kategorileriyle klinik pratiğe yerleşmiştir.
- B semptomları, başta Hodgkin ve Hodgkin dışı lenfomalar olmak üzere, KLL ve diğer hematolojik malignitelerde ileri hastalığı, yüksek tümör yükünü ve daha belirgin sistemik inflamasyonu yansıtır.
- Patofizyolojik olarak, proinflamatuvar sitokinlerin hipotalamus, karaciğer, kas ve yağ dokusu üzerindeki etkileriyle ilişkilidir.
- Klinik açıdan, hem evreleme, hem prognoz tahmini, hem de tedavi planlaması ve tedavi yanıtının izlenmesi için temel parametrelerden biridir.
- Evrimsel bakış açısıyla, bağışıklık yanıtına enerji tahsisini artıran adaptif mekanizmaların, malign süreçte kronikleşmiş ve zarar verici bir türevi olarak görülebilir.
2. Terminoloji ve Etimoloji
2.1. “Semptom” kavramı
“Semptom” sözcüğü, Yunanca sýmptōma (σύμπτωμα) kökünden gelir; “birlikte ortaya çıkan”, “tesadüfi olay”, “başına gelen şey” anlamlarına dayanır. Klinik bağlamda semptom, hastanın öznel olarak fark ettiği ve tarif ettiği, hekim tarafından doğrudan ölçülmeyen fenomenleri ifade eder (örn. ağrı, halsizlik, terleme hissi). “B semptomları” kavramı, bu öznel bildirimleri, objektif ölçümlerle (örneğin termometre ile doğrulanan ateş, kaydedilmiş ağırlık kaybı) birleştiren melez bir kategori hâline getirir.
“Konstitüsyonel semptomlar” ya da “sistemik semptomlar” ifadesi, ateş, kilo kaybı, gece terlemesi, iştahsızlık, halsizlik gibi tüm organizmayı ilgilendiren ve altta yatan süreç ne olursa olsun vücudun bütüncül yanıtını yansıtan bulguları tanımlamak için kullanılır. “B semptomları” bu daha geniş konstitüsyonel belirti kümesinin onkolojik bağlamda standartlaştırılmış bir alt kümesi olarak görülebilir.
2.2. “B” harfinin kökeni
Ann Arbor evreleme sistemi, 1971’de Hodgkin lenfomanın klinik evrelemesini standardize etmek amacıyla geliştirilmiştir. Bu sistemde hastalık evresi, esas olarak lenf nodu bölgelerinin sayısı, tutulduğu taraf (diyafram üstü/altı), ekstranodal tutuluma dair bulgular ve sistemik semptomların varlığına göre belirlenir.
- “A” harfi: Tanımlanmış sistemik semptomların yokluğunu
- “B” harfi: Bu semptomların varlığını
gösterir.
“B” harfinin kendisi, alfabetik olarak “A”nın karşıtı ve tamamlayıcısı olması dışında özgül bir etimolojik gerekçeye sahip değildir; yani “B” harfi, belirli bir kelimenin baş harfi (örneğin body ya da B-symptoms gibi) olarak seçilmemiştir. Daha çok, evreleme şemasında semptom varlığını işaretleyecek ikinci bir kategoriye gereksinim duyulması sonucu, alfabetik bir kodlama mantığı ile kullanıma girmiş, zamanla yerleşmiş bir kısaltmadır.
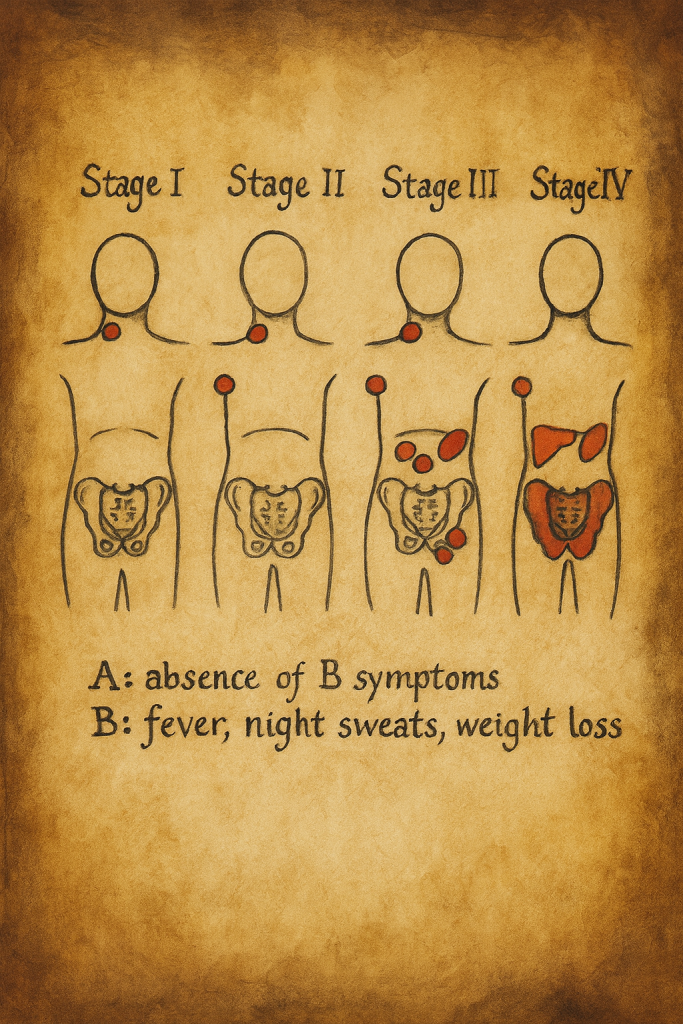
3. Ann Arbor Evreleme Sistemi ve B Semptomlarının Tarihsel Yeri
3.1. Ann Arbor sistemi: Temel yapı
Ann Arbor evreleme sistemi, başlangıçta Hodgkin lenfoma için geliştirilmiş; daha sonra pek çok NHL alt tipine de uyarlanmıştır. Sistem, hastalığın yayılım derecesini şu eksenler üzerinden tanımlar:
- Evre I: Tek bir lenf nodu bölgesinde veya tek bir ekstranodal bölgeyle sınırlı hastalık
- Evre II: Diyaframın aynı tarafında, iki veya daha fazla lenf nodu bölgesinin tutulumu (veya bunlara komşu tek bir ekstranodal tutulum)
- Evre III: Diyaframın her iki tarafında lenf nodu bölgelerinin tutulumu
- Evre IV: Yaygın, diffüz veya dissemine ekstranodal tutulum (örneğin karaciğer, kemik iliği, akciğer, santral sinir sistemi gibi organlarda)
Bu anatomik evreye ek olarak şu modifikasyonlar kullanılır:
- A/B: Sistemik B semptomlarının yokluğu/varlığı
- Bazı şemalarda ek kodlar:
- E (ekstranodal komşuluk tutulum),
- S (dalak tutulumu),
- X (bulky, yani büyük kitleli hastalık) vb.
3.2. A ve B ayrımının rasyoneli
Aynı anatomik evreye sahip iki hastanın prognozunun, sistemik semptomların varlığına göre farklı seyrettiği gözlemi, A/B ayrımının çıkar noktasını oluşturur. Örneğin:
- Evre II lenf nodu tutulumu olup B semptomu olmayan bir hasta: Evre IIA
- Aynı yayılım derecesinde olup B semptomu taşıyan bir hasta: Evre IIB
Bu kodlama, anatomik yayılımın ötesinde, vücudun tümör yüküne ve tümör kaynaklı inflamatuvar yanıta verdiği yanıtın da evreleme şemasına entegre edilmesini amaçlar.
4. B Semptomlarının Standart Tanımı
Klasik tanım üç ana semptomu içerir:
- Açıklanamayan ateş
- Genellikle >38 °C (veya >38,3 °C) olan, persistan ya da tekrarlayan ateş epizodları
- Ateşi açıklayabilecek belirgin enfeksiyon odağı ya da başka bir non-malign nedenin olmaması
- Bazı tanımlarda, “en az üç ardışık gün” süren veya belirli periyotlarla yineleyen ateşten söz edilir.
- Sırılsıklam gece terlemeleri
- Hasta geceleri pijama ve çarşaflarını değiştirmek zorunda kalacak kadar yoğun terleme
- Oda sıcaklığı veya kalın giyinme gibi çevresel faktörlerle açıklanamayan terleme
- Gün içi hafif terlemeler bu kategoriye girmez; vurgu, “drenching” olarak tarif edilen yoğunluğa yapılır.
- İstemsiz ve anlamlı kilo kaybı
- Son 6 ay içinde vücut ağırlığının >%10’unun kaybı
- Diyet, egzersiz veya bilinçli yaşam tarzı değişiklikleriyle açıklanamayan bir kayıp
- Örneğin 70 kg’lık bir bireyde 6 ay içinde 7 kg’dan fazla istemsiz kayıp, B semptomu kriterini karşılar.
Bu üç semptomdan en az birinin, tanımlanmış standartlara uygun biçimde varlığı, hastanın “B” kategorisine yerleştirilmesi için yeterlidir.
5. Patofizyolojik Temeller: Sitokinler, Hipotalamus ve Metabolik Yanıt
B semptomları, tümörün bulunduğu anatomik bölgeyle sınırlı lokal etkilerden çok, sistemik inflamatuvar ve metabolik yanıtların ürünüdür. Bu yanıtın biyolojik altyapısını anlamak için sitokin ağı, hipotalamik düzenleyiciler ve enerji metabolizması birlikteliğine bakmak gerekir.
5.1. Sitokin aracılı inflamatuvar yanıt
Lenfomada tümör hücreleri (örneğin Hodgkin lenfomasında Reed-Sternberg hücreleri) ve tümör mikroçevresindeki immün hücreler (T lenfositler, makrofajlar, stromal hücreler) çok sayıda proinflamatuvar sitokin salgılar:
- Interlökin-1 (IL-1)
- Interlökin-6 (IL-6)
- Tümör nekroz faktörü alfa (TNF-α)
- Interferon-γ (IFN-γ) vb.
Bu sitokinler:
- Hipotalamusta termoregülatuvar merkezlerin set-point’ini yükselterek ateşe yol açar.
- Karaciğerde akut faz yanıtını tetikleyerek CRP, fibrinojen gibi akut faz proteinlerinin artmasına neden olur.
- Kas ve yağ dokusunda katabolizmayı artırarak kilo kaybını ve kas kitlesi kaybını (kaşeksi) tetikler.
- Merkezi sinir sistemi üzerinden uyku-uyanıklık düzenini ve otonom yanıtları etkileyerek gece terlemelerine zemin hazırlayabilir.
5.2. Enerji metabolizması ve kaşeksi
B semptomlarıyla seyreden lenfomalarda sıkça gözlenen kilo kaybı, basitçe “az yemeye” indirgenebilecek bir olgu değildir. Çoğu hastada:
- Bazal metabolik hız artmıştır,
- Lipoliz ve proteoliz sitokinler aracılığıyla hızlanmıştır,
- İştahı düzenleyen leptin, ghrelin ve diğer nöropeptidlerin dengesi bozulmuştur.
Bu durum, evrimsel açıdan bakıldığında, enfeksiyon veya ağır stres koşullarında organizmanın enerji kaynaklarını bağışıklık yanıtına ve doku onarımına tahsis etmesiyle paralellik gösterir; ancak malign süreçlerde bu yanıt kronikleşir ve maladaptif hâle gelir.
6. B Semptomları ve Lenfomalar
6.1. Hodgkin Lenfoma (HL)
Hodgkin lenfoma, tipik olarak:
- Genç erişkinlerde sık görülen,
- Reed-Sternberg hücreleri ve zengin inflamatuvar mikroçevresiyle karakterize,
- Çoğu olguda servikal veya mediastinal lenfadenopatiyle başlayan
bir lenfoma alt grubudur.
B semptomlarının HL’deki özellikleri:
- Özellikle ileri evre (Evre III–IV) ve bazı histolojik alt tiplerde (örn. nodüler sklerozan, mikst sellüler tip) daha sık görülür.
- B semptomları varlığı, hastanın “B” alt grubu içinde sınıflandırılmasına yol açar (örn. Evre IIIB).
- Tarihsel olarak B semptomlarının varlığı, daha kötü prognostik görünüm ve daha agresif tedavi ihtiyacı ile ilişkilendirilmiştir. Güncel tedavi şemalarında risk stratifikasyonu daha çok çoklu parametrelere (yaş, lökosit sayısı, hemoglobin düzeyi, serum albümini, lenfosit sayısı vb.) dayansa da B semptomları hâlen önemli bir klinik belirteçtir.
HL’de sıklıkla eşlik eden diğer klinik özellikler:
- Ağrısız, lastik kıvamında lenfadenopati
- Özellikle banyodan ya da alkol alımından sonra lenf düğümlerinde ağrı
- Pruritus (yaygın kaşıntı)
- Bazen mediastinal kitleye bağlı öksürük, dispne ve göğüs ağrısı
6.2. Hodgkin dışı Lenfomalar (NHL)
NHL, biyolojik davranışı son derece heterojen, B hücreli, T hücreli ve NK hücreli alt tipleri içeren geniş bir lenfoid malignite grubudur. Bu grupta:
- Agresif lenfomalar (örn. diffüz büyük B hücreli lenfoma, periferik T hücreli lenfomalar) B semptomları ile daha sık başvurur.
- İndolent lenfomalar (örn. foliküler lenfoma, küçük lenfositik lenfoma) ise uzun süre sadece lenfadenopati ile seyredebileceği için B semptomları başlangıçta daha nadirdir, ancak hastalık ilerledikçe ortaya çıkabilir.
NHL’de B semptomlarının klinik etkileri:
- Sistemik hastalık yükünü ve inflamatuvar aktiviteyi işaret eder.
- Tedavi planlamasında, özellikle agresif rejimlerin (örn. R-CHOP, daha yoğun protokoller) seçilmesinde dolaylı rol oynar.
- Bazı prognostik indekslerde (ör. Uluslararası Prognostik İndeks, IPI) doğrudan yer almasa da, yüksek evre ve yüksek LDH düzeyi ile kombine olduğunda kötü prognozun bir parçası olarak değerlendirilebilir.
NHL’de eşlik edebilen diğer bulgular:
- Büyümüş periferik lenf nodları
- Hepatosplenomegali
- Ekstranodal tutulum bulguları (ör. gastrointestinal sistemde karın ağrısı, kanama; santral sinir sisteminde nörolojik defisitler)
7. Diğer Hematolojik Maligniteler ve B Semptomlarına Benzer Tablo
7.1. Kronik Lenfositik Lösemi (KLL) ve diğer lösemiler
KLL, genellikle indolent seyirli bir B hücreli neoplazi olup, uzun süre asemptomatik kalabilir. Ancak ilerleyen evrelerde:
- B semptomları (ateş, gece terlemesi, kilo kaybı),
- Belirgin lenfadenopati ve splenomegali,
- Hematopoetik yetersizlik bulguları (anemi, trombositopeni)
ortaya çıkabilir.
KLL’de B semptomlarının klinik önemi:
- Hastalığın daha agresif bir faza geçişini düşündürebilir;
- Kimi olgularda Richter transformasyonu (KLL’nin agresif büyük B hücreli lenfomaya dönüşmesi) için alarm bulgusu olabilir;
- Tedavi başlama endikasyonları arasında, ileri sitopeniler ve hastalığa bağlı komplikasyonlarla birlikte önemli bir yer tutar.
Akut miyeloid lösemi (AML) ve akut lenfoblastik lösemi (ALL) gibi diğer lösemilerde de ateş, kilo kaybı ve terleme sık görülür; ancak bu tablolar, enfeksiyon, hızlı proliferasyon ve kemik iliği yetmezliğine bağlı karmaşık mekanizmaların ürünüdür ve klasik Ann Arbor “B semptomu” kategorisinden çok “konstitüsyonel semptomlar” başlığı altında değerlendirilir.
7.2. Multipl miyelom ve miyeloproliferatif neoplaziler
Multipl miyelomda:
- Kilo kaybı, halsizlik ve zaman zaman ateş, ilerlemiş hastalık ve enfeksiyonlarla ilişkili olarak görülebilir.
- Sitokin ağı (özellikle IL-6), hem kemik yıkımı hem de sistemik semptomatoloji açısından önemli rol oynar.
Miyeloproliferatif neoplazilerde (örn. miyelofibroz, polisitemia vera, esansiyel trombositemi):
- Ateş, gece terlemesi ve kilo kaybı, yüksek sitokin yükü ve hematopoetik disfonksiyonun parçası olarak ortaya çıkabilir.
- Özellikle miyelofibrozda belirgin B benzeri semptomlar söz konusudur; yine de bu tablo klasik lenfoma B semptomu kategorisinden bağımsız, fakat patofizyolojik açıdan akraba kabul edilebilir.
8. Tanısal Değerlendirme: B Semptomlarını Saptamak ve Ayırıcı Tanı
8.1. Ayrıntılı anamnez ve objektif ölçüm
B semptomlarının doğru şekilde değerlendirilmesi için:
- Ateşin ölçülmüş değerleri, süresi, paterninin (sürekli, aralıklı, dalgalı) kaydı
- Kilo değişiminin belgelenmiş olması (önceki tıbbi kayıtlar, düzenli tartım)
- Gece terlemelerinin şiddet, sıklık ve fonksiyonel etkilerinin (örn. uykudan uyandırması, kıyafet/çarşaf değiştirme gereksinimi) ayrıntılı sorgulanması
gereklidir.
Klinik pratikte, “Sıcak bastığı için mi pijamanızı çıkarıyorsunuz, yoksa çarşafları değiştirecek kadar sırılsıklam mı uyanıyorsunuz?” gibi sorular, B semptomları ile daha hafif terleme yakınmalarını ayırt etmeye yardımcı olur.
8.2. B semptomlarını taklit eden durumlar
Bu semptomlar malign hastalıklara özgü değildir ve şu durumlarda da sıkça görülebilir:
- Enfeksiyonlar: Tüberküloz, HIV, endokardit, kronik bakteriyel enfeksiyonlar
- Otoimmün ve romatolojik hastalıklar: Romatoid artrit, vaskülitler, bağ dokusu hastalıkları
- Endokrin bozukluklar: Hipertiroidi, feokromositoma
- Metabolik/diğer nedenler: İleri kalp yetmezliği, kronik böbrek hastalığı, ciddi depresyon, yeme bozuklukları
Bu nedenle, B semptomları saptandığında, hematolojik malignitelerin yanı sıra, bu alternatif nedenlerin de sistematik şekilde dışlanması gerekir.
9. B Semptomlarının Prognostik ve Terapötik Önemi
9.1. Evreleme ve prognoz
Lenfomada B semptomlarının evreleme içindeki rolü, özellikle üç düzeyde önem taşır:
- Risk sınıflaması: Aynı anatomik evre içinde B semptomlarının varlığı, çoğu çalışma ve klinik şemada daha kötü prognoz ile ilişkilidir.
- Tedavi yoğunluğunun belirlenmesi: B semptomlu hastalarda, yüksek tümör yükü ve sistemik inflamasyon varsayımıyla, daha yoğun veya uzatılmış kemoterapi protokolleri seçilebilmektedir.
- Tedavi yanıtının izlenmesi: Başarılı tedaviyle B semptomlarının gerilemesi, hem hastanın yaşam kalitesi hem de tümör yükünün azalması bakımından önemli bir klinik gösterge kabul edilir.
9.2. Görüntüleme ve ileri tanısal işlemler
B semptomlarının varlığı, hastalığın yaygınlığını saptamak için daha kapsamlı incelemeleri tetikleyebilir:
- BT ve PET-BT ile lenf nodu ve ekstranodal tutulumun kapsamlı değerlendirilmesi
- Kemik iliği biyopsisi ile kemik iliği infiltrasyonunun araştırılması
- Gerekirse organ spesifik incelemeler (örn. MRI, endoskopi, biyopsiler)
Bu sayede, B semptomları yalnızca bir sınıflandırma kodu değil, tanısal stratejinin şekillenmesini sağlayan bir klinik işaret hâline gelir.
10. Evrimsel Tıp Perspektifi: Ateş, Terleme ve Kilo Kaybı Neden Bir Arada?
Evrimsel açıdan bakıldığında, ateş, iştahsızlık ve enerji tüketimindeki artış, akut enfeksiyonlarda konak lehine, patojen aleyhine işleyen koruyucu mekanizmalar olarak yorumlanır:
- Ateş, pek çok patojenin replikasyonunu zorlaştırır, immün hücre fonksiyonlarını (örn. fagositoz, antijen sunumu) optimize eder.
- İştahsızlık ve geçici katabolizma, sindirim sisteminden ziyade immün sisteme enerji kaydırılmasını ve zararlı maddelerin alımının kısıtlanmasını sağlayabilir.
- Terleme, hem termoregülasyonun bir parçası hem de otonom sinir sistemi aktivasyonunun dışavurumu olarak ortaya çıkar.
Lenfoma ve diğer kanserlerde bu yanıt, patojenlere değil tümör hücrelerine ve tümör mikroçevresindeki kronik inflamatuvar uyaranlara karşı tetiklenir. Bu durumda:
- Başlangıçta savunma amaçlı olan mekanizma,
- Tümörün tamamen ortadan kaldırılamadığı kronik bir durumda süregenleşir
- Ve sonuçta maladaptif bir hâl alarak hastanın kas kütlesi kaybetmesine, güçsüzleşmesine ve yaşam kalitesinin düşmesine yol açar.
B semptomları böylece, evrimsel açıdan adaptif süreçlerin, onkolojik bağlamda patolojik bir uzantısı olarak da okunabilir.
Keşif
1. İsim Konmadan Önce: 19. Yüzyılda İlk Gözlemler
1.1. Malpighi’den Hodgkin’e uzanan çizgi
Lenfomaya özgü bir tabloyu andıran ilk patolojik tanımlamalardan biri, 17. yüzyılda Marcello Malpighi’ye atfedilir. 1666 tarihli çalışmasında, dalağında nodüler lezyonları olan genç bir kadından söz eder; bu olgu daha sonra geriye dönük olarak Hodgkin benzeri bir tablo olarak yorumlanacaktır.
Yine de modern anlamda “Hodgkin lenfoma”ya giden yol, Thomas Hodgkin ile başlar. 1832’de, ünlü makalesi “On Some Morbid Appearances of the Absorbent Glands and Spleen”’de, Guy’s Hospital’dan yedi olguyu sistematik biçimde tarif eder: boyun, mediasten, dalak ve bazen karaciğerde belirgin büyümeler; eşlik eden halsizlik, bazen uzamış ateş ve belirgin zayıflama. Hodgkin, bugün bizim “B semptomu” dediğimiz triadı isimlendirmez; ama hastaların bir kısmında sistemik kötüleşmenin, yalnızca şişmiş lenf düğümleriyle açıklanamayacağını dikkatle kaydeder.
Bu dönem için ayırt edici olan şudur:
- Lenf düğümlerindeki büyüme herkesin dikkatini çeker.
- Ateş, terleme, zayıflama ise “genel halsizlik” başlığı altında, dağınık biçimde not edilir.
- Yani lokal anatomi çok ciddiye alınırken, sistemik belirtiler henüz ayrı bir kavramsal kategori hâline gelmemiştir.
1.2. Wilks, Reed, Sternberg ve hastalığın kimlik kazanması
- yüzyıl ortalarından itibaren tablo netleşmeye başlar:
- Samuel Wilks (1865 civarı), Hodgkin’in olgularını yeniden gözden geçirir, yeni olgular ekler ve hastalığı “Hodgkin hastalığı” olarak adlandırır.
- 1898’de Carl Sternberg, 1902’de Dorothy Reed lenf nodlarında, bugün kendi adlarını taşıyan büyük, çift çekirdekli Reed–Sternberg hücrelerini tarif eder.
Bu isimlerin çalışmaları, hastalığı ayrı bir neoplazi olarak netleştirir; ama hâlâ kimse “ateş + gece terlemesi + kilo kaybı” için özel bir isim kullanmaz. Bunlar, tıpkı tüberküloz veya kronik enfeksiyonlardaki gibi “yapı bozulması ve zayıflama” olarak görülür.
2. 20. Yüzyıl Ortası: Radyoterapi, Stajing İhtiyacı ve Ann Arbor’a Giden Yol
2.1. Erken evreleme denemeleri
- yüzyılın ilk yarısında radyoterapi güçlendikçe, başka bir soru öne çıkar:
“Hodgkin hastalığının hangi evresine ne kadar ışın verelim?”
Bu soru, anatomik yayılımı standart bir dille tarif etme ihtiyacını doğurur. 1950’lerde:
- Vera Peters ve çağdaşları, alan sınırlı radyoterapi ile erken evre Hodgkin hastalarında kür olabileceğini gösterir.
- Peters, Rosenberg ve diğerleri, lenf nodu bölgelerini tek tek tanımlayan ve “evre I, II, III” gibi kavramları kullanan erken stajing şemalarını geliştirir.
Bu erken şemalarda, hastanın genel durumu ve konstitüsyonel belirtileri elbette kaydedilir; fakat bunlar hâlâ evre koduna gömülmüş değildir. Ateş ve kilo kaybı, prognoz sezgisi verir ama adlandırılmış bir alt sınıf hâlini almaz.
2.2. 1971: Ann Arbor Evreleme Sistemi ve “B” harfinin doğuşu
Kırılma noktası, 1971’dir. Paul P. Carbone başkanlığındaki bir komite – Henry S. Kaplan, Karl Musshoff, David W. Smithers, Maurice Tubiana ile birlikte – klasik makaleleri “Report of the Committee on Hodgkin’s Disease Staging Classification”’ı yayımlar.
Bu rapor, bugün “Ann Arbor Evreleme Sistemi” diye bildiğimiz şemayı resmileştirir:
- Evre I–IV: Lenf nodu bölgelerinin sayısı, diyaframın hangi tarafında oldukları, ekstranodal tutulum (E), dalak tutulumu (S) vb. ile tanımlanır.
- İlk kez, sistemik semptomlar ayrı ve standart bir kategoriye dönüştürülür.
Komite üç temel sistemik belirtiyi şu şekilde kodlar:
- Açıklanamayan ateş:
- 38 °C; bilinen enfeksiyonla açıklanamayan, günler süren ateş epizodları.
- Sırılsıklam gece terlemeleri:
- Hasta pijamasını, çarşafını değiştirmek zorunda kalacak kadar terleme.
- 6 ay içinde vücut ağırlığının >%10’unun istemsiz kaybı.
Bu üçlü, “B semptomları” olarak adlandırılır ve:
- Bu semptomlar yoksa: evre sonuna “A”,
- En az biri varsa: evre sonuna “B”
harfi eklenir (örn. IIA, IIIB).
Komite, B sınıflaması için ilginç bir ayrıntıyı da ekler:
- Sırf pruritus (kaşıntı) olması B sınıfı için yeterli değildir.
- Ateşin “kısa süreli ve açıklanmış bir enfeksiyonla ilişkili” olması da B sınıfına sokulmaz.(Scribd)
“Neden B?” sorusunun cevabı, aslında son derece dünyevîdir:
- A = Asymptomatic (ya da semptomsuz) gibi okunabilecek, “semptom yok” anlamını taşıyan bir etiket.
- Buna karşıt kategoriyi belirtmek için, alfabetik olarak bir sonraki harf olan B seçilir.
- Herhangi bir mitolojik ya da kelime kökenine dayanan özel gerekçe yoktur; amaç, pratik, kısa, evrensel bir kod yaratmaktır.
Bu noktayla birlikte, 19. yüzyıldan beri dağınık biçimde not edilen “ateş – terleme – kilo kaybı” üçlüsü, resmen evrensel bir prognostik sembole dönüşür.
3. 1980–1990’lar: Kemoterapi Çağı, B Semptomlarının Prognostik Güce Dönüşmesi
3.1. MOPP, ABVD ve “agresif hastalık” vurgusu
1970’lerin sonu–1980’lerin başı, sistemik kemoterapinin Hodgkin lenfomada kürü mümkün kıldığı dönemdir. Vincent DeVita ve çalışma arkadaşlarının MOPP rejimi, daha sonra Bonadonna ve ekibinin geliştirdiği ABVD şeması, ileri evre Hodgkin hastalığında bile uzun süreli sağkalımın mümkün olduğunu gösterir.
Bu çalışmalarda giderek netleşen gözlem şudur:
- Aynı anatomik evrede olan hastalarda, B semptomu olanlar,
- Daha yüksek tümör yüküne,
- Daha sık hepatosplenomegali ve kemik iliği tutulumuna,
- Daha yüksek LDH ve inflamatuvar belirteçlere sahiptir.
Bu nedenle, tedavi planları giderek iki eksende şekillenmeye başlar:
- Evre (I–IV): Hastalığın ne kadar yayıldığı.
- A/B durumu: Organizmanın bu tümör yüküne ne kadar “sistemik” yanıt verdiği.
Örneğin, servikal ve mediastinal nodlarla sınırlı iki hasta düşünelim:
- B semptomu olmayan: Evre IIA,
- Aynı yayılımda, ama 39 °C’ye varan açıklanamayan ateş, gece terlemeleri ve belirgin kilo kaybı olan: Evre IIB.
Bu iki hastanın anatomik haritası aynı olsa da, tedavi yaklaşımı ve beklenen prognoz farklıdır; B semptomlu hasta, daha agresif kombine radyoterapi + kemoterapi rejimlerine aday hâle gelir.
3.2. Cotswolds toplantısı ve Ann Arbor’un rafine edilmesi
1989’da T. Andrew Lister başkanlığındaki Cotswolds toplantısı, Ann Arbor sistemini ayrıntılı biçimde revize eder.
Bu toplantıda:
- A/B kodlaması korunur,
- B semptomlarının tanımı netleştirilir,
- “Bulky disease (X)” ve ekstranodal tutulumun detayları (E, S gibi ekler) daha sistematik hâle getirilir.
Böylece B semptomları:
- Sadece klinik pratikte kullanılan bir pratik kısaltma olmaktan çıkıp,
- Uluslararası klinik araştırma tasarımlarının ve
- Prognostik indekslerin ayrılmaz parçası hâline gelir.
4. 2000’lere Doğru: B Semptomları Hodgkin’in Dışına Taşınıyor
4.1. Hodgkin dışı lenfomalar (NHL) ve agresif alt tipler
Zamanla Ann Arbor sistemi, Hodgkin dışı lenfomalara da uyarlanır. Agresif alt tipler – özellikle diffüz büyük B hücreli lenfoma (DLBCL), bazı T hücreli lenfomalar – tanımlandıkça, klinisyenler şu paterni fark eder:
- B semptomları NHL’de de ileri evre ve yüksek proliferasyon ile birlikte görülme eğilimindedir.
- Bununla birlikte, B semptomlarının NHL’deki bağımsız prognostik rolü, Hodgkin’deki kadar net değildir; bazı çalışmalarda, B semptomları daha çok yaygın hastalık ve yüksek histolojik grade ile koreledir, kendi başına bağımsız bir risk faktörü olmayabilir.
Bu dönemde B semptomları:
- NHL evrelemesinde de “A/B” ayrımına yansır,
- Özellikle agresif lenfomalarda, tedavi yoğunluğunu belirlerken yardımcı bir işarete dönüşür,
- Ancak giderek daha karmaşık prognostik skorlar (IPI, FLIPI, MIPI vb.) içinde **tek başına belirleyici olmaktan uzaklaşır.
4.2. KLL ve diğer hematolojik maligniteler
B semptomu triadı, yavaş yavaş:
- Kronik lenfositik lösemi (KLL)
- Miyeloproliferatif neoplaziler
- Multipl miyelom gibi tablolar için de günlük dilde kullanılmaya başlar.
Özellikle KLL’de:
- B semptomlarının ortaya çıkması, çoğu zaman daha indolent bir fazdan agresif dönüşüme (örneğin Richter dönüşümü) işaret eden bir alarm bulgusudur.
Resmi kılavuzların bir kısmı B semptomlarını bu hastalıkların “evre koduna” gömmese de, klinik pratikte:
“Bu hasta artık B semptomu taşıyor; sadece takip etmek yerine tedavi planlamalı mıyız?”
sorusunu tetikleyen kritik bir eşik hâline gelir.
5. Patofizyolojik Derinleşme: Sitokinler, Kaşeksi ve Hipotalamus
5.1. IL-6, IL-10, TNF-α ve B semptomlarının biyokimyasal zemini
1990’lar ve 2000’lerle birlikte, B semptomlarının biyolojisi daha ayrıntılı araştırılmaya başlar. Bir dizi çalışma göstermiştir ki:
- Hodgkin hastalığı ve diğer lenfomalarda serum IL-6 ve IL-10 düzeyleri yükselmiştir.
- Özellikle IL-6 düzeyleri, B semptomlarının varlığıyla korelasyon gösterir; IL-6 ne kadar yüksekse, ateş ve kilo kaybı o kadar belirgindir.
Bu sitokinler:
- Hipotalamusta ısı ayar noktasını yükselterek ateşe,
- Karaciğerde akut faz yanıtını (CRP, fibrinojen artışı),
- Kas ve yağ dokusunda proteoliz ve lipolizi hızlandırarak kilo kaybına,
- Otonom sinir sistemi üzerinden gece terlemelerine katkıda bulunur.
B semptomları, bu açıdan bakıldığında:
- Tümörün lokal varlığından çok,
- Tümör ve konak bağışıklık sistemi arasındaki sitokin fırtınasının klinik yüzüdür.
5.2. Kanser kaşeksisi araştırmaları ile birleşen hat
Paralel bir araştırma hattı, kanser kaşeksisi (anoreksi, kas ve yağ kaybı, artmış enerji harcaması) üzerine yoğunlaşır. Bu literatür, TNF-α, IL-1, IL-6, IL-8, IL-10 ve çeşitli tümör kaynaklı faktörlerin:
- Bazal metabolik hızı artırdığını,
- İştahı azalttığını,
- Kas protein yıkımını ve yağ mobilizasyonunu hızlandırdığını,
- Brown yağ dokusunda termogenezi artırarak ısı üretimini yükselttiğini gösterir.
Lenfomalı hastalarda B semptomlarıyla beraber görülen:
- Hızlı kilo kaybı,
- Kas gücü kaybı,
- Sürekli hafif ateş hâli
bu kaşeksi biyolojisinin somutlaşmış biçimi olarak yorumlanmaya başlanır. Böylece B semptomları, sadece “stajing kodu” değil, sistemik metabolik ve immün bozulmanın bir aynası olarak da ele alınır.
6. 2010’lar: PET-BT, Lugano Sınıflaması ve B Semptomlarının Yeniden Konumlandırılması
6.1. PET-BT’nin evrelemeye girmesi
2000’lerin sonu–2010’larla birlikte 18F-FDG PET/BT, lenfoma evreleme ve yanıt değerlendirmesinde merkezî rol üstlenir. Birçok çalışma, metabolik aktivitenin ve metabolik tümör volümünün (MTV) prognozla güçlü ilişkisini ortaya koyar.
Bu dönüşüm, stajing sistemine de yansır:
- 2014 tarihli Lugano sınıflaması (Cheson ve ark.), Ann Arbor’u modernize eder:
- FDG-tutucu lenfomalar için PET-BT’yi standart evreleme aracı olarak benimser.
- Kemik iliği biyopsisinin gerekliliğini pek çok olguda azaltır.
- A/B kodlamasını esasen Hodgkin lenfoma ile sınırlar; NHL’de A/B vurgusu zayıflar.
Amerikan Kanser Derneği ve diğer kılavuzlar, Hodgkin lenfoma için artık “Lugano temelli, modifiye Ann Arbor” sistemini kullanmakta; evre I–IV, E, X ve A/B kodları hâlâ yerini korumaktadır.
6.2. B semptomları PET çağında ne kadar önemli?
PET-BT çağıyla birlikte yeni bir tartışma doğar:
“Hâlâ üç semptomlu bu kaba klinik triada bu kadar ağırlık vermeli miyiz,
yoksa PET-BT parametreleri (SUV, MTV, TLG vb.) daha mı değerli?”
DLBCL ve diğer agresif lenfomalarda:
- Bazı çalışmalar, B semptomlarının, güncel prognostik modellerde bağımsız yerinin sınırlı olduğunu;
- Buna karşın PET-BT’deki metabolik parametrelerin (örneğin tedavi öncesi MTV, tedavi ortası SUV düşüşü) sağkalımı daha güçlü öngördüğünü gösterir.
Buna rağmen klinik pratikte:
- B semptomları hâlâ anamnezde mutlaka sorulan temel bir bloktur.
- Özellikle sınırda ya da belirsiz PET bulgularında, devam eden ateş–terleme–kilo kaybı, rezidüel aktif hastalık lehine yorumlanabilir.
Lugano sınıflaması da bu ikili dengeyi yansıtır:
- Bir yanda son derece sofistike görüntüleme ve kantitatif parametreler,
- Diğer yanda hâlâ geçerliliğini koruyan, basit ama güçlü üç klinik soru:
“Ateşin var mı?
Geceleri sırılsıklam terliyor musun?
Son 6 ayda istemeden ciddi kilo kaybettin mi?”
7. 2020’ler ve Ötesi: Güncel Araştırma Hatları
7.1. Daha karmaşık prognostik modeller içinde B semptomları
Güncel araştırmalar, B semptomlarını artık:
- Tek başına “iyi/kötü prognoz” belirleyicisi olarak değil,
- Moleküler alt tipler, gen ekspresyon imzaları, PET-BT ölçümleri, serolojik biyobelirteçler ile birlikte işleyen bir ağın parçası olarak ele alıyor.
Örneğin:
- DLBCL’de hücre kökenine (GCB vs non-GCB), MYC/BCL2/BCL6 yeniden düzenlenmelerine,
- Relaps/rezistan hastalarda CAR-T öncesi PET-BT parametrelerine göre geliştirilen modellerde, B semptomları çoğu zaman ikincil ya da tamamlayıcı bir değişken olarak yer alıyor.
7.2. Sitokin imzaları ve hedefe yönelik semptom yönetimi
İnflamatuvar sitokinler üzerine yürüyen yeni çalışmalar, özellikle:
- IL-6 ailesi sitokinleri,
- TNF-a ilişkili kaskadları,
- Tümör kaynaklı proteoliz ve lipoliz indükleyici faktörleri
ayrıntılı biçimde haritalamaya çalışıyor. Amaç, yalnızca tümörü tedavi etmek değil, B semptomlarının kendisini – yani sistemik inflamasyon ve kaşeksiyi – hedef alacak tedavi stratejileri geliştirmek.
Bu yaklaşım, iki düzeyde önem kazanıyor:
- Yaşam kalitesi: Ateş, gece terlemeleri ve hızlı kilo kaybı, hastanın günlük hayatını en çok bozan belirtiler arasında.
- Tedavi toleransı: Kaşektik ve sistemik inflamasyonu yüksek hastalar, agresif kemoterapi veya CAR-T gibi tedavilere biyolojik olarak daha kırılgan.
Bu nedenle gelecekte B semptomları, yalnızca stajing kodunda bir harf değil, immün-metabolik hedefli destek tedavilerin tasarlandığı bir biyobelirteç ekseni hâline gelebilir.
8. Genel Çizginin Toplanışı
Tarihsel çizgiye yukarıdan bakıldığında:
- 19. yüzyılda Hodgkin ve çağdaşları, tanımsız ama dikkat çekici bir sistemik şablon görmüşlerdi: açıklanamayan ateşler, geceleri ıslanan çarşaflar, eriyen bedenler.
- 1971’le birlikte Carbone, Kaplan ve komitesi bu tabloya bir harf verdi: B; ateş, gece terlemesi ve kilo kaybını, evrensel bir klinik kısa adıma dönüştürdü.
- 1980–1990’larda kemoterapinin yükselişiyle B semptomları, “daha agresif, daha yaygın hastalık” eşanlamlısı hâline geldi ve tedavi kararlarına yön verdi.
- 2000’lerden itibaren kavram, Hodgkin dışı lenfomalara, KLL’ye ve diğer hematolojik malignitelere doğru genişledi; eşzamanlı olarak sitokin biyolojisi ve kaşeksi araştırmaları, bu semptomların biyolojik köklerini aydınlattı.
- PET-BT ve Lugano sınıflaması çağında B semptomları, daha sofistike görüntüleme ve moleküler belirteçlerin gölgesinde kalsa da, hâlâ hem klinik değerlendirmede hem de hastanın kendi hastalık anlatısında merkezî bir rol oynamaya devam ediyor.
İleri Okuma
- Carbone, P. P., Kaplan, H. S., Musshoff, K., Smithers, D. W., & Tubiana, M. (1971). Report of the Committee on Hodgkin’s Disease Staging Classification. Cancer Research, 31(11), 1860–1861.
- Lister, T. A., Crowther, D., Sutcliffe, S. B., Glatstein, E., Canellos, G. P., Young, R. C., Rosenberg, S. A., Coltman, C. A., & Tubiana, M. (1989). Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. Journal of Clinical Oncology, 7(11), 1630–1636.
- Tzankov, A., & Dirnhofer, S. (2006). Pathobiology of classical Hodgkin lymphoma. Pathobiology, 73(3), 107–125. doi:10.1159/000095558
- Connors, J. M. (2005). State-of-the-art therapeutics: Hodgkin’s lymphoma. Journal of Clinical Oncology, 23(26), 6400–6408. doi:10.1200/JCO.2005.05.016
- Cheson, B. D., Fisher, R. I., Barrington, S. F., Cavalli, F., Schwartz, L. H., Zucca, E., & Lister, T. A. (2014). Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano classification. Journal of Clinical Oncology, 32(27), 3059–3067. doi:10.1200/JCO.2013.54.8800
- Ansell, S. M. (2015). Hodgkin lymphoma: 2015 update on diagnosis, risk-stratification, and management. American Journal of Hematology, 90(11), 1125–1132. doi:10.1002/ajh.24175
- Connors, J. M. (2015). State-of-the-art therapeutics: Hodgkin’s lymphoma. Journal of Clinical Oncology, 33(27), 2975–2983.
- Armitage, J. O. (2017). The aggressive peripheral T-cell lymphomas: 2017 update on diagnosis, risk stratification, and management. American Journal of Hematology, 92(7), 706–715. doi:10.1002/ajh.24791
- Swerdlow, S. H., Campo, E., Harris, N. L., Jaffe, E. S., Pileri, S. A., Stein, H., Thiele, J., & International Agency for Research on Cancer (eds.). (2017). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th ed. Lyon: IARC. ISBN 978-92-832-4494-3
- Alizadeh, A. A., Armand, P., & Shipp, M. A. (2018). Clinical characteristics and treatment of B-cell non-Hodgkin lymphoma. New England Journal of Medicine, 378(15), 1485–1496. doi:10.1056/NEJMra1707850
- Hallek, M., Shanafelt, T. D., & Eichhorst, B. (2018). Chronic lymphocytic leukaemia. The Lancet, 391(10129), 1524–1537. doi:10.1016/S0140-6736(18)30422-7




Yorum yazabilmek için oturum açmalısınız.