Aşağıdaki anlatı, löseminin iki yüzyıla yaklaşan serüvenini; ilk olgu betimlemelerinden sitogenetik devrimlere, kemoterapiden hedefe yönelik tedavilere ve hücresel immünoterapilere, nihayet güncel multi-omik ve ilaç geliştirme atılımlarına uzanan bir “bilimsel keşif hikâyesi” olarak bir araya getirir.
1) Erken izler: “beyaz kan” fikrinin belirişi (19. yüzyılın ilk yarısı)
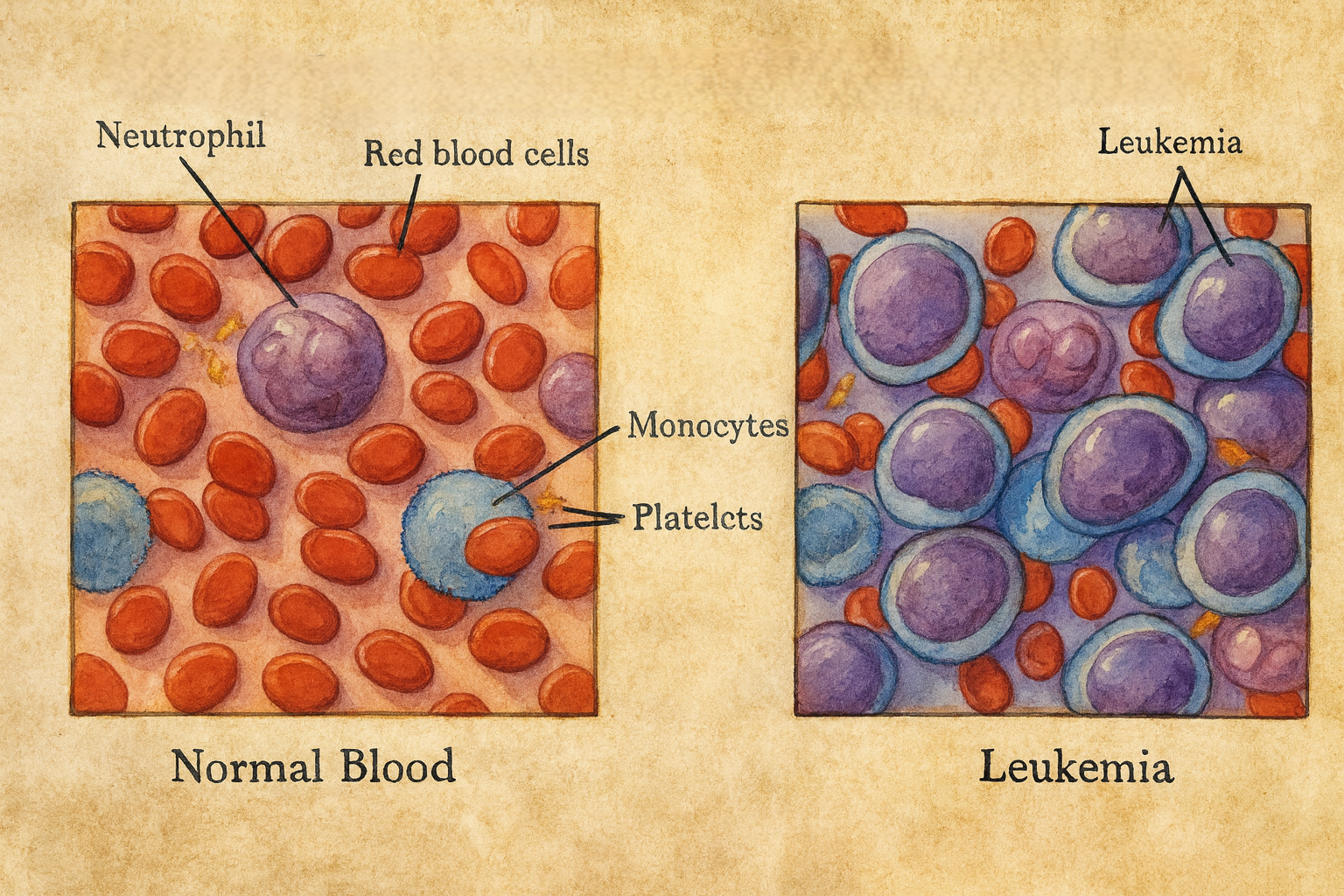
- yüzyıl tıbbında mikroskopun rutinleşmesiyle kan, artık yalnızca kırmızı bir sıvı değil; hücresel bir evren olarak görülmeye başladı. 1820’ler–1840’larda Alfred Velpeau ve Alfred Donné’nin gözlemleri, olağandışı beyaz küre birikimlerine işaret ediyordu. 1845’te Edinburgh’da John Hughes Bennett, dalak ve karaciğer büyümesi eşliğinde kanda “irin benzeri” lökosit bolluğu bulunan bir olguyu yayımlayarak hastalığı “leucocythemia/beyaz hücreli kan” terimleriyle betimledi; iki yıl sonra Berlin’de Rudolf Virchow, aynı varoluşu “Leukämie/leukemia” adıyla andı ve tarihe hastalığın isim babası olarak geçti. Bu erken yıllar, löseminin bir “kanın dönüşümü” olduğu düşüncesini doğurdu; ne var ki kaynağının nerede olduğu belirsizdi.
2) Kanın beşiği bulunuyor: kemik iliği ve hücre sınıflaması (1868–1900)
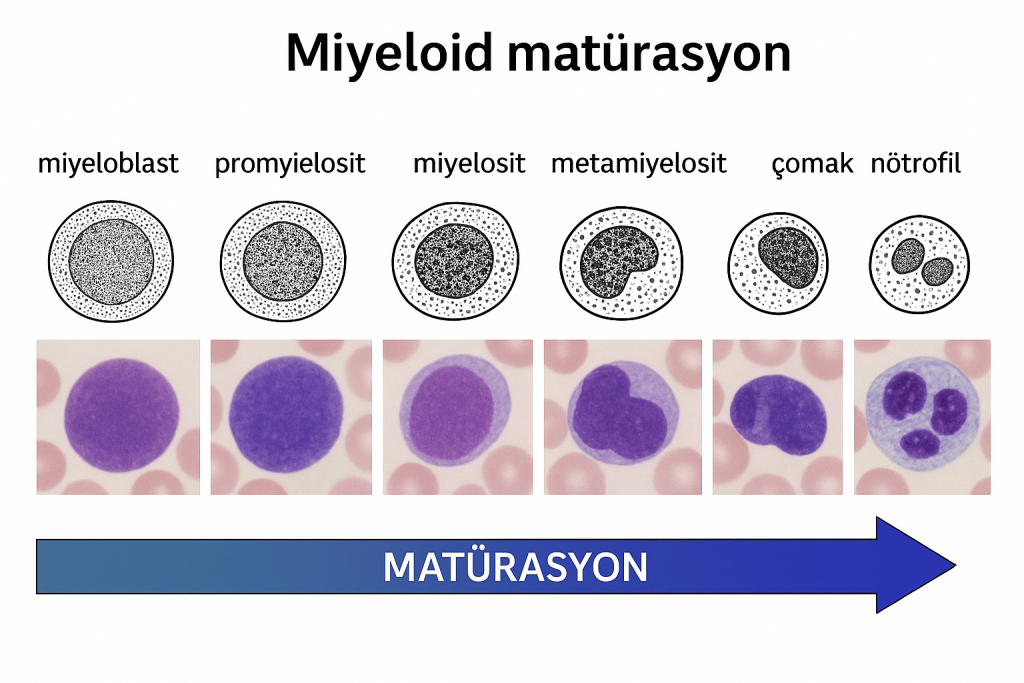
1868’de Königsbergli patolog Ernst Neumann, postembriyonik yaşamda kan yapımının başlıca yerinin kemik iliği olduğunu göstererek hematopoezin “sahnesini” belirledi; ilerleyen yıllarda bu sahnenin başrolünde kök/öncül hücrelerin olduğu fikri güçlendi. Aynı yüzyılın son çeyreğinde Paul Ehrlich, anilin boyalarla geliştirdiği diferansiyel kan yayması ve granülosit/mast hücresi betimlemeleriyle lökosit alt tiplerini ayrıştırdı; bu, lösemilerin lenfoid ve miyeloid soylar olarak kavramsallaştırılmasının zeminini hazırladı.
3) Sitogenetik döneme giden yol ve “Philadelphia kromozomu” (1940’lar–1970’ler)
- yüzyılın ortası, lösemide iki büyük devrime sahne oldu: terapide folat antagonisti ile ilk remisyonlar ve kanserde tutarlı kromozom bozukluğunun keşfi. 1948’de Boston’da Sidney Farber, aminopterin ile çocukluk çağı akut lösemilerinde geçici de olsa dramatik remisyonlar bildirdi; modern kemoterapinin kapısı böyle aralandı.
1960’ta Philadelphia–Pennsylvania bağlantılı iki isim, Peter Nowell ve David Hungerford, KML’li hastalarda mikroskop altında “dakik (minute) bir kromozom” saptadı: Philadelphia kromozomu. Bu, insan kanserlerinde tutarlı bir kromozom anomalisinin ilk örneğiydi. 1973’te Chicago’dan Janet D. Rowley, yeni geliştirilmiş bantlama teknikleriyle bu yapının bir t(9;22) translokasyonu olduğunu gösterdi; ardından t(8;21) ve t(15;17) gibi başka imza translokasyonları da tanımladı. Sitogenetik bulguların, “kanser genetik bir hastalıktır” tezini kliniğe taşımasında Rowley’nin çalışmaları kurucu rol oynadı.
4) “Fikirden kür potansiyeline”: nakil, farklılaşma tedavisi ve hedefe yönelik devrim (1970’ler–2000’ler)
Farber’in açtığı yolda kombinasyon kemoterapileri gelişirken, E. Donnall Thomas’ın öncülüğünde allojenik kemik iliği/kök hücre nakli kavramı klinikte olgunlaştı; 1990’da bu çalışmalar Nobel ile onurlandırıldı. Leukemik klonu silip sağlıklı hematopoezle değiştirme fikri, yüksek riskli olgular için “kür potansiyeli” taşıyan bir paradigma sundu.
Bir diğer kırılma, akut promiyelositik lösemi (APL)’de gerçekleşti. 1980’lerden itibaren Şanghay ekolü (Zhen-Yi Wang, Zhu Chen ve çalışma arkadaşları), all-trans retinoik asit (ATRA) ile lösemik promiyelositleri farklılaştırarak hastalığı ölümcül DİK tablosundan “yüksek ölçüde kür edilebilir” bir duruma çevirdi; arsenik trioksit ile ATRA’nın akıllı kombinasyonları kemoterapisiz şemalara giden yolu açtı.
2001’de imatinib, BCR–ABL1 füzyon kinazını özgül olarak hedefleyerek KML’yi ölümcül bir hastalıktan yönetilebilir bir kronik duruma dönüştürdü; bu başarı, moleküler hedefli onkolojinin “kanıtı” oldu ve ikinci/üçüncü kuşak TKİ’lerle genişledi. Sonraki yıllarda asciminib, ABL’nin myristoyl cebine bağlanan ilk-in-sınıf STAMP inhibitörü olarak direnç paternlerini aşma stratejisini çeşitlendirdi.
5) Hücresel bağışıklığın sahneye çıkışı: CAR-T ve akıllı antikorlar (2010’lar–2020’ler)
2017’de FDA, çocuk ve genç erişkin B-ALL için ilk CAR-T ürününü (tisagenlecleucel) onayladı; bu karar, hastanın kendi T hücrelerinin yeniden programlanıp lösemik B hücrelerine yönlendirildiği bir çağın eşiğiydi. 2024’te CLL/SLL alanında da ilk CAR-T (lisocabtagene maraleucel/Breyanzi) hızlandırılmış onay aldı. Akıbetinde bispesifik T-hücre bağlayıcıları ve antikor-ilaç konjugatları, özellikle ALL ve KLL’de kemoterapi-dışı yaklaşımlara alan açtı.
6) Ölçebildiğin kadar kişiselleştir: MRD, paneller ve ELN çağının anatomisi (2010’lar–2020’ler)
Tedavi başarısı yalnız “tam remisyon”la değil, ölçülebilir artık hastalık (MRD) düzeyiyle de tanımlanır hâle geldi. Akım sitometrisi, PCR ve NGS tabanlı MRD testleri; ALL’de rutine girdi, AML’de prognostik ve tedavi uyarlama aracı olarak ağırlık kazandı. Paralelde, ELN 2022 gibi moleküler risk sınıflamaları (ör. NPM1, FLT3, TP53 vb.) endüksiyondan nakil kararına dek yol haritasını standartlaştırdı.
7) En güncel ufuk: menin ve ötesi (2024–2025)
2024’te FDA, KMT2A (MLL) translokasyonlu akut lösemilerde ilk menin inhibitörü revumenib’i onayladı; menin-KMT2A ekseninin farmakolojik baskılanması, özellikle pediatrik ve tedaviye dirençli alt gruplarda yeni bir hedefe-yönelik sayfa açtı. NPM1-mutant AML için de menin yolağını hedefleyen moleküller hızla ilerliyor. Aynı dönemde pirtobrutinib gibi kovalent olmayan (reversible) BTK inhibitörleri, KLL tedavi haritasını direnç mutasyonlarına rağmen genişletmeye başladı.
8) Haritanın “piksel çözünürlüğü”: tek hücreli ve bütünleşik çok-omik çağ
Bugün lösemiyi yalnız mutasyon listeleriyle değil, tek hücreli transkriptomik/epigenomik ve multi-omik atlaslarla, klonal evrim ve niche etkileşimini eşzamanlı okuyarak anlıyoruz. 2024–2025 arası çalışmalar, karma karyotipli AML’de tedaviye dirençli alt klonları ve hedeflenebilir fenotipleri tek hücre çözünürlüğünde ayırt etti; CML kök hücre altpopülasyonlarının TKİ’ye farklı yanıtlama kalıpları yine tek hücreli yaklaşımlarla çözümlendi. Bu veriler, MRD’nin yeniden tanımlanması, ilaç kombinasyonu tasarımı ve erken dönüş (early switch) kararlarını bilimsel zeminde keskinleştiriyor.
9) Hastalıktan önceki gölgeler: CHIP ve ön-lösemik durumlar
Genç bir kavram olan “belirsiz potansiyelli klonal hematopoez/CHIP”, görünürde sağlıklı bireylerde DNMT3A, TET2, ASXL1 gibi sürücü mutasyonları taşıyan kök hücre klonlarının yıllık yaklaşık %0,5–1 oranında hematolojik maligniteye evrilebildiğini gösterdi; aynı zamanda sistemik inflamasyon ve kardiyovasküler riskle de bağlantılı. Bu “ön sahne”, lösemi riskinin erken tanımlanması ve önleyici hematoloji için yeni sorular açıyor.
Bugünden yarına: nereye gidiyor?
Lösemi araştırmaları bugün üç geniş eksende derinleşiyor: (i) Kök-hücre biyolojisi ve klonal evrim (menin ekseni, menin-kombinasyonları ve NPM1-mutasyonlu AML hedefleri); (ii) Hücresel ve antikor-temelli immünoterapilerin erişkin AML ve KLL alt gruplarına, hatta kemoterapisiz protokollere doğru evrilmesi; (iii) Tek hücreli/bütünleşik multi-omik ile MRD ve riskin moleküler “yeniden kalibrasyonu”. Bu üç kulvarın kesiştiği yerde, tanı anından nükse, hatta ön-lösemik evrelerden tedavi-anahtarlama kararlarına kadar daha “ince ayarlı” bir kişiselleştirme ufku belirginleşiyor.


Yorum yazabilmek için oturum açmalısınız.