İçindekiler
Tanım ve Terminoloji
Adipositler (yağ hücreleri), enerji depolama, ısı üretimi ve endokrin sinyalizasyon işlevlerini bir arada yürüten yüksek derecede özelleşmiş mezenkimal kökenli hücrelerdir. Gündelik kullanımda “yağ hücresi” olarak da adlandırılırlar. Gelişimsel çizgide mezenkimal kök hücre → adipogenik öncü (preadiposit; klasik literatürde “steatoblast”) → olgun adiposit sıralaması ayırt edilir. “Steatoblast” terimi tarihsel olup güncel literatürde “preadiposit/adiposit öncüsü” karşılığı tercih edilir.
- Adiposit, enerji depolayan, ısı üreten ve endokrin sinyaller yayan bir hücre tipidir.
- Beyaz (depolama odaklı) ve kahverengi (termogenez odaklı) alt tipler yanında bej ara fenotip bulunur.
- İnsülin, β-adrenerjik ve natriüretik peptid sinyalleri, lipogenez-lipoliz dengesini dakika-saat ölçeğinde ayarlar.
- Yaşlanma, lipolitik kapasite ve mitokondriyal verimi azaltır; lipid alımı görece korunur.
- Depotip ve cinsiyet hormonları, dağılım ve risk profillerini belirgin biçimde etkiler.
- Uniloküler/multiloküler: Tek/çok damlacıklı lipid morfolojisi.
- UCP1: Termogenez için proton sızıntısı sağlayan mitokondriyal taşıyıcı.
- ATGL/HSL/MGL: Sırasıyla tri-, di- ve monogliserid lipazları.
- PPARγ / C/EBP: Adiposit farklılaşmasının transkripsiyonel ana düzenleyicileri.
- Bejleşme (browning): WAT içinde UCP1+ fenotipin indüksiyonu.
- SVF (stromal vasküler fraksiyon): Adiposit dışı hücrelerin ve öncülerin zengin olduğu fraksiyon.
Histoloji ve Ultrastrüktür
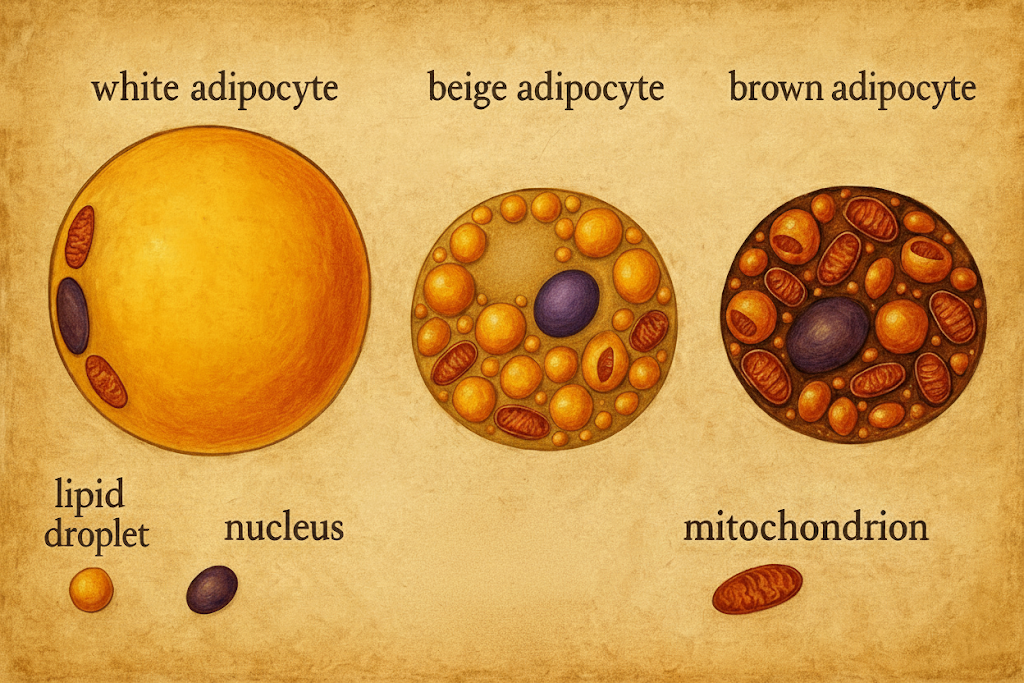
Olgun beyaz adipositler tipik olarak 50–150 µm çapında, ileri dolgunlukta ~200 µm’a erişebilen, tek çekirdekli ve uniloküler (tek büyük lipid damlacıklı) hücrelerdir. Sitoplazma, periferde ince bir halka biçiminde kalır; çekirdek yassılaşarak hücre kenarına itilir. Organeller, özellikle mitokondriler, periferik sitoplazmada seyrek ve küçüktür. Her adiposit, bazal lamina ile sarılıdır ve hücre dışı matrikste retiküler lifler (Tip III kollajen) ağı üzerine oturur. Plazma membranı boyunca çok sayıda kaveola bulunur; bunlar transmembran taşıma ve sinyal iletiminde işlevseldir.
Kahverengi adipositler ise multiloküler (çok damlacıklı) morfoloji, mitokondri zenginliği ve yüksek vaskülarite ile tanınır; çekirdek daha santral veya hafif eksantrik yerleşimli olabilir. Mitokondri iç zarlarında UCP1 (uncoupling protein 1) ifade edilir; bu protein oksidatif fosforilasyonu ayırarak ısı üretimini mümkün kılar. Kahverengi depolar, yoğun sempatik innervasyon ve kapiller ağ ile desteklenir.
Olgun adipositler sinsityal yapılar oluşturmaz, yani komşu adipositlerle fizyolojik koşullarda kaynaşmazlar; her biri ayrı bazal lamina ile çevrili, bağımsız hücrelerdir.
Doku Düzeyinde Organizasyon
Beyaz yağ dokusu (WAT), deri altı (subkütan) ve visseral (intraabdominal) depolarda toplanır. Kahverengi yağ dokusu (BAT), yenidoğanda belirgindir; yetişkinlerde servikal–supraklaviküler, paravertebral ve mediastinal bölgelerde değişken miktarda sürer. Bej/“brite” adipositler, WAT içinde uyaranlara (soğuk, β-adrenerjik uyarım vb.) yanıtla kahverengimsi fenotipe kayan indüklenebilir hücrelerdir.
Gelişim ve Adipogenez
Adipositler, mezenkimal kök hücreler ve damar düz kası/perisit soylarıyla ilişkili stromal vasküler fraksiyon (SVF) içindeki öncülerden türeyebilir. Adipogenezin temel moleküler ekseni:
- PPARγ: Master transkripsiyon faktörü; adiposit kader belirleyicisi.
- C/EBP ailesi (β, δ → α): Erken ve geç farklılaşma basamaklarını sıralı biçimde yürütür.
- PRDM16, PGC-1α: Kahverengi/bej yönelimin belirleyicileri; mitokondriyal biyogenez ve UCP1 programını destekler.
- INS/IGF-1 sinyali, BMP’ler, TGF-β ailesi: Kader belirleme ve büyüme üzerinde bağlama özgü düzenleyicilerdir.
Adipogenez, lipid damlacığı proteinleri (ör. perilipin), lipogenez enzimleri ve glukoz taşıyıcıları (GLUT4)’ın artışıyla sonlanır. Erişkin yaşamda depolar hipertrofi (hücre büyümesi) ve hiperplazi (yeni adiposit oluşumu) ile genişleyebilir; hiperplazi özellikle kronik enerji fazlasında ve belirli depotiplerinde belirgindir.
Sınıflandırma
1) Fonksiyonel ve Morfolojik Sınıflandırma
- Beyaz adiposit: Uniloküler, düşük mitokondri içeriği; temel işlev enerji depolama ve endokrin sinyalizasyon.
- Kahverengi adiposit: Multiloküler, yüksek mitokondri içeriği; temel işlev termogenez (UCP1 aracılı).
- Bej/brite adiposit: Uyarana bağlı, WAT içinde “kahverengileşebilir”; fenotipik plastisite gösterir.
2) Dağılım ve Cinsiyet Dimorfizmi
- Android (abdominal/visseral baskın) dağılım: Karaciğer drenajına yakınlığı nedeniyle insülin direnci, dislipidemi ve kardiyometabolik risk ile daha güçlü ilişkilidir.
- Jinoid (gluteofemoral/subkütan baskın) dağılım: Nispeten metabolik açıdan koruyucu kabul edilir; serbest yağ asidi (SYA) akışı daha yavaştır, adipokrin profil farklıdır.
Membran Reseptörleri ve Sinyal İletimi
Adiposit membranında zengin reseptör repertuvarı bulunur:
- İnsülin reseptörü: GLUT4 translokasyonu ve lipogenez aktivasyonu.
- β-adrenerjik reseptörler (β1/β2/β3): cAMP–PKA yolu üzerinden lipoliz ve kahverengi/bej program aktivasyonu.
- α2-adrenerjik reseptör: Antilipolitik etki.
- Natriüretik peptid reseptörleri (NPR-A): cGMP–PKG üzerinden lipoliz ve mitokondriyal biyogenez katkısı.
- Leptin, adiponektin, endotelin, anjiyotensin, glukokortikoid ve seks steroid reseptörleri: Depotipine ve fizyolojik bağlama göre düzenleyici etkiler.
Metabolik İşlevler
1) Lipit Alımı ve Depolama
Postprandiyal dönemde, kapiller endotel yüzeyine bağlı lipoprotein lipaz (LPL), şilomikron ve VLDL trigliseridlerini hidroliz ederek serbest yağ asitleri ve gliserol oluşturur. Serbest yağ asitleri taşıyıcılar (CD36/FAT, FABP’ler) ve pasif difüzyonla adiposite alınır; esterifikasyon ile trigliseride çevrilerek lipid damlacığında depolanır. İnsülin, asetil-KoA karboksilaz, yağ asidi sentaz ve gliserolipid sentez enzimlerini artırarak lipogenezi güçlendirir.
2) Lipoliz ve Yağ Asidi Salınımı
Açlık, egzersiz, soğuk ve stres gibi durumlarda β-adrenerjik aktivasyon ile ATGL (adipose triglyceride lipase) → HSL (hormone-sensitive lipase) → MGL sıralı hidrolizi tetiklenir; perilipin fosforilasyonu damlacık erişimini kolaylaştırır. Ortaya çıkan SYA’lar dolaşıma verilir; gliserol karaciğerde glukoneogeneze girer. İnsülin, lipolizi baskılar; glukagon ve adrenalin lipolizi uyarır (insanda glukagon etkisi daha dolaylıdır; karaciğer ağırlıklıdır).
3) Termogenez
Kahverengi ve indüklenmiş bej adipositlerde, UCP1 proton gradyanını kısa devre ederek ısı üretir; ATP verimi düşerken substrat oksidasyonu artar. Soğuğa maruziyet, sempatik aktivasyon, bazı natriüretik peptidler ve kas kökenli myokinler bu programı destekler.
Endokrin ve Parakrin İşlevler
Adipositler, yağ dokusunu endokrin organ konumuna yükselten geniş bir adipokin repertuvarı salgılar:
- Leptin: Hipotalamik iştah merkezlerine sinyal; enerji dengesinin uzun dönem geri bildirim düzenleyicisi.
- Adiponektin: İnsülin duyarlılığını, yağ asidi oksidasyonunu ve anti-inflamatuar yanıtları destekler; düzeyi genellikle yağlanma arttıkça azalır.
- Resistin, visfatin (NAMPT), omentin, apelin, chemerin ve diğerleri: Dokular arası metabolik iletişimde rol alırlar.
- Sitokin/kemokinler (TNF-α, IL-6, MCP-1 vb.): Özellikle visseral depolarda ve obezitede artan alçak dereceli inflamasyona katkı verirler.
- Anjiyotensinojen, PAI-1 gibi faktörler: Kardiyometabolik risk ile ilişkilidir.
Adipoz doku stroması, M1/M2 makrofajlar, T ve B lenfositler, mast hücreleri, endotelyal hücreler ve fibroblastlar ile zengin bir ekosistemdir; “crown-like structures” (nekrotik adiposit çevresinde makrofaj bilezikleri) obezitede sıktır.
Sinirsel ve Damar Denetimi
Adipoz doku, sempatik otonom sinir sistemi tarafından yoğun biçimde innerve edilir; bu innervasyon lipoliz ve termogenezin ani düzenlenmesini sağlar. Vaskülarite, özellikle BAT’ta yüksektir; oksijen ve substrat tedariki ısı üretimi için kritiktir.
Yaşlanma ve Plastisite
Yaşla birlikte:
- Lipolitik yanıt ve mitokondriyal işlev zayıflayabilir.
- Lipid alım kapasitesi görece korunurken hücresel lipid dönüşümü yavaşlar; bu durum kilo alma eğilimi ve yağ yeniden dağılımı (subkütandan visserale kayış) ile ilişkilendirilir.
- Ekstraselüler matriks sertleşmesi ve fibrozis eğilimi artabilir; hipertrofik adipositlerin mekanik ve metabolik stresi büyür.
Adipositler belirli koşullarda fenotipik plastisite sergiler: WAT içinde bejjleşme (browning) veya tersine beyazlaşma (whitening) programları, çevresel (soğuk/sıcak), davranışsal (egzersiz), hormonal ve farmakolojik uyaranlarla etkilenir.
Cinsiyet Hormonları ve Depotipik Farklılıklar
Östrojenler, gluteofemoral depolamayı ve daha “elverişli” adipokin profilini destekleyebilir; androjenler, androjenik dağılımı ve visseral artışı kolaylaştırabilir. Menopoz sonrası dönemde östrojen azalmasıyla visseral yağlanma belirginleşir. Bu farklılıklar android ve jinoid paternlerin biyolojik temelini oluşturur.
Klinik ve Biyomedikal Yansımalar
- Obezite ve metabolik sendrom: Visseral WAT genişlemesi, insülin direnci, hepatik steatoz ve aterojenik dislipidemi ile ilişkilidir.
- Lipodistrofiler: Konjenital veya edinilmiş yağ dokusu yetersizlikleri; ağır insülin direnci ve ektopik yağ birikimi ile seyreder.
- Adipoz doku inflamasyonu: Kronik düşük dereceli inflamasyon kardiyometabolik riski artırır.
- Tümörler: Lipom (benign), hibernom (BAT kökenli nadir benign), liposarkom (malign).
- Görüntüleme: MRI/CT ile depotipleme ve hacim ölçümü; 18F-FDG PET/BT ile aktif BAT haritalaması.
- Farmakolojik hedefler: PPARγ agonistleri (adipogenez ve insülin duyarlılığı), β3-agonistler (termogenez/lipoliz; insan etkinliği sınırlı ve bireysel değişken), GLP-1R agonistleri/ikili inkretinler (vücut ağırlığı üzerinden ikincil etkiler), FGF21 ekseni ve natriüretik peptid yolları araştırma odağındadır. Yaşam tarzı: Soğuğa maruz kalma ve dayanıklılık egzersizi, bejleşme ve mitokondriyal programları uyarabilir.
Keşif
Yağın anatomi kitaplarındaki “sarı dokudan” ibaret bir dolgu malzemesi olarak görüldüğü çağları hayal edin. İnsan bedeni, organların bir araya geldiği bir makine; yağ ise aralara sıkışmış, işlevi tartışmalı bir madde… Adipositin—yağ depolayan ve/veya ısı üreten bu hücrenin—bilim tarihindeki yolculuğu, hem biyolojinin nasıl ince ayrıntılara indiğini hem de “atıl doku” sanılan bir yapının bütün metabolizmayı nasıl yönettiğini anlamamızın adım adım nasıl gerçekleştiğini gösterir.
Rönesans’ın notları: “Yağ”ın sahneye çıkışı
Erken anatomi metinlerinde yağ, forma ve estetiğe dair bir unsur olarak anılır; canlı bir parça olduğu sezilir ama mekanizması bilinmez. Hibernatör hayvanlarda günümüzün “kahverengi yağ”ına karşılık gelen koyu renkli, damar ve mitokondriden zengin dokuların varlığı 16. yüzyıl doğa tarihçilerinin betimlerinde yer yer belirir. O dönem için bu gözlemler, “yağ”ın yekpare bir madde olmadığını sezdirmekten öteye geçmez; yine de ilerideki ayrımın (beyaz vs. kahverengi) tohumlarıdır.
Mikroskobun gelişi: “Damla dolu hücre” fikri
17. yüzyılın mikroskop devrimiyle dokuların hücresel mimarisi görünür oldukça, yağ dokusunun içinin boş değil, büyük bir damla (tek ya da çok damlacık) nötr lipid taşıyan hücrelerden oluştuğu anlaşılır. Bu hücrelerin çekirdeğinin ve organellerinin damlanın baskısıyla periferde incelip itilmesi, adiposite özgü siluetiyle histolojiye kazınır. 18.–19. yüzyıla gelindiğinde Bichat gibi anatomistler “doku sınıflandırması” kavramını oturtur; yağ dokusu, bağ dokusunun bir alt türü olarak konumlanır. Ardından hücresel patolojinin yükselişiyle (19. yüzyıl ortaları) yağ hücrelerinin pasif bir depo değil, canlı, uyaran alan ve yanıt veren birimler olduğu fikri güçlenir.
Kimyasal çağ: Lipoproteinler, enzimler ve akışkan metabolizma
20. yüzyıl ortası yağ biliminin kimyasal çağını açar. Besinle gelen trigliseritlerin kanda nasıl taşındığı, damar yatağında nasıl hidroliz edildiği ve yağ hücresine nasıl girdiği çözümlenir. Heparinin damara verilişiyle “süt gibi bulanık” lipemik plazmanın hızla berraklaşması, damarda gizli bir “temizleyici etken” olduğuna işaret eder; bu etken kısa sürede bir lipaz enzimi olarak tanımlanır ve bugün lipoprotein lipaz (LPL) dediğimiz, şilomikron/VLDL trigliseritlerini parçalayıp yağ asitlerini adiposite sunan kapı bekçisi olduğu anlaşılır. Bu keşif, adipositin besinden kana, kandan hücreye uzanan yağ akışındaki düğüm noktalarını ilk kez mekanistik düzeyde tarif eder.
Aynı yıllarda hormon biyokimyası hızla gelişir: Katekolaminlerin lipolizi başlatabildiği, glukagonun yağ yıkımını desteklediği, insülinin ise esterifikasyon ve trigliserit sentezini artırarak depo yönünü kuvvetlendirdiği gösterilir. Böylece adiposit, “çevresel yakıt istasyonu” olmaktan çıkıp endokrin ve sinirsel sinyallerle ayarlı, çift yönlü bir metabolik vana olarak resmedilir.
Kahverenginin doğuşu: Termojenez organı olarak yağ
20. yüzyılın ortalarında memelilerin bir bölümünde (özellikle yavru ve kış uykusuna yatan türlerde) “kahverengi yağ” denen farklı bir yağ dokusunun bulunduğu giderek netleşir. Mikroyapıdaki çok sayıda küçük yağ damlacığı ve olağanüstü mitokondri yoğunluğu, bu dokunun depo değil “yakıcı” olduğuna işaret eder. 1960’lardan itibaren kahverengi yağın ana işlevinin, mitokondriyal solunum zincirini eşleştirmeden (uncoupling) ısı üretmek olduğu ikna edici şekilde gösterilir. 1970’lerin sonunda bu sürecin imzası niteliğindeki UCP1 (uncoupling protein 1) kimlik kazanır: proton gradyanını ATP yerine ısıya çeviren biyolojik bir “rezistans teli”. Bu bulgu, yağın yalnızca depolayan değil, gerektiğinde yakan ve ısıtan bir organ olduğuna dair kavrayışımızı kalıcı biçimde değiştirir.
Hücre kültürü devrimi: 3T3-L1 ve adipogenez programı
1970’lerin ortasında bir başka sıçrama yaşanır: 3T3-L1 gibi preadiposit hücre dizileri laboratuvarda olgun adiposite farklılaştırılabilir hale gelir. Bu, yağ hücresinin “kimliğe geçiş” programını, yani adipogenezi aşama aşama çözmenin kapısını açar. Kısa süre içinde C/EBP ve PPAR ailesi gibi transkripsiyon faktörleri kaskadının adipogenezde “kimlik kartını” yazdığı ortaya konur. Özellikle PPARγ, 1990’ların ortasında “adiposit kaderinin ustabaşısı” olarak öne çıkar: onu etkinleştirmeniz, fibroblast benzeri bir hücreyi bile yağ hücresine çevirmeniz için çoğu zaman yeterlidir.
Yağın endokrin keşfi: Leptin ve adipokinler
1994, adiposit tarihinin kırılma yıllarından biridir. ob geninin ürünü olan leptinin keşfi, yağ dokusunun beyne enerji durumu hakkında sinyal gönderen bir endokrin organ olduğunu dünyaya ilan eder. Arkadan adiponektin (yaklaşık 1995–1996), rezistin (2001) ve pek çok başka adipokin tanımlanır. Saha birkaç yıl içinde dönüşür: Yağ dokusu, yalnızca “kalori deposu” değil, inflamasyon, insülin duyarlılığı, damar tonusu ve iştah gibi aksların aktif bir düzenleyicisidir.
Bağışıklık ve yağ: Kronik inflamasyonun görünür olması
2003’te yağ dokusunda makrofajların—özellikle obeziteyle artan—birikimi gösterilir. Mikroskop düzeyinde, ölen/ölmekte olan adipositleri çelenk gibi saran “crown-like structures (CLS)” görüntüleri, metabolik hastalıkların alttan alta süren doku inflamasyonuna dayanan yüzünü somutlaştırır. “İmmünometabolizma” denen alan, yağ dokusunun bağışıklık hücreleriyle kurduğu simbiyotik (kimi zaman patolojik) dili çözmeye koyulur.
Kahverenginin dönüşü: Erişkinde BAT ve “bej” hücreler
2009’da bir sürpriz: Pozitron emisyon tomografisi (PET/BT) ve doku örneklemeleri, erişkin insanlarda da anatomik olarak anlamlı miktarda aktif kahverengi yağ depoları bulunduğunu ikna edici şekilde gösterir. Metabolizma alanı adeta yeniden kalibre olur; soğuğa uyum protokolleri, kahverengi yağ aktivitesini ve total enerji harcamasını artırabildiğini ortaya koyar. 2010’ların başında “bej/brite adiposit” kavramı belirir: Bazı beyaz yağ depoları, uygun uyaranlarla (soğuk, adrenerjik sinyal, bazı hormonlar) termojenik fenotipe “bürünebilir”. Bu dönüşümde PRDM16, PGC-1α gibi transkripsiyonel düzenleyiciler kilit roller üstlenir.
Aynı dönemde insan adipositinde hangi adrenerjik alt tipin baskın olduğu tartışması derinleşir: Kemirgenlerde β3-AR simgesel iken, insan kahverengi/beyaz adipositlerinde β2-AR katkısının güçlü olduğuna dair kanıtlar birikir. Klinik sahada mesane için onaylı β3-agonist mirabegronun erişkinde kahverengi yağı aktive edebildiği gösterilir; doz–yan etki–metabolik fayda dengesi ise hâlâ dikkatle tartışılan bir alandır.
Yeni sinyaller: Natriüretik peptitler ve ötesi
2000’li yılların başında kalpten salınan atriyal/brain natriüretik peptitlerin insan adipositinde cGMP aracılı güçlü lipolitik sinyaller olduğu keşfedilir. Böylece adipoz doku–kalp–damar ekseninde çift yönlü bir haberleşme ağı daha ortaya çıkar. Paralelde FGF21 gibi hepatokinlerin yağ dokusunda termojenik gen programını güçlendirebildiği, egzersizle ilişkili irisin gibi myokinlerin “bejleşme” üzerindeki etkilerinin ise tür ve ölçüm yöntemi farklarına çok duyarlı olduğu—dolayısıyla tartışmalı—bir literatürle şekillenir.
Haritalar ve atlaslar: Tek hücre ve mekânsal omik çağ
2020’lerde yağ dokusunu tek tek hücrelerin gözünden görmeye başlıyoruz. Tek hücre/nükleus RNA-dizileme çalışmaları, insan ve fare beyaz yağ dokusunun ayrıntılı atlaslarını sunuyor; preadiposit alt popülasyonları, damar ve sinir nişleri, “lipid-ilişkili makrofajlar” gibi bağışıklık kümeleri işlevsel imzalarıyla tanımlanıyor. Mekânsal transkriptomik teknikleri aynı veriyi doku mimarisiyle üst üste koyarak CLS bölgeleri, sinir-vasküler demetlerin çevresi, fibrotik adacıklar gibi mikro-nişleri yüksek çözünürlükte resmediyor. Alandaki büyük konsorsiyumlar (ör. Human Cell Atlas içinde adipoz biyonetwork) hücre tiplerini ve adlandırmayı standardize etmeye çalışıyor. Bu sayede “metabolik olarak sağlıklı obezite” ile “sağlıksız” fenotip arasındaki farklılıklar, yalnızca toplam yağ miktarıyla değil, hücresel bileşim ve iletişim ağlarıyla açıklanabilir hale geliyor.
Klinik eşiği: Soğuk, agonistler ve kombinasyon stratejileri
Bugün araştırmalar üç ana kulvarda ilerliyor:
- Çevresel/yaşam tarzı manipülasyonları: Kontrollü soğuğa alıştırma protokolleriyle BAT aktivitesi ve insülin duyarlılığında ölçülebilir iyileşmeler; etkinliğin sürekliliği ve bireysel yanıt farklılığı araştırılıyor.
- Farmakoloji: β3-agonistler (mirabegron), PDE inhibitörleri, natriüretik peptit yolları, tiroid hormonu analogları ve FGF21 ailesi gibi ajanlar üzerinde doz-etki-güvenlik optimizasyonu sürüyor; insan adipositinde β2/β3 ağırlığının hedef seçimini nasıl etkileyeceği hâlâ kritik bir soru.
- Hücresel yeniden programlama: PRDM16, PGC-1α, UCP1 ekseni ve nöro-immün sinyaller üzerinden “bejleşme”yi kalıcılaştırma çabaları; tek hücre ve mekânsal omik veriler, doğru hedefi doğru mikro-nişte vurmayı mümkün kılacak bir harita işlevi görüyor.
Kısacası: Adipositin hikâyesi, “dolgu” sanılan bir dokudan başlayıp, endokrin, immün ve sinir ağlarının kavşağındaki, gerektiğinde depolayan gerektiğinde yakan, organizmanın enerji ekonomisini ayarlayan bir hücreye evrilen bir bilim serüvenidir. Bugün, yağ hücresini yalnızca “kaç kalori tuttuğu” ile değil, hangi alt tipe ait olduğu, hangi nişlerde yer aldığı, hangi sinyallere nasıl cevap verdiği ve komşularıyla nasıl konuştuğu ile tanımlıyoruz. Bu dönüşüm, obezite, diyabet ve metabolik hastalıkların tedavisinde daha rafine, kişi-özel ve doku-mimarisi hassas stratejilerin önünü açıyor.
İleri Okuma
- Virchow R. Cellular Pathology. 1858.
- Hahn PF. Abolishment of alimentary lipemia following injection of heparin. Science. 1943;98:19–20.
- Korn ED. Clearing factor, a heparin-activated lipoprotein lipase. J Biol Chem. 1955;215:1–14.
- Green H, Kehinde O. An established preadipose cell line and its differentiation in culture. Cell. 1975;5:19–27.
- Nicholls DG, Lindberg O. Brown-adipose-tissue mitochondria: thermogenic respiratory control. 1970’ler sonu literatürü.
- Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994;372:425–432.
- Tontonoz P, Hu E, Spiegelman BM. Stimulation of adipogenesis in fibroblasts by PPARγ2. Cell. 1994;79:1147–1156.
- Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q produced by adipocytes. J Biol Chem. 1995;270:26746–26749. (Adiponektin)
- Puigserver P, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis (PGC-1α). Cell. 1998;92:829–839.
- Sengenès C, et al. Natriuretic peptides: a new lipolytic pathway in human adipocytes. FASEB J. 2000;14:1345–1351.
- Steppan CM, Bailey ST, et al. The hormone resistin links obesity to diabetes. Nature. 2001;409:307–312.
- Weisberg SP, McCann D, et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest. 2003;112:1796–1808.
- Seale P, Kajimura S, et al. Transcriptional control of brown fat determination by PRDM16. Cell Metab. 2007;6:38–54.
- van Marken Lichtenbelt WD, et al. Cold-activated brown adipose tissue in healthy men. N Engl J Med. 2009;360:1500–1508.
- Cypess AM, et al. Identification and importance of brown adipose tissue in adult humans. N Engl J Med. 2009;360:1509–1517.
- Virtanen KA, et al. Functional brown adipose tissue in healthy adults. N Engl J Med. 2009;360:1518–1525.
- Wu J, et al. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell. 2012;150:366–376.
- Cypess AM, et al. Activation of human brown adipose tissue by a β3-adrenergic receptor agonist (mirabegron). Cell Metab. 2015;21:33–38.
- Blondin DP, et al. Human brown adipocyte thermogenesis is driven by β2-adrenergic signaling. Cell Metab. 2020;32:287–300.e7.
- Emont MP, et al. A single-cell atlas of human and mouse white adipose tissue. Nat / veri kaynağı: 2022–2023 tek hücre atlasları.
- Massier L, et al. An integrated single cell and spatial transcriptomic map of human white adipose tissue. Cell Reports. 2023.
- Trayhurn P. Brown adipose tissue: a short historical perspective. Front Physiol. 2022.
- Human Cell Atlas Adipose Bionetwork. Towards a consensus atlas… 2025 ön raporları.

Yorum yazabilmek için oturum açmalısınız.