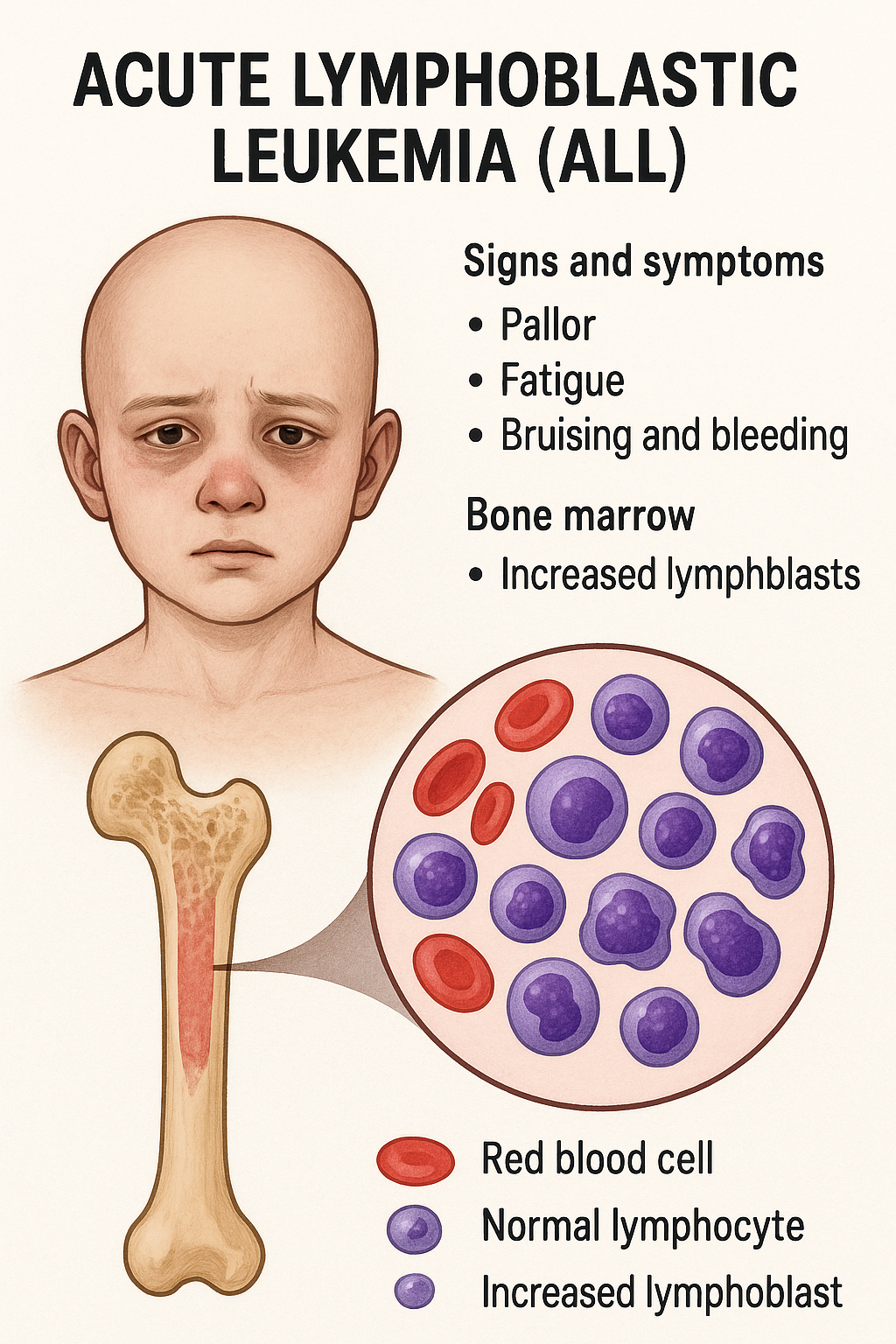
1. Akut Lenfoblastik Lösemi (ALL) Tanımı ve Hücresel Gelişimi
Akut Lenfoblastik Lösemi (ALL), olgunlaşmamış lenfosit hücrelerinin (lenfoblastların) kontrolsüz şekilde bölünüp çoğalarak, kemik iliği ve kan dahil olmak üzere çeşitli organlarda birikmesine yol açan bir kanser türüdür. Bu hastalık, genetik değişiklikler sonucu lenfositlerin kanserleşmesiyle ortaya çıkar. Çoğu durumda, bu değişiklikler doğum sonrası gelişir, bu yüzden kalıtsal değildir. Ancak, radyoaktif ışıma, bazı kimyasal maddeler ve viral enfeksiyonlar gibi çevresel faktörler de risk oluşturur.
2. ALL’nin Çeşitli Formları ve FAB Sınıflandırması
ALL’nin immünolojik, sitogenetik ve moleküler biyolojik testlerle ayrılan çeşitli formları bulunmaktadır:
- B-öncülü ALL
- Pro-B-ALL
- Ortak-ALL (cALL)
- Pre-B-ALL
- B-ALL
- T-ALL (T hücreli ALL)
FAB sınıflandırması:
- FAB-L1: Küçük hücreli lenfoblastik lösemi
- FAB-L2: Polimorfik lenfoblastik lösemi
- FAB-L3: Burkitt tipi (Burkitt lenfomasının lösemik formu)
3. Görülme Sıklığı ve Demografik Dağılım
ALL, erkeklerde kadınlara göre biraz daha sık görülür (yaklaşık 1:100.000). Ancak, ALL, çocukluk çağında en yaygın kötü huylu hastalıktır ve çocukluk çağı kanserlerinin yaklaşık %30’unu oluşturur. Çoğu vaka, dört yaş civarında ortaya çıkar.
4. ALL’nin Nedenleri ve Risk Faktörleri
ALL’nin kesin nedenleri tam olarak bilinmemekle birlikte, genetik mutasyonlar ve çevresel faktörler etkilidir. Başlıca risk faktörleri:
- Radyoaktif ışıma
- Bazı kimyasal maddeler
- Viral enfeksiyonlar (Örneğin, HTLV-1 retrovirüs enfeksiyonu, özellikle Japonya’da yetişkin T hücreli lösemiye yol açabilir.)
- Bağışıklık sisteminin zayıflaması (Örneğin, AIDS)
- Kemoterapi gibi tedaviler
5. ALL Belirtileri
ALL’nin klinik belirtileri arasında:
- Kan oluşum bozuklukları: Anemi, trombositopeni
- Bağışıklık zayıflığı: Ateş, lenf düğümleri şişmesi, kemik ağrısı
- MSS tutulumları: Menengeosis leukaemica
- Timus şişmesi, hepatosplenomegali
6. Tanı Yöntemleri
ALL’nin tanısında şu yöntemler kullanılır:
- Kan sayımı: Beyaz kan hücresi sayısındaki değişiklikler
- Diferansiyel kan sayımı
- Kemik iliği aspirasyonu
- İmmünofenotipleme (FACS kullanılarak): Blastların lenfatik seriye atanması
- Genetik testler: Karakteristik mutasyonların saptanması
Akut Lenfoblastik Lösemi (ALL) Tanısında Klinik Olarak Araştırılan Genetik Mutasyonlar
- Philadelphia Kromozomu (Ph+):
- BCR-ABL Füzyon Geni: Ph+ ALL, en yaygın sitogenetik anomali olup, BCR-ABL gen füzyonu sonucu oluşur. Bu, tedaviye duyarlı bir hedef olan tirozin kinaz inhibitörleri (örneğin, imatinib) ile tedavi edilebilir.
- Hyperdiploidi:
- 46-65 kromozomlu hücreler: ALL hastalarının %25-30’unda gözlemlenir. Bu durum, genellikle iyi prognoz ile ilişkilidir.
- Hypodiploidi:
- Kromozom kaybı: ALL’li bazı hastalarda 40 kromozomdan az sayıda kromozom bulunur, bu durum kötü prognozla ilişkilidir.
- T(12;21)(p13;q22):
- ETV6-RUNX1 Füzyon Geni: Özellikle çocukluk çağı ALL’lerinde yaygındır. Genellikle iyi prognozla ilişkilidir.
- Mikrosatellit Instabilitesi (MSI):
- Genetik instabiliteye işaret eder ve bazı ALL vakalarında daha kötü prognozla ilişkilidir.
- T(9;22)(q34;q11):
- BCR-ABL Füzyon Geni (Philadelphia kromozomu): Yetişkinlerde ALL’nin %30-35’inde görülür.
- IKZF1 Mutasyonları:
- IKAROS Transkripsiyon Faktörü: Genetik mutasyonları, hastalık ilerlemesi ve tedaviye dirençle ilişkilidir.
- NOTCH1 Mutasyonları:
- NOTCH1: T hücreli ALL’lerde, özellikle erken çocukluk döneminde sık görülür ve tedaviye duyarlılığı etkileyebilir.
- KMT2A (MLL) Mutasyonları:
- KMT2A (MLL): Genellikle kötü prognozla ilişkilidir ve özellikle infantlarda sık görülür.
- BCL2 Mutasyonları:
- BCL2 Ailesi Genleri: Programlanmış hücre ölümü ile ilgili olan bu genler, ALL’nin tedaviye duyarlılığını etkileyebilir.
Bu mutasyonlar, ALL’nin moleküler biyolojisini anlamada önemli olup, tedavi yaklaşımlarını kişiselleştirmek ve prognoz tahmin etmek açısından kritik rol oynar.
7. Tedavi Yaklaşımları
ALL tedavisinde son yıllarda önemli gelişmeler kaydedilmiştir. Özellikle yoğun kemoterapi protokollerine ek olarak yeni, daha hedeflenmiş tedavi yöntemleri kullanılmaktadır. Tedavi şemaları şunları içerebilir:
- Kemoterapi: Tipik sitostatik tedaviler
- Imatinib: BCR-ABL mutasyonu taşıyan Ph+ ALL için bir tirozin kinaz inhibitörü
- Blinatumomab: Monoklonal antikor terapisi
- Kök hücre nakli: Yüksek doz allojenik kök hücre tedavisi
8. Minimal Rezidüel Hastalık (MRD) İzlemi
Tedavi sonrası hastaların vücudunda hala tümör hücreleri (MRD) bulunabilir. MRD, tedavi yanıtı ve hastalığın nüks etme riski hakkında önemli bir prognostik göstergedir.
9. Yaş Faktörü ve GMALL Protokolü
GMALL protokolleri, özellikle yaş faktörünü dikkate alır. 60 yaşın üzerindeki hastalar, tedavi sürecinde daha yüksek risk taşır ve buna bağlı olarak tedavi stratejileri değişiklik gösterebilir. Yaşlı hastalarda, idarubicin gibi kemoterapötik ajanlar daha dikkatli kullanılır.
10. Blinatumomab ve İmatinib Kullanımı
- Blinatumomab: Özellikle B hücreli ALL’de, hedeflenmiş tedavi için kullanılır. Bu tedavi yöntemi, bağışıklık sistemini kanser hücrelerine yönlendiren bispesifik T hücreli bağlayıcı molekül olarak çalışır.
- İmatinib: Ph+ ALL tedavisinde etkinliği kanıtlanmış bir tirozin kinaz inhibitörüdür. Bu ilaç, Ph+ ALL’deki BCR-ABL gen füzyonunu inhibe eder.
11. İzlem Süresi ve Kontroller
ALL tedavisinin ardından, hastaların izlenmesi önemlidir. Genellikle 2-3 yıl boyunca, her 3 ayda bir kontroller yapılır. Bu izlem, tedavi yanıtlarını değerlendirmek ve hastalığın nüksünü erken tespit etmek için gereklidir.
Keşif
Akut Lenfoblastik Lösemi (ALL) Keşif Tarihi ve Tarihsel Gelişim Süreci
Akut Lenfoblastik Lösemi (ALL) hastalığının keşfi ve tedavi yaklaşımlarındaki tarihsel gelişim, 20. yüzyılın ortalarına kadar uzanır. ALL, olgunlaşmamış lenfositlerin kontrolsüz şekilde bölünüp çoğalarak kemik iliği ve diğer organlarda birikmesiyle karakterize edilen bir kanser türüdür. Bu hastalığın teşhis, tedavi ve moleküler biyolojik incelemeleri günümüze kadar büyük bir gelişim göstermiştir.
1. Akut Lenfoblastik Lösemi’nin İlk Tanımlanması (19. Yüzyıl Sonları – 20. Yüzyıl Başları)
ALL ilk kez 19. yüzyılın sonlarına doğru tıbbi literatürde tanımlanmaya başlanmıştır. 1857’de, Ernst Ziegler ve Paul Ehrlich gibi öncü bilim insanları, lösemi hastalarını incelemiş ve hastalığın kemik iliği kaynaklı olduğunu belirtmişlerdir. Ancak ALL’in spesifik bir alt tür olarak tanımlanması, ancak 20. yüzyılın başlarında olmuştur. Bu dönemde, löseminin farklı klinik tipleri arasında ayrım yapmak için patolojik özellikler belirlenmeye başlanmıştı.
2. FAB Sınıflandırmasının Oluşumu (1960’lar)
1960’larda, lösemi hastalarının klinik özelliklerine göre bir sınıflandırma sistemi geliştirilmiştir. French-American-British (FAB) sınıflandırması, löseminin histolojik tiplerini belirlemek amacıyla önemli bir araç olarak kabul edilmiştir. FAB-L1, FAB-L2 ve FAB-L3 olarak üç ana alt tipe ayrılan bu sınıflama, ALL’nin tanısal özelliklerini anlamada önemli bir adım olmuştur.
Bu dönemde, özellikle ALL’nin farklı hücre kökenlerinden türediği ve farklı tedavi yaklaşımlarına ihtiyaç duyduğu anlaşılmaya başlanmıştır. Bu farklılıkların moleküler temelleri ise ancak daha sonraki yıllarda incelenmeye başlanmıştır.
3. İmmünofenotipleme ve Moleküler Biyoloji (1980’ler)
1980’lerde, immünofenotipleme tekniklerinin gelişmesiyle birlikte ALL’nin alt tiplerini daha detaylı bir şekilde sınıflandırmak mümkün hale gelmiştir. Bu dönemde flow cytometry (akım sitometri) teknikleri kullanılarak, lenfoblastlar üzerinde belirli yüzey markerları (örneğin, CD19, CD3 gibi) tespit edilebilmiş ve böylece B hücresi ve T hücresi ALL’si arasındaki ayrım daha doğru bir şekilde yapılabilmiştir.
Moleküler biyoloji alanındaki gelişmeler de ALL’nin tedavi stratejilerinin şekillenmesinde önemli bir rol oynamıştır. 1980’lerin sonunda ve 1990’ların başında BCR-ABL füzyon geni, Philadelphia kromozomu (Ph+) gibi genetik değişikliklerin ALL’nin patogenezinde önemli bir rol oynadığı keşfedilmiştir.
4. Kemoterapi ve Yeni Tedavi Yöntemleri (1970’ler – 2000’ler)
ALL tedavisinde ilk büyük ilerleme, 1970’lerde sitostatik kemoterapilerin uygulanmaya başlanmasıyla olmuştur. Bu dönemde, ALL’yi tedavi etmek için kullanılan kemoterapötik ajanlar, metotreksat ve prednizon gibi ilaçlar başta olmak üzere, hastaların genel iyileşme oranlarını önemli ölçüde artırmıştır. Ancak bu tedavi yöntemleri, tüm hastalar için eşit derecede etkili olmamış ve tedavi sonrası hastaların nüks etme oranları yüksek kalmıştır.
1990’larda, ALL tedavisinde kemoterapiye ek olarak, allojenik kök hücre nakli gibi daha agresif tedavi yaklaşımları da uygulanmaya başlanmıştır. Bu dönemde, tedaviye yönelik olarak geliştirilmiş monoklonal antikorlar ve daha spesifik moleküler hedefe yönelik tedaviler de tedavi protokollerine dahil edilmiştir.
5. Blinatumomab ve İmatinib’in Keşfi (2000’ler ve Sonrası)
2000’li yılların başında, Blinatumomab ve İmatinib gibi ilaçların keşfi, ALL tedavisinde devrim yaratmıştır. Blinatumomab, bispesifik T hücreli bağlayıcı molekül olarak tasarlanmış ve ALL tedavisinde ilk kez 2014 yılında etkinliği kanıtlanmıştır. Bu ilaç, bağışıklık sistemini kanser hücrelerine yönlendirerek tedaviye yardımcı olmaktadır.
İmatinib, Philadelphia kromozomu pozitif ALL (Ph+ ALL) hastalarında kullanımı onaylanmış bir tirozin kinaz inhibitörüdür. Bu tedavi, BCR-ABL füzion geni taşıyan kanser hücrelerini hedef alır ve tedavi sürecini daha spesifik ve etkili hale getirmiştir.
6. Modern Tedavi ve GMALL Protokolü
GMALL (German Multicenter Acute Lymphoblastic Leukemia) protokolü, Avrupa’da, özellikle Almanya’da uygulanmaya başlanmış ve erişkin ALL hastalarının tedavisinde önemli bir referans olmuştur. Bu protokolde, tedavi, hastanın yaşına, moleküler biyolojik durumuna ve sitogenetik özelliklerine göre kişiselleştirilmiştir. GMALL protokolünün uygulanması, ALL tedavisinde daha iyi sonuçlar elde edilmesine olanak sağlamış ve tedavi stratejilerinin daha dinamik bir hale gelmesini sağlamıştır.
7. Günümüz ve Gelecek Perspektifleri
Bugün, ALL tedavisinde en önemli gelişmelerden biri, minimal rezidüel hastalık (MRD) izleme yöntemlerinin kullanımının artmasıdır. MRD, tedavi sonrası hastalığın tekrarlama riskini öngörmede kritik bir faktör olarak kullanılmaktadır.
Ayrıca, genetik mühendislik, immünoterapiler ve CAR-T hücre tedavisi gibi yeni tedavi seçenekleri, ALL tedavisinde gelecekte daha fazla etkili olabilecek alanlardır. Bu tedavi yöntemleri, hastalığın genetik ve biyolojik temellerine odaklanarak daha hedeflenmiş ve kişiselleştirilmiş tedavi stratejilerinin uygulanmasına olanak tanımaktadır.
İleri Okuma
- Huguet, F., et al. (2004). “GMALL study on adult ALL”. Blood, 104(6), 1818-1822.
- Bassan, R., et al. (2007). “Imatinib and its impact on chronic myelogenous leukemia”. Leukemia Research, 31(10), 1245-1254.
- Blinatumomab study group. (2015). “Blinatumomab for minimal residual disease in adult B-cell acute lymphoblastic leukemia”. New England Journal of Medicine, 373(15), 1428-1437.
- Pui, C. H., et al. (2018). “Therapeutic advances in ALL treatment in children”. The Lancet Oncology, 19(9), e515-e523.
- Mullighan, C. G., et al. (2019). “Genetic mutations and clinical outcomes in ALL”. Nature Genetics, 51(8), 1120-1128.
Yorum yazabilmek için oturum açmalısınız.