Anti-NMDA reseptör ensefaliti, sinaptik düzeyde işlev gören bir glutamat reseptörü olan N-metil-D-aspartat (NMDA) reseptörüne karşı gelişen, antikor aracılı, potansiyel olarak ağır fakat çoğu kez tedavi edilebilir bir otoimmün ensefalittir. Klinik olarak psikiyatrik sendrom, epileptik nöbetler, motor ve otonom bozukluklar ile değişen bilinç düzeyi birlikteliğiyle karakterizedir ve özellikle genç kadınlarda görülür.
İçindekiler
Terminoloji ve etimoloji
Ensefalit terimi, Yunanca enkephalos (ἐγκέφαλος, “beyin”) ve iltihabı ifade eden ek -itis’ten türemiş olup “beyin iltihabı” anlamına gelir.
N-metil-D-aspartat (NMDA), deneysel olarak glutamat reseptörlerinin bir alt tipini tanımlamak için kullanılan sentetik bir aminokarboksilik asittir; bu bileşik, NMDA reseptörünün seçici bir agonistidir. Reseptörün adı doğrudan bu molekülden gelmektedir.
Reseptör (Lat. recipere = almak, kabul etmek) bir sinyal molekülünü “alan” protein yapılardır.
Dolayısıyla “anti-NMDA reseptör ensefaliti”, kelime kelime “N-metil-D-aspartat reseptörüne karşı (anti) gelişen, beyin iltihabı (ensefalit)” anlamına gelir ve terminolojik olarak hastalığın temel özelliğini – sinaptik NMDA reseptörlerine yönelik otoantikorların yol açtığı ensefaliti – oldukça doğrudan yansıtır.
NMDA reseptörünün fizyolojisi ve hedef alınmasının sonuçları
NMDA reseptörü, iyonotropik glutamat reseptörleri ailesine ait, özellikle hipokampus, amigdala, prefrontal korteks ve striatumda yoğunlaşmış bir reseptördür.
- Yapısal olarak reseptör, zorunlu bir GluN1 (NR1) alt birimi ve bir veya daha fazla GluN2 (NR2A–D) / GluN3 alt biriminden oluşan tetramerik bir kompleks şeklindedir.
- Kalsiyum geçirgenliğine sahip olması, uzun süreli potansiyasyon (LTP) ve uzun süreli depresyon (LTD) gibi sinaptik plastisite mekanizmaları için temel önem taşır; bu süreçler öğrenme ve belleğin nörobiyolojik altyapısını oluşturur.
Anti-NMDA reseptör ensefalitinde antikorlar, GluN1 alt birimine karşı IgG sınıfında otoantikorlar olup reseptörün hücre yüzeyindeki yoğunluğunu fonksiyonel olarak azaltırlar:
- Antikorlar, sinaptik organizasyonda önemli bir rol oynayan EphB2 reseptörü ile NMDAR arasındaki etkileşimi bozar.
- Bu bozulma, NMDAR’ların klatrin aracılı endositoz yoluyla içselleştirilmesine ve sinaptik membranda reseptör yoğunluğunun azalmasına yol açar.
- Özellikle hipokampus ve limbik sistemdeki uyarıcı glutamaterjik nöronlar ve bu devreleri dengeleyen GABAerjik internöronlar etkilenir; bu da geniş ölçekli ağ düzeyinde disinhibisyon, senkronizasyon bozukluğu ve epileptiform aktivite şeklinde kendini gösterir.
Bu mekanizma, klasik paraneoplastik ensefalitlerden farklı olarak belirgin nöronal kayıptan çok fonksiyonel bir sinaptik ensefalopati doğurur. Bu da erken ve yeterli immünoterapi uygulandığında klinik düzelmenin neden çoğu hastada oldukça belirgin olabildiğini açıklar.
Epidemiyoloji
Anti-NMDA reseptör ensefaliti, otoimmün ensefalitler içinde en sık tanınan form haline gelmiştir.
- İnsidans: Kesin rakamlar değişmekle birlikte, kaba tahminler yılda yaklaşık 1 / 1,5 milyon kişi civarında bir insidansa işaret etmektedir; bununla birlikte gerçek sıklığın, artan farkındalık ve test olanaklarıyla daha yüksek olduğu düşünülmektedir.
- Cinsiyet: Olguların yaklaşık %80’i kadındır; özellikle genç kadınlarda, tümör ilişkili (over teratomu) olgular baskındır.
- Yaş: Hastalık her yaşta görülebilir; tipik başlangıç 2.–4. dekat arasında olmakla birlikte, çocukluk çağından ileri yaşa kadar tüm yaş spektrumu tanımlanmıştır. Ortalama başlangıç yaşının 20’li yaşların başı–ortaları civarında olduğu bildirilir.
- Tümör ilişkisi: Erişkin kadınlarda over teratomu, genel hasta grubunun yaklaşık %20–40’ında saptanırken, daha yaşlı erişkinlerde ya da erkeklerde tümör sıklığı daha düşüktür.
- Pediatrik hastalar: Çocukluk çağında tümör ilişkisi daha nadirdir; buna karşın enfeksiyon sonrası (özellikle herpes simpleks ensefaliti sonrası) otoimmün aktivasyon daha sık bir bağlam oluşturur.
Anti-NMDA reseptör ensefaliti, görece yeni tanımlanmasına karşın, paraneoplastik ve otoimmün ensefalit spektrumu içinde nispeten sık bir varlık olarak kabul edilmektedir.
Etiyopatogenez
1. Otoimmün mekanizma
Merkezde, GluN1 alt birimine karşı gelişen IgG antikorları yer alır. Bu antikorlar hücre yüzeyine bağlanır, reseptör içselleştirilmesini tetikler ancak klasik kompleman aracılı sitotoksisite veya masif nöronal ölümden ziyade fonksiyonel reseptör kaybı ile sonuçlanır.
- Bu olay, özellikle hipokampus, limbik devreler ve prefrontal korteksi içeren ağlarda sinaptik transmisyonu bozar.
- Klinik düzeyde bu durum, psikoz–diskognisyon–nöbet–hipoventilasyon–otonom instabilite şeklinde çok aşamalı bir tabloya dönüşür.
2. Paraneoplastik mekanizma (over teratomu ve diğer tümörler)
Olguların kabaca yarısında veya daha azında, özellikle genç kadınlarda over teratomu saptanır.
- Teratomlar, embriyonik germ hücrelerinden gelişen ve farklı dokular (epitel, kas, sinir dokusu vb.) içerebilen tümörlerdir. “Teratoma” terimi, Yunanca téras (τέρας, “canavar, tuhaf yaratık”) kökünden türemiştir; tümörün içindeki “tuhaf doku çeşitliliğine” gönderme yapar.
- Over teratomları, içinde nöronal doku ve NMDA reseptörü ekspresse eden nöron benzeri hücreler barındırabilir.
- Tümördeki bu nöronal antijenlere karşı gelişen immün yanıt, moleküler taklit mekanizmasıyla santral sinir sistemindeki fizyolojik NMDAR’lara yönelir ve paraneoplastik ensefalite yol açar.
Klinik olarak paraneoplastik ve paraneoplastik olmayan formlar birbirine çok benzer; ancak tümör varlığında tümörün cerrahi rezeksiyonu, immünoterapiyle birlikte prognozu belirgin şekilde iyileştirir.
3. Post-herpes simpleks ensefaliti
Herpes simpleks virüs tip-1 (HSV-1) ensefaliti, özellikle limbik sistem ve temporal lobları tutan ağır bir nekrotizan ensefalittir. Bazı hastalarda akut enfeksiyon düzeldikten haftalar–aylar sonra, klinik tablo yeniden kötüleşir:
- Yeni veya artan psikiyatrik belirtiler
- Nöbetler
- Kognitif bozulma
Bu ikinci fazda, BOS ve serumda anti-NMDAR antikorları saptanabilir; bu durum herpes ensefaliti sonrası sekonder otoimmün ensefalit olarak yorumlanmaktadır. Çeşitli serilerde HSV ensefaliti geçiren hastaların yaklaşık beşte birinde NMDAR antikorlarının gelişebildiği bildirilmektedir.
4. İdiyopatik ve diğer tetikleyiciler
Hastaların önemli bir kısmında ne tümör ne de yakın zamanda geçirilmiş HSV ensefaliti saptanır; bu olgular idiyopatik olarak sınıflandırılır.
- Genetik yatkınlık (örneğin HLA tipleri) ve çevresel tetikleyiciler (viral enfeksiyonlar, immün modülasyon dönemleri vb.) üzerinde çalışmalar sürmektedir.
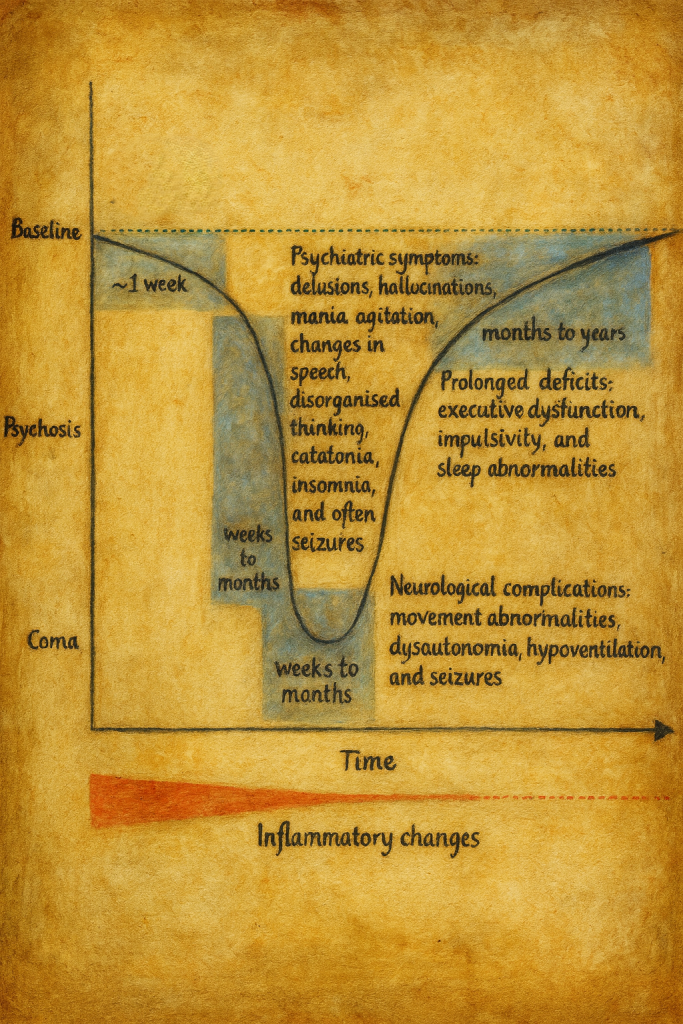
Klinik tablo ve evreler
Anti-NMDA reseptör ensefaliti tipik olarak çok aşamalı bir klinik seyir izler:
1. Prodromal dönem
Hastalığın başlangıcında çoğu hastada grip benzeri, özgül olmayan prodromal semptomlar görülür:
- Hafif ateş, baş ağrısı
- Halsizlik, bitkinlik
- Myalji
- Uyku bozuklukları
- İştahsızlık, bulantı
Bu faz genellikle birkaç gün–yaklaşık iki hafta sürer ve sıkça viral bir enfeksiyon zannedilir.
2. Psikiyatrik ve nöropsikiyatrik dönem
Bundan sonra, çoğu hastada subakut psikiyatrik tablo gelişir. Klinik görünüm sıklıkla şizofreni spektrum bozukluklarını andırır:
- Akut veya subakut başlayan psikoz, sanrılar ve işitsel ya da görsel halüsinasyonlar
- Ajitasyon, öfori, irritabilite veya derin anksiyete
- Tuhaf davranışlar, sosyal içe çekilme, regresyon
- Kısa süreli bellek bozuklukları, dezoryantasyon, dikkatte belirgin azalma
- Dil üretiminde bozulma, anlamsız konuşma veya mutizm gelişmeye eğilim
Bu dönem, yanlışlıkla primer psikiyatrik bozukluk tanıları (örneğin “akut şizofrenik atak”, “bipolar mani”, “uyum bozukluğu”) almasına yol açabilir.
3. Nörolojik ve katatonik dönem
Ortalama birkaç hafta içinde, tabloya belirgin nörolojik bulgular eklenir:
- Epileptik nöbetler: Fokal veya jeneralize nöbetler; status epileptikus gelişebilir.
- Hareket bozuklukları: Kore, koreoatetoz, distoni; özellikle orofasiyal diskinezi (dil çıkarma, ağız büzme, çiğneme benzeri hareketler) çarpıcıdır.
- Konuşma bozuklukları: Disartri, afazi benzeri dil bozukluğu, nihayetinde mutizm.
- Bilinç değişikliği: Somnolans, stupor; katatonik özellikler, motor katılık, negativizm.
- Disotonomik belirtiler: Kardiyak aritmiler, kan basıncında dalgalanmalar, terleme krizleri, hiper-/hipotermi.
- Solunum bozukluğu: Hipoventilasyon, apne atakları; çoğu ağır hastada mekanik ventilasyon gereksinimi doğar.
Bu evrede hastalar çoğu zaman yoğun bakım koşullarına ihtiyaç duyar; klinik tablo, ağır bir ensefalopati ile katatoni, nöbetler ve otonom instabilitenin kombinasyonu haline gelir.
4. İyileşme ve rezidüel dönem
Erken ve etkili immünoterapi uygulanan olgularda, haftalar–aylar içinde yavaş ama çoğunlukla belirgin bir toparlanma gözlenir:
- Önce otonom ve solunum fonksiyonları stabil hale gelir.
- Motor bulgular ve hareket bozuklukları geriler.
- Son aşamada psikiyatrik belirtiler ve kognitif bozukluklar düzelme eğilimi gösterir; ancak bazı hastalarda kalıcı dikkat ve bellek sorunları, yürütücü işlevlerde hafif bozulma devam edebilir.
Pediatrik hastalarda, tablo bazen geç başlangıçlı otizm benzeri regresyon, sosyal iletişimde azalma ve tekrar eden davranış örüntüleri şeklinde sunulabilir; bu durumda mutlaka otoimmün ensefalit olasılığının da düşünülmesi gerekir.
Tanı
1. Klinik şüphe
Anti-NMDA reseptör ensefaliti tanısının temelini, klinik olarak tipik, çok aşamalı sendromun tanınması oluşturur. Subakut başlangıçlı psikiyatrik belirtiler, nöbetler, hareket bozuklukları, bilinç değişikliği ve otonom disfonksiyon birlikteliğinde mutlaka otoimmün ensefalit araştırılmalıdır.
2016 Graus kriterleri ve çeşitli ulusal/uluslararası kılavuzlar, klinik şüphe, BOS bulguları, EEG, MRG ve antikor testlerini kombine eden bir tanı yaklaşımı önermektedir.
2. BOS ve serumda antikor saptanması
Tanının altın standardı, BOS’ta anti-NMDAR (anti-GluN1) IgG antikorlarının gösterilmesidir.
- BOS analizi, serumdan daha yüksek duyarlığa sahiptir ve birçok kılavuzda tercih edilen örnek materyal olarak vurgulanmaktadır.
- Antikorlar genellikle hücre temelli testler (cell-based assay, CBA) ve doku bazlı immünfloresans ile gösterilir.
- BOS’ta hafif lenfositoz, oligoklonal band pozitifliği ve protein artışı görülebilir ancak bu bulgular özgül değildir.
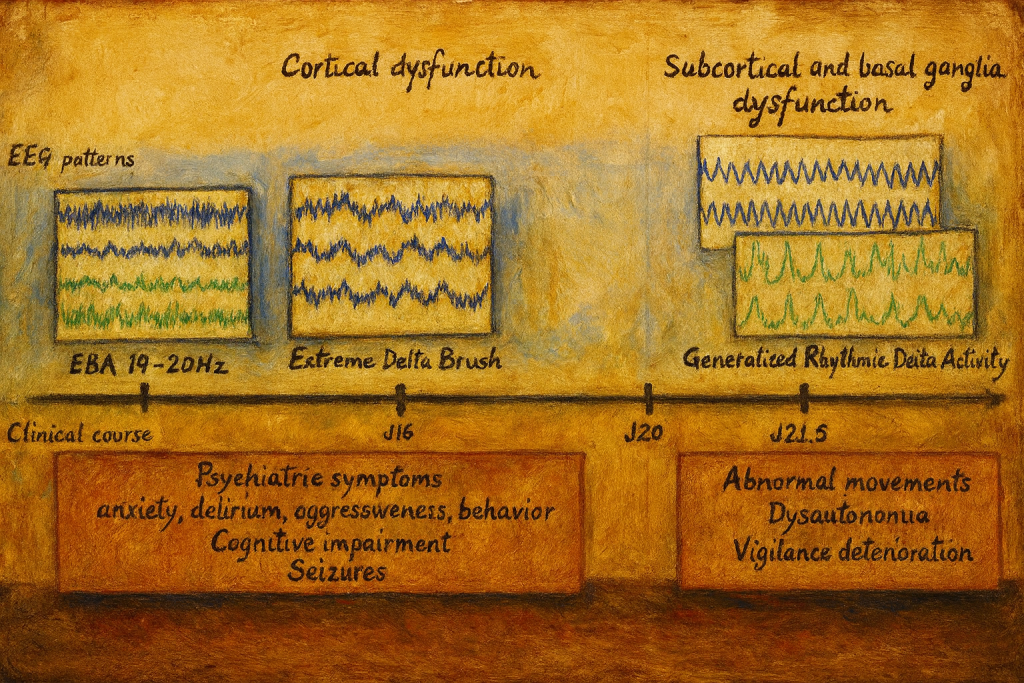
3. Elektroensefalografi (EEG)
EEG, hemen tüm hastalarda anormaldir; fakat bulgular spesifik değildir:
- Yavaşlama, diffüz delta–theta aktivitesi
- Fokal epileptiform deşarjlar
- Bazı hastalarda “extreme delta brush” olarak adlandırılan, üzerinde beta aktivite binen yaygın delta dalgaları ile karakteristik bir desen tanımlanmıştır; bu desen anti-NMDAR ensefaliti için nispeten karakteristik kabul edilir.
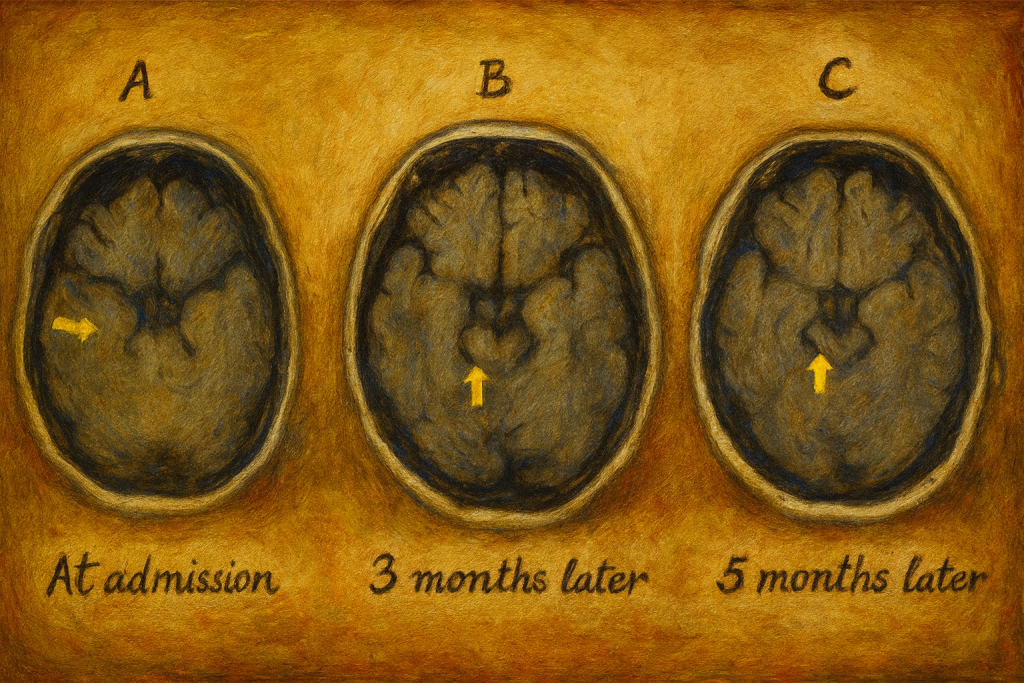
4. Beyin MRG
Manyetik rezonans görüntülemede:
- Hastaların yaklaşık yarısında normal veya yalnızca hafif nonspesifik değişiklikler görülür.
- Bazı olgularda medial temporal lob, kortikal-subkortikal alanlar veya bazal gangliyonlarda T2/FLAIR sinyal artışı saptanabilir.
Normal MRG, anti-NMDA reseptör ensefaliti tanısını dışlamaz; bu, klinik–BOS–antikor üçlüsünün önemini artırır.
5. Tümör taraması
Paraneoplastik olasılık nedeniyle, özellikle 12–45 yaş arası kadınlarda over teratomu başta olmak üzere tümör taraması yapılmalıdır:
- Pelvik USG, kontrastlı BT veya MRG
- Şüpheli bulgular varsa cerrahi değerlendirme
Yaş ve klinik bağlama göre akciğer, timus ya da diğer organ neoplazileri de araştırılabilir.
Ayırıcı tanı
Anti-NMDA reseptör ensefaliti, hem psikiyatrik hem nörolojik alanda geniş bir ayırıcı tanı listesiyle karşılaştırılmalıdır:
1. Primer psikiyatrik bozukluklar
- Şizofreni spektrumu
- Bipolar bozukluk (özellikle manik epizod)
- Akut ve geçici psikotik bozukluklar
Genç yaşta başlayan, hızla kötüleşen psikoz, nöbet, motor bozukluk ve otonom instabilite birlikteliğinde primer psikiyatrik tanı tek başına yeterli değildir; otoimmün ensefalit mutlaka dışlanmalıdır.
2. Diğer otoimmün / paraneoplastik limbik ensefalitler
- Anti-LGI1
- Anti-CASPR2
- Anti-AMPAR
- Anti-GABA_B reseptörü
- Daha nadir olarak anti-mGluR5, neurexin-3α vb.
Bu tablolar da kognitif bozulma, nöbetler ve psikiyatrik belirtilerle seyreder; antikor profili, MRG paterni ve tümör ilişkililiği ayırıcı tanıda önemlidir.
3. Enfeksiyöz ensefalitler
- Özellikle HSV-1 ensefaliti, erken dönemde klinik ve MRG bulguları ile güçlü bir ayırıcı tanıdır.
- Diğer viral, bakteriyel, fungal ve parazitik ensefalitler de dışlanmalıdır.
4. Metabolik, toksik ve diğer nedenler
- Metabolik ensefalopatiler (karaciğer yetmezliği, üremi, hipoglisemi, hiponatremi)
- Toksik ilaç veya madde kullanımına bağlı ensefalopatiler
- Mitokondriyal ve diğer dejeneratif hastalıklar (özellikle çocuklarda)
Tedavi
Tedavide temel hedefler:
- İmmün cevabın baskılanması / modülasyonu,
- Varsa temel tümörün eradikasyonu,
- Yoğun bakım ve semptomatik destek ile sekellerin ve mortalitenin azaltılmasıdır.
1. Birinci basamak immünoterapi
Kılavuzlar, anti-NMDAR ensefaliti dahil otoimmün ensefalitlerde benzer ilk basamak tedavi stratejilerini önermektedir:
- Yüksek doz IV metilprednizolon (ör. 1 g/gün, 3–5 gün)
- Ardından oral steroid tapering veya
- IV immünoglobulin (IVIG) (toplam 2 g/kg, genellikle 3–5 güne bölünerek) ve/veya
- Plazmaferez (plazma değişimi)
Bu yaklaşımlar tek tek veya kombine şekilde uygulanabilir. Özellikle ağır olgularda, plazmaferez antikor yükünü hızlıca azaltmak için tercih edilebilir.
2. Tümör rezeksiyonu
Paraneoplastik olgularda tümörün cerrahi olarak çıkarılması, prognoz üzerinde dramatik etki gösterebilir:
- Over teratomu rezeksiyonu sonrası, uygun immünoterapi ile birlikte klinik iyileşme hızlanır ve nüks riski azalır.
Bu nedenle, tümör saptandığında en kısa sürede cerrahi girişim planlanmalıdır.
3. İkinci basamak immünoterapi
Birinci basamak tedavilere yanıtın yetersiz olduğu veya ağır seyrettiği durumlarda B-hücre hedefli veya sitotoksik immünoterapi gündeme gelir:
- Rituksimab: Anti-CD20 monoklonal antikor; hafif toksisite profili ve B hücrelerini hedeflemesi nedeniyle ikinci basamakta sık kullanılan ajan haline gelmiştir.
- Siklofosfamid: Alkilleyici ajan; özellikle sistemik otoimmünite veya vaskülit eşlik eden ağır olgularda düşünülür.
Güncel konsensus dokümanları, hücre yüzey antijenlerine yönelik antikorların rol aldığı otoimmün ensefalitlerde ikinci basamakta rituksimabı siklofosfamide göre ön planda önermektedir.
4. Üçüncü basamak / kurtarma tedavileri
Dirençli olgularda, daha yoğun immün baskılayıcı stratejiler gündeme gelebilir:
- Bortezomib: Plazma hücrelerini hedefleyen proteazom inhibitörü; özellikle yüksek antikor titresinin devam ettiği ve rituksimaba dirençli olgularda vaka serilerinde kullanılmıştır.
- Tosilizumab (anti-IL-6 reseptör antikoru) ve diğer biyolojik ajanlar, seçilmiş olgularda düşünülmektedir.
Bu tedaviler için kanıt düzeyi hâlâ sınırlıdır ve genellikle ağır, refrakter olgularla sınırlı deneyime dayanmaktadır.
5. Semptomatik ve yoğun bakım tedavisi
- Antiepileptik tedavi: Akut dönemde nöbet kontrolü için gerekli; ancak çoğu nöbetin “semptomatik” olması nedeniyle, iyileşme sonrası ilaçlar kademeli olarak azaltılabilir.
- Sedasyon ve davranış kontrolü: Ajitasyon ve psikotik belirtiler bazen yoğun sedatif/antipsikotik gereksinimi doğurur; fakat dopamin bloke edici ilaçlar hareket bozukluklarını kötüleştirebileceğinden dikkatli kullanılmalıdır.
- Solunum ve otonom kontrol: Hipoventilasyon için mekanik ventilasyon, hemodinamik dalgalanmalar için yoğun bakım izlemi gerekebilir.
- Nörorehabilitasyon ve psikososyal destek: İyileşme sürecinin ayrılmaz parçasıdır.
Prognoz ve nüksler
Anti-NMDAR ensefaliti, tanınması ve tedavisi nispeten yeni olan bir hastalık olmakla birlikte, erken ve agresif immünoterapiyle genellikle iyi seyirlidir:
- Büyük kohort çalışmalarda hastaların yaklaşık %75–80’inde tam düzelme veya yalnızca hafif, günlük yaşamı fazla kısıtlamayan nörolojik/kognitif sekeller bildirilmiştir.
- Yaklaşık %15–20’lik bir grupta orta–ağır düzeyde kalıcı nörolojik, kognitif veya psikiyatrik hasar kalabilmektedir.(ResearchGate)
- Mortalite oranı, serilere göre değişmekle birlikte %4–5 civarındadır.
Nüks (relaps)
Nüks, anti-NMDAR ensefalitinin önemli bir özelliğidir:
- Çeşitli çalışmalarda 2 yıl içinde nüks oranı yaklaşık %10–15 olarak bildirilmiştir; bazı kaynaklarda daha geniş aralıklarla %10–30 oranları verilmektedir.
- Nüksler genellikle başlangıç atağından daha hafif seyredebilir; ancak yine de ciddi morbidite potansiyeli taşır.
- Nüks riskini artıran faktörler arasında gecikmiş veya yetersiz immünoterapi, rezidüel tümör dokusu, BOS’ta 12. ayda persistan antikor pozitifliği gibi göstergeler tartışılmaktadır.
Bu nedenle, hastalar en az ilk 2–3 yıl içinde klinik ve mümkünse immünolojik açıdan yakından izlenmeli, yeni semptomlar açısından uyanık olunmalıdır.
Tarihçe ve toplumsal yansımalar
Anti-NMDA reseptör ensefaliti, nöroimmünolojide görece genç sayılabilecek bir kavramdır.
- 2000’li yılların başında over teratomu ile ilişkili, psikiyatrik belirtiler ve hipoventilasyonla seyreden paraneoplastik ensefalit olguları tanımlanmaya başlandı.
- Josep Dalmau ve çalışma arkadaşları, 2007 yılında NMDAR’ın NR2 alt birimlerine karşı antikorlarla ilişkili, ağır fakat tedaviye yanıtlı bir ensefalit formunu ayrıntılı olarak tanımladı; bu, hastalığın modern anlamda doğuşu olarak kabul edilmektedir.
- 2008’de yayımlanan büyük vaka serisi, tipik çok aşamalı klinik seyri, antikor özelliklerini ve tümör ilişkisinin önemini ortaya koydu ve hastalık kısa sürede nöroloji ve psikiyatri pratiğinde tanınır hale geldi.
Toplumsal düzeyde, anti-NMDAR ensefaliti özellikle iki örnekle geniş kitlelerin dikkatine girmiştir:
- “Brain on Fire” (Susannah Cahalan): New Yorklu bir gazetecinin anti-NMDAR ensefalitine yakalanışını, tanıdaki güçlükleri ve iyileşme sürecini anlattığı otobiyografik kitabı ve onun sinemaya uyarlanan filmi, hastalığın adeta “yüzü” haline gelmiştir.
- Berlin Hayvanat Bahçesi’nin kutup ayısı “Knut”: 2011’de havuza düşerek nöbet sırasında boğulan ünlü kutup ayısının beyin dokusu üzerinde yapılan otopsi ve immünolojik incelemelerde, GluN1’e özgül anti-NMDAR antikorları ve anti-NMDA reseptör ensefalitiyle uyumlu ensefalitik değişiklikler gösterilmiş; böylece bu hastalık insan dışı bir memelide ilk kez tanımlanmıştır.
Bu iki örnek, hem klinik farkındalığı artırmış hem de hastalığın yalnızca insanlarla sınırlı olmayan, daha genel bir nöroimmün fenomen olabileceğine işaret etmiştir.
Evrimsel ve nörobiyolojik perspektif
NMDA reseptörleri, omurgalı evriminde oldukça korunmuş yapılar olup, özellikle bellek, mekânsal navigasyon ve karmaşık sosyal davranışların nörobiyolojik altyapısında rol oynarlar.
- Hipokampusta NMDA reseptör aracılı plastisite, hem memelilerde hem de kuşlarda öğrenme ve hafıza için temel bir mekanizma olarak gösterilmiştir.
- Bu reseptörlerin fonksiyonel kaybı veya disregülasyonu, yalnızca insanlarda değil, diğer memelilerde de ağır davranışsal ve nörolojik sendromlar doğurabilmektedir; Knut olgusu bu açıdan çarpıcı bir örnektir.
Anti-NMDA reseptör ensefaliti, bu açıdan bakıldığında, evrimsel olarak korunmuş bir sinaptik mekanizmayı – glutamat aracılı plastisiteyi – hedef alan bir otoimmün “deney” gibi okunabilir:
- Bağışıklık sistemi, yanlış hedef aldığı sinaptik reseptörler üzerinden, karmaşık bilişsel ve davranışsal işlevleri geçici olarak devre dışı bırakmaktadır.
- Hastalığın tedavi edilebilir olması ve çoğu hastanın tedavi sonrası eski işlevlerine büyük oranda dönebilmesi, sinaptik ağların plastik ve yeniden organizasyona açık doğasını vurgular.
Bu nedenle anti-NMDAR ensefaliti, yalnızca klinik olarak önemli bir nöroimmün hastalık değil, aynı zamanda bilinç, benlik algısı, davranış ve bağışıklık sistemi arasındaki incelikli ilişkileri anlamak için de benzersiz bir “doğal model” olarak değerlendirilebilir.
Keşif
20. yüzyılın sonlarında nörologların ve psikiyatristlerin elinde “adı konulamayan” birkaç hastayla başlıyor: genç, çoğu zaman tamamen sağlıklı kadınlar; önce grip benzeri bir tablo, ardından günler–haftalar içinde hızla çözülen kişilik, ani psikoz, kabuslar, kontrolsüz çalkalanmalar, epileptik nöbetler, yoğun bakıma götüren hipoventilasyon. Beyin biyopsilerinde belirgin bir virüs yok, otopside özgül bir tümör yoksa her şey “kriptogenik ensefalit” ya da “atipik şizofreni” başlığı altında kaybolup gidiyor.
1. İsmi olmayan hastalığın ilk gölgeleri: 1990’lar ve 2000’lerin başı
1990’ların sonu ve 2000’lerin hemen başında, Amerika ve Avrupa’da birkaç nöroloji ekibi aynı tuhaf örüntüye tekrar tekrar rastlamaya başlıyor: genç kadınlarda, over teratomu ile birlikte görülen, psikiyatrik belirtiler + nöbet + hipoventilasyon üçlüsü. Bu olgular, o zamanlar henüz “anti-NMDA reseptör ensefaliti” adını almamışken, paraneoplastik, limbik ağırlıklı, sebebi belirsiz bir ensefalit olarak rapor ediliyor.
Bu dönemin önemli isimlerinden biri, 2005 civarında over teratomu, ağır psikoz ve hipoventilasyon birlikteliğini tanımlayan Raffaele Vitaliani ve ekibi; burada henüz NMDA reseptöründen söz edilmiyor, ama “genç kadın + over teratomu + psikiyatrik belirtiler + ağır ensefalit” motifi gün yüzüne çıkmış durumda.
Klinik tablolar o kadar “psikiyatrik” görünüyor ki, bu hastaların önemli bir kısmı ilk günlerde psikiyatri kliniklerine yatırılıyor, antipsikotik tedaviler alıyor, EEG ve BOS incelemeleri çoğu zaman ancak tablo dramatik biçimde ağırlaştığında yapılıyor. Daha sonra geriye dönük bakıldığında, bugün “anti-NMDAR” diye sınıflandıracağımız çok sayıda olgunun bu dönemde farklı başlıklar altında kayıtlara geçtiği anlaşılıyor.
2. Josep Dalmau ve ekolün doğuşu: 2005–2008
Hikâyenin kırılma noktası, İspanyol asıllı nörolog Josep Dalmau’nun sahneye çıkışıyla başlıyor. Dalmau, daha önce de paraneoplastik nöroloji alanında (anti-Hu, anti-Yo vb.) önemli katkılarıyla bilinen bir isim. 2000’lerin ortasında, ABD’de (Pennsylvania ve daha sonra New York–Barcelona ekseninde) çalışan ekibiyle birlikte, bu “garip” teratom ilişkili ensefalit olgularını sistemli biçimde toplamaya başlıyor.
2005’te, Vitaliani ve Dalmau’nun içinde olduğu ekip, over teratomu ile ilişkili, psikiyatrik belirtiler ve hipoventilasyonla seyreden paraneoplastik bir ensefalit sendromunu ayrıntılı olarak tanımlıyor. Henüz spesifik antikor bilinmiyor; fakat bir “paraneoplastik ensefalit” tablosu olarak literatüre giriyor.
Birkaç yıl içinde, bu olguların beyin omurilik sıvılarında ve serumlarında ortak bir antijen hedefinin var olduğu fikri güçleniyor. Dalmau’nun laboratuvarında çalışan Andrew J. Gleichman, Eric G. Hughes ve diğer araştırmacılar, deney hayvanlarının beyin dokusu ve hücre kültürü sistemlerinde, hasta serumlarının nereye bağlandığını adım adım izliyor.
2007’de, dönüm noktası niteliğinde çalışma yayımlanıyor: over teratomu olan 12 genç kadında, N-metil-D-aspartat (NMDA) reseptörünü, daha spesifik olarak GluN1 (NR1) alt birimini hedefleyen otoantikorlar tanımlanıyor; klinik tablo, bugünkü anlamıyla “paraneoplastik anti-NMDA reseptör ensefaliti” olarak adlandırılıyor.
Bu çalışma, birkaç açıdan çığır açıcı:
- Hedef antijen intracellüler değil, hücre yüzeyindeki bir reseptör; bu, antikorlar temizlendiğinde reseptörün ve nöronların fonksiyonel olarak toparlanabileceği, yani hastalığın tedavi edilebilir olduğu anlamına geliyor.
- Klinik tablo, klasik paraneoplastik ensefalitlerden farklı olarak çok belirgin bir psikiyatrik başlangıç ve otonom instabilite deseni sergiliyor.
- Hastaların büyük kısmı genç kadın ve over teratomu taşıyor; moleküler taklit ve tümör kaynaklı antijen sunumu fikri güçleniyor.
2008’de Dalmau ve çalışma arkadaşlarının daha büyük bir vaka serisi yayımlanıyor; yüzü aşkın hasta, tipik klinik evreler (prodromal dönem, psikiyatrik evre, nörolojik/katatoni evresi, iyileşme), BOS ve EEG bulguları ve tedavi yanıtları sistematik biçimde sunuluyor. Bu makale, bugün hâlâ anti-NMDAR ensefalitinin “kurucu metni” olarak kabul ediliyor.
Bu dönemde isimleri öne çıkan araştırmacılar arasında, Dalmau’ya ek olarak R. Vitaliani, A. Gleichman, E. Hughes, L. Sansing, D.R. Lynch ve laboratuvar–klinik köprüyü kuran pek çok nörolog-immunolog yer alıyor.
3. Psikiyatri ile nöroimmünolojinin kesişmesi: 2010’ların başı
2007–2010 arasında, dünyanın farklı yerlerindeki klinisyenler, Dalmau’nun çizdiği klinik profile bakarak kendi hastalarını geri dönük olarak gözden geçirmeye başlıyor. “Tipik” anti-NMDAR tabloları – genç kadın, ani psikoz, ardından nöbetler, diskenizi, hipoventilasyon – bir anda nöroloji ve psikiyatri dergilerinde peş peşe vaka serileri olarak görünmeye başlıyor.
Bu süreçte:
- Psikiyatristler, “tedaviye dirençli akut psikoz” gördüklerinde BOS ve antikor analizi istemeyi öğreniyor.
- Nörologlar, “viral ensefalit gibi başlayan ama hiçbir patojen bulunamayan” olgularda otoimmün paneli genişletiyor.
- Yoğun bakım hekimleri, kontrolsüz otonom instabilite ve hipoventilasyonla giden genç hastalarda anti-NMDAR olasılığını düşünmeye başlıyor.
Anti-NMDA reseptör ensefaliti bir tür “köprü hastalık” haline geliyor: bir ayağı psikiyatrinin, diğer ayağı nörolojinin ve immünolojinin içinde.
Bu dönemin önemli katkı veren isimleri arasında Michael S. Kayser, David R. Lynch, H. Prüss, F. Graus, T. Bien, pek çok pediatrik nörolog ve yoğun bakım uzmanı bulunuyor; her biri, sendromun farklı bir boyutunu – psikoz, epilepsi, limbik ensefalit ilişkisi, çocukluk çağı olguları, tedavi stratejileri – ayrıntılandırıyor.
4. “Autoimmune encephalitis” çağının doğuşu
Anti-NMDAR ensefalitinin keşfi, aslında daha geniş bir paradigmanın kapısını açıyor: otoimmün ensefalit kavramı. Daha önce yalnızca klasik paraneoplastik antikorlar (anti-Hu, anti-Yo, anti-Ma vb.) ve bazı nöromiyotoniler (anti-VGKC kompleksi) bilinirken, 2010’lar boyunca hücre yüzeyine ve sinaptik proteinlere karşı giderek artan sayıda antikor tanımlanıyor:
- LGI1, CASPR2, AMPAR, GABA_B, mGluR5, nöreksin-3α ve diğerleri.
Bu tabloyu sistematik bir çerçeveye oturtan isimlerden biri de Francesc Graus ve çalışma arkadaşları. 2016’da yayımlanan kriterler, anti-NMDAR ensefaliti dahil otoimmün ensefalitlerin tanısı için klinik, görüntüleme, BOS ve antikor verilerini entegre eden bir algoritma sunuyor. Böylece anti-NMDAR ensefaliti, sadece bir vaka serisi olmaktan çıkıp, algoritmik tanısal yaklaşımın merkezinde yer alan bir “prototip sendrom” haline geliyor.
5. Çocuklar, erkekler ve tüm spektrum: Nosadini kuşağı
Başlangıçta neredeyse “genç kadınların, over teratomuna bağlı hastalığı” gibi görünen sendromun, aslında çok daha geniş bir spektrumu kapsadığı kısa sürede anlaşılıyor.
- Erkeklerde, çocuklarda, ileri yaşlarda da anti-NMDAR olguları rapor ediliyor.
- Pediatrik nörologlar, çocuklarda tabloya otizm benzeri regresyon, yoğun davranış değişiklikleri ve epilepsi ağırlıklı seyir gibi nüansların eklenebileceğini gösteriyor.
Bu alanda özellikle Michela Nosadini ve uluslararası pediatrik konsorsiyumların çalışmaları, çocukluk çağı anti-NMDAR ensefalitinin klinik özelliklerini, tedavi yanıtlarını ve uzun dönem bilişsel sonuçlarını sistematik biçimde ortaya koyuyor; 2020’li yıllara gelirken çocuklar için ayrı tedavi önerileri ve izlem algoritmaları hazırlanmış durumda.
6. Mekanizmanın çözülmesi: GluN1, reseptör içselleşmesi ve sinaptik plastikite
Laboratuvar cephesinde, Dalmau ekolü ve başka gruplar, antikorların tam olarak ne yaptığını anlamaya yöneliyor. Hücre kültürü ve hayvan modellerinde:
- Anti-NMDAR antikorlarının özellikle GluN1 alt birimine bağlandığı,
- Bu bağlanmanın NMDA reseptörü ile EphB2 reseptörü arasındaki etkileşimi bozduğu,
- Sonuçta reseptörlerin klatrin aracılı endositoz yoluyla içselleştirildiği ve postsinaptik membrandaki NMDAR yoğunluğunun azaldığı gösteriliyor.
İlginç olan, bu sürecin geri döndürülebilir olması: antikor kaynağını (tümör, B hücreleri, plazma hücreleri) baskıladığınızda reseptörler yeniden yüzeye dönüyor, sinaptik akım normalleşiyor ve klinik tablo düzelebiliyor. Bu, klasik “nöron öldürücü” otoimmün süreçlerden (örneğin anti-Hu) çok farklı, fonksiyonel bir sinaptik ensefalopati mekanizmasını işaret ediyor.
Bu aşamada, glutamat reseptörleri ve sinaptik plastisite üzerine çalışan temel bilimciler ile klinik nörologlar arasında yoğun bir işbirliği doğuyor; anti-NMDAR ensefaliti, adeta bilinç, bellek ve davranışın sinaptik temellerini gözlemlemek için “doğal bir deney” gibi kullanılmaya başlanıyor.
7. Knut’un hikâyesi: İnsan-dışı ilk vaka
2011’de Berlin Hayvanat Bahçesi’nin dünyaca ünlü kutup ayısı Knut, havuza düşerek nöbet sırasında boğuluyor. O dönem yapılan patolojik incelemeler, ayının ağır bir ensefalit nedeniyle nöbet geçirdiğini gösteriyor; fakat etken bulunamıyor.
Yıllar sonra, Harald Prüss ve ekibi, Knut’un arşivlenmiş beyin dokusunu ve serumunu modern otoantikor testleriyle yeniden inceliyor. Sonuç: Knut’un, insanlarda tanımlanan anti-NMDA reseptör ensefalitinin neredeyse bire bir aynısını taşıdığı gösteriliyor; GluN1’e özgül antikorlar, tipik histopatolojik desen, klinik seyir
Böylece anti-NMDAR ensefaliti, yalnızca insanlarda değil, başka memelilerde de ortaya çıkabilen evrimsel olarak korunmuş bir nöroimmün kırılganlık noktası olarak görülmeye başlanıyor. Bu çalışma, hem hastalığın popüler farkındalığını artırıyor hem de “insanın psişesine özgü görünen” bu sendromun aslında daha genel bir sinaptik fenomen olduğunu hatırlatıyor.
8. Klinik pratiğin olgunlaşması: kılavuzlar, tedavi algoritmaları, uzun dönem izlem
2010’ların ikinci yarısından itibaren, akademik dünya anti-NMDA reseptör ensefalitine artık “yeni ve egzotik” bir merak unsuru olarak değil, günlük pratiğin parçası olan bir teşhis ve tedavi alanı olarak bakmaya başlıyor:
- Uluslararası kılavuzlar ve uzman görüşü yazıları, birinci ve ikinci basamak immünoterapi (yüksek doz steroid, IVIG, plazmaferez, rituksimab, siklofosfamid) sıralamasını netleştiriyor.
- Pediatrik ve erişkin hastalar için farklı doz ve izlem şemaları öneriliyor.
- Nüks oranları, uzun dönem kognitif sekeller, mesleki ve sosyal geri dönüş oranları gibi veriler, çok merkezli kohortlardan elde edilmeye başlanıyor.
Aynı dönemde “hasta hikâyeleri” de tıpkı Brain on Fire örneğinde olduğu gibi, hastalığın kamusal algısında önemli bir rol oynuyor: bir sabah gözünü açtığında “kendisi olmayan” birine dönüşen genç yetişkinler; aylarca yoğun bakımda kalıp, sonra yavaş yavaş okula, işe, aile yaşamına dönen insanlar. Bu anlatılar, bir yandan klinik farkındalığı artırırken, diğer yandan otoimmün ensefalitlerin psikiyatrik hastalıklarla olan sınırlarını tartışmaya açıyor.
9. Güncel araştırma cephesi: biyobelirteçler, yapay zekâ ve yeni hedefler
2020’lere gelindiğinde, anti-NMDA reseptör ensefaliti üzerine çalışmalar artık yalnızca “tanı koyalım mı, nasıl tedavi edelim?” sorusundan ibaret değil. Araştırma gündemi birkaç eksende yoğunlaşıyor:
1. Biyobelirteçler ve prognoz tahmini
Yeni çalışmalar, BOS ve kanda ölçülebilen antikor titreleri, sitokin profilleri, nörofilament hafif zincir gibi nörodejenerasyon belirteçleri ve MRG/FDG-PET paternlerini bir araya getirerek kimlerin ağır seyredeceğini, kimlerin birinci basamak tedaviyle iyileşeceğini, kimlerde erken dönemde ikinci basamak (rituksimab, siklofosfamid) ya da daha agresif tedavinin gerektiğini öngörmeye çalışıyor.
2. Yapay zekâ ve klinik karar destek
Geniş hasta serilerinden elde edilen veriler, makine öğrenimi modelleriyle analiz edilerek mortalite, yoğun bakım ihtiyacı, nüks riski gibi sonlanımlar için risk skorları geliştiriliyor. 2025 civarında yayımlanan bazı çalışmalar, klinik veriler + laboratuvar + görüntüleme kombinasyonuyla çalışan modellerin, geleneksel klinik öngörüden daha iyi performans gösterebildiğini bildiriyor.
3. Yeni immün hedefler: plazma hücreleri ve ötesi
Rituksimab (B hücrelerine, CD20 üzerinden) ve siklofosfamide ek olarak, plazma hücrelerini hedefleyen tedaviler gündemde:
- Bortezomib gibi proteazom inhibitörleri, refrakter anti-NMDAR olgularında vaka serileriyle denenmiş durumda.
- 2020’lerin ortasına doğru, anti-CD38 antikoru daratumumab gibi ajanlarla başarılı tedavi edilen, çok ağır ve tedaviye dirençli olguların bildirildiği yayınlar ortaya çıkıyor; bu, özellikle kronikleşmiş, yüksek antikor titreli hastalarda plazma hücrelerinin rolüne işaret ediyor.
4. Kognitif rehabilitasyon ve uzun dönem beyin sağlığı
Bazı projeler, anti-NMDAR ensefalitinden çıkan hastalarda yıllar sonra bile tespit edilebilen ince yürütücü işlev bozuklukları, dikkat ve bellek sorunları üzerine odaklanıyor. Hastalara çevrim içi bilişsel rehabilitasyon programları uygulanması, evden izlem ve dijital sağlık uygulamalarıyla uzun dönem beyin sağlığının takip edilmesi gibi modeller deneniyor.
5. Bibliyometrik ve ağ analizleri
2024’te yayımlanan bibliyometrik analizler, 2005’ten itibaren anti-NMDAR ensefaliti ile ilgili yayın sayısının logaritmik denebilecek bir hızla arttığını, dünyanın dört bir yanında (özellikle Çin, ABD, Avrupa) çok merkezli ağların oluştuğunu gösteriyor. Bu haritalar, “keşif”ten “yerleşik bilgi alanı”na geçişi nicel olarak da görünür kılıyor.
10. Keşiften bugüne uzanan çizgi
Bugün, bir acil servise 23 yaşında, daha iki hafta önce sağlıklı olan bir kadın; ani paranoid hezeyanlar, halüsinasyonlar, dengesiz tansiyon dalgalanmaları ve arada gelişen epileptik nöbetlerle getirildiğinde, pek çok klinisyen için anti-NMDA reseptör ensefaliti olasılığı artık yabancı bir fikir değil.
Bu noktaya gelene kadar:
- 1990’ların sonundaki “anlaşılamayan ensefalit” olgularından,
- 2005’teki Vitaliani tipi paraneoplastik sendrom tariflerinden,
- 2007’de Dalmau ve ekibinin antikoru tanımlamasına,
- 2008’de yüzlerce hastalık serilere,
- 2010’larda Graus kriterleri ve uluslararası kılavuzlara,
- Knut’un beyin dokusunda insan dışı ilk vakanın gösterilmesine,
- 2020’lerde yapay zekâ destekli prognoz modelleri ve yeni immünoterapötik hedeflere
uzanan katmanlı bir tarih birikmiş durumda.
Anti-NMDA reseptör ensefaliti, böylece yalnızca spesifik bir hastalık olmaktan çıkıp, bağışıklık sistemi ile sinaptik plastisite, psikiyatri ile nöroloji, insan beyni ile evrimsel biyoloji arasındaki karmaşık ilişkinin anlatıldığı, çok katmanlı bir keşif hikâyesine dönüşmüş durumda.
İleri Okuma
- Dalmau J (2007). Paraneoplastic anti–N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology, 61(1), 25-36. DOI: 10.1002/ana.21050.(Wiley Online Library)
- Dalmau J (2008). Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. The Lancet Neurology, 7(12), 1091-1098. DOI: 10.1016/S1474-4422(08)70224-2.(PubMed)
- Dalmau J (2011). Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis. The Lancet Neurology, 10(1), 63-74. DOI: 10.1016/S1474-4422(10)70253-2.(PubMed)
- Graus F (2016). A clinical approach to diagnosis of autoimmune encephalitis. The Lancet Neurology, 15(4), 391-404. DOI: 10.1016/S1474-4422(15)00401-9.(PubMed)
- Kayser MS (2014). Anti-NMDA receptor encephalitis, autoimmunity, and psychosis. Biological Psychiatry, 75(6), 410-411. DOI: 10.1016/j.biopsych.2013.09.021.(PMC)
- Nosadini M (2021). International Consensus Recommendations for the Treatment of Pediatric NMDAR Encephalitis. Neurology: Neuroimmunology & Neuroinflammation, 8(4), e1052. DOI: 10.1212/NXI.0000000000001052.(Neurology)
- Abboud H (2021). Autoimmune encephalitis: proposed recommendations for symptomatic and long-term management. Journal of Neurology, Neurosurgery & Psychiatry, 92(8), 897-907. DOI: 10.1136/jnnp-2020-324350.(jnnp.bmj.com)
- Prüss H (2015). Anti-NMDA Receptor Encephalitis in the Polar Bear (Ursus maritimus) Knut. Scientific Reports, 5, 12805. DOI: 10.1038/srep12805.(Nature)
- Nguyen L (2023). Anti-NMDA Receptor Autoimmune Encephalitis: Diagnosis and Management Strategies. International Journal of General Medicine, 16, 2241-2256. DOI: 10.2147/IJGM.S404643.(Dove Medical Press)
- Zhao X (2023). Clinical characteristics of anti-N-methyl-D-aspartate receptor encephalitis: a systematic review. Frontiers in Human Neuroscience, 17, 1261638. DOI: 10.3389/fnhum.2023.1261638.(Frontiers)

Yorum yazabilmek için oturum açmalısınız.