-yunanca; pus, podos (ayak) ve (bkz: cyt) kelimelerinden oluşmaktadır.
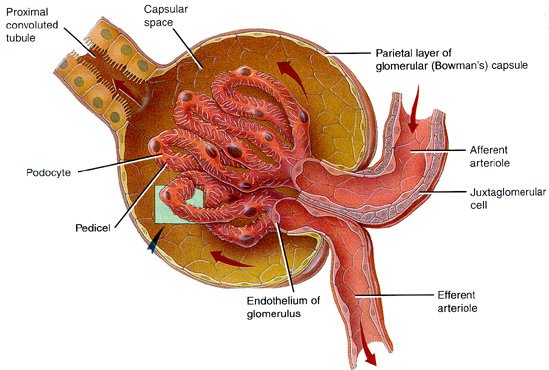
-bowman kapsülünün iç kısmı yapar.
–glomerulus kılcallarını sarar.
-primer idrarı, böbrek cisimciğinde oluşturur.
Glomerulus
Sinonim: Glomerulum.
- Latincede(m); Küçük yuvarlak yığın, küçük yumak anlamlarına gelir. (Bkz; Glomer–ulus)
- Sinir veya küçük damar topluluğudur.
- Bböbrekte , glomerulus ise; glomeruli corpusculi renalisı ifade eder.
- Böbrekte primer üre için ultra filtrasyonu gerçekleştirir.
- Blukoz, idrar maddeleri ve potasyum iyonları tubuluslara burdan geçebilir.
- Podositler burada bulunur.

Kaynak: http://www.beltina.org/pics/glomerulus.jpg
muskulus psoas mayor
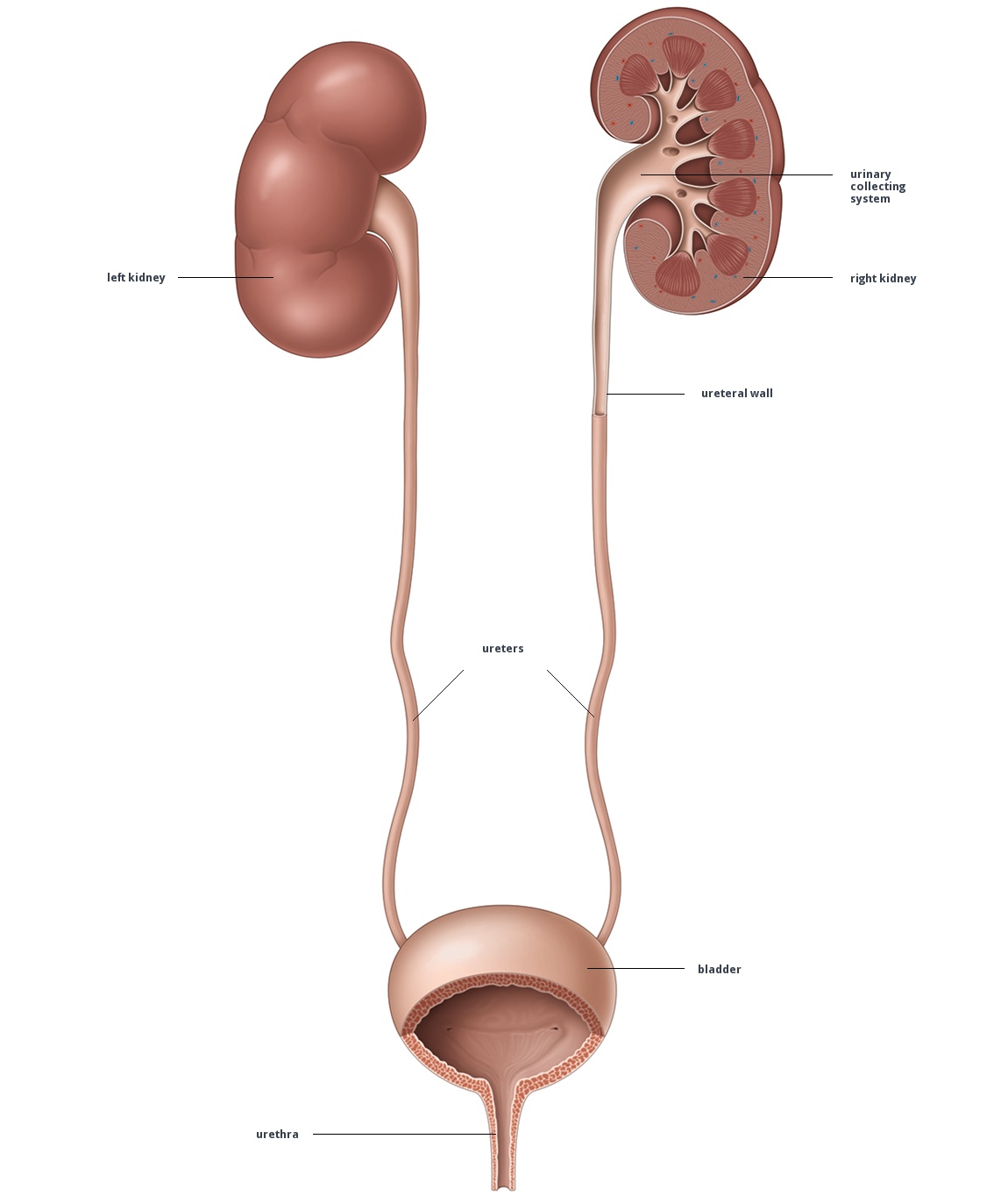
İdrar borusu
Sinonim: Üreterler, Ureter, Harnleiter, Ουρητήρας, ureters
- Yunancada(m); Üreter: idrar yolu, böbreklerden, idrar torbasına idrarın taşınmasını sağlar. 25-35 cm arasındadır.
- Hilyum renalisde böbreği terk eder, musculus psoas major ön kısmından aşağı doğru iner, vasa iliacayı linea terminalis de çaprazlar.
- Üreteral (ureter-al) idrar borusunu etkileyen veya ona ait olan anlamındadır.

Appendises epiploika
Sinonim: Appendices epiploicae.
Kolonun dış kısmında bulunan yağla dolu kabarcıklardır. (Bkz; appendices) (Bkz; epiploicae)

haustren
–colonun dış kısmında olan görülebilir çıkıntı, kabartı.
taenia
-memelilerde, colonda düz kasların kalınlaştığı band çizgilerine denir.colon için karakteristik özelliktir.
Mide
Etimolojik Köken ve Kavramsal Çerçeve
“Mide” terimi Arapça miʿdaʿ (معدة) kökünden türemiş olup sindirim organını ifade eder. Yunanca gaster ve Latince ventriculus terimleriyle eşdeğerdir. Bu sözcükler yalnızca anatomik bir yapıyı değil, besinlerin kimyasal ve mekanik dönüşümünü mümkün kılan merkezi bir biyolojik işlev alanını tanımlar. Antik tıp literatüründe mide, humoral dengenin ve metabolik düzenin belirleyici merkezlerinden biri olarak ele alınmıştır; bu yaklaşım modern fizyoloji açısından kavramsal olarak aşılmış olsa da midenin sistemik etkileri güncel bilimsel anlayışta hâlen merkezi bir konumdadır.
Evrimsel ve Karşılaştırmalı Biyolojik Bağlam
Mide, omurgalı evriminde beslenme stratejilerinin çeşitlenmesiyle paralel olarak farklılaşmış bir organdır. İlkel omurgalılarda basit genişlemeler şeklinde görülen mide benzeri yapılar, etçil ve omnivor türlerde belirgin bir asidik sindirim odasına dönüşmüştür. Hidroklorik asit üretiminin evrimsel kazanımı, proteinlerin denatürasyonu ve patojen eliminasyonu açısından güçlü bir seçilim avantajı sağlamıştır. İnsan midesi bu evrimsel çizginin ileri bir örneğini temsil eder; yüksek asidite kapasitesi, karmaşık glandüler organizasyon ve nöroendokrin düzenleme mekanizmaları ile karakterizedir.
Makroskopik Anatomi ve Bölgesel Organizasyon
Mide, özofagus ile duodenum arasında yer alan, ortalama 1,5–2 litre hacme kadar genişleyebilen, J-şekilli bir organdır. Proksimal bölümde fundus ve korpus ağırlıklı olarak depo ve sekresyon işlevi görürken, distal bölümde antrum pyloricum mekanik karıştırma ve boşaltımın düzenlenmesinde rol oynar. Mide girişinde cardia, çıkışında ise musculus sphincter pylori yer alır. Pilorik sfinkter, kimusun partikül boyutunu ve osmotik özelliklerini denetleyerek duodenuma geçişi hassas biçimde kontrol eder.
Histolojik Yapı ve Hücresel Bileşenler
Mide duvarı klasik olarak dört tabakadan oluşur: mukoza, submukoza, muskularis propria ve seroza. Mukoza tabakası tek katlı silindirik epitel ile örtülüdür ve belirgin kıvrımlar (rugae) içerir. Gastrik bezler üç ana salgı hücresini barındırır:
- Servikal mukositler, karbonhidratça zengin mukus ve bikarbonat içeren tamponlayıcı bir salgı üretir. Bu bariyer, pH değeri yaklaşık 0,9’a kadar düşebilen mide lümenine karşı epitel bütünlüğünü korur.
- Paryetal ekzokrinositler, hidroklorik asit ve intrinsik faktör salgılar. HCl, amilazı inaktive eder, proteinleri denatürize eder ve patojen mikroorganizmaları elimine eder. İntrinsik faktör ise ileumda vitamin B₁₂ emilimi için zorunludur.
- Prensipal (chief) ekzokrinositler, inaktif pepsinojen salgılar; bu proenzim asidik ortamda pepsine dönüşerek proteinleri daha küçük peptitlere parçalar. Pepsin özellikle kollajen gibi bağ dokusu proteinlerinin sindiriminde etkilidir.
Buna ek olarak mide özsuyunda kathepsin gibi diğer proteolitik enzimler de bulunur. Günlük gastrik sekresyon miktarı ortalama 1,5–2 litre civarındadır.
Nöromüsküler ve Endokrin Düzenleme
Midenin motor ve sekretuar faaliyetleri enterik sinir sistemi tarafından düzenlenir. Submukozada plexus submucosus, muskularis propriada ise plexus myentericus yer alır. Distal mide bölgesinde bulunan “adım atıcı” hücreler peristaltik dalgaların ritmini belirler. Kimus, peristaltik karıştırma sonucu partikül çapı yaklaşık 1 mm’nin altına düşene kadar pylorik sfinkterden geçemez.
Hormonal düzenlemede gastrin, mide genişlemesi ve motilin uyarıcı etki gösterirken; sekretin, gastrik inhibitör peptid (GIP) ve somatostatin inhibitör rol oynar. Bu denge, mide boşalmasının ve asit sekresyonunun ince ayarını sağlar.
Lenfatik Drenaj ve İmmünolojik Boyut
Mide, hem ventral hem dorsal mezenterium ile ilişkili olup zengin bir lenfatik ağ içerir. Seroza altında yer alan yoğun lenfatik damarlar, lenfi büyük ve küçük eğrilikler boyunca taşır. Bölgesel lenf düğümleri bu eğrilikler boyunca, dalak hilusunda ve pankreasın üst kenarı boyunca yoğunlaşır. Lenf akışı Lnn. coeliaci üzerinden Lnn. mesenterici superiorese, oradan da truncus intestinalise katılır. Bu yapı, mide kaynaklı enfeksiyonların ve malign hücrelerin yayılımında kritik öneme sahiptir.
Patolojik Değişiklikler: Ülser ve Malignite
Normal mide mukozasında yüzey epiteli, salgı bezleri, lamina propria ve muscularis mucosae düzenli bir organizasyon sergiler. Mide ülserinde ise doku bütünlüğü belirgin biçimde bozulur. Ülser tabakasında fibrin, granülositler, eritrositler ve besin artıkları içeren eksüdat bulunur. Bunu fibrinoid nekroz, ardından granülasyon dokusu izler; granülasyon dokusunda kılcal damarlar, lenfositler, granülositler ve plazma hücreleri yer alır. İyileşme sürecinde yara dokusu gelişir. Ülser çevresinde tromboangiitis obliterans ve Schwann hücrelerinin nörom benzeri proliferasyonu görülebilir.
Mide kanserinde histopatolojik tablo daha karmaşıktır. Ülserasyon sıklıkla eşlik eder; submukozada ve muskularis propriada atipik salgı bezleri saptanır. Lenfosit ağırlıklı kronik inflamasyon, hem tümör mikroçevresinin bir parçası hem de bağışıklık yanıtının göstergesi olarak değerlendirilir. Bu değişiklikler lenfatik yayılım eğilimiyle birlikte klinik prognozu belirler.
Farmakolojik ve Klinik Yaklaşımın Bütüncül Değerlendirilmesi
Midenin fizyolojik ve patolojik özellikleri, farmakolojik müdahalelerin temelini oluşturur. Asit sekresyonunu baskılayan proton pompa inhibitörleri ve H₂ reseptör antagonistleri, mukozal koruyucular ve motilite düzenleyiciler bu çerçevede geliştirilmiştir. İntrinsik faktör eksikliğine bağlı B₁₂ emilim bozuklukları hematolojik ve nörolojik sonuçlar doğurur. Dolayısıyla mide, yalnızca lokal bir sindirim organı değil; sistemik metabolik, immünolojik ve nöroendokrin etkileri olan çok katmanlı bir biyolojik merkez olarak ele alınmalıdır.
Keşif
I. Prebilimsel Dönem: Sezgi, Deneyim ve Metafor (MÖ 3000 – MÖ 500)
Mideye ilişkin ilk bilgiler sistematik gözleme değil, yaşamsal deneyime dayanır. Mezopotamya ve Eski Mısır metinlerinde mide, “içsel kazan” veya “pişirme kabı” metaforlarıyla betimlenir. Besin alımı sonrası hissedilen sıcaklık, dolgunluk ve ağrı, midenin aktif bir dönüşüm alanı olduğu düşüncesini doğurmuştur. Ancak bu dönemde mide, anatomik bir yapıdan ziyade bedensel enerjilerin toplandığı belirsiz bir merkez olarak algılanır.
Antik Hint Ayurveda geleneğinde agni kavramı, sindirimin ateşle özdeşleştirilmesini temsil eder; bu yaklaşım, mide asiditesinin sezgisel bir öncülüdür. Benzer biçimde Çin tıbbında mide (wei) yaşam enerjisinin (qi) işlenme alanı olarak tanımlanır.
II. Antik Yunan: Doğal Felsefeden Anatomiye (MÖ 5.–2. yüzyıl)
Mideyi sistematik biçimde ele alan ilk düşünürler Antik Yunan hekimleridir. Hipokrates okulunda mide, humoral teorinin merkezinde yer alır; sindirim, besinlerin “olgunlaşması” olarak değerlendirilir. Hipokrates için mide pasif bir kap değildir; ancak işleyişi sıcaklık ve nem gibi niteliklerle açıklanır.
Aristoteles, mideyi organizmanın teleolojik düzeni içinde ele alır. Ona göre mide, besinleri canlıya uygun forma dönüştüren zorunlu bir ara istasyondur. Ancak deneysel diseksiyon sınırlı olduğu için yapı-fonksiyon ilişkisi hâlâ spekülatiftir.
Bu dönemde en önemli kırılma Galen ile yaşanır. Galen, hayvan diseksiyonlarına dayanarak midenin katmanlı yapısını tanımlar, sindirimin yalnızca mekanik değil, kimyasal bir süreç olduğunu ileri sürer. Asidik bir sıvının varlığını sezmiş olsa da bunun doğası henüz açıklanamaz. Galen’in otoritesi, Orta Çağ boyunca sorgulanmadan kabul edilir.
III. Orta Çağ İslam Dünyası: Koruma ve Genişletme (9.–13. yüzyıl)
Antik mirasın korunması ve eleştirel biçimde geliştirilmesi İslam tıbbı aracılığıyla gerçekleşir. İbn Sînâ, El-Kanun fi’t-Tıbb’da mideyi ayrıntılı biçimde ele alır; gastrik bozuklukları klinik belirtilerle ilişkilendirir. Mide salgılarının niteliği, gıdaya bağlı değişkenlik ve mide ağzı (cardia) kavramı bu dönemde belirginleşir.
Bu dönemin ayırt edici yönü, midenin yalnızca sindirim değil, sistemik hastalıkların kaynağı olabileceği fikrinin ortaya çıkmasıdır. Böylece mide, klinik düşüncenin merkezine yerleşir.
IV. Rönesans ve Anatomik Devrim: Yapının Keşfi (16.–17. yüzyıl)
Vesalius ile birlikte insan diseksiyonu bilimsel norm hâline gelir. Mide ilk kez ayrıntılı anatomik çizimlerle belgelenir. Katmanlı duvar yapısı, eğrilikler ve pylorik bölge net biçimde tanımlanır. Ancak hâlâ sindirimin kimyası bilinmez.
Bu dönemde mekanik sindirim teorileri öne çıkar; mide, kasılmalarla besini parçalayan bir öğütücü olarak görülür. Kimyasal dönüşüm fikri, deneysel kanıt eksikliği nedeniyle geri plandadır.
V. Deneysel Fizyolojinin Doğuşu: Asidin Keşfi (18.–19. yüzyıl)
Bilimsel kırılma noktası 18. yüzyılda gelir. Reaumur ve Spallanzani, sindirimin mekanik değil kimyasal olduğunu deneylerle gösterir. Ancak en dramatik ilerleme 19. yüzyılda William Beaumont’un çalışmalarıyla yaşanır. Mide fistülü olan Alexis St. Martin üzerinde yapılan gözlemler, canlı insanda gastrik sekresyonun doğrudan incelenmesini mümkün kılar.
Bu çalışmalar sonucunda mide özsuyunun güçlü bir asit içerdiği anlaşılır. Hidroklorik asidin tanımlanması, sindirimin kimyasal doğasını kesinleştirir. Pepsin enziminin keşfiyle birlikte protein sindirimi ilk kez moleküler düzeyde anlaşılmaya başlanır.
VI. Hücresel ve Histolojik Dönem: Mikroskobik Devrim (19. yüzyıl sonu)
Mikroskopinin gelişimi, mide bilgisinde yeni bir çağ açar. Gastrik bezler, paryetal ve prinsipal hücreler tanımlanır. Hücrelerin farklı salgılar ürettiği anlaşılır; yapı-fonksiyon ilişkisi somutlaşır. Asit sekresyonunun belirli hücrelere özgü olduğu fikri, fizyolojiyi hücresel temele taşır.
Bu dönemde mide mukozasının kendini sindirmekten nasıl korunduğu sorusu ortaya çıkar; mukus-bikarbonat bariyeri kavramı doğar.
VII. Nöroendokrin Entegrasyon: Düzenleyici Ağların Keşfi (20. yüzyıl)
- yüzyıl, midenin izole bir organ olmadığı gerçeğini ortaya koyar. Gastrin hormonunun keşfi, mide sekresyonunun endokrin kontrol altında olduğunu gösterir. Ardından sekretin, somatostatin ve motilin tanımlanır. Enterik sinir sisteminin varlığı kabul edilir; mide “ikinci beyin” kavramının ilk adımlarını oluşturur.
Bu dönemde intrinsik faktörün tanımlanması, mide ile hematoloji ve nöroloji arasında doğrudan bir bağ kurar. Pernisiyöz anemi, mide patolojisinin sistemik sonuçlarına örnek teşkil eder.
VIII. Patoloji ve Onkoloji: Hastalıkların Haritalanması (20. yüzyıl ortası)
Mide ülseri ve mide kanseri histopatolojik olarak sınıflandırılır. Asit fazlalığı teorisi uzun süre baskın olurken, kronik inflamasyonun rolü giderek önem kazanır. Lenfatik yayılım yollarının anlaşılması, cerrahi onkolojide dönüm noktası oluşturur.
IX. Modern Dönem: Mikrobiyota, Moleküler Biyoloji ve Translasyonel Yaklaşımlar (20. yüzyıl sonu – günümüz)
Helicobacter pylori’nin keşfi, mide bilgisinde paradigmatik bir değişim yaratır. Ülser ve kanser patogenezinde enfeksiyonun rolü kabul edilir. Mide artık steril bir asit havuzu değil, kontrollü bir mikrobiyal ekosistem olarak değerlendirilir.
Güncel araştırmalar mideyi;
– kök hücre nişleri,
– epigenetik düzenleme,
– immün-mikrobiyota etkileşimi,
– nörogastroenteroloji
başlıkları altında ele alır. Proton pompa inhibitörlerinin uzun dönem etkileri, mide pH’ının sistemik mikrobiyotaya yansımaları ve gastrik kanserde hedefe yönelik tedaviler çağdaş yaklaşımın merkezindedir.
İleri Okuma
- Hippocrates (MÖ 4. yy). Corpus Hippocraticum. Antik Yunan tıp derlemeleri, çeşitli el yazmaları ve modern edisyonlar.
- Aristoteles (MÖ 4. yy). De Partibus Animalium. Antik Yunan biyoloji ve anatomi metni.
- Galenus, C. (MS 2. yy). De Usu Partium Corporis Humani. Roma dönemi anatomik ve fizyolojik inceleme.
- Avicenna, I. S. (1025). El-Kanun fi’t-Tıbb. Orta Çağ İslam tıbbının temel eseri.
- Vesalius, A. (1543). De Humani Corporis Fabrica. Basel, Johannes Oporinus.
- Réaumur, R. A. F. (1752). Observations sur la digestion des oiseaux. Paris, Histoire de l’Académie Royale des Sciences.
- Spallanzani, L. (1783). Dissertazioni di fisica animale e vegetabile. Modena.
- Beaumont, W. (1833). Experiments and Observations on the Gastric Juice and the Physiology of Digestion. Boston, Allen & Ticknor.
- Schwann, T. (1836). Über das Wesen der Fermentwirkung. Annalen der Physik und Chemie, 38, 491–514.
- Heidenhain, R. (1870). Physiologie der Absonderungsvorgänge. Hermann’s Handbuch der Physiologie, Leipzig.
- Pavlov, I. P. (1897). Lektsii o rabote glavnykh pishchevaritel’nykh zhelez. St. Petersburg.
- Edkins, J. S. (1905). The chemical mechanism of gastric secretion. Journal of Physiology, 34, 133–144.
- Castle, W. B. (1929). Observations on the etiologic relationship of achylia gastrica to pernicious anemia. American Journal of the Medical Sciences, 178, 748–764.
- Schindler, R. (1937). Gastritis. Philadelphia, W.B. Saunders.
- Marshall, B. J., Warren, J. R. (1984). Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. The Lancet, 323(8390), 1311–1315.
- Konturek, S. J. (2003). Physiology of the gastrointestinal tract. Journal of Physiology and Pharmacology, 54(Suppl 4), 3–15.
- Kusters, J. G., van Vliet, A. H. M., Kuipers, E. J. (2006). Pathogenesis of Helicobacter pylori infection. Clinical Microbiology Reviews, 19(3), 449–490.
- Mills, J. C., Shivdasani, R. A. (2011). Gastric epithelial stem cells. Gastroenterology, 140(2), 412–424.
- Fox, J. G., Wang, T. C. (2015). Inflammation, atrophy, and gastric cancer. Journal of Clinical Investigation, 125(5), 1679–1684.
- Sepulveda, A. R., Graham, D. Y. (2018). Gastric cancer: epidemiology, pathogenesis, and prevention. Gastroenterology Clinics of North America, 47(3), 515–532.
krikoid
Sinonim: cricoid, cricoidea, krikoidea.

Antik Yunancadaki κρίκος (kríkos, “yüzük”) ile eidos (biçim)’nın birleşmesinden oluşan κρικοειδής (krikoeidḗs, “Yüzük şeklinde“)’nın kısaltılmışıdır.
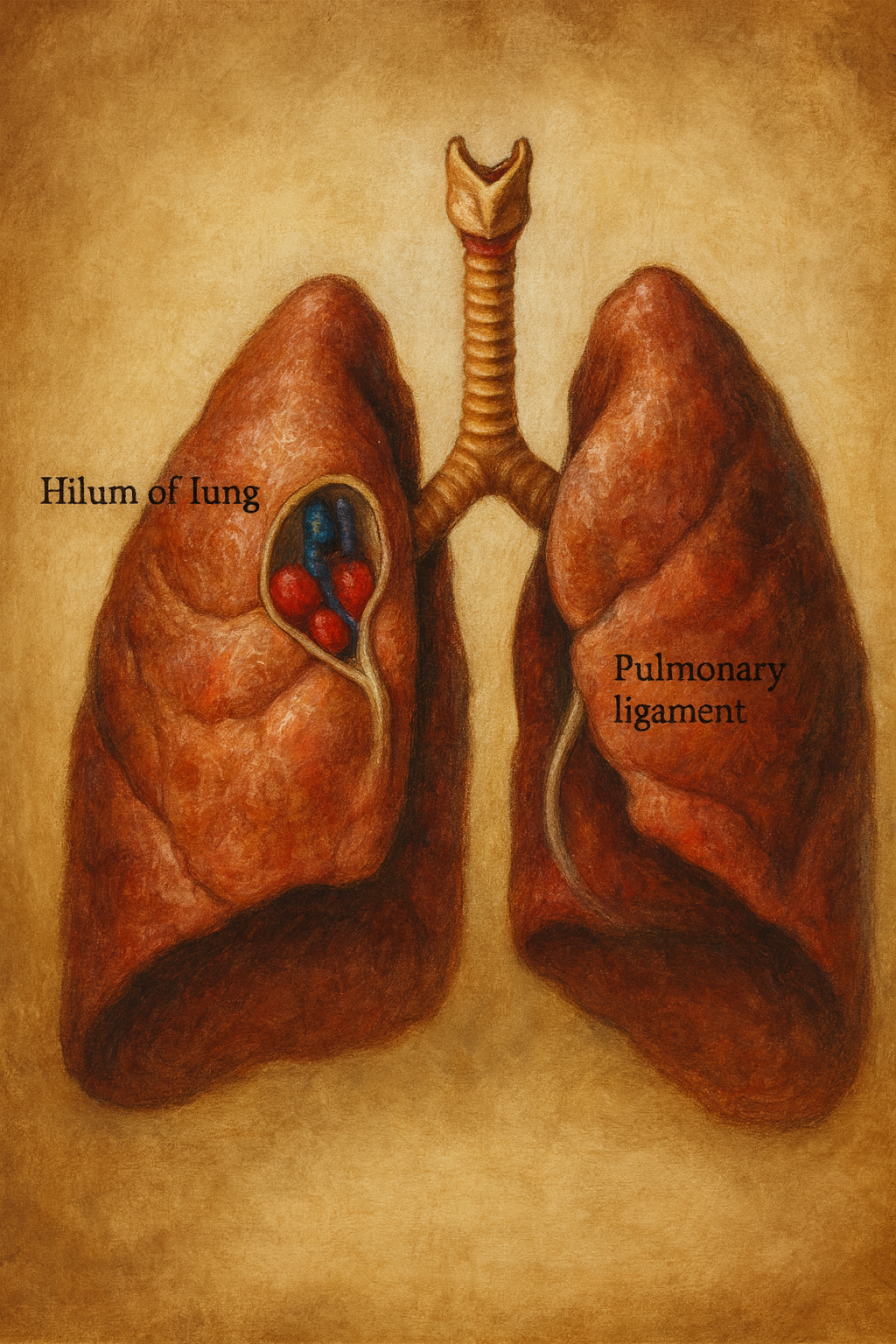
Hilum pulmonis
Tanım ve genel bakış
Hilum pulmonis, her akciğerin medial yüzünde yer alan, bronşların, pulmoner damarların, bronşiyal damarların, sinirlerin ve lenfatiklerin akciğere girip çıktığı kama biçimli kapıdır. Anatomik olarak hilum, parankim üzerinde çökük bir yüzey alanını ifade eder; bu “kapıdan” geçen yapıların tümüne birlikte akciğer kökü (radix pulmonis) denir. Dolayısıyla hilum yer, akciğer kökü ise demet-haznedir. Hilum düzeyinde plevra visceralis ile plevra parietalis birleşir; hilumun inferiorunda bu yapraklar pulmoner ligaman adı verilen çift katlı bir plika oluşturarak kaudale doğru uzanır.
Makroanatomi ve topografik ilişkiler
- Plevral ilişkiler: Visseral plevra hilumda parietal plevraya döner; birleşme hattı inferiora doğru pulmoner ligaman (özellikle küçük damarlar ve lenfatikler içerir) şeklinde uzanır.
- Mediastinal komşuluklar:
- Sağda: Hilumun süperolateralinde azigos veni arkı sağ ana bronşun üzerinden geçerek VCS’ye açılır; anteriorunda frenik sinir ve perikardiyakofrenik damarlar, posteriorunda vagus siniri izlenir.
- Solda: Üstte aort yayı ve önde sol frenik sinir, arkada sol vagus; posterolateralde iniş aortası ile komşudur.
- Sinir ilişkileri: Her iki akciğer kökü önünde frenik sinir, arkasında vagus siniri seyreder; akciğer kökü çevresinde anterior ve posterior pulmoner pleksuslar oluşur (parasempatik lifler vagustan, sempatik lifler torakal trunkustan).
Hilumun içerikleri ve düzenlenişi
Hilumdan geçen başlıca yapılar:
- Bronşlar: Sağda sağ ana bronş, solda sol ana bronş ve lobar dalları.
- Pulmoner arterler: Sağ ve sol ana pulmoner arter dalları.
- Pulmoner venler: Her iki tarafta üst ve alt pulmoner ven (genellikle hilumun en anterior ve en inferior bileşenleri).
- Bronşiyal arterler ve venler: Çoğunlukla solda iki, sağda bir bronşiyal arter; venöz drenaj azigos/hemiazigos sistemine ve kısmen pulmoner venlere.
- Lenfatikler ve nodlar: Hiler (stasyon 10) ve interlobar (stasyon 11) lenf düğümleri başta olmak üzere zengin lenfatik ağ.
- Bağ dokusu ve yağ dokusu (areolar doku), otonom sinir pleksusları.
Önden arkaya tipik sıralanış akılda kalıcıdır: V–A–B (Pulmoner Ven – Pulmoner Arter – Bronş).
Arter-bronş ilişkisi için klasik mnemonik: RALS → Right: arter Anterior (bronşa göre), Left: arter Superior. Bunun klinik karşılığı: sağda ana pulmoner arter, sağ ana bronşun önünden; solda sol pulmoner arter, sol ana bronşun üstünden geçer.
Sağ–sol farklılıkları ve varyasyonlar
- Eparteriyel/hiparteriyel bronş: Sağ üst lob bronşu eparteriyeldir (sağ pulmoner arterin üstünde başlar); sol üst lob bronşu hiparteriyeldir (sol pulmoner arterin altında).
- Hiler yükseklik: Ön-arka grafide sol hilum çoğu olguda (~%97) sağdan daha yüksektir; sağ hilumun soldan yüksek olması seyrektir ve dikkatle değerlendirilmelidir.
- Bronşiyal arter sayısı: Solda sıklıkla iki, sağda bir; köken çoğunlukla torasik aorta ve/veya interkostal dallar.
Segmental ve vasküler düzen
- Arterler bronkopulmoner segmentleri bronşlarla birlikte intrasegmental olarak izler.
- Venler segmentler arasında intersegmental seyreder ve hilumda üst/alt pulmoner venlere katılır.
- Bu düzen, segmentektomilerde venlerin “plan” belirlemede kullanılmasını sağlar.
Pulmoner ligaman
Hilumun inferiorundan sarkar; plevranın iki yaprağının birleşmesiyle oluşan gevşek bir plevral plikadır. Küçük venler, lenfatikler ve az miktarda bağ dokusu içerir; solunum sırasında kökün yukarı-aşağı hareketini tolere eder. Cerrahide (lobektomi/segmentektomi) sıklıkla kontrollü olarak serbestlenir.
Mikroskopik anatomi ve nörovejetatif denetim
- Bronş duvarı hiyalin kıkırdak plakları, düz kas, submukoz glandlar ve çok sıralı silyalı epitel içerir; daha distalde kıkırdak kaybolur.
- Otonom innervasyon: Vagus kaynaklı parasempatik lifler bronkokonstriksiyon ve mukus sekresyonunu artırır; sempatik lifler bronkodilatasyon ve vazokonstriksiyon eğilimindedir. Viskoelastik hava yolu tonusu ve refleksler hilum çevresindeki pleksuslarla bütünleşir.
Radyolojik anatomi
- Akciğer grafisi: Hiler gölgeler esas olarak pulmoner arterlerin görünümünü yansıtır; hilar nokta (arter dalı ile üst lob veninin kesişimi) tanımlıdır.
- Hilum overlay işareti: Mediastinal/ön-arka düzlemde yer alan kitle ile hilar kaynaklı kitlenin ayrımında kullanılır; damar siluetleri kitle üzerinden seçilebiliyorsa lezyon hilar değildir.
- BT: Damarlar, bronşlar ve nodlar kısa eksen ölçümleriyle değerlendirilir; hiler lenf nodu kısa eksen ≤10 mm genellikle “boyutsal olarak normal” kabul edilir, ancak tek başına boyut maligniteyi dışlamaz.
- PET/BT: Hiler (stasyon 10–11) nodlarda artmış FDG-tutulumu, klinik bağlama göre metastaz, granülomatöz hastalık veya reaktif hiperplazi ile korele edilir.
Hiler lenf düğümleri: sınıflama ve boyut
- Nodal haritalama: IASLC haritasına göre stasyon 10 (hilar) ve stasyon 11 (interlobar) akciğer hilusu ve yakın dallanma bölgelerini kapsar; bunlar akciğer kanserinde N1 kategorisine dahildir.
- Normal boyut: Çoğu kaynakta kısa eksen ≤10 mm sınır değerdir. Sigara içimi, enfeksiyonlar ve toz maruziyeti reaktif büyümeye yol açabilir; küçük metastatik nod olabileceği, büyük reaktif nod da olabileceği unutulmamalıdır.
Klinik korelasyonlar
“Normal hilum” kavramı
Simetrik konturlar, solda hafif daha yüksek hiler tepe, belirgin bir kitle etkisi olmaksızın düzgün damar dallanmaları ve ayrı seçilemeyen lenf düğümleri beklentidir. Pulmoner venler genelde en ventral ve inferior elemanlardır.
Hiler anormallik ve genişleme
Hiler genişleme tipik olarak dört süreçten birine bağlıdır:
- Lenfadenopati/tümöral kitle: Sarkoidoz, tüberküloz, lenfoma, metastaz; merkezi yerleşimli akciğer karsinomları ve tipik/atipik bronkopulmoner karsinoid.
- Pulmoner venöz hipertansiyon: Sol kalp yetmezliği, mitral kapak hastalıkları; venlerin dolgunluğu ve perihiler ödem (“kelebek kanadı”) eşlik edebilir.
- Pulmoner arteriyel hipertansiyon: Merkezi pulmoner arterlerin genişlemesi, periferik vasküler “çentiklenme” ile birlikte.
- Varyant/anatomik ve inflamatuvar durumlar: Reaktif nodlar, vaskülit, nadiren konjenital anomaliler.
Bilateral, simetrik hiler büyüme sarkoidoz lehine; asimetrik ya da tek taraflı büyüme primer akciğer kanseri veya metastatik/infeksiyöz süreçleri düşündürür. Sağ hilumun soldan yüksek görünmesi nadirdir; teknik faktörler, rotasyon, volüm kaybı ya da kitle etkisi ekarte edilmelidir.
“Hiler kitle” ve yönetim
Merkezi (hiler) akciğer tümörlerinde tedavi, evreleme (klinik-radyolojik + invaziv örnekleme), rezektabilite ve hastanın fonksiyonel rezervine bağlıdır.
- Cerrahi seçenekler: Lobektomi, sleeve lobektomi (bronkus segmentiyle birlikte rezeksiyon ve anastomoz), seçilmişte segmentektomi; uygun nodal diseksiyon şarttır.
- Endobronşiyal tedaviler: Karsinoid ve bazı sınırlı, lümene sınırlı lezyonlarda bronkoskopik rezeksiyon/ablasyon.
- Onkolojik tedavi: Rezektabl olmayan veya mikrometastatik hastalıkta kemoradyoterapi ve immünoterapi kombinasyonları. Erken tanı alan seçilmiş hiler karsinomların tedavi edilebilir olduğu kanıtlıdır; uzun dönem sonuçlar evre ve biyolojiyle belirlenir.
Tanısal yaklaşımlar
- BT ve PET/BT ile görüntüleme; damar–kitle ayrımı için kontrastlı fazlar önemlidir.
- EBUS-TBNA (endobronşiyal US eşliğinde ince iğne aspirasyonu) ile stasyon 10–11 nodların minimal invaziv örneklemesi mümkündür.
- Şüpheli vasküler genişlemelerde ekokardiyografi ve sağ kalp kateterizasyonu pulmoner basınçların değerlendirilmesini sağlar.
Cerrahi ve anestezi açısından önem
- Pulmoner ligamanın serbestlenmesi, alt lob mobilizasyonu için ana adımdır.
- V–A–B düzeni diseksiyon güvenliği için kilittir: Anterior düzlemde önce ven, ardından arter, en posterior planda bronş bulunur.
- Anatominin sağ–sol farkları (eparteriyel/hiparteriyel) ve yakın komşu yapılar (azigos arkı, aort yayı) komplikasyon önleme açısından kritik önemdedir.
Embriyoloji kısa notu
Trakeobronşiyal tomurcukların ventral ön bağırsaktan ayrılmasıyla bronşiyal ağaç gelişir; vasküler yatak 6. aortik ark ve pulmoner arterlerden köken alır. Hilum düzeyinde plevral yaprakların birleşmesi, plevral boşlukların nihai sınırlarını belirler.
Terminoloji ve sık hatalar
- Hilum ≠ kök: Hilum yüzeyde kapı, kök içerikten oluşan demettir.
- Hilar genişleme ile parahilar ya da mediastinal kitlelerin karıştırılması yaygındır; “overlay/convergence” işaretleri ve kontrastlı BT ayırımı netleştirir.
- Sadece nod boyutu ile malignite dışlanamaz; klinik–radyolojik bağlam ve gerektiğinde histoloji şarttır.
Keşif
Aşağıdaki anlatı, “hilum pulmonis”in (akciğer hilusu) öyküsünü bir “bulunuş”tan çok, yüzyıllara yayılan bir adlandırma, görselleştirme ve sistematikleştirme serüveni olarak izler: damarların ve bronşların akciğere girdiği o dar kapı, bilginin akışına da bir eşik oldu; her kuşak, kapının ardını biraz daha aydınlattı.
Kapının adı doğuyor: tohumdaki izden akciğerin eşiğine
“Hilum” sözcüğü, Latincede fasulyenin gövdeye bağlandığı “tohum izi”nden gelir; anatomiye geçtiğinde “bir organa damar ve sinirlerin girdiği-çıktığı kapı” anlamını kazandı. Ortaçağ ve Rönesans elyazmaları, akciğerin bu kapısını kimi zaman porta pulmonis, kimi zaman radix pulmonis diye andı; modern terminolojide ise “hilum pulmonis” yerleşti. Böylece botanikten ödünç alınan bir metafor, göğsün derinliklerinde iş gören anatomik bir kavrama dönüştü.
Kanın rotası yeniden çizilir: Hilusu anlamlı kılan kuramsal devrim
Antik yazarlardan devralınan şemada kan, kalpten akciğere ve geriye tam anlaşılmamış yollarla gidip geliyordu. 13. yüzyılda İbnü’n-Nefîs, kalp karıncıkları arasında “gizli gözenek” olmadığını, kanın sağ karıncıktan pulmoner artere, akciğerlerden pulmoner venlerle sol kalbe döndüğünü yazdı. Bu, akciğer kapısının yalnızca bir morfolojik çöküklük değil, dolaşımın zorunlu kavşağı olduğunu söyleyen ilk berrak şemaydı. 16. yüzyılda Vesalius, diseksiyonu norm hâline getirerek akciğer kökünün kaba mimarisini el yordamıyla değil, gözle görülür biçimde anlattı; trakeanın iki ana bronşa ayrılışı ve damarların köke katılışı artık kitaba girmişti. 17. yüzyılda Harvey’in dolaşım kuramı, ardından Malpighi’nin pulmoner kapiller betimi, hilusu fizyolojinin tam ortasına yerleştirdi: hilum, bronşların geçtiği kapı olmanın ötesinde, arter ile venin yeniden buluşmasının zorunlu eşiğiydi.
Görmenin tarihi: renklendirilen damarlar ve akciğer kökünün dokusu
Rönesans sonrası anatomi, yalnızca “nerede?” sorusunu değil, “nasıl görürüz?” sorusunu da sordu. 17–18. yüzyılda Frederik Ruysch, damar içi enjeksiyon teknikleriyle akciğer kökünde en ince damar dallanmalarını görünür kıldı; hilum, kaba bir üçgen çöküklükten damar ve bronş topografyasının haritasına dönüştü. Bu görsel devrim, 20. yüzyılın ortasında Cauldwell ve arkadaşlarının 150 kadavralık çalışmasıyla bronşiyal arterlerin varyasyonlarını standartlaştıran bir anatomiye evrildi; “akciğerin çift dolaşımı” (pulmoner ve bronşiyal) hilus çevresinde cerrahiye kılavuz olacak netlikte tarif edildi.
Dilin düzeni: Hilumun standartlaşması
- yüzyılın sonundan itibaren uluslararası terminoloji girişimleri, “hilum pulmonis”i küresel tıp dilinde resmî kıldı. Eponimlerden kaçınan ve Latin kökleri koruyan modern sözlük, hilumu yalnız akciğerde değil, böbrek ve dalak gibi organlarda da aynı ilkeye bağladı: “Bir organın kapısı, damar ve sinirlerin geçiş noktasıdır.” Bu, eğitimde ve klinikte aynı kelimenin aynı yapıyı çağrıştırmasını sağladı.
Radyolojinin sahnesi: Kapının gölgeleri ve ışıkla okunan anatomi
Göğüs grafisinde hiler konturların esasen pulmoner arter ağacını yansıtması, “hilar nokta” gibi işaretlerin tanımlanması, ardından BT’de kısa eksen ölçümleri ve PET/BT’de metabolik etkinlik okumaları, hilusu görüntülemenin ortak diline dönüştü. Klinik pratikte hiler lenf nodları (istasyon 10–11) akciğer kanserinde N1 alanını oluşturur; yalnızca “boyut”a değil, dağılım ve biyolojiye bakan çağdaş yaklaşım, kapının ardındaki hastalıkları olgu bağlamında çözümler.
İğnenin gözü: EBUS ile hilusun içeriden okunması
- yüzyıl başında konveks prob endobronşiyal ultrason (EBUS) ve gerçek zamanlı TBNA, hiler (10–11) ve komşu mediastinal istasyonlara trakeobronşiyal ağaç içinden ulaşmayı olanaklı kıldı. Mediastinoskopinin tekeline son veren bu teknik, tanısal doğruluk ve güvenlik profiliyle hiler patolojilerin minimal invaziv örneklemesini günlük pratiğe taşıdı. Bugün EBUS; PET/BT ve BT ile tümleyici biçimde çalışır, örnekleme stratejileri evrelemeyi rafine eder ve cerrahi–onkolojik kararları doğrudan etkiler. Son birkaç yılda robotik bronkoskopi ve konik ışın BT (CBCT)/dijital tomosentez eşleşmeleri, özellikle periferik lezyonlarda tanısal verimi artırırken; aynı seansta RAB + çizgisel EBUS sıralamasını test eden çok merkezli çalışmalar, hiler/mediastinal evrelemeyi lojistik ve verimlilik açısından yeniden düzenlemektedir. 2025’te uygulamaya giren TNM 9. baskı, IASLC düğüm haritasını temel alarak hiler istasyonların tanımlarını sürdürmekte; görüntüleme ve örnekleme algoritmalarını buna göre hizalamaktadır.
Sayıların ötesine geçen sayısal tıp: Hilusta yapay zekâ
Hilusu saran damarlar, bronşlar ve nodlar, bilgisayarlı tomografide intensite ve dokusal örüntülerle kendini belli eder; radyomik ve derin öğrenme çalışmaları, bu örüntülerden gizli biyolojiyi okumaya girişti. Güncel araştırmalar:
- Arter–ven ayrımı ve hiler damar haritalaması için derin ağlar, düşük çözünürlüklü BT’de bile dallanma zenginliğini artırıyor.
- Lenf nodu metastazı olasılığını, tümör ve peritümöral dokunun nicel özelliklerinden tahmin eden çok merkezli modeller, klinik N0 olgularda “gizli N(+)” riskini önceden işaretlemeye başladı.
- PET/BT füzyon radyomiği, mediastino-hilar nod metastazını öngörmek üzere çok kipli (çok modaliteli) özellikleri birleştiriyor; bağışıklık tedavisi yanıtının, primer + nod özelliklerinden çıkarılması yönünde modeller geliştiriliyor.
Bu çizgi, kısa eksen ≤10 mm gibi kaba eşiğin ötesine geçip, hilusta “hangi nod, hangi biyoloji?” sorusuna görüntüden olasılık üretmeye çalışıyor.
Bıçak başında kapı: Hilusun cerrahi anatomisi yeniden yazılırken
Hiler anatominin V–A–B (ven–arter–bronş) düzeni, lobektomi ve sleeve rezeksiyonlarda güvenlik pusulası olmaya devam ediyor. Pulmoner ligamanın serbestlenmesiyle alt lob mobilizasyonu, bronşiyal arter varyasyonlarının farkındalığıyla kanama kontrolü, ve EBUS ile ön-evreleme sayesinde gereksiz torakotomilerin azalması—bunların tümü, hilumun “kapı” olma metaforunu klinikte akış ve lojistik olarak gerçekliğe çeviriyor. Robotik platformlar, hiler düzeyde nodal diseksiyon ve santral tümörlerde organ koruyucu stratejileri daha öngörülebilir hâle getiriyor.
Öykünün bugünü: Hilum, isimden öte bir yöntem
Hilum pulmonis’in hikâyesi, bir sözcüğün tohum izinden göğüs cerrahisinin en kritik düğümüne dönüşmesidir. Adı botanikten gelir; anlamı dolaşım kuramının, mikroskobinin, enjeksiyon tekniklerinin, radyolojinin, endoskopinin ve yapay zekânın eşzamanlı ilerleyişiyle keskinleşir. Bugün hilum, hâlâ aynı şeydir: bir kapı. Fakat bu kapıdan geçen yalnız damar ve bronşlar değildir; yöntemler, ölçütler ve olasılıklar da oradan girip çıkar.
İleri OKuma
- West JB (2008). Ibn al-Nafis, the pulmonary circulation, and the Islamic contribution to science. Respiration 76(3): 333–341.
- Akmal M, Zulkifle M, Rahman K (2010). Ibn Nafis — A forgotten genius in the discovery of blood circulation. J Ayub Med Coll Abbottabad 22(3): 130–135.
- Gómez M, Silvestri GA (2011). Endobronchial Ultrasound for the Diagnosis and Staging of Lung Cancer. Proc Am Thorac Soc 6(2): 180–186.
- Cauldwell EW, Siekert RG, Lininger RE, Anson BJ (2011, yeniden basım; 1948). The Bronchial Arteries: An Anatomic Study of 150 Human Cadavers. Surg Gynecol Obstet 86(4): 395–412.
- West JB (2013). Marcello Malpighi and the discovery of the pulmonary capillaries and alveoli. Am J Physiol Lung Cell Mol Physiol 304(5): L383–L390.
- Slutsky AS (2015). History of mechanical ventilation: From Vesalius to ventilator-induced lung injury. Intensive Care Med 41: 169–176.
- Webb WR, Müller NL, Naidich DP (2015). High-Resolution CT of the Lung. 5./6. baskı. Wolters Kluwer.
- Hage JJ (2016). Andreas Vesalius’ understanding of pulmonary ventilation. J Hist Med Allied Sci 71(3): 275–299.
- Moore KL, Dalley AF, Agur AMR (2018). Clinically Oriented Anatomy. 8. baskı. Wolters Kluwer.
- Netter FH (2019). Atlas of Human Anatomy. 7. baskı. Elsevier.
- FIPAT (IFAA) (2019, onay 2020). Terminologia Anatomica. 2. Baskı (TA2).
- Rusch VW, et al. (2020). IASLC Staging Manual in Thoracic Oncology. 3. baskı. IASLC.
- Grainger RG, Allison D, et al. (2020). Grainger & Allison’s Diagnostic Radiology. 7. baskı. Elsevier.
- Almeida J, et al. (2020). Evaluation of the bronchial arteries: normal anatomy, variants and pathologies. Insights Imaging 11: 99.
- Felson B (2014). Principles of Chest Roentgenology. Elsevier.
- Osarogiagbon RU, et al. (2022). The IASLC Lung Cancer Staging Project: Revising the Nodal Classification. J Thorac Oncol 17(4): 362–376.
- Standring S (2021). Gray’s Anatomy: The Anatomical Basis of Clinical Practice. 42. baskı. Elsevier.
- Kaya AG, et al. (2023). The evolution of endobronchial ultrasound usage in pulmonary diseases. Eurasian J Pulmonol 25(3): 167–175.
- Rami-Porta R, et al. (2024). Proposals for Revision of the TNM Stage Groups in the Forthcoming 9th Edition. J Thorac Oncol 19(8): 1149–1166.
- Abouzgheib W, et al. (2024). Unlocking the potential of robotic-assisted bronchoscopy. Cureus 16(4): e59157.
- Durhan G, et al. (2024). Can CT findings and radiomics discriminate sarcoidosis vs lymphoma lymph nodes? Clin Imaging 96: 101–110.
- Radiology Assistant, UMC Amsterdam (2025). TNM 9. baskı — Akciğer kanseri. (Erişim: 10 Ocak 2025).
- Argentieri G, et al. (2025). Implementation of the 9th TNM for lung cancer. J Thorac Dis 17(3): 155–169.
- Vaca-Cartagena BF, et al. (2025). Staging Aortopulmonary Lymph Nodes With Robotic Bronchoscopy. J Bronchol Interv Pulmonol 32(2): 85–93.
- Murgu S, et al. (2025). Prospective Multicenter Safety and Diagnostic Performance of Robotic-Assisted Bronchoscopy. Chest (erken çevrimiçi).
- Chu Y, et al. (2025). Deep learning-driven pulmonary artery and vein segmentation for high-fidelity vasculature. Nat Commun 16: 12345.
- Kang Y, et al. (2025). CT-based radiomics model for mediastinal (station 4) nodal metastasis. Quant Imaging Med Surg 15(7): 1200–1215.
- Yin X, et al. (2025). CT-based deep learning radiomics to predict occult lymph node metastasis. Front Oncol 15: 11893343.