- yunancada; megas , karyon ve kytos kelimelerinden gelmektedir.(Bkz; Mega–karyo–cyt)
- 70- 120 mikro metre büyüklüğündedir kemik iliğinde bulunur.
- megakaryoblastlardan farklılaşmışlardır ve thrombocytlere dönüşürler.


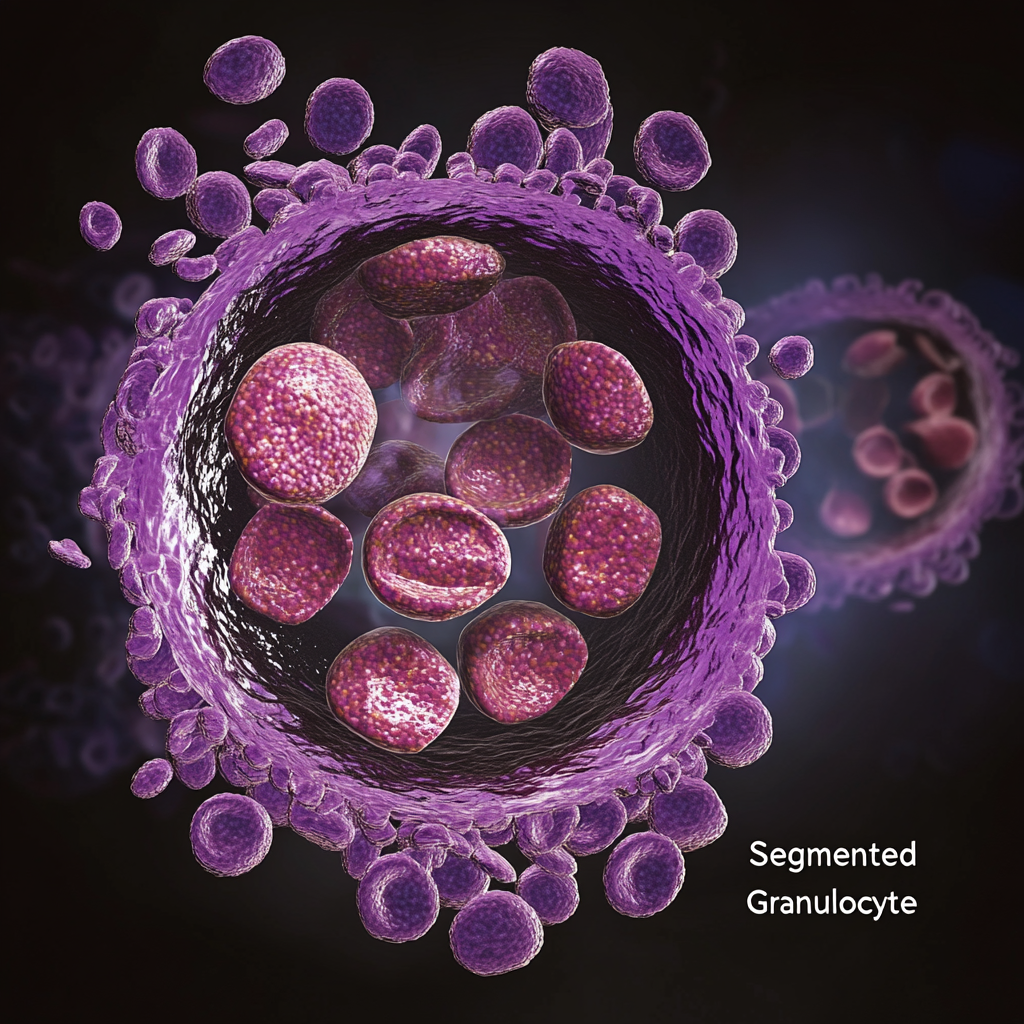
Segmentli granülosit
“Segmentli granülosit” terimi bu hücrelerin iki temel özelliğinden türetilmiştir:
- “Segmentli” olgun nötrofillerdeki çekirdeğin ayırt edici şeklini ifade eder. Çekirdek 2-5 lob veya segmente bölünerek polimorfonükleer bir görünüm kazanır. Bu segmentasyon nötrofil olgunlaşmasının son aşamalarında, çekirdeğin bant şeklinden tamamen segmentli bir forma geçişiyle gerçekleşir.
- “Granülosit”, hücrenin sitoplazmasında spesifik granüllerin varlığını tanımlar. Bu granüller çeşitli antimikrobiyal ajanlar, enzimler ve hücrenin bağışıklık fonksiyonu için çok önemli olan diğer maddeleri içerir.
“Nötrofil” teriminin kendisi hücrenin boyanma özelliklerinden gelmektedir. Hematoksilen ve eozin (H&E) boyalarına maruz kaldıklarında nötrofiller, bazofillerin koyu mavisi veya eozinofillerin parlak kırmızısının aksine nötr pembe bir renk alır.
Bu nedenle, “segmentli granülosit” tam terimi, hücrenin ayırt edici nükleer morfolojisini ve sitoplazmik granüllerin varlığını doğru bir şekilde tanımlar; her ikisi de olgun nötrofillerin tanımlayıcı özellikleridir.
Bölümlü Granülositler
Granülopoezde Tanım ve Rol
Bölümlü granülositler, polimorfonükleer lökositler (PMN’ler) olarak da bilinir, granülosit gelişiminin (granülopoez) son, olgun aşamasını temsil eder. İnce kromatin filamentleriyle birbirine bağlanan 2-5 ayrı loba bölünmüş bir çekirdek ile karakterize edilirler. Bu hücreler periferik kanda en bol bulunan granülositlerdir ve toplam lökositlerin %45-70’ini oluştururlar, nötrofiller baskın alt tiptir (dolaşımdaki bölümlü granülositlerin ~%95’i).
Gelişimsel Bağlam (Granülopoez)
Granülopoez kemik iliğinde meydana gelir ve şu aşamalardan geçer:
- Miyeloblast → 2. Promiyelosit → 3. Miyelosit → 4. Metamiyelosit → 5. Bant (Çubuk) hücresi → 6. Bölümlü granülosit.
- Bölümlü granülositler “bant hücresi” aşamasını (çubuk çekirdekli) takip eder ve dolaşıma salınır.
- G-CSF (Granülosit Koloni Uyarıcı Faktör) gibi sitokinler tarafından düzenlenen bu süreç ~10–14 gün sürer.
- Yaşam süresi: Dokulara göç etmeden önce 6–10 saat dolaşımda kalır ve 1–4 gün yaşar.
Morfoloji
Boyut: 9–16 μm çapında.
Çekirdek:
- 2–5 lob (ortalama: 3), nükleer filamentlerle birbirine bağlanmıştır.
- Kromatin, olgunlaşma nedeniyle yoğun bir şekilde kümelenmiştir (piknotik).
Sitoplazma:
- Nötrofiller: Enzimler (örn. alkalin fosfataz, lizozim) ve antimikrobiyal proteinler içeren ince, soluk pembe granüller (spesifik/ikincil granüller). Gelişimin erken dönemlerinde oluşan azurofilik (birincil) granüller devam eder.
- Eozinofiller: Büyük, parlak turuncu-kırmızı granüller (ana bazik protein açısından zengin).
- Bazofiller: Kaba, koyu mavi granüller (heparin, histamin içerir).
Histolojik Tanımlama
- Boyama: Periferik kan yaymalarında Wright-Giemsa boyası.
Temel Özellikler:
- Nötrofiller: Soluk sitoplazmaya sahip çok loblu çekirdek (Şekil 1A).
- Eozinofiller: Belirgin turuncu granüllere sahip iki loblu çekirdek.
- Bazofiller: Yoğun mavi granüller nedeniyle belirsiz çekirdek.
- Hipersegmentasyon: ≥5 nükleer lob, B12 vitamini/folat eksikliği veya yaşlanmayla ilişkilidir.
Klinik Önem
Enfeksiyon/İltihaplanma:
- Bakteriyel enfeksiyonlarda artan nötrofiller (nötrofili).
- “Sola kayma”: Şiddetli enfeksiyonlarda olgunlaşmamış formların (bantlar) varlığı.
- “Sağa kayma”: Megaloblastik anemide hipersegmente nötrofiller.
Otoimmün Bozukluklar ve Alerjiler:
- Paraziter enfeksiyonlarda veya astımda eozinofili.
- Kronik miyeloid lösemide (KML) veya aşırı duyarlılık reaksiyonlarında bazofili.
Nötropeni: Düşük nötrofil sayısı (<1,5 × 10⁹/L), enfeksiyon riskini artırır.
Fonksiyonel Roller
- Nötrofiller: Patojenleri fagosite eder, nötrofil ekstraselüler tuzaklarını (NET’ler) serbest bırakır ve sitokinler aracılığıyla bağışıklık hücrelerini toplar.
- Eozinofiller: Parazitlerle savaşır; alerjik tepkileri düzenler.
- Bazofiller: Anafilakside histamin salgılar; anti-helmint bağışıklığına katılır.
Laboratuvar Değerlendirmesi
- Tam Kan Sayımı (CBC): Granülosit alt kümelerini niceliksel olarak belirler.
- Ayırıcı Yayma: Nükleer segmentasyonu, granülasyon desenlerini ve anormallikleri (örneğin sepsiste toksik granüller) belirler.
Patolojik Hususlar
- Reaktif Değişiklikler: Toksik granülasyon, Döhle cisimcikleri (mavi sitoplazmik inklüzyonlar) veya şiddetli enfeksiyonlarda vakuolleşme.
- Displastik Değişiklikler: Miyelodisplastik sendromlarda hipogranülarite veya psödo-Pelger-Huët anomalisi (iki loblu çekirdekler).
Şekil Referansları
Bölümlü Granülositler için Şekil Referansları
Bölümlü granülositlerin görsel olarak tanımlanması için, şu standart histoloji/hematoloji kaynaklarına bakın:
Hematoloji Atlası (WHO Sınıflandırması)
- Şekil: Bölümlü çekirdeğe sahip nötrofil (genellikle granülosit olgunlaşması üzerine bölümlerde etiketlenmiştir).
- Kaynak: Kumar & Clark’ın Klinik Tıp veya Robbins Temel Patoloji.
Wright-Giemsa Boyalı Kan Yayması Görüntüleri
Çevrimiçi Veritabanları:
- CellWiki – “Bölümlü nötrofil” veya “polimorfonükleer lökosit” ifadesini arayın.
- Wikimedia Commons – Kan hücrelerinin yüksek çözünürlüklü görüntüleri.
- CDC’nin Halk Sağlığı Görüntü Kütüphanesi (PHIL) – “nötrofil” veya “granülosit” arayın.
Eğitim Ders Kitapları
- Metin: Barbara J. Bain (Wiley-Blackwell) tarafından yazılan Kan Hücreleri: Pratik Bir Kılavuz.
- Şekil: Bölüm 3 (Normal Kan Hücreleri) segmentli nötrofillerin, eozinofillerin ve bazofillerin etiketli görüntülerini içerir.
- Atlas: Irma Pereira ve diğerleri tarafından yazılan Periferik Kan Atlası.
Granülosit Tanımlaması için Boyama Protokolleri
1. Wright-Giemsa Boyası (Kan Yaymaları için Standart)
Amaç: Granülosit tiplerini nükleer morfoloji ve sitoplazmik granüllere göre ayırır.
Adımlar:
İnce Kan Yayması Hazırlayın:
- Yaymayı tamamen hava ile kurutun.
Sabitleme:
- Lamı 1-2 dakika boyunca mutlak metanol ile doldurun.
- Tekrar hava ile kurutun.
Boyama:
- Yaymayı 3-5 dakika boyunca Wright-Giemsa boyası (önceden karıştırılmış solüsyon) ile örtün.
- Eşit hacimde fosfat tamponu (pH 6,8) ekleyin ve nazikçe karıştırın. 10-15 dakika boyunca boyayın.
Durulama:
- Yayma pembe-mavi görünene kadar damıtılmış suyla yıkayın.
Ayrımlaştırma (gerekirse):
- Fazla boyayı çıkarmak için kısa bir süre %0,1 asetik asit içine daldırın (1-2 saniye).
Havada Kurutun ve Monte Edin:
- Yağ daldırma altında inceleyin (1000x büyütme).
Sonuçlar:
- Nötrofiller: İnce leylak granüllü soluk pembe sitoplazma; çok loblu çekirdek (3–5 segment).
- Eozinofiller: Parlak turuncu-kırmızı granüller; iki loblu çekirdek.
- Bazofiller: Koyu mavi-siyah granüller; belirsiz çekirdek.
2. May-Grünwald-Giemsa (MGG) Boyası
Amaç: Granülositlerde granül görünürlüğünü artırır.
Adımlar:
- Havada kurutulmuş yaymaları 3–5 dakika boyunca May-Grünwald boyasında (metanol bazlı) sabitleyin.
- Tamponla (pH 6.8) seyreltin ve 10-15 dakika boyayın.
- Durulayın, kurutun ve monte edin.
Avantajı: Wright-Giemsa’ya kıyasla granül yapısının daha iyi korunması.
3. Granülosit Alt Tipleri için Özel Boyalar
Eozinofiller:
- Luxol Fast Blue: Eozinofil granüllerini vurgular.
- İmmünohistokimya (CD125): Eozinofil-spesifik belirteçleri belirler.
Bazofiller:
- Toluidin Mavisi: Bazofil granüllerinin metakromatik boyanması (mor-kırmızı).
- Astral Mavi: Bazofil granüllerindeki heparini boyar.
Nötrofiller:
- Miyeloperoksidaz (MPO) Boyası: Birincil granülleri (kahverengi çökelti) doğrular.

4. Hipersegmentasyon Değerlendirmesi
Boya: Wright-Giemsa.
Kriterler:
- Hipersegmente Nötrofil: ≥5 nükleer lob (megaloblastik anemide görülür).
- Normal segmentasyonla karşılaştırın (2–5 lob).
Boyama Sorun Giderme
- Aşırı renk açma: Çekirdek soluk görünür; durulama süresini azaltın.
- Az boyama: Granüller görünmez; boyama süresini artırın.
- Çökeltiler: Kullanmadan önce boyayı filtreleyin.
Mikroskobik Değerlendirme İçin Önemli Notlar
- Bant ve Segmentli Nötrofil:
- Bant hücre: Çekirdek U şeklindedir ve daralma yoktur.
- Bant hücre: Filamentlerle birbirine bağlı loblara belirgin bir şekilde ayrılmıştır.
- Patolojik Bulgular:
- Toksik Granülasyon: Koyu renkli iri granüller (sepsis, inflamasyon).
- Döhle Cisimcikleri: Mavi sitoplazmik inklüzyonlar (enfeksiyon, yanıklar).
Keşif
Bölümlere ayrılmış granülositlerin keşfi, 19. yüzyılın sonlarında mikroskopi ve boyama tekniklerindeki ilerlemelerle başlamıştır. Alman bir doktor ve bilim insanı olan Paul Ehrlich, kömür katranı boyaları kullanarak kan hücrelerini ayırt etmek için yöntemler geliştirerek çok önemli bir rol oynamıştır. 1879-1880 yılları arasında yayınlanan çalışması, nötrofiller de dahil olmak üzere çeşitli lökositlerin tanımlanmasına olanak sağlamıştır. Ehrlich bu hücreleri “polimorf çekirdekli hücreler” olarak tanımlamış, parçalı çekirdeklerine ve nötr olarak boyanan granüllerin varlığına dikkat çekmiştir. Bu, nötrofillerin ayrı bir hücre tipi olarak ilk kez net bir şekilde tanınmasına işaret ederek hematoloji ve immünolojinin temelini attı.
Ehrlich’in teknikleri sadece nötrofilleri tanımlamak için değil, aynı zamanda lösemiler ve anemiler gibi kan hastalıklarının sınıflandırılmasını sağlamak için de önemliydi. Yaklaşımı, hücre tiplerini ayırt etmek için asidik, bazik ve nötr boyalar kullanmayı içeriyordu ki bu, doktora tezinde mast hücrelerini keşfetmesinin doğrudan bir devamıydı. Bu çalışma, Paul Ehrlich Wikipedia adresinde bulunanlar gibi tarihsel anlatımlarda ayrıntılı olarak açıklanmıştır.
İşlevsel İçgörüler: Fagositozun Rolü
Ehrlich’in morfolojik tanımlamasının ardından, nötrofillerin işlevsel rolü Élie Metchnikoff’un çalışmalarıyla ortaya çıkmaya başlamıştır. 1884 yılında Rus bir biyolog olan Metchnikoff, hücrelerin bakteri gibi yabancı partikülleri yuttuğu ve sindirdiği bir süreç olan fagositozu tanımlamıştır. Gözlemleri, o zamanlar özel olarak adlandırmamış olsa da, şu anda nötrofil olarak tanıdığımız hücreleri içeriyordu. Metchnikoff’un çalışması, fagositozu temel bir bağışıklık mekanizması olarak ortaya koyması ve nötrofillerin de bu sürece dahil olan birincil hücreler arasında yer alması nedeniyle çığır açıcı olmuştur. Bu durum, Metchnikoff’un 1880’lerde “fagosit” terimini ortaya attığını belirten Phagocytosis Britannica gibi kaynaklarda belirtilmektedir.
Metchnikoff’un keşfi, daha sonra kendisine Ehrlich ile birlikte 1908 Nobel Fizyoloji veya Tıp Ödülü’nü kazandıran doğuştan gelen bağışıklık üzerine yaptığı daha geniş araştırmanın bir parçasıydı. Frontiers Immunology] (https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2012.00174/full) gibi çalışmalarda belirtildiği üzere, gözlemleri nötrofillerin mikroorganizmalara karşı “başlıca savaşçılar” olduğunu vurgulamıştır.
Resmi Tanınma ve Nobel Ödülü
Nötrofillerin bağışıklık sistemindeki önemi, 1908 yılında Paul Ehrlich ve Élie Metchnikoff’un bağışıklık konusundaki çalışmaları nedeniyle Nobel Fizyoloji veya Tıp Ödülü’ne layık görülmesiyle resmen tanınmıştır. Ehrlich’in katkıları arasında beyaz kan hücrelerinin tanımlanması ve sınıflandırılması yer alırken, Metchnikoff’un fagositoz üzerine yaptığı çalışmalar nötrofillerin işlevsel rolünü anlamamızı sağlamıştır. Bu dönüm noktası, Nobel Ödülü Ehrlich ve Nobel Ödülü Metchnikoff‘da belgelendiği üzere, nötrofillerin immünolojik araştırmalardaki yerini sağlamlaştırmıştır.
Sonraki Gelişmeler ve Araştırmalar
İlk keşif ve işlevsel anlayış 19. yüzyılın sonları ve 20. yüzyılın başlarında yerleşmiş olsa da, nötrofiller üzerine yapılan araştırmalar gelişmeye devam etmiştir. 1930’larda, nötrofillerdeki solunum patlaması keşfedilmiştir; bu, mikrobisidal aktiviteleri için çok önemli olan fagositoz sırasında artan oksijen tüketimini içeren bir süreçtir. Bu durum ASH Blood Phagocytes gibi tarihsel incelemelerde belirtilmiştir.
- yüzyılın ortalarında, mikroskopi ve biyokimyadaki gelişmeler, spesifik granüllerin ve enzimler ve antimikrobiyal proteinler gibi içeriklerinin tanımlanması da dahil olmak üzere nötrofil yapısının daha derinlemesine anlaşılmasını sağlamıştır. 20. yüzyılın sonlarında, PMC Neutrophil Advances gibi modern incelemelerde tartışıldığı gibi, nötrofil aktivasyonu ve fagositozda yer alan spesifik reseptörleri ve sinyal yollarını ortaya çıkaran moleküler biyoloji tekniklerinin uygulanmasına tanık oldu.
- yüzyılda yapılan araştırmalar, nötrofil fonksiyonunun karmaşıklığını ortaya çıkarmış, enflamasyon, immün modülasyon ve kanser ve otoimmün bozukluklar gibi hastalık patogenezindeki rollerini ortaya koymuştur. Bu durum Nature Neutrophil Diversity gibi son çalışmalarda ayrıntılı olarak açıklanmaktadır.
İleri Okuma
- Ehrlich, P. (1879). Beiträge zur Kenntniss der Anilinfärbungen und ihrer Verwendung in der mikroskopischen Technik. Archiv für mikroskopische Anatomie, 16, 263–277.
- Ehrlich, P. (1880). Methodologische Beiträge zur Physiologie und Pathologie der verschiedenen Formen der Leukocyten. Zeitschrift für klinische Medizin, 1, 553–606.
- Schridde, H. (1908). Über die Entwicklung und Bedeutung der neutrophilen Leukocyten im menschlichen Organismus. Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medizin, 191, 363–408.
- Maximow, A. A. (1909). Über die Morphologische Grundlage der Blutbildenden Gewebe und ihre Bedeutung für die Frage der Blutbildung. Folia Haematologica, 8, 125–199.
- Arneth, J. (1904). Über die quantitative Untersuchung der verschiedenen kernigen Formen der neutrophilen Leukocyten im normalen Blut und bei Leukämie. Zeitschrift für klinische Medizin, 54, 511–534.
- Schilling, V. (1924). Das Verhalten der neutrophilen Kernformen bei Infektionskrankheiten. Zeitschrift für die gesamte experimentelle Medizin, 41, 436–458.
- Fliedner, T. M., & Steinbach, K. (1958). Zellkinetische Untersuchungen über die Entwicklung segmentkerniger Granulozyten. Blut, 4(4), 202–218.
Çubuk çekirdekli granülosit
Granülosit olgunlaşmasının çubuk şeklinde, parçalanmamış bir çekirdekle karakterize edilen bir aşamasıdır. (bkz: granulosit )
Granülopoez
Çubuk çekirdekli granülositler granülopoezin sondan bir önceki aşamasıdır. Granülopoez sıralamasında metamiyelositlerden sonra ve segment çekirdekli granülositlerden önce yer alırlar ve hem kemik iliğinde hem de periferik kanda bulunurlar. Burada, çubuk çekirdekli granülositler normalde lökositlerin %3’üne kadar bir paya sahip olabilir.

Morfoloji
Çubuk çekirdekli granülositlerin çekirdeği parçalanmamış ve at nalı şeklinde veya S kıvrımlıdır, bu da bu hücre formuna adını verir. Sitoplazma spesifik granülasyonlar içerir.

Klinik
Çubuk çekirdekli granülositlerin artış göstermesi, diferansiyel kan tablosunda sola kayma olarak adlandırılan durumun bir özelliğidir ve bir enfeksiyonun varlığına işaret eder.

Vezikül
Latincede; vesicula kelimesinden gelir. küre şeklindeki, yuvarlak hücre yapısıdır. yaklaşık 50-100 nm çapı vardır. elektromikroskop ile alınan bir kısımdan, yuvarlak veya oval olarak belirlenebilir. hücre zarına benzer basit bir yapı ile çevrelenmiştir.
Kesecik nedir ve işlevi nedir?
Veziküller, bir hücre içinde, taşıma, kaldırma kuvveti kontrolü ve enzim depolamada yer alan bir lipit çift tabaka ile çevrelenmiş sıvıdan oluşan küçük yapılardır.
Vezikülün basit tanımı nedir?
Bir zar tarafından oluşturulan ve sıvı ile dolu küçük bir kese. Hücrelerin içindeki veziküller maddeleri hücre içine veya dışına taşır.
Lizozom ile vezikül arasındaki fark nedir?
Vezikül, içeriği hücre tarafından sindirildiğinde lizozom olarak bilinir. Ekzosistoz, hücresel içeriği hücre dışına salan membran taşıma sürecidir.
Vezikül örneği nedir?
Kabarcıklar. Kesecik, cilt üzerinde içi sıvı dolu küçük bir kabarcıktır.
Kesecik hangi organeldir?
Veziküller, hücrelerde bulunan küçük hücre organelleridir. Bu organeller, maddeleri depolayan ve bir hücreden diğerine ve bir hücrenin bir bölümünden diğerine taşıyan küçük, zarla çevrili keselerdir. Bir hücrenin en önemli parçalarından biridir.
Hangi süreç vezikül oluşturur?
Veziküller, salgılama (ekzositoz), alım (endositoz) ve plazma membranı içinde materyallerin taşınması süreçleri sırasında doğal olarak oluşur. Alternatif olarak, yapay olarak hazırlanabilirler, bu durumda lipozom olarak adlandırılırlar (lizozomlarla karıştırılmamalıdır).
Bir vezikül hücre içinde nasıl hareket eder?
Veziküller ilk olarak, vezikül ve hedef membranları yakınlaştırmaya yardımcı olan bağlayıcı proteinlerle (A) etkileşime girer. SNARE’ler daha sonra etkileşime girebilir ve eşleşirlerse, birbirlerinin etrafında dönmeye başlarlar ve döndükçe iki zarı birbirine yaklaştırırlar.
Bir hücrenin hangi kısımları vezikül oluşturabilir?
Materyalin hücre içindeki hareketi için son derece önemli olan veziküller, endoplazmik retikulum ve Golgi kompleksi gibi organellerden membran tomurcuklanmasıyla oluşur ve motor proteinler tarafından hücre iskeleti elemanları boyunca hareket ettirilebilir.
Hangi organizmalar veziküllere sahiptir?
Hücre dışı veziküller: Ekstraselüler veziküller hücrenin dışında bulunur ve hücre içine taşınmak için kullanılır. Bu tip veziküller hem ökaryotik hem de prokaryotik hücrelerde görülür. Gaz kesecikleri: Bunlar bakterilerde bulunur ve hücreye kaldırma kuvveti sağlar.
Kesecikler DNA içerir mi?
Hem bakteriyel hem de memeli EV’leri üzerine yapılan çalışmalarda DNA’nın veziküler “yüzeyom “un bir bileşeni olduğu bildirilmiştir. Bakterilerde, membran veziküllerinin (ökaryotik L-EV’lere benzer) veziküler yüzeyde DNA taşıdığı bulunmuştur
Bir hücrede veziküllerin üç işlevi nedir?
Veziküller, çeşitli işlevleri yerine getiren küçük hücresel kaplardır.
- Molekülleri hareket ettirmek,
- maddeleri salgılamak,
- materyalleri sindirmek veya hücre içindeki basıncı düzenlemek için kullanılabilirler.
Veziküllerin ve vakuollerin işlevi nedir?
Veziküller ve vakuoller, depolama ve taşıma işlevi gören zara bağlı keselerdir.
Veziküller eksikse ne olur?
- Salgılama mümkün olmaz, dolayısıyla materyal birikimi meydana gelir
- Hücredeki diğer organellere zarar verir.
Vezikül insan vücudunda nerede bulunur?
Sitoplazmada endoplazmik retikulumun yanında ve hücre çekirdeğinin yakınında bulunur.
Klinik
Ciltteki veziküllere ne sebep olur?
Kabarcık veya veziküler lezyon olarak da bilinen vezikül, sıvı cildin üst tabakasının (epidermis) altında sıkışarak kabarcık benzeri bir kese oluşturduğunda oluşur. Cilt veziküllerine suçiçeği, egzama, cilt tahrişi veya alerjiye bağlı döküntü, zona, sürtünme, bakteriyel enfeksiyonlar ve herpes simpleks neden olabilir.
Veziküller ciltte neye benzer?
Veziküller cildinizde görülebilen küçük sıvı dolu keseler veya kabarcıklardır. Bu keselerin içindeki sıvı berrak, beyaz, sarı veya kanla karışık olabilir. Veziküller 5 mm’den (1/2 cm) küçük sıvı dolu lezyonlardır. Sıvı dolu lezyon 0,5 mm’den büyükse buna bül denir.
Bir vezikül nasıl patlatılır?
Bir kişi kabarcığı patlatmaya karar verirse, enfeksiyonu önlemek için elinden geleni yapmalıdır. AAD’ye göre, bir kişi bir kabarcığı düzgün bir şekilde boşaltmak için aşağıdaki adımları izleyebilir: Küçük, ince bir iğneyi ispirto veya kaynar su ile sterilize edin. Kabarcığı kenarından dikkatlice delin ve bir miktar sıvı boşaltın.
Vezikül ve bül arasındaki fark nedir?
Vezikül, çapı 1 em’den küçük, içi sıvı dolu, kabarık deri lezyonu olarak tanımlanır. Lezyonun çapı 1 em’den büyük olduğunda bül olarak adlandırılır. Bir vezikül veya bül berrak sıvı içerir. Bir vezikül veya bül daha ziyade irin içerir.
base
yunancada; çıkış, esas, kök veya temel anlamlarına gelir.
Asit
AHA *ak– “keskin ol, bir noktaya yüksel (dışarı), delin.” → Latince acere “Ekşi olmak, keskin olmak,” → acidus “ekşi, keskin, nahoş” → 16. yy. Fransızcada acide →1620’lerde “Sirke tadı,”
Asitler genel olarak sulu çözeltide 7 pH değerine neden olan maddeler olarak anlaşılır. Genellikle asit-baz reaksiyonlarında reaksiyon gösterirler ve bazlarla nötralize edilebilirler.

İngilizcede figüratif kullanım 1775’ten itibaren; 1916’dan itibaren yoğun olarak renklere uygulandı; bir asit boyası, asit banyosunu(1888) içerir.
Asit testi, nitrik asit uygulamasıyla altını benzer metallerden ayırmanın hızlı bir yolu olan Amerikan İngilizcesi 1881’dir.
Asit yağmuru ‘atmosferik kirliliğin neden olduğu yağmurda yüksek asitlik’ ilk olarak 1859’da İngiltere referans alınarak kaydedildi.
Tartarik asitle tatlandırılmış bir tür sert şeker şekeri olarak asit damlası 1835 yılına kadar, ‘pastil’ anlamında damla ile.

Asidin tanımı yıllar içinde değişti. Çeşitli olası tanımlar aşağıda gösterilmiştir.
T lenfositleri
- T harfi, timus için vardır. Timus, hücrelerin farklılaşma yeridir. (bkz: lenfosit)
 Spesifik immun systemin bir parçasıdır.
Spesifik immun systemin bir parçasıdır.
Hücresel Tip Bağışıklık Yanıtı: Kilit Oyuncular ve Mekanizmalar
Bağışıklık sistemi, vücudu bakteriler, virüsler ve parazitler gibi zararlı patojenlere karşı savunmak için birlikte çalışan karmaşık bir hücre, doku ve molekül ağıdır. Bağışıklık yanıtının önemli bir yönü, enfekte veya anormal hücrelerle doğrudan mücadele eden ve onları ortadan kaldıran özelleşmiş hücreleri içeren hücresel tip bağışıklık yanıtıdır. Bu makale, ilgili anahtar hücreler ve etki mekanizmaları dahil olmak üzere hücresel tip bağışıklık tepkisine ayrıntılı bir genel bakış sağlamayı amaçlamaktadır.
Hücresel Tip Bağışıklık Yanıtında Yer Alan Anahtar Hücreler:
T Lenfositleri (T Hücreleri): T hücreleri hücresel tip bağışıklık yanıtında merkezi bir rol oynar. Kemik iliğinde üretilirler ve timus bezinde olgunlaşırlar. T hücreleri sitotoksik T hücreleri (CD8+), yardımcı T hücreleri (CD4+) ve düzenleyici T hücreleri (Treg) dahil olmak üzere çeşitli alt tiplere ayrılır. Her alt tipin bağışıklık yanıtında farklı işlevleri vardır.
Sitotoksik T Hücreleri: Sitotoksik T hücreleri, hücre ölümüne neden olan perforin ve granzimler gibi toksik maddeler salgılayarak enfekte veya anormal hücreleri tanır ve yok eder.
Yardımcı T Hücreleri: Yardımcı T hücreleri diğer bağışıklık hücrelerine destek ve koordinasyon sağlar. Makrofajlar ve B hücreleri gibi diğer bağışıklık hücrelerinin işlevlerini aktive eden ve geliştiren sitokinler salgılarlar.
Düzenleyici T Hücreleri: Düzenleyici T hücreleri, aşırı bağışıklık tepkilerini bastırarak ve otoimmün reaksiyonları önleyerek bağışıklık homeostazının korunmasına yardımcı olur.
Doğal Öldürücü (NK) Hücreler: NK hücreleri, doğuştan gelen bağışıklık yanıtında çok önemli bir rol oynayan bir lenfosit türüdür. Virüsle enfekte olmuş hücreleri ve tümör hücrelerini doğrudan öldürebilirler. NK hücreleri, yüzey moleküllerindeki değişiklikleri tanıyarak ve sitotoksik granüllerin salınımı yoluyla hücre ölümünü indükleyerek anormal hücreleri tanımlar.
Hücresel Tip Bağışıklık Yanıtının Mekanizmaları:
Hücre Aracılı Sitotoksisite: Sitotoksik T hücreleri ve NK hücreleri etkilerini hücre aracılı sitotoksisite yoluyla gösterirler. Hücre yüzeyinde sunulan spesifik antijenleri tespit ederek enfekte veya anormal hücreleri tanırlar. Bu hücreler aktive olduktan sonra, hedef hücrelerde apoptozu indükleyen perforin ve granzimler gibi sitotoksik moleküller salgılar.
Sitokin Salınımı: T hücreleri, özellikle de yardımcı T hücreleri, çeşitli sitokinler salgılayarak bağışıklık yanıtlarının düzenlenmesinde hayati bir rol oynar. Sitokinler, bağışıklık hücresi aktivasyonunu, çoğalmasını ve farklılaşmasını düzenleyen küçük sinyal proteinleridir. Diğer bağışıklık hücrelerinin aktivitesini modüle eder, enflamatuar hücreleri enfeksiyon bölgesine toplar ve sitotoksik hücrelerin öldürme kapasitesini artırırlar.
Antijen Sunumu: Dendritik hücreler, makrofajlar ve B hücreleri dahil olmak üzere antijen sunan hücreler (APC’ler) hücresel bağışıklık yanıtında çok önemli bir rol oynar. Patojenlerden veya anormal hücrelerden türetilen antijenleri yakalayıp işler ve T hücrelerine sunarlar. Bu süreç T hücrelerini aktive ederek antijenlere karşı bir bağışıklık yanıtı başlatır.
Hafıza Yanıtı: Belirli bir patojen veya antijene ilk maruziyetin ardından, T hücreleri ve B hücreleri immünolojik hafıza geliştirebilir. Hafıza T hücreleri ve hafıza B hücreleri, daha önce karşılaşılan antijenler hakkında bilgi tutarak, aynı patojene yeniden maruz kalındığında daha hızlı ve daha güçlü bir bağışıklık tepkisi verilmesini sağlar.
Hücresel tip bağışıklık yanıtı, bağışıklık sisteminin patojenlere ve anormal hücrelere karşı savunmasının temel bir bileşenidir. Sitotoksik T hücreleri, yardımcı T hücreleri ve düzenleyici T hücrelerinin yanı sıra NK hücreleri de dahil olmak üzere T hücreleri bu yanıtta kritik rol oynar. Bu hücreler, enfekte veya anormal hücrelerle mücadele etmek için hücre aracılı sitotoksisite, sitokin salınımı, antijen sunumu ve hafıza yanıtı gibi mekanizmaları kullanır. Hücresel tip bağışıklık yanıtının anlaşılması, bağışıklık sisteminin karmaşık işleyişine ışık tutmaya ve çeşitli hastalıklar için hedefe yönelik immünoterapilerin geliştirilmesine yardımcı olur.
Tarih
T hücreleri olarak da bilinen T lenfositlerin tarihi uzun ve büyüleyici bir tarihtir. T hücreleri, bağışıklık sisteminde hayati bir rol oynayan bir tür beyaz kan hücresidir. Bakteriler, virüsler ve parazitler gibi yabancı istilacıları tanımaktan ve onlara saldırmaktan sorumludurlar.
İlk T hücreleri 1960’ların başında Toronto Üniversitesi’nde James Gowans liderliğindeki bir grup bilim insanı tarafından keşfedilmiştir. Gowans ve meslektaşları farelerin bağışıklık sistemini incelerken bazı beyaz kan hücrelerinin kan dolaşımından timüs bezine gidebildiğini fark ettiler. Timus bezi, göğüste bulunan ve T hücrelerinin gelişiminden sorumlu olan küçük bir organdır.
Gowans ve meslektaşları timüs bezinde bulundukları için bu hücrelere “T hücreleri” adını verdiler. Ayrıca T hücrelerinin yabancı istilacılara karşı bağışıklık tepkisinde rol oynadığını keşfettiler.
Keşiflerinden bu yana geçen yıllar içinde T hücreleri üzerinde kapsamlı çalışmalar yapıldı. Bilim insanları T hücrelerinin iki ana türe ayrıldığını öğrendi: yardımcı T hücreleri ve sitotoksik T hücreleri.
Yardımcı T hücreleri: Yardımcı T hücreleri, B hücreleri ve doğal öldürücü hücreler gibi diğer bağışıklık hücrelerini aktive ederek vücudun enfeksiyonla savaşmasına yardımcı olur.
Sitotoksik T hücreleri: Sitotoksik T hücreleri enfekte hücreleri ve tümör hücrelerini öldürür.
T hücreleri bağışıklık sisteminin önemli bir parçasıdır. Vücudu enfeksiyon ve hastalıklardan korumada hayati bir rol oynarlar.
İşte T hücrelerinin tarihindeki bazı önemli olaylar:
1960s: James Gowans ve meslektaşları T hücrelerini keşfeder.
1970s: Bilim insanları iki ana T hücresi türünü tanımladı: yardımcı T hücreleri ve sitotoksik T hücreleri.
1980s: Bilim insanları T hücrelerinin otoimmün hastalıklarda rol oynadığını keşfeder.
1990s: Bilim insanları kanser için T hücresi tedavileri geliştirir.
2000s: Bilim insanları T hücrelerini incelemeye ve çeşitli hastalıklar için yeni tedaviler geliştirmeye devam ediyor.
Günümüzde T hücreleri modern tıbbın önemli bir parçasıdır. Kanser, otoimmün hastalıklar ve HIV/AIDS dahil olmak üzere çeşitli hastalıkların tedavisinde kullanılırlar.
T hücreleri, bağışıklık sisteminde hayati bir rol oynayan büyüleyici ve karmaşık bir hücre grubudur. Keşfedilmeleri tıpta büyük ilerlemelere yol açmış ve sayısız hayatın kurtarılmasına yardımcı olmuştur.
Kaynakça
- Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 9th edition. Philadelphia, PA: Elsevier; 2017.
- Janeway CA Jr, Travers P, Walport M, et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
- Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002.
B lenfositleri
B-lenfositlerindeki “B” gerçekten de kuşlarda B hücrelerinin ilk kez tanımlandığı bir organ olan bursa of Fabricius’tan kaynaklanmaktadır. Bu organ kloak yakınında bulunur ve kuş türlerinde B-lenfositlerinin gelişimi ve olgunlaşmasında çok önemli bir rol oynar.

B-Lenfositlerinin Kökeni ve İsimlendirilmesi
- Fabricius’un bursası: 1950’lerde ve 1960’larda, kuşlar, özellikle de tavuklar üzerinde yapılan çalışmalar, bağışıklık hücrelerinin, adını İtalyan anatomist Hieronymus Fabricius‘tan alan Fabricius bursası olarak bilinen bir organda olgunlaştığını ortaya koymuştur. Bu bağışıklık hücreleri daha sonra kökenlerini belirtmek için B-lenfositleri veya B hücreleri olarak adlandırıldı.
- İnsan Bağlamı ve Kemik İliği: İnsanlar da dahil olmak üzere memelilerde Fabricius bursası mevcut değildir. Bunun yerine, B-lenfositleri kemik iliğinde gelişir ve olgunlaşır ve “B” bazen bu bağlamda “kemik iliği” anlamına gelecek şekilde yorumlanır. Bununla birlikte, “B hücresi” terimi kuş araştırmalarında yalnızca Fabricius bursasından kaynaklandığından, bu yeniden yorumlama esas olarak anlaşılması için uygundur.
Bağışıklık Sisteminde Gelişim ve İşlev
B-lenfositleri adaptif bağışıklık sisteminin merkezi bir bileşenidir ve burada oldukça özelleşmiş bir role sahiptirler:
Olgunlaşma ve Farklılaşma:
- B hücreleri kemik iliğinde (memelilerde) veya Fabricius bursasında (kuşlarda) olgunlaşır ve titiz seçim süreçlerinden geçer. Bu süreç, B hücrelerinin yabancı antijenleri tanıyabilmesini sağlarken, otoimmün tepkileri önleyen kendi antijenlerinden kaçınmasını sağlar.
- B hücreleri olgunlaştıktan sonra kanda ve lenf düğümleri ve dalak gibi lenfoid dokularda dolaşarak antijenlerle karşılaşmaya hazır hale gelirler.
Antijen Tanıma ve Bağışıklık Yanıtındaki Rolü:
- B hücreleri, yüzeylerinde her biri tek bir antijene özgü benzersiz B hücre reseptörleri (BCR’ler) ile donatılmıştır. Bir B hücresi, BCR’siyle eşleşen bir antijenle karşılaştığında, antijene bağlanarak B hücresinin aktive olması ve çoğalması için sinyal verir.
- Aktivasyonun ardından B hücreleri plazma hücrelerine veya bellek B hücrelerine farklılaşır:
- Plazma Hücreleri: Bunlar antikor üreten fabrikalardır ve karşılaşılan antijene özgü büyük miktarlarda antikor (immünoglobülin) salgılarlar. Antikorlar kanda ve lenfte dolaşarak antijenlere bağlanır ve onları diğer bağışıklık hücreleri tarafından yok edilmek üzere işaretler.
- Hafıza B Hücreleri: Bu hücreler ilk enfeksiyondan uzun süre sonra da varlığını sürdürür ve aynı antijenle tekrar karşılaşıldığında hızlı ve güçlü yanıtlar verir. Bu yetenek, immünolojik hafızanın ve aşı etkinliğinin temelini oluşturur.
Antikor Üretimi ve Antijen Sunumu:
- B hücreleri, spesifik antijenlere bağlanabilen Y şekilli proteinler olan antikorları üretir. Antikorlar bağlandıktan sonra patojenleri yok edilmek üzere işaretler veya aktivitelerini doğrudan nötralize eder.
- B hücreleri ayrıca yüzeylerindeki antijen parçalarını işleyip göstererek ve bunları T hücrelerine sunarak antijen sunan hücreler (APC’ler) olarak da hareket edebilir. Bu etkileşim, patojenlere karşı daha geniş ve daha etkili bir savunmayı koordine ederek adaptif bağışıklık tepkisini güçlendirir.
Bağışıklık Sistemine Temel Katkılar
- Hümoral Bağışıklık: B hücreleri, antikorlar da dahil olmak üzere vücut sıvılarında bulunan maddeleri içeren bağışıklık yönü olan *humoral bağışıklığın* merkezidir. Bu bağışıklık, esas olarak T hücrelerini içeren hücre aracılı bağışıklıktan farklıdır.
- Özgünlük ve Uyarlanabilirlik: Lenfoid foliküllerde *somatik hipermutasyon* ve afinite olgunlaşması olarak bilinen bir süreç sayesinde, B hücreleri spesifik antijenleri tanıma yeteneklerini geliştirir. Bu adaptasyon süreci, bir bağışıklık yanıtı sırasında üretilen antikorların patojene son derece spesifik olmasını sağlar.
- Türler Arası Alaka: Fabricius bursası kuşlara özgü olsa da, B hücresi gelişimi, antijen tanıma ve antikor üretimi ilkeleri insanlar da dahil olmak üzere tüm omurgalılar için geçerlidir. Kuşlarda B hücrelerinin incelenmesi, immünoloji için geniş çapta geçerli olan adaptif bağışıklık konusunda önemli bilgiler sağlamıştır.
B Hücrelerinin İmmünolojik Rolünün Özeti
B-lenfositler, patojenleri tanıma, antikor üretme ve immünolojik hafızayı koruma konularında uzmanlaşmış adaptif bağışıklık sisteminin temel taşıdır. Vücudu çeşitli patojenlere karşı savunmak ve hafıza hücreleri aracılığıyla uzun vadeli bağışıklığı desteklemek için gerekli olan oldukça spesifik bir bağışıklık yanıtı mekanizmasını temsil ederler. Fabricius bursasından gelen tarihsel isimlendirme, immünoloji araştırmalarının benzersiz kökenlerini ve karşılaştırmalı çalışmaların insan bağışıklığını anlamadaki önemini vurgulamaktadır.
Keşif
B-lenfositlerin** (B hücreleri) keşfi ve anlaşılması, immünolojide kayda değer atılımlarla zaman içinde gelişmiştir. İşte B hücresi araştırmalarındaki önemli dönüm noktalarının akıcı bir anlatımı:
1. Kuş İmmünolojisindeki Kökenler ve Fabricius’un Bursa’sı (1950’ler)
B hücrelerinin keşfi, immünologların kloak yakınında *bursa of Fabricius* adı verilen bir organı gözlemledikleri tavuklar üzerinde yapılan çalışmalarla başladı. Adını İtalyan anatomist Hieronymus Fabricius’tan alan bu yapının, kuşlarda bağışıklık gelişiminde merkezi bir rol oynadığı tespit edildi.
İmmünologlar bursanın çıkarılmasının, daha sonra B-lenfositleri olarak tanımlanan bazı bağışıklık hücrelerinin oluşumunu engellediğini keşfettiler. Bu gözlem B hücresi araştırmalarının başlangıcını oluşturmuş, bilim insanları bursanın kuşlarda antikor üretimi için çok önemli olduğunu fark etmiştir. B-lenfositlerdeki “B” bu organı ifade eder ve bu adlandırma daha sonra B hücrelerinin kemik iliğinde geliştiği insanlara kadar uzanacaktır.
2. B Hücrelerinin Tanımlanması ve Antikor Üretimindeki Rolleri (1960’lar)
Kuşlar üzerinde yapılan çalışmalara dayanarak immünologlar memelilerde antikor üreten hücreleri incelemeye başladılar. Bu hücrelerin bursa yerine kemik iliğinde olgunlaştığını ve enfeksiyonlarla savaşan antikorların üretilmesinden sorumlu olduğunu buldular.
B hücrelerinin *humoral bağışıklığın* (bağışıklığın vücut sıvılarındaki antikorları içeren yönü) merkezinde olduğunun keşfi immünolojiyi dönüştürdü. B hücreleri, son derece spesifik antikorlar üretme ve geçmiş enfeksiyonların hafızasını tutarak uzun süreli bağışıklık sağlama yetenekleriyle tanındı.
3. Klonal Seçilim Teorisi (1957)
İmmünolog *Frank Macfarlane Burnet*, bağışıklık tepkisi anlayışını yeniden tanımlayacak bir kavram olan *klonal seleksiyon teorisini* önerdi. Her B hücresinin tek bir antijene özgü benzersiz reseptörler taşıdığını ve bu antijenle karşılaştığında hücrenin çoğalarak hedeflenen yanıtı verebilecek bir hücre “klonu” ürettiğini öne sürdü.
Bu teori, bağışıklık sisteminin spesifik patojenleri nasıl hedefleyebileceğini açıklamış ve adaptif bağışıklığın anlaşılması için temel oluşturmuştur. Klonal seçilim teorisi, B hücrelerinin antikor üreten plazma hücrelerine ve gelecekteki enfeksiyonlara hızlı yanıt vermek için vücutta kalan hafıza B hücrelerine nasıl farklılaştığına dair içgörü sağlamıştır.
4. B Hücresi Reseptörlerinin Keşfi (1970’ler)
Araştırmacılar, B hücrelerinin yüzeyindeki *B hücre reseptörlerini (BCR’ler)* keşfederek, bu hücrelerin spesifik antijenleri doğrudan tanımasını ve bunlara bağlanmasını sağladı. BCR’ler son derece spesifiktir ve her B hücresi bir antijen için benzersiz bir reseptör ifade eder.
BCR’lerin tanımlanması, B hücrelerinin patojenleri nasıl tanıdığının ve bunlara nasıl yanıt verdiğinin anlaşılmasını sağlamıştır. BCR’ler patojen yüzeyindeki antijenleri bağlayarak B hücresine aktive olması ve farklılaşması için sinyal gönderir. Bu keşif, her B hücresinin benzersiz bir patojeni hedef aldığı adaptif bağışıklık yanıtının özgüllüğünü vurgulamıştır.
5. Somatik Hipermutasyon ve Afinite Olgunlaşmasını Anlamak (1980’ler)
1980’lerde bilim insanları *somatik hipermutasyon* ve afinite olgunlaşması süreçlerini ortaya çıkararak B hücrelerinin antikor özgüllüklerini artırmalarını sağladı. Bir B hücresi aktive edildiğinde, DNA’sı hedeflenen mutasyonlara uğrayarak antikorun spesifik antijenine uyumunu iyileştirir.
Bu keşifler, antikorların patojenleri tanıma ve etkisiz hale getirme yeteneklerini geliştirerek zaman içinde nasıl daha etkili hale geldiklerini açıklamıştır. Somatik hipermutasyon ve afinite olgunlaşması, B hücrelerinin bir seçilim sürecinden geçerek enfeksiyonlarla savaşmak için gerekli olan yüksek afiniteli antikorlarla sonuçlandığı lenf düğümlerindeki *germinal merkezlerde* gerçekleşir.
6. Otoimmünitede B Hücrelerinin Rolü (1990’lar)
1990’larda yapılan araştırmalar, B hücrelerinin bazen yanlışlıkla vücudun kendi dokularına saldırarak otoimmün hastalıklara yol açabileceğini ortaya koydu. Lupus ve romatoid artrit gibi hastalıklar, kendi antijenlerine karşı antikor üreten işlevsiz B hücreleriyle ilişkilendirildi.
Bu buluş, B hücrelerinin hem koruyucu hem de patolojik bağışıklık tepkilerinde rol oynadığını göstererek B hücrelerinin anlaşılmasını genişletti. B hücreleri ve otoimmünite arasındaki bağlantı, otoimmün hastalıkları tedavi etmek için spesifik B hücresi popülasyonlarını baskılayan veya düzenleyen hedefe yönelik tedavilere yönelik araştırmaları teşvik etmiştir.
7. Terapötik Gelişmeler: Monoklonal Antikorlar ve B Hücresi Hedefli Tedaviler (2000’ler)
2000’li yılların başında *monoklonal antikor tedavilerinin* geliştirilmesi, tedavi için B hücrelerinin hedeflenmesinde bir dönüm noktası olmuştur. Rituximab** gibi ilaçlar B hücrelerini seçici olarak hedefleyecek şekilde tasarlandı ve otoimmün hastalıklar ve belirli kanser türleri için tedavilere yol açtı.
Monoklonal antikor tedavileri, B hücresi odaklı tedaviler için yeni olanaklar yarattı. B hücresi aktivitesini seçici olarak tüketerek veya modüle ederek, bu tedaviler lenfoma ve romatoid artrit gibi hastalıklar için etkili tedaviler sundu ve B hücrelerini immünoterapide önemli bir hedef haline getirdi.
8. CAR-T Hücre Tedavisinin Ortaya Çıkışı (2010’lar)
2010’larda, *kimerik antijen reseptörü T-hücresi (CAR-T) tedavisi*, B hücresi malignitelerini, özellikle de B hücresi lösemi ve lenfoma gibi kanserleri hedef alan yenilikçi bir yaklaşım olarak ortaya çıktı. CAR-T terapisi, hastanın kendi T hücrelerinin belirli B hücresi belirteçlerini hedef alacak şekilde mühendisliğini içerir.
CAR-T terapisi, kişiselleştirilmiş tıpta yeni bir sınırı temsil etmekte ve aksi takdirde zorlu kanserleri tedavi etmek için hücresel mühendisliği immünoloji ile birleştirmektedir. Terapötik hedefler olarak B hücresi belirteçlerinin önemini vurgulamakta ve bağışıklık temelli tedavilerdeki ilerlemelere örnek teşkil etmektedir.
9. B Hücresi Hafızası ve Aşılama Üzerine Görüşler (2020’ler)
Son araştırmalar, geçmiş enfeksiyonları hatırlayarak ve yeniden maruz kalındığında daha güçlü yanıt vererek uzun vadeli bağışıklık sağlayan *hafıza B hücrelerini* anlamaya odaklanmıştır. COVID-19 üzerine yapılan çalışmalar, hafıza B hücrelerinin enfeksiyon veya aşılamanın ardından kalıcı bağışıklığa nasıl katkıda bulunduğunu vurgulamıştır.
B hücresi hafıza araştırmalarındaki ilerlemeler aşı geliştirmeyi güçlendirmiş, hafıza B hücreleri sağlam ve uzun süreli bağışıklık oluşturmada önemli bir rol oynamıştır. Bu araştırmadan elde edilen bilgiler, özellikle yeni ortaya çıkan bulaşıcı hastalıklara karşı güçlü ve kalıcı bağışıklık tepkileri ortaya çıkaran aşıların tasarlanmasında uygulanmaktadır.
İleri Okuma
- Owen, J. J. T., & Cooper, M. D. (1975). Development of the immune system in the embryo. Nature, 258(5534), 589–594.
- Yancopoulos, G. D., Blackwell, T. K., Suh, H., Hood, L., & Alt, F. W. (1986). Introduced T-cell receptor variable region gene segments in normal and mutated immunoglobulin genes. Nature, 319(6055), 846–848.
- Berek, C., & Milstein, C. (1987). Mutation drift and repertoire shift in the maturation of the immune response. Immunological Reviews, 96(1), 23–41.
- Janeway, C. A., & Travers, P. (2001). Immunobiology: The Immune System in Health and Disease. New York: Garland Science.
- Cooper, M. D., & Alder, M. N. (2006). The evolution of adaptive immune systems. Cell, 124(4), 815–822.
Osilasyon
Latincede oscillate +–ion → oscillatio→ Fransızcadan oscillation →
- Herhangi bir ölçülebilenin, merkezi bir değere (genelde bir denge noktasına) göre veya iki ya da daha fazla durum arasında genellikle zamana göre tekrarlanan değişikliklere verilen addır.
- Salınım terimi, bir durumun periyodik ve düzenli olarak dinlenme durumundan saptığı bir süreci tanımlar.
- Titreşim terimi de bazen sınırlı olarak mekanik salınımları tarif etmekte kullanılsa da bazen salınım ile eş anlamda kullanılır.
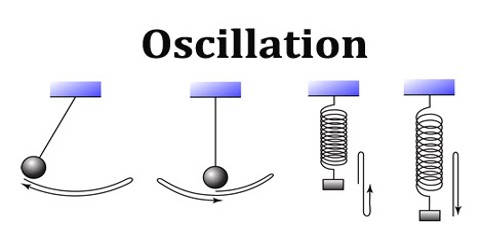
Temel bilgiler
Dinlenme durumundan sapmanın gücü genlik, frekans ise frekans olarak bilinir.
Vücutta gözlemlenilen bölgeler
İnsan organizmasında, örneğin bir kalp atışıyla veya elektrikli diş fırçası gibi mekanik cihazlarla bir salınım meydana gelebilir.
- Osilatör, ‘titreşimler (salınımlar) şeklinde’ veya ‘salınım’ anlamına gelir.
- Langerhans adacıklarında her 10 ila 20 dakikada bir insülin salınımı.
Osilometri
- Vücut pletismografisi ile karşılaştırıldığında bu, hava yolu direncini ölçmek için basit bir yöntemdir. (Bkz; Osilo–metri)
- Hava yollarına gönderilen salınımlı bir akış, akciğerlerin çevresine doğru devam eder. Bu, solunum direncinin hesaplanabileceği alternatif basıncın alternatif akıma oranıyla sonuçlanır.