Amoksisilinin “keşif hikâyesi”, tek bir laboratuvar anından ibaret değildir; daha çok, bakterilerle insanların aynı biyolojik sahneyi paylaştığı uzun bir çağın içinde, birbirine eklemlenen gözlemler, teknik atılımlar, kuramsal sıçramalar ve endüstriyel ölçekte problem çözmenin birikimli tarihidir. Bu hikâye, bir küf kolonisinin etrafında oluşan saydam bir halkanın merak uyandırmasıyla başlar; sonunda ise genomik sürveyans, farmakodinamik optimizasyon ve akılcı kullanım ilkeleriyle şekillenen çağdaş bir “antimikrobiyal ekoloji yönetimi” anlayışına kadar uzanır.
1920’ler: İlk kıvılcım — antibiyozis fikrinin görünür hâle gelişi
1928 yılında Londra’da, St. Mary’s Hospital’daki laboratuvarında çalışan Alexander Fleming, kültür plaklarında üreyen bir küfün çevresinde bakterilerin çoğalamadığını fark etti. Bu, antibakteriyel bir maddenin varlığına işaret eden güçlü bir görsel ipucuydu: canlıların birbiriyle rekabet ederken kimyasal “silahlar” üretebildiği düşüncesi, artık yalnızca sezgisel değil, deneysel olarak gözlemlenebilir hâle gelmişti. Fleming bu etkeni “penisilin” olarak adlandırdı ve bakteriyel enfeksiyonların tedavisinde yeni bir çağın kapısının aralanabileceğini öngördü.
Fleming’in bulgusu, bilimsel merakın tipik bir ikilemini taşıyordu: keşif açıktı, fakat maddenin saflaştırılması ve klinik ölçekte üretimi dönemin teknolojisiyle henüz kolay değildi. Penisilinin kaderi, tek bir gözlemden ziyade, onu “ilaç” yapan mühendislik ve biyokimya atılımlarına bağlıydı.
1939–1945: Oxford hattı — penisilini ilaç yapan ekip çalışması
Fleming’in açtığı patika, 1939’da Oxford Üniversitesi Sir William Dunn School of Pathology’de bir ekibin elinde ana yola dönüştü. Ekibin lideri Howard Florey, biyokimyacı Ernst Boris Chain ve deneysel düzeneklerin ustası Norman Heatley ile birlikte penisilinin ekstraksiyonu, saflaştırılması, stabilizasyonu ve biyolojik etkinliğinin nicel ölçümü için yöntemler geliştirdi. Bu dönem, “bir molekülü görmek” ile “bir molekülü hastaya verebilecek hâle getirmek” arasındaki mesafenin kapandığı yıllardı.
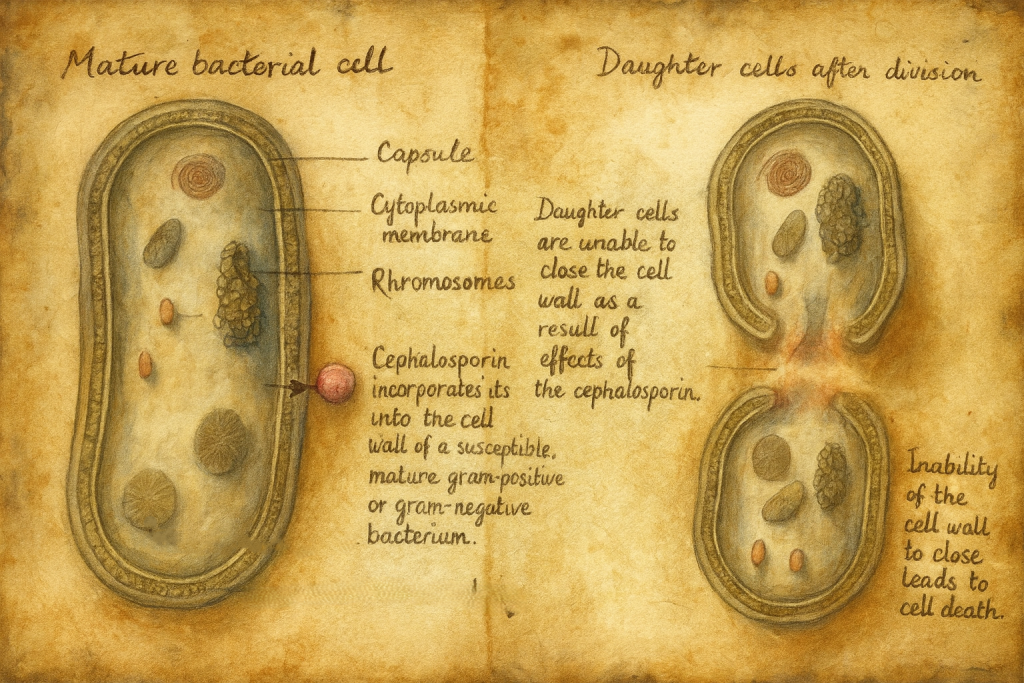
Bu yıllarda bir başka kritik kavşak daha belirdi: bakteriler, penisiline karşı direnç gösterebiliyordu. Penisilinin “mucize” olarak yükselişiyle eşzamanlı olarak, bakterilerin savunma repertuvarı da görünürleşiyordu.
1940’lar: Direnç gerçeğinin adı konuyor — β-laktamazların sahneye çıkışı
1940’larda, özellikle Edward P. Abraham gibi araştırmacıların katkılarıyla, bazı bakterilerin penisilini parçalayan enzimler üretebildiği anlaşıldı. Bu enzimler daha sonra β-laktamaz olarak adlandırılacak ve β-laktam antibiyotiklerin kaderini belirleyen en önemli direnç mekanizmalarından biri olarak tıp tarihine kazınacaktı. Yani daha baştan, şu ders yazılıydı: antibiyotikler “nihai zafer” değil, evrimsel bir satranç oyununda güçlü ama karşı hamleye açık taşlardı.
Bu farkındalık, iki yönlü bir araştırma programını tetikledi:
- Penisilin çekirdeğini değiştirerek daha dayanıklı türevler geliştirmek
- Direnç enzimlerini etkisizleştirerek antibiyotiklerin etkisini geri kazanmak
Amoksisilin, birinci programın; amoksisilin-klavulanat ise iki programın birleştiği bir sonucun simgesidir.
1950’ler: Yarı sentetik çağın kapısı — “çekirdek” bulunuyor (6-APA)
Penisilinin kimyasal omurgası üzerinde çalışabilmek için, önce o omurgayı “yan zincirlerinden arındırılmış” saf bir yapı taşı olarak elde etmek gerekiyordu. Bu, yarı sentetik β-laktamların doğum belgesidir.
1959 yılında Beecham araştırma hattında, F. R. Batchelor, F. P. Doyle, J. H. C. Nayler ve G. N. Rolinson, penisilin fermentasyonlarında 6-aminopenisillanik asit (6-APA) oluşumunu gösteren ve bunu yarı sentetik türevlerin çıkış noktası hâline getiren çalışmalarıyla dönüm noktasını yarattılar. 6-APA, “penisilin çekirdeği”nin elde edilebilir olduğu anlamına geliyordu: artık kimyacılar, çekirdeğe yeni yan zincirler bağlayarak asit stabilitesi, oral emilim, spektrum genişliği gibi klinik özellikleri tasarlayabilirdi.
Bu, ilaç keşfinin karakterini de değiştirdi. Rastlantısal biyolojik gözlemlerden, tasarıma dayalı kimyasal biyoloji dönemine geçiliyordu.
1961: İlk büyük sıçrama — ampisilin ve “aminopenisilin” fikri
6-APA’nın sağladığı özgürlük, kısa sürede ilk büyük ürününü verdi: ampisilin. 1961’de piyasaya çıkan ampisilin, yalnızca yeni bir antibiyotik değildi; “aminopenisilin” düşüncesinin klinik kanıtıydı. Amino grubunun eklenmesiyle Gram-negatiflerin bir kısmına karşı aktivite artıyor, üstelik oral kullanıma uygunluk korunabiliyordu. Ancak ampisilinin de sınırlılıkları vardı: özellikle oral biyoyararlanım ve bazı klinik senaryolarda yeterli ve öngörülebilir serum düzeyleri elde etme konusu daha iyiye götürülebilirdi.
İşte amoksisilin tam bu noktada, bir “ikinci nesil iyileştirme” hedefiyle doğdu: aynı temel fikri koruyup, farmakokinetik ve klinik pratikte daha avantajlı bir profil oluşturmak.
1960’lar sonu–1970’ler başı: Amoksisilinin tasarlanışı — Long ve Nayler’in molekülü
Beecham’ın Brockham Park’taki araştırma ekosistemi, 6-APA üzerinden sistematik yan zincir varyasyonlarıyla ilerlerken, hedef nettir: ampisiline benzer spektrumla daha iyi oral emilim, daha yüksek ve daha güvenilir doku/sekresyon düzeyleri.
Bu arayışın somut meyvesi, Anthony Alfred Walter Long ve John Herbert Charles Nayler tarafından geliştirilen ve patent literatüründe p-hidroksi-ampisilin hattına oturan moleküldür: amoksisilin. Burada kimyasal “küçük” görünen bir ek—aromatik halkadaki hidroksi (–OH) grubu—biyoyararlanım ve klinik performans açısından “büyük” bir fark yaratır. Molekül daha hidrofilik/ambifilik bir dengeye yaklaşır; oral emilim, pratikte daha avantajlı hâle gelir.
Bu dönem, ilaç keşfinin sessiz ama belirleyici bir disiplinini gösterir: molekülün etkinliğini yalnızca hedef enzime bağlanma üzerinden değil, insan bedenindeki yolculuğu üzerinden optimize etmek. Bir antibiyotiği “iyi” yapan şey, yalnızca bakteriyi öldürmesi değil; doğru yerde, doğru sürede, doğru düzeyde bulunabilmesidir.
1972: Sahaya iniş — amoksisilin klinik kullanıma giriyor
1972, amoksisilinin klinik dünyaya resmen adım attığı yıldır. Bu tarih, aynı zamanda aminopenisilinlerin evriminde ikinci basamaktır: ampisilinden sonra, amoksisilin pratik hekimliğin günlük ritmine daha rahat yerleşebilecek bir oral ajan olarak konumlanır. Kısa süre sonra:
- 1974’te ABD’de düzenleyici onay alır,
- 1977’de Birleşik Krallık’ta klinik kullanım çerçevesi belirginleşir.
Bu yıllarda amoksisilin, solunum yolu enfeksiyonları, otitis media, streptokokal farenjit gibi toplum kökenli enfeksiyonlarda güçlü bir “ilk seçenek” adayı hâline gelmeye başlar. Başarı, yalnızca spektrumla ilgili değildir: dozlamanın uygulanabilirliği, tolerabilite ve hekim/hasta uyumu da bu yükselişin sessiz motorlarıdır.
1972–1977: Dirence karşı ikinci hat — klavulanik asit doğuyor
Amoksisilinin yükselişiyle eş zamanlı olarak, β-laktamazların klinik etkisi giderek daha görünür olur. Eğer bakteriler β-laktam halkasını parçalayan enzimlerle savunma kuruyorsa, o enzimlerin “kilit” noktasını hedefleyen yeni bir hamle gerekir.
Bu hamlenin adı klavulanik asittir.
- 1976’da Beecham araştırma çizgisinde, A. G. Brown ve çalışma arkadaşları, Streptomyces clavuligerus kaynaklı β-laktam yapılı, güçlü β-laktamaz inhibitör özellik taşıyan bileşiği tanımlar; yapı aydınlatma süreci aynı dönemde ilerler.
- 1977’de C. Reading ve çalışma arkadaşları, klavulanik asidin üretimi, izolasyonu ve biyolojik özelliklerini ayrıntılandıran çalışmalarıyla bileşiği bilim dünyasında sağlam bir zemine oturtur.
Bu keşfin entelektüel güzelliği şuradadır: klavulanik asit “antibiyotik” gibi görünür, ama asıl gücü, başka bir antibiyotiğin —özellikle amoksisilinin— etkisini korumasıdır. Bir anlamda, antibiyotiğin etrafına biyokimyasal bir “koruma kalkanı” örer.
1981: Birleşme — ko-amoksiklav (Augmentin) ve kombinasyon stratejisinin zaferi
Klavulanik asit bulunduğunda, doğal soru şuydu: Hangi antibiyotikle eşleştirilmeli?
Seçim amoksisilin olur. Bunun rasyoneli nettir:
- amoksisilinin oral emilimi güçlüdür,
- geniş kullanım alanı vardır,
- β-laktamazla yıkıma duyarlılığı, inhibitörle “tamamlanmaya” uygundur.
Sonuç, 1981’de Birleşik Krallık’ta tablet formülasyonu ile amoksisilin/klavulanat kombinasyonunun (ko-amoksiklav) piyasaya çıkmasıdır. Bu, modern antibiyotik tarihinde yalnızca yeni bir ürün değil, yeni bir strateji anlamına gelir: “Direnç mekanizmasını hedefle ve antibiyotiği yeniden etkin kıl.”
Bu strateji, daha sonra başka β-laktamaz inhibitörlerinin geliştirilmesinin de düşünsel temelini güçlendirir; ancak ko-amoksiklav, geniş kullanım ve klinik pratikteki etkisiyle bu yaklaşımın en ikonik örneği olarak kalır.
1990’lar–2000’ler: Molekülün olgunluk çağı — standardizasyon, kılavuzlaşma ve klinik ekoloji
Amoksisilin artık “yeni” bir ilaç değildir; ancak geniş kullanım, onu bilimsel olarak daha az ilginç kılmaz. Tersine, yaygın ilaçlar çoğu zaman en derin sorunları görünür kılar:
- Hangi endikasyonda amoksisilin tek başına yeterlidir?
- Hangi durumda inhibitör eklemek gereklidir?
- Gereksiz geniş spektrum kullanımının toplum düzeyindeki bedeli nedir?
Bu yıllarda antibiyotik uygulaması, giderek daha fazla kılavuz temelli ve kanıt hiyerarşisine dayalı hâle gelir. Amoksisilin, özellikle pediatrik solunum yolu enfeksiyonlarında, doğru endikasyonda kullanıldığında yüksek değer taşırken; ko-amoksiklavın daha yüksek gastrointestinal yan etki yükü ve daha geniş ekolojik etkisi, “gerektiğinde kullan” ilkesini güçlendirir.
Bu dönem aynı zamanda farmakodinamik düşüncenin günlük kliniğe yerleştiği dönemdir: β-laktamların zamana bağlı öldürme karakteri, doz bölme ve yüksek doz stratejilerinin belirli senaryolarda neden anlamlı olduğunu daha sistematik biçimde açıklar.
2010’lar: Direnç çağında yeniden değerlendirme — “eski” ilacın yeni soruları
Direnç ekolojisi sertleşmiştir. Toplumda ve hastanelerde:
- β-laktamaz repertuvarı çeşitlenmiş,
- bazı patojenlerde hedef proteinler (PBP’ler) değişmiş,
- Gram-negatiflerde geçirgenlik/effluks engelleri güçlenmiştir.
Bu şartlarda amoksisilin, iki uç arasında dikkatle konumlandırılır:
- Bir yanda, doğru patojen ve doğru dozla hâlâ son derece etkin, güvenli ve erişilebilir bir seçenek,
- diğer yanda, yanlış kullanıldığında direnç seçilimini hızlandırabilecek güçlü bir seçilim baskısı.
Ayrıca modern araştırmalar, antibiyotiklerin yalnızca hedef patojenle değil, mikrobiyota ile ilişkisini de daha görünür kılar. Bu, “yan etki” kavramını genişletir: ishal veya kandidiyazis gibi klinik sonuçların arkasında, ekolojik bir yeniden yapılanma vardır.
2020’ler: Çağdaş yaklaşım — amoksisilini yeniden ‘doğru yere’ koymak
Güncel bilimsel yaklaşımda amoksisilin anlatısı, üç büyük eksende yürür:
1) Akılcı kullanım ve dar spektrum tercihi
Çağdaş eğilim, mümkün olduğunda amoksisilini tek başına tercih etmeyi; ko-amoksiklavı ise β-laktamaz üreten patojen olasılığının yüksek olduğu veya klinik tablonun bunu gerektirdiği durumlarla sınırlamayı savunur. Bu yaklaşım, klinik etkinliği korurken ekolojik maliyeti azaltma hedefi taşır.
2) Doz optimizasyonu ve gerçek dünya farmakodinamiği
Yalnızca “kaç mg” değil, “hangi aralıkla” sorusu önem kazanır. Özellikle çocukluk çağı otitis media gibi tabloların bazı alt gruplarında yüksek doz stratejilerinin gerekçesi, farmakodinamik hedeflere dayanır. Aynı zamanda renal fonksiyon bozukluğu gibi durumlarda doz aralığının ayarlanması, toksisite riskini azaltırken etkinliği sürdürmenin temel aracıdır.
3) Üretim biyoteknolojisi ve sistem biyolojisi
Klavulanik asit üretimi gibi süreçler, artık yalnızca klasik fermantasyon optimizasyonu değil; omik veriler, metabolik ağ modelleme, suş mühendisliği ve biyoproses tasarımı ile geliştirilen çok katmanlı bir mühendislik alanıdır. Streptomyces clavuligerus’un metabolizmasının sistem biyolojisi perspektifiyle ele alınması, inhibitörün üretim verimini ve sürdürülebilirliğini artırmaya dönük çağdaş bir araştırma alanı oluşturur.
Bu üç eksen, amoksisilini yalnızca bir antibiyotik değil, modern tıbbın “doğru molekülü doğru bağlamda kullanma” disiplininin merkezî örneklerinden biri hâline getirir.
Kronolojik anlatının özeti gibi okunabilecek “başlıca aktörler” geçidi
Hikâye boyunca sahneye çıkan isimler, tek bir çizgi üzerinde birleşir: gözlemden üretime, kimyadan kliniğe, klinikten ekolojiye.
- Alexander Fleming: antibiyozis gözlemini görünür kılan başlangıç noktası
- Howard Florey, Ernst Boris Chain, Norman Heatley: penisilini klinik gerçekliğe dönüştüren ekip bilimi
- Edward P. Abraham ve dönemin direnç araştırmacıları: β-laktamaz gerçeğini tanımlayan karşı anlatı
- F. R. Batchelor, F. P. Doyle, J. H. C. Nayler, G. N. Rolinson: 6-APA ile yarı sentetik çağın kapısını açan çekirdek keşfi
- 1961’de ampisilinin endüstriyel/klinik doğuşunu mümkün kılan Beecham çizgisi
- Anthony A. W. Long ve J. H. C. Nayler: amoksisilinin tasarımcıları
- A. G. Brown ve çalışma arkadaşları; C. Reading ve çalışma arkadaşları: klavulanik asit ve kombinasyon stratejisinin bilimsel temelini atanlar
- 1981 sonrası klinik topluluk: kılavuzlar, farmakodinamik yaklaşım ve akılcı kullanım ilkeleriyle ilacı olgunlaştıran kolektif aktör










Yorum yazabilmek için oturum açmalısınız.