İçindekiler
Tanım ve Kavramsal Çerçeve
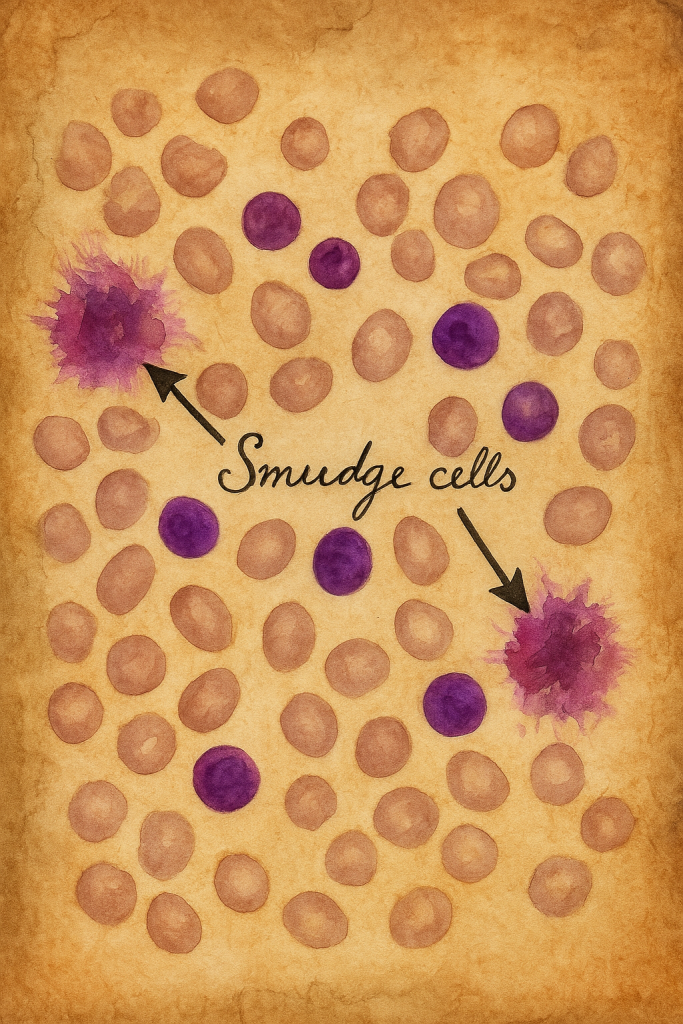
Leke hücreleri (İng. smudge cells, ayrıca “sepet hücreleri” olarak da anılır), periferik kan yaymalarında nükleer materyalin yayılmasına ve hücre zarı bütünlüğünün bozulmasına bağlı olarak oluşan, belirgin sınırları seçilemeyen, düzensiz ve “lekelenmiş” görünümlü lenfosit kalıntılarıdır. Bu yapılar in vivo var olan özgün bir hücre tipini değil, in vitro lam hazırlanması sırasında kırılgan lenfositlerin mekanik travmayla parçalanması sonucu ortaya çıkan bir artefaktı yansıtır. Klinik pratikte en çok kronik lenfositik lösemi (KLL) ile ilişkilendirilmekle birlikte, çeşitli lenfoproliferatif tablolar ve bazı reaktif lenfositozlarda da gözlenebilir.
Etimoloji ve Tarihçe
“Smudge” İngilizcede “bulaştırmak/lekelenmek” anlamına gelir; terim, cam lam üzerinde yayılan hücresel materyalin sürtünme ile yayılıp şekilsiz bir lekeye dönüşmesini betimler. “Basket cell” (sepet hücresi) deyimi ise özellikle nükleer kromatinin ağsı/örgümsü görünümüne yapılan görsel bir göndermedir. Türkçedeki “leke hücresi” karşılığı, bu morfolojik izlenimi doğrudan yansıtır. Hematolojik morfolojinin klasikleşmiş terminolojisi içinde bu yapıların tanımlanması, periferik kan yaymasının ilk sistematik incelemelerinin yaygınlaştığı 20. yüzyıl ortalarından itibaren standart raporlama diline yerleşmiştir.
Morfoloji ve Oluşum Mekanizması
Işık mikroskobisi altında leke hücreleri:
- Hücre zarının izlenemediği veya yırtılmış olduğu,
- Nükleer materyalin lam yüzeyine yayılıp düzensiz sınırlar oluşturduğu,
- Sitoplazmik ayrıntıların silindiği,
- Kromatinin damarlanmış veya ağsı bir dağılım sergilediği alanlar olarak görülür.
Oluşumun temel biyofiziksel nedeni, lamlama esnasındaki kesme (shear) ve sıkıştırma kuvvetlerinin, kırılgan lenfositlerde zarsal-sitokeletal bütünlüğü bozmasıdır. KLL’de gözlenen lenfosit fragilitesine; aktin-sitokeletal organizasyonun değişimi, membran lipid kompozisyonu ve adezyon moleküllerindeki farklılıklar; ayrıca kromatin yoğunluğu ve nükleer zarfın mekanik özelliklerindeki alterasyonlar katkıda bulunabilir. Bu nedenle aynı hastanın kan örneğinde dahi pre-analitik koşullar (antikoagülan tipi, bekleme süresi, yayma tekniği, lam-lamel açısı, kurutma hızı) leke hücresi oranını belirgin biçimde etkileyebilir.
Pre-analitik ve Analitik Değişkenler
- Antikoagülan ve Bekleme Süresi: EDTA ile uzun süre bekleyen örneklerde membran bütünlüğü daha kolay bozulabilir. Taze örnekle hazırlanan yaymalarda leke hücresi oranı genellikle daha düşüktür.
- Yayma Tekniği: Yayıcı lamın açısı (yaklaşık 30–45°), itilme hızı ve tek hamlede pürüzsüz yayma yapılması esastır. Aşırı basınç veya tekrar eden hareketler fragilizasyonu artırır.
- Kuruma ve Fiksasyon: Hızlı hava ile kurutma ve uygun fiksasyon boyutsal artefaktları azaltır.
- Protein Destekleme (Albümin): Bazı laboratuvar protokollerinde yayma öncesi örneğe düşük konsantrasyonda serum albümini eklenmesi, zarsal bütünlüğü destekleyerek leke hücresi oluşumunu azaltabilir; bu yaklaşım özellikle prognoz değerlemesi yapılacak serilerde metodolojik standardizasyon için kullanılmıştır.
Dağılım ve Epidemiyoloji
Leke hücreleri sağlıklı bireylerin periferik yaymalarında nadirdir ve gözlense bile genellikle düşük yüzdelerdedir. Yaşlı erişkinlerde en sık görülen lösemi olan KLL söz konusu olduğunda, yaymalarda belirgin artış göstermeleri tipiktir. Klinik uygulamada bazı laboratuvarlar leke hücresi yüzdesini (ör. 200–500 lökositlik sayımda) raporlar; ancak kesin tanısal eşik evrensel olarak standart değildir. Literatürde %20’nin üzerindeki oranlar KLL lehine yorumlanan bulgular arasında anılsa da, bu değer tek başına tanısal değildir ve teknik değişkenlere duyarlıdır.
Klinik Bağlam ve Ayırıcı Tanı
- Kronik Lenfositik Lösemi (KLL): Leke hücrelerinin sıklıkla artmış olduğu en tipik bağlamdır. KLL’deki küçük, olgun görünümlü ancak kırılgan lenfositlerin lam hazırlığında kolay yırtılması karakteristiktir.
- Diğer Lenfoproliferatif Hastalıklar: Bazı marjinal zon lenfomaları, splenik lenfomalar, prolimfositik lösemi ve seçilmiş mantle hücreli lenfoma olgularında da leke hücreleri görülebilir; ancak oran ve süreklilik KLL’ye kıyasla değişkendir.
- Reaktif Lenfositozlar: Özellikle belirli viral enfeksiyonlar (örn. EBV ilişkili mononükleoz) sırasında hazırlık artefaktları artabilir; burada klinik bağlam, atipik reaktif lenfosit morfolojisi ve akış sitometrisi ile ayrım yapılır.
Ayırıcı tanıda yalnız morfoloji yetersizdir. Akış sitometrisi ile klonal B-hücre immünfenotipi (ör. CD5+, CD23+, zayıf yüzey immünoglobulin, kappa/lambda hafif zincir kısıtlılığı vb.) KLL tanısında esastır. Ek olarak sitogenetik/moleküler belirteçler (ör. del(13q), del(11q), trisomi 12, del(17p)/TP53 mutasyonu), IGVH mutasyon durumu, serum β2-mikroglobulin ve klinik evreleme (Rai/Binet) gibi parametreler tanı ve risk sınıflamasına entegre edilir.
Prognozla İlişki: Yüzde ve Biyolojik Zemin
Çeşitli çalışmalarda periferik yaymadaki leke hücresi yüzdesinin KLL’de iyimser prognozla ilişkili olabileceği bildirilmiştir. Özetle:
- Yüksek leke hücresi yüzdesi bildirilen olgularda sıklıkla daha uzun tedavisiz sağkalım ve daha indolent klinik seyir gözlenmiştir.
- Bu ilişkinin olası biyolojik temeli, daha kırılgan (dolayısıyla lamda kolay parçalanan) lenfositlerin daha düşük agresiflik fenotipleri veya daha olgunlaşmış B-hücre özellikleri taşıması olabilir. Bu hipotez, IGVH mutasyonlu olgular ve düşük proliferasyon indeksleriyle bildirilen korelasyonlarla uyumludur; ancak bu korelasyon nedensellik kanıtı değildir.
- Leke hücresi yüzdesi tek başına modern KLL risk sınıflamalarını (ör. TP53 bozuklukları, kompleks karyotip, minimal rezidüel hastalık durumları) ikame edemez; fakat kolay erişilebilir, düşük maliyetli ve tam kan sayımı ile eş zamanlı bir destek parametresi olarak değerlidir.
Laboratuvar Raporlaması ve Standardizasyon
- Raporlama: Leke hücresi varlığı nitel (var/yok, az/çok) ve gerektiğinde nicel (% oran) olarak bildirilebilir. Klinik bilgi eşlik etmelidir (yaş, lenfositoz derecesi, bilinen KLL tanısı vb.).
- Teknik Not: Pre-analitik değişkenlerin etkisi mutlaka belirtilmelidir. İzlem amaçlı yüzdelerin aynı protokol ile hazırlanmış yaymalardan karşılaştırılması önerilir.
- Kalite Güvencesi: Dahili gözden geçirmeler, eğitimli morfologlar arası uyum (interobserver agreement) ve periyodik dış kalite programları, artefakt ile gerçek patolojik bulguların ayrımında kritiktir.
Patofizyolojik ve (Geniş Anlamda) Evrimsel Değiniler
KLL lenfositlerinin mekanik fragilitesi, hücresel iskelet ve membran mimarisindeki farklılıkların sonucudur. Bu farklılıklar, dolaşımda hemodinamik kuvvetlere maruz kalan hücrelerin lam yüzeyinde maruz kaldığı anlık kesme kuvvetlerine zayıf dirençle yansır. Evrimsel açıdan doğrudan seçilime konu olmuş bir özellikten söz etmek uygun değildir; çünkü leke hücreleri laboratuvar üretimi bir fenomendir. Bununla birlikte, B-hücre olgunlaşması, klonal seçilim ve tümör evrimi bağlamında KLL klonlarının kazandığı moleküler özellikler (ör. sinyal yolaklarının yeniden programlanması, kromatin durumu, adezyon/kemotaksi davranışları) hücrelerin mekanomekanik profillerini de etkileyebilir; bu durum in vitro olarak leke hücresi sıklığına yansıyabilir.
Klinik Pratikte Kullanım
- Tarama/İpucu: Yaşlı bireyde persistan lenfositoz ve yaymada belirgin leke hücresi yoğunluğu, KLL açısından güçlü bir ipucudur.
- Tanı Onayı: Akış sitometrisi ve sitogenetik/moleküler incelemelerle mutlaka teyit gerekir.
- Takip: Aynı merkezde standardize yayma koşullarında leke hücresi yüzdesinin seyri, diğer klinik ve laboratuvar parametrelerle birlikte izlenebilir; tedavi kararlarını tek başına belirlemez, ancak destekleyici bilgi sunar.
- Teknik Düzeltmeler: Araştırma/izlem amaçlı netleştirme gereken olgularda, albümine edilmiş yaymalar veya otomatik dijital morfometri gibi yöntemlerle artefakt katkısı azaltılabilir.
Sınırlılıklar
- Leke hücreleri tanısal spesifiteye sahip değildir; varlıkları bağlama duyarlıdır.
- Yüzdesel değerler yüksek operatör ve teknik bağımlılık gösterir; laboratuvarlar arası karşılaştırmalar dikkat gerektirir.
- Modern KLL yönetiminde biyobelirteç temelli risk sınıflaması baskındır; leke hücresi yüzdesi yardımcı bir ölçüttür.
Keşif
Lam üzerine yayılan ince bir kan damlası, camla camın birbirine değdiği o kısa an, mikrotanecik bir dünyada devinim başlatır; sürtünme, kesme kuvveti ve kuruma dinamikleri bir araya geldiğinde bazı lenfositler bütünlüğünü korur, bazıları ise dağılır. .
Erken Gözlemler ve Terminolojinin Yerleşmesi
Periferik kan yaymalarının rutinleştirilmesi, Romanowsky-türevi boyaların standardizasyonu ve manuel diferansiyel sayımın altın çağını yaşadığı 20. yüzyıl ortalarında, morfologlar bazı yaymalarda sınırları belirgin olmayan, zarı yırtılmış, kromatini lam üzerinde yayılmış “şekilsiz” lenfosit kalıntılarının düzenli biçimde belirdiğini not etmeye başladı. Bu yapılar bir “hücre tipi” değil, lam hazırlama sürecinde kırılgan hücrelerin mekanik travmaya yenik düşmesinin artefaktıydı. İngilizcede “smudge” sözcüğü, “bulaşma/lekelenme” anlamıyla tam da mikroskobik izlenimi yakalıyordu; “basket cell” (sepet hücresi) ifadesi ise kromatinin ağsı, örgü benzeri yayılımını betimleyen görsel bir mecazdı. Türkçedeki “leke hücresi” karşılığı aynı sezgisel doğruluğu taşıdı. Terminoloji bir kişiye atfedilecek keşif yerine, kümülatif bir alan bilgisinin dili hâline geldi; ders kitapları ve laboratuvar raporlama şablonları bu adlandırmayı standartlaştırdı.
Artefaktın Biyofiziği: Neden Kırılırlar?
Leke hücresinin ortaya çıkışı, hücre zar-sitokelet sisteminin lam üzerindeki kesme kuvvetlerine verdiği yanıtla ilgilidir. Kırılgan lenfositler, özellikle de KLL’de görülen küçük, olgun görünümlü B hücreleri, yayma sırasında itici lamın açısı, itilme hızı, uygulanan basınç ve kurutma koşullarına bağlı olarak zarsal bütünlüğünü kolay kaybeder. EDTA’lı tüpte bekleme süresi uzadıkça, membran ve sitoskeletal bağlar daha kırılgan hâle gelebilir; taze örnekle yapılan hızlı yaymalarda leke hücresi oranı genellikle daha düşer. Bazı laboratuvarların yayma öncesi örneğe düşük konsantrasyonda albümin eklemesi, zarsal bütünlüğü destekleyerek artefaktı azaltmayı amaçlayan pratik bir yöntem olarak doğdu; bu da leke hücresi yüzdelemelerinin teknik koşullara duyarlılığını laboratuvar pratiğinde görünür kılan bir başka sayfa oldu.
KLL ile Bağın Kurulması: Morfolojiden Şüpheye, Şüpheden Tanıya
Leke hücreleri sağlıklı birey yaymalarında seyrektir; yaşlı erişkinlerde persistan lenfositozla birlikte belirginleştiğinde KLL şüphesini güçlendirir. Bu noktada leke hücresi “tanı koyan” bir bulgu değil, biyolojik bir kırılganlığın lam üzerindeki iz düşümüdür. Ayırıcı tanıda tek başına morfoloji değildir belirleyici olan: akış sitometrisi, KLL’ye özgü immünfenotipik imzayı (örneğin CD5 ve CD23 ko-pozitifliği, zayıf yüzey immünoglobulin ekspresyonu, belirgin hafif zincir kısıtlılığı) ortaya koyar; sitogenetik ve moleküler testler (örneğin del(13q), trisomi 12, del(11q), del(17p)/TP53 bozukluğu) ile IGHV mutasyon durumu, güncel risk katmanlandırmasının omurgasını oluşturur. Leke hücresi, bu çok katmanlı değerlendirmede ucuz, erişilebilir ve morfolojiye dayalı bir ipucu olarak yerini alır.
Yüzdeler, Eşikler ve Standardizasyon Arayışı
Laboratuvar raporlarında leke hücresi varlığı nitel (“az/çok”) ya da nicel (yüzde) bildirilebilir; ancak evrensel bir “eşik”ten söz etmek zordur. Literatürde %20 ve üzeri oranların KLL lehine yorumlandığına sıkça rastlansa da, bu değer pre-analitik değişkenlere ve operatör deneyimine duyarlıdır. Bu nedenle karşılaştırmalı izlemde aynı merkezde, aynı protokolle, benzer yayma teknikleriyle elde edilmiş sayımların değerlendirilmesi önerilir. Uluslararası standart önerileri, kan yaymasının hazırlama ve boyama adımlarını ayrıntılandırarak artefakt kaynaklı değişkenliği azaltmayı hedefler; böylece leke hücresi yüzdesi, başka parametrelerle birlikte daha anlamlı bir bağlamda okunabilir.
Prognozla İlişkilendirme: Kırılganlığın Anlamı
KLL’de periferik yaymadaki leke hücresi yüzdesinin daha yüksek olduğu olgularda, tedavi gereksinimine kadar geçen sürenin ve genel sağkalımın daha elverişli seyrettiğine işaret eden çalışmalar, bu artefaktın biyolojik arka planına dair yorumları tetikledi. Mekanik olarak kolay dağılan lenfositlerin, daha olgunlaşmış B-hücre fenotipleriyle veya düşük proliferasyon indeksiyle ilişkili olabileceği; IGHV mutasyonlu, daha indolent biyolojiye sahip klonlarla kısmi örtüşme gösterebileceği düşünüldü. Buna karşın korelasyonun nedensellik olmadığının altı çizildi; leke hücresi yüzdesi, TP53 bozukluğu, kompleks karyotip veya minimal rezidüel hastalık gibi güncel belirleyicilerin yerini tutmaz, ancak klinik tabloya hızlı ve maliyetsiz bir bağlamsal sinyal ekler.
“Keşif”in Kolektif Doğası: Kâşifler ve Okullar
Leke hücreleri için bir “ilk gözlemci” listesi çıkarmak, örneğin bir bakterinin izole edilmesi gibi tekil bir tarih anına işaret etmekten farklıdır. Burada keşif, lam başında ardışık kuşakların aynı fenomene tekrar tekrar tanık olması ve bunu ortak bir dille adlandırmasıyla gerçekleşti. Britanya ve Avrupa laboratuvar kültürlerinde “smudge/basket cell” terimlerinin, Kuzey Amerika’daki morfoloji eğitimlerinin ve hematoloji ders kitaplarının bu dili yaygınlaştırması; standart kurulları ve rehberlerin, raporlama şablonlarına bu birimi yerleştirmesi, kâşiflerin tek tek adlarını değil, mesleki bir kolektivitenin bilgisini öne çıkarır. Bu nedenle “tüm kâşifler”, gerçekte lamın başında aynı izi tarif eden morfologlar topluluğudur; isimlerden çok okul ve metinler konuşur.
Güncel Yönelimler: Mekanobiyoloji, Dijital Patoloji ve Otomasyon
Moleküler çağın derinleşmesiyle leke hücresinin önemi kaybolmadı, yalnızca bağlamı değişti. Güncel çalışma eksenleri üç başlıkta toplanabilir:
- Mekanobiyoloji ve Hücresel Kırılganlık: KLL hücrelerinde aktin-sitokeletal örgü, nükleer zarf ve kromatin yoğunluğunun hücresel deformabiliteye etkisini inceleyen deneysel yaklaşımlar, lam üzerindeki kırılganlığın hücre içi mimariyle nasıl bağlantılandığını anlamaya odaklanıyor. Bu kapsamda hücre deformabilitesini ölçen mikrofloıdik platformlar, lamdaki artefaktın laboratuvar koşullarına değil, hücrenin fiziksel fenotipine ait payını ayırt etmeye yardımcı oluyor.
- Dijital Morfoloji ve Yapay Zekâ: Tarayıcılarla sayısallaştırılmış yaymalar üzerinde, leke hücrelerini diğer artefaktlardan ve gerçek hücresel yapılardan ayrıştıran derin öğrenme modelleri geliştiriliyor. Amaç, operatör bağımlı değişkenliği azaltmak, pre-analitik gürültüyü modellemek ve yüzdeleri daha tutarlı hale getirmek. Bu sayede leke hücresi yüzdesi, geniş seriler ve çok merkezli veriyle yeniden kalibre edilebilecek bir yardımcı göstergeye dönüşüyor.
- Klinik Entegrasyon ve Tedavi Çağrışımları: Leke hücresi yüzdesinin, IGHV mutasyon durumu, TP53 bozukluğu, β2-mikroglobulin düzeyi ve klinik evreleme ile birlikte çok değişkenli modellerde ne kadar ek öngörü gücü taşıdığı sınanıyor. Yeni nesil tedavilere (örneğin BTK inhibitörleri veya BCL2 inhibitörleri) yanıt profilleriyle leke yüzdesi ilişkisini araştıran çalışmalar, morfolojik kırılganlığın tedavi biyolojisine dair zayıf ama ölçülebilir ipuçları verip vermediğini sorguluyor. İlk sonuçlar, leke hücresi yüzdesinin tek başına karar belirleyici olmaktan ziyade, karar ağaçlarında hafif ağırlıklı bir düğüm olarak konumlandığını düşündürüyor.
Laboratuvar Pratiğinde Bugün
Güncel laboratuvarlar, leke hücresi raporlamasını pre-analitik değişkenlerle birlikte yorumluyor: örnek yaşı, antikoagülan tipi, yayma tekniği ve boyama ayrıntıları rapor notlarında görünür kılınıyor. İzlemde aynı protokolün korunması, yüzdelerin zaman içindeki değişimini yorumsal açıdan daha güvenilir kılıyor. Klinik ekip ise bu bilgiyi, akış sitometrisi ve moleküler belirteçlerle birlikte, KLL’nin gerçek biyolojik resmine yerleştiriyor. Leke hücresi, keşif hikâyesini tamamlamış bir “artık bilgi” değil; mikroskobik bir iz olarak, modern hematolojide hâlâ konuşan, ama tek başına hüküm vermeyen bir tanık.
İleri Okuma
- Nowell, P. C., & Hungerford, D. A. (1960). Chromosome studies on normal and leukemic human leukocytes. Journal of the National Cancer Institute, 25(1), 85–109.
- Nowell, P. C. (1962). Phytohemagglutinin: An initiator of mitosis in cultures of normal human leukocytes. Cancer Research, 22(5), 689–696.
- Matutes, E., Owusu-Ankomah, K., Morilla, R., Garcia Marco, J., Houlihan, A., Que, T. H., & Catovsky, D. (1994). The immunological profile of B-cell disorders and proposal of a scoring system for the diagnosis of CLL. Leukemia, 8(10), 1640–1645.
- Nowakowski, G. S., Hoyer, J. D., Shanafelt, T. D., et al. (2007). Percentage of smudge cells on routine blood smears predicts overall survival in chronic lymphocytic leukemia. Cancer, 109(8), 1643–1649. DOI 10.1002/cncr.22573.
- Seegmiller, A. C., & Hsi, E. D. (2008). Smudge cells in chronic lymphocytic leukemia: Morphology, mechanism, and clinical relevance. Archives of Pathology & Laboratory Medicine, 132(7), 1106–1111. DOI 10.5858/132.7.1106.
- Riley, R. S., Ben-Ezra, J. M., Massey, D., et al. (2016). The clinical and laboratory significance of blood film examination. Laboratory Medicine, 47(2), 97–110. DOI 10.1093/labmed/lmw001.
- Kipps, T. J., Stevenson, F. K., Wu, C. J., et al. (2017). Chronic lymphocytic leukaemia. Nature Reviews Disease Primers, 3, 16096. DOI 10.1038/nrdp.2016.96.
- Rizzo, K., Nassiri, M., & Doan, R. (2010). Smudge cell percentage on routine blood smear predicts survival in chronic lymphocytic leukemia. Blood, 116(21), 3447–3447.
- ICSH (2015). ICSH recommendations for the standardization of blood film preparation and staining. International Journal of Laboratory Hematology, 37(3), 287–303. DOI 10.1111/ijlh.12327.
- CLSI (2019). Reference Leukocyte Differential Count (Proportional) and Evaluation of Instrumental Methods; Approved Standard (CLSI H20—latest revision). Clinical and Laboratory Standards Institute., ISBN 9781684400633.
- Bain, B. J. (2021). Blood Cells: A Practical Guide. Wiley-Blackwell, 6th ed., ISBN 9781119854238.
- Swerdlow, S. H., Campo, E., Harris, N. L., et al. (2022). WHO Classification of Tumours of Haematolymphoid Tissues. IARC, 5th ed., ISBN 9789283244540.
- Arber, D. A., Orazi, A., Hasserjian, R. P., et al. (2022). The 2022 International Consensus Classification of mature lymphoid neoplasms. Blood, 140(11), 1229–1253. DOI 10.1182/blood.2022015851.
Yorum yazabilmek için oturum açmalısınız.