İçindekiler
1. CAR-T Hücre Tedavisinin Prensibi
CAR-T (Kimerik Antijen Reseptörlü T Hücre) tedavisi, hastanın kendi T lenfositlerinin genetik olarak modifiye edilerek kanser hücrelerine karşı daha etkili hale getirilmesini amaçlayan bir adoptif hücre tedavisi biçimidir. Tedavide kullanılan sentetik reseptör (CAR), üç temel yapıdan oluşur:
- Antijen bağlayıcı dış kısım: Genellikle tümöre özgü bir antijene bağlanabilen tek zincirli değişken bölge (scFv) içerir.
- Transmembran bölge: Hücre zarından geçen kısmı oluşturur.
- İntraselüler sinyal iletim alanı: CD3ζ ve yardımcı kostimülatör (örneğin CD28 veya 4-1BB) bölgeler içerir ve T hücresini aktive eder.
CAR-T hücreleri hedef antijen ile karşılaştığında güçlü bir sinyal alır ve proliferasyon, sitokin salınımı ve tümör hücresine yönelik doğrudan sitotoksik etki gerçekleşir.
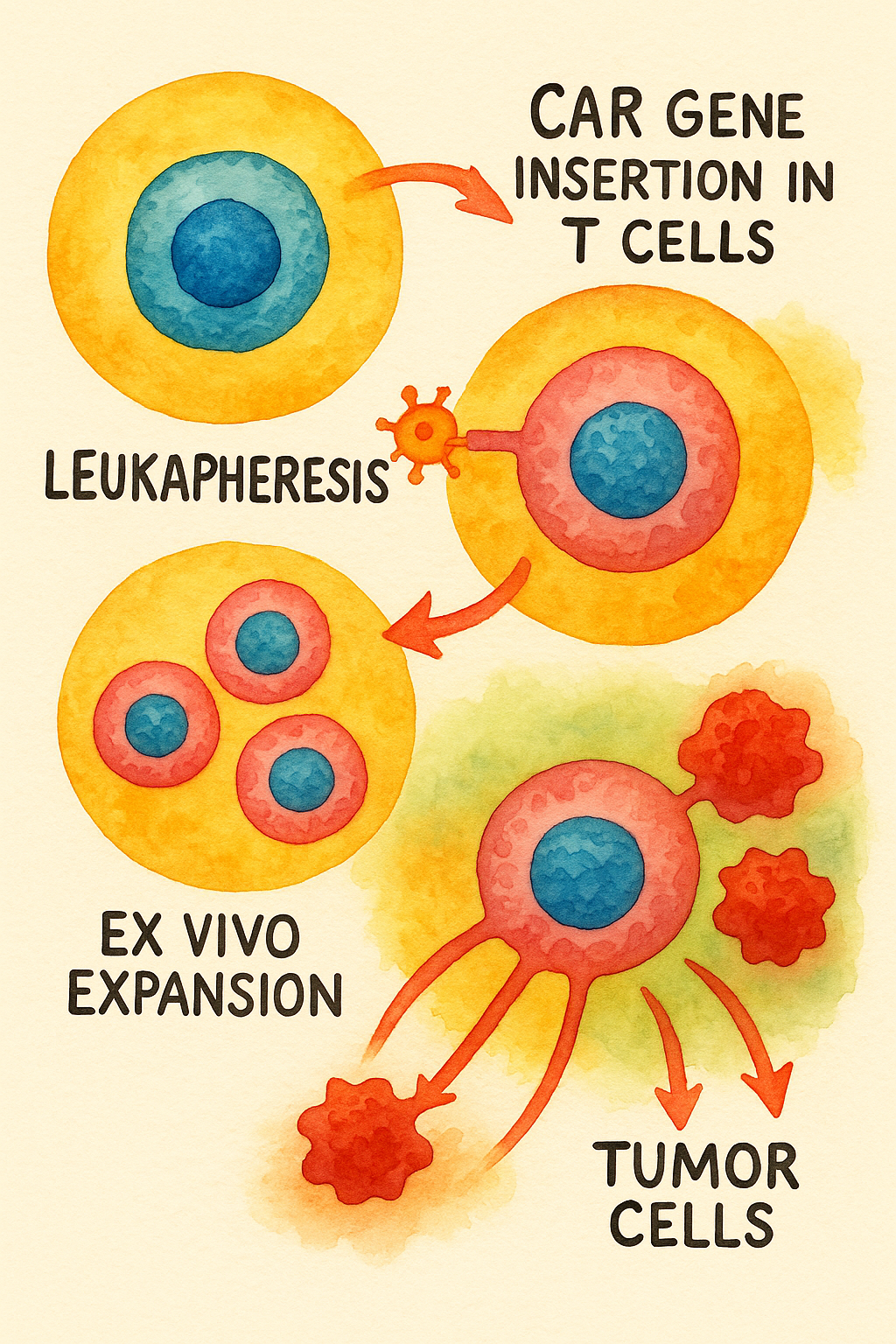
2. Üretim Süreci
- Lökaferez (Leukapheresis): Hastanın periferik kanından mononükleer hücreler (özellikle T hücreleri) ayrıştırılır.
- Gen Transferi: Viral vektörler (retroviral veya lentiviral) kullanılarak CAR yapısı T hücrelerinin genomuna entegre edilir.
- Ex vivo çoğaltma: Genetik olarak değiştirilmiş T hücreleri özel kültür ortamlarında (IL-2, IL-7, IL-15 gibi sitokinlerle) çoğaltılır.
- Kalite kontrol: Transdüksiyon verimliliği, saflık, viral kontaminasyon ve fonksiyonel testler yapılır.
- Hastaya geri veriliş (infüzyon): Lökositleri azaltan (lenfodepleting) ön tedavinin ardından hücreler hastaya damar yoluyla infüze edilir.
3. Rituximab’a Göre Önemli Avantajları
- Doğrudan hedefe yönelik sitotoksisite: Rituximab ADCC (antikor aracılı hücre kaynaklı sitotoksisite) yoluyla etki gösterirken, CAR-T hücreleri hedef antijenle doğrudan bağlanır ve bağımsız sitotoksik mekanizmalar aktive olur.
- Uzun süreli kalıcılık: CAR-T hücreleri vücutta aylarca hatta yıllarca kalabilir, bu da kalıcı tümör baskılanması sağlar.
- Direnç mekanizmalarının aşılması: CD20 kaybı veya Fc reseptör değişiklikleri gibi Rituximab direncine neden olan mekanizmalar CAR-T hücreleri için etkisizdir.
- Hedefe göre özelleştirilebilirlik: CAR yapısı farklı antijenlere göre dizayn edilebilirken, monoklonal antikorlar bu esnekliğe sahip değildir.
4. CAAR-T Hücre Tedavisi
CAAR-T (Chimeric Autoantibody Receptor T) hücre tedavisi, otoimmün hastalıklarda kullanılır ve klasik CAR yapısının bir varyasyonudur. Bu yöntemde T hücresine otoantikor hedefini tanıyan bir antijen yerleştirilir.
Örnek: Pemfigus vulgaris hastalığında, Desmoglein-3 antijenini içeren CAAR-T hücreleri, bu antijene karşı otoantikor üreten B hücrelerini seçici olarak yok eder. Böylece bağışıklık sistemine daha hedefe yönelik bir müdahale yapılır.
5. Hematolojik Etkiler: ANC Düşüşü ve Geç Sitopeniler
CAR-T tedavisinden sonra nötrofil sayısında (ANC) belirgin bir düşüş meydana gelir. Bu düşüşün sebepleri şunlardır:
- Lenfodepleting ön tedavi,
- CAR-T hücrelerinin hızlı çoğalması,
- Yaygın sitokin salınımı.
Ayrıca, aylar boyunca sürebilen geç dönem pansitopeniler (anemi, trombositopeni, nötropeni) görülebilir. Bu durum, kemik iliği baskılanması ve bağışıklık sistemi üzerindeki kalıcı etkilerle ilişkilidir. Destek tedavileri arasında G-CSF, kan ve trombosit transfüzyonları yer alır.
6. Bağışıklık Toksisiteleri: CRS ve ICANS
a) Sitokin Salınım Sendromu (CRS)
- Patofizyoloji: Aktive olan CAR-T hücreleri yüksek miktarda sitokin (IL-6, IFN-γ, TNF-α) salgılar, bu da sistemik inflamasyona yol açar.
- Klinik Bulgular: Ateş, hipotansiyon, hipoksi, organ disfonksiyonu.
- Derecelendirme: Lee CRS sınıflandırmasına göre 1’den 4’e kadar derecelendirilir.
- Tedavi: IL-6 reseptör antagonisti Tocilizumab, kortikosteroidler ve gerekirse yoğun bakım desteği.
b) ICANS (Immune effector Cell-Associated Neurotoxicity Syndrome)
- Klinik: Konfüzyon, afazi, nöbetler, koma.
- Mekanizma: Kan-beyin bariyerinin bozulması, endotel aktivasyonu ve nöroinflamasyon.
- Tedavi: Genellikle yüksek doz steroidler (örn. Deksametazon); Tocilizumab ICANS’ta sınırlı etkilidir.
7. Uzun Vadeli Bağışıklık Sonuçları
- B Hücre Aplazisi ve Hipogamaglobulinemi: CD19 hedefli CAR-T hücreleri normal B hücrelerini de ortadan kaldırır. Bu nedenle hastalarda aylarca süren B hücre yokluğu ve IgG düşüklüğü görülebilir.
- Artan enfeksiyon riski: Hem hücresel hem de humoral bağışıklık baskılanır. Profilaktik antiviral, antifungal ve IVIG desteği gerekebilir.
- Takip ve destek: IgG düzeyleri düzenli olarak kontrol edilmeli, gerektiğinde IVIG tedavisi başlanmalıdır.
Keşif
Başlangıç: T Hücrelerinin Gücü ve Antikorların Keskinliği (1980–1990’lar)
1980’li yıllarda immünolojide büyük bir dönüşüm yaşanıyordu. T hücrelerinin tümörlerle savaşmadaki doğal yetenekleri araştırmacıların dikkatini çekmişti, ancak bu hücrelerin tümöre özgü hedefleme konusunda sınırlı kaldığı da açıktı. Aynı dönemde monoklonal antikorlar (örneğin CD20’ye karşı geliştirilen Rituximab) kanser tedavisinde devrim yaratmış, ancak pasif bağlanma dışında başka bir şey yapmıyorlardı.
İlham verici fikir şuydu:
“Ya bu iki gücü birleştirsek? Yani, antikorun özgüllüğüyle T hücresinin öldürme kapasitesini tek hücrede toplasak?”
Bu fikir, birkaç bağımsız laboratuvarda gelişmeye başladı. 1989’da Zelig Eshhar adlı İsrailli bir immünolog, Weizmann Enstitüsü’nde çalışırken fare modellerinde, T hücrelerine antikor benzeri tanıma özelliği kazandırmanın yollarını araştırdı. Bu çalışmalar, ilk nesil “kimerik antijen reseptörleri (CAR)” fikrini doğurdu.
İlk Nesil CAR’lar: Teori Gerçek Olunca (1993–2002)
1993 yılında, Eshhar ve arkadaşları, scFv (tek zincirli antikor parçası) ile T hücresinin iç sinyal mekanizmasını (CD3ζ) birleştirerek ilk fonksiyonel CAR yapısını tasarladılar. Bu hücreler hedef hücrelere bağlanıyor, sinyal alıyor ve öldürücü aktivite başlatabiliyordu.
Ancak ortada büyük bir sorun vardı:
- Bu hücreler vücutta uzun süre yaşamıyordu.
- Sitokin üretimleri yetersizdi.
- İkinci bir sinyal, yani kostimülasyon eksikti.
Tıpkı bir arabayı çalıştırmak için yalnızca kontağı çevirmek yeterli olmadığı gibi, T hücreleri de sadece CD3ζ sinyaliyle tam anlamıyla aktive olamıyordu.
İkinci Nesil: T Hücrelerini “Turbo Motora” Dönüştürmek (2002–2010)
2002’de Michel Sadelain ve Carl June gibi öncü araştırmacılar, CAR yapısına ikinci bir iç sinyal alanı (örneğin CD28 veya 4-1BB) eklediler. Bu yeni yapı, CAR-T hücrelerinin hem daha uzun yaşamasını, hem de daha güçlü sinyal üretmesini sağladı.
İkinci nesil CAR’lar artık yalnızca hedefe kilitlenmekle kalmıyor, aynı zamanda birer sitokin fabrikası gibi çalışıyor, hızlı çoğalıyor ve tümörlere karşı daha dayanıklı kalıyordu.
İlk Klinik Denemeler: Umut ve Kaos Yan Yana (2010–2012)
2010 yılında, ABD’nin Pennsylvania Üniversitesi’nde Carl June liderliğindeki bir ekip, kronik lenfositik lösemi (CLL) hastası olan David Porter adlı bir kişiye CD19 hedefli CAR-T hücrelerini uyguladı. Bu vakada hastanın tümör yükü dramatik şekilde azaldı. Ancak tedavi sonrası ortaya çıkan şiddetli sitokin salınım sendromu (CRS), doktorları zor durumda bıraktı. Hasta yüksek ateş, hipotansiyon ve çoklu organ yetmezliği belirtileri gösterdi.
Ancak… hayatta kaldı. Hem de hastalığı tamamen gerileyerek. Bu vaka bir dönüm noktası oldu. 2011’de New England Journal of Medicine‘da yayımlandı ve bilim dünyasında büyük yankı uyandırdı.
FDA Onayı ve Küresel Dönüm Noktası (2017)
2017 yılında, Novartis firmasının geliştirdiği tisagenlecleucel (Kymriah), akut lenfoblastik lösemisi (ALL) olan çocuklarda kullanılması için ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylandı.
Bu, CAR-T hücre tedavisinin dünya tarihinde ilk defa bir ilaç olarak kabul edilmesi demekti.
Hemen ardından Gilead/Kite firması tarafından geliştirilen axicabtagene ciloleucel (Yescarta) onay aldı. Diğer CD19 hedefli CAR-T hücreleri, agresif B hücreli lenfomalar, mantle hücreli lenfoma ve multipl miyelom gibi hastalıklarda klinik kullanıma geçti.
CAAR-T, Solid Tümörler ve Gelecek Perspektifi (2020–Günümüz)
Son yıllarda araştırmalar iki ana eksende ilerliyor:
- CAAR-T Hücreleri: Otoimmün hastalıkların tedavisinde kullanılmak üzere geliştirildi. Örneğin, Pemfigus vulgaris’te Desmoglein-3’e karşı CAAR-T hücreleri ilk kez 2016’da başarıyla test edildi.
- Solid tümörler: CAR-T hücrelerinin katı tümörlere girememesi veya mikroskobik heterojenlik nedeniyle hedef kaybı yaşaması gibi zorluklara karşı, bispesifik CAR’lar, doku penetrasyon artırıcı dizaynlar, hatta yapay zekâ tabanlı hedef keşif algoritmaları geliştiriliyor.
İleri Okuma
- Porter, D. L., Levine, B. L., Kalos, M., Bagg, A. & June, C. H. (2011). Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. New England Journal of Medicine, 365(8), 725–733.
- Grupp, S. A., Kalos, M., Barrett, D., Aplenc, R., Porter, D. L., Rheingold, S. R., … & June, C. H. (2013). Chimeric antigen receptor–modified T cells for acute lymphoid leukemia. New England Journal of Medicine, 368(16), 1509–1518.
- Ellebrecht, C. T., Bhoj, V. G., Nace, A., Choi, E., Mao, X., Cho, M. J., … & Payne, A. S. (2016). Reengineering chimeric autoantibody receptor T cells for targeted B cell depletion in pemphigus vulgaris. Nature Medicine, 22(6), 843–850.