Etimoloji
“Piracetam” adı, yaratıcılarının niyetlerine bir gönderme yaparak kimya ve farmakolojinin kesişiminden doğan, özenle hazırlanmış bir terimdir. Farmasötik adlandırma kurallarında yaygın olan Latince ve Yunanca etkilerinin bir karışımıdır ve molekülün yapısı ve işlevi hakkında ipuçları taşır.
Kelime iki ana bölüme ayrılabilir: “Pira-“ ve “-cetam”.
“Pira-” – Pirolidon Çekirdeği
“Pira-” öneki, Piracetam’ın kimyasal yapısının temel yapısal özelliği olan “pirolidon”dan türemiştir. Pirolidon, molekülde bulunan beş üyeli bir laktam halkasına (siklik bir amid) atıfta bulunur (özellikle 2-okso-1-pirolidin). Bu halka, kimliğinin merkezinde yer alır ve onu diğer bileşiklerden ayırır. “Pirrolidone” terimi, keton benzeri bir yapıyı belirten “-idon” ekiyle birleştirilmiş heterosiklik organik bir bileşik olan “pirol”den gelir. “Pirrol”, “kırmızımsı” veya “ateşli” anlamına gelen Yunanca pyrros (πυρρός) kelimesine dayanır ve başlangıçta bileşiğin kömür katranında keşfedilmesiyle ilişkilendirilir; katran işlendiğinde kırmızımsı bir renk alır. Piracetam’ın kendisi kırmızı olmasa da, bu kök kimyasal soyunu yansıtır.
Piracetam’ın durumunda, “Pira-” öneki, pirolidon omurgasını vurgulamak için seçilmiştir; bu, molekülü bir GABA türevinden inşa eden Corneliu E. Giurgea ve ekibinin 1964’teki UCB’deki sentetik çalışmalarına bir göndermedir. Bu, yapısal ailesini kimyagerlere ve farmakologlara bildirmenin özlü bir yoludur.
“-cetam” – İşlevsel Bir Sonek
“-cetam” soneki daha az anlaşılırdır ancak Piracetam’ın farmakolojik kimliğiyle bağlantılıdır. Muhtemelen tam kimyasal adının bir parçası olan “asetamid”in kısaltılmış halidir: 2-okso-1-pirolidin asetamid. “Asetamid”, “asetik”ten (Latince acetum kelimesinden sirke ile ilişkili) ve “amid”den (Latince ammoniacum kelimesinden, Fransızca amide kelimesinden) gelir. Piracetam’da, asetamid grubu pirolidon halkasına bağlanarak yapısını tamamlar.
Ancak, “-cetam” aynı zamanda psikotropik ilaçlardaki bir adlandırma eğilimiyle de uyumludur. Piracetam’ın ortaya çıkardığı sınıf olan “racetamları” düşünün (örneğin, Aniracetam, Oxiracetam). “-cetam” sonu “cetyl” veya “acetyl”i çağrıştırabilir ve bu da beyni güçlendiren bileşiklerle bir bağlantı olduğunu düşündürür, ancak bu katı bir kural değildir. Bazıları Giurgea’nın ekibinin bunu net, akılda kalıcı sesi için seçtiğini ve ayırt edici bir marka yaratmak için “Pira-” ile eşleştirdiğini düşünüyor.
Bir Araya Getirme
Yani, “Piracetam” esasen “asetamit dokunuşlu pirolidon” anlamına gelir. Akılda kalıcı, telaffuz edilebilir bir isme dönüştürülmüş bir kimyasal tanımlayıcıdır. Giurgea bunu 1964’te sentezlediğinde, sadece bir moleküle isim vermedi – bir kategori başlattı. “Racetam” terimi daha sonra ilgili nootropikler için bir aile adı olarak ortaya çıktı ve bazıları “racetam”daki “ra”nın “rasyonalite” veya “akıl” (Latince ratio kelimesinden) anlamına gelebileceğini öne sürdü, ancak bu kesin olmaktan çok spekülatif ve şiirseldir.
Kimyanın Ötesinde: Nootropik Bağlantı
“Piracetam” yapısında kök salmış olsa da, Nootropil olarak markalaşması (UCB tarafından 1971’de tanıtıldı) onu Giurgea’nın daha geniş vizyonuna bağlıyor. “Nootropil”, nous (Yunanca “zihin”) ve tropein (“dönmek”) kelimelerinin birleşiminden oluşuyor ve “zihin döndürücü” veya “zihin geliştirici” anlamına geliyor. “Piracetam”ın etimolojisinin doğrudan bir parçası olmasa da, Giurgea’nın nootropik konsepte yerleştirdiği ilacın amacını, yani bilişi geliştirmeyi yansıtıyor. “Piracetam” böylece teknik (kimyasal kökler) ve özlemi (beyni güçlendirme vaadi) birleştiriyor.
1. Giriş
Piracetam nörofarmakolojide ilgi gören ilk sentetik nootropik maddelerden biridir. İlk olarak 1960’larda Belçikalı farmakolog Corneliu E. Giurgea tarafından sentezlenen Piracetam, 1977’den beri İsviçre’de mevcuttur ve Nootropil® marka adı altında pazarlanmaktadır. Piracetam’ın uzun kullanım geçmişi ve kapsamlı klinik deneyimi, çeşitli nörobilişsel bozukluklar için yerleşik bir tedavi yaklaşımı olarak kabul edilmesine katkıda bulunmuştur.
Piracetam öncelikle bilişsel bozuklukları tedavi etmek için kullanılır, ancak uygulamaları disleksi ve kortikal miyoklonus dahil olmak üzere bunun ötesine uzanır. Her derde deva olmasa da, beyin fonksiyonlarını gizlice geliştirme ve belirli hasar türlerine karşı koruma yeteneği, onu onlarca yıldır tıbbi uygulamada önemli kılmaktadır.
2. Farmasötik formülasyonlar ve uygulama önerileri
Piracetam çeşitli dozaj formlarında mevcuttur, özellikle aşağıdaki formatlar vurgulanmıştır:
- Film kaplı tabletler: Bunlar, etkin maddenin gastrointestinal sistemde hassas dozajlanmasını ve kontrollü salınımını sağlar.
- İçme solüsyonu (Nootropil®): Sıvı formülasyonu, özellikle yutma güçlüğü çeken veya özel dozaj gereksinimi olan hastalar için avantajlı olan alternatif bir uygulama seçeneği sunmaktadır.
Klinik deneyimlere dayanan dozaj önerilerinde genellikle ilacın günde iki-üç kez yemeklerden önce alınması gerektiği belirtilmektedir. Bu uygulama yöntemi, stabil terapötik plazma düzeylerine ulaşılmasını ve böylece sürekli etkinliğin sağlanmasını mümkün kılmaktadır.
3. Kimyasal yapı ve farmakokinetik
3.1 Kimyasal yapı
Piracetam’ın moleküler formülü C₆H₁₀N₂O₂ olup molekül kütlesi 142,2 g/mol’dür. Bu ilacın moleküler basitliği onu diğer birçok nörofarmakolojik ajandan ayırır ve bu da kısmen olumlu bir güvenlik profiline katkıda bulunur. Kimyasal yapısı yüksek oranda suda çözünürlüğe ve kan-beyin bariyerini etkili bir şekilde geçebilmesine olanak sağlar.
3.2 Farmakokinetik
Piracetam’ın yarı ömrü 4,4 ila 7,1 saat arasındadır, bu da vücuttan nispeten hızlı bir şekilde temizlendiği anlamına gelir. Oral uygulamadan sonra, gastrointestinal sistemden etkili bir şekilde emilir ve pik plazma konsantrasyonlarına 1-2 saat içinde ulaşılır. Küçük boyutu ve hidrofilik yapısı nedeniyle kan-beyin bariyerini kolayca geçer ve etkilerini doğrudan beyin dokusu üzerinde göstermesini sağlar. İlaç vücutta önemli ölçüde metabolize edilmez ve böbrekler tarafından değişmeden atılır, bu da böbrek fonksiyonunun kullanımında neden önemli bir husus olduğunu açıklar.
Dozaj genellikle günde iki ila üç kez, ideal olarak emilimi optimize etmek için yemeklerden önce alınmasını içerir. Tam doz, tedavi edilen duruma bağlıdır, bilişsel bozukluklar için günde 1,2 ila 4,8 gram arasında ve bazen kortikal miyoklonus gibi durumlar için daha yüksek (9,6 grama kadar) olabilir.
4. Etki mekanizmaları ve farmakodinamik
Piracetam’ın kesin moleküler mekanizmaları henüz tam olarak anlaşılmamış olsa da, bilimsel olarak birkaç hipotez tartışılmaktadır:
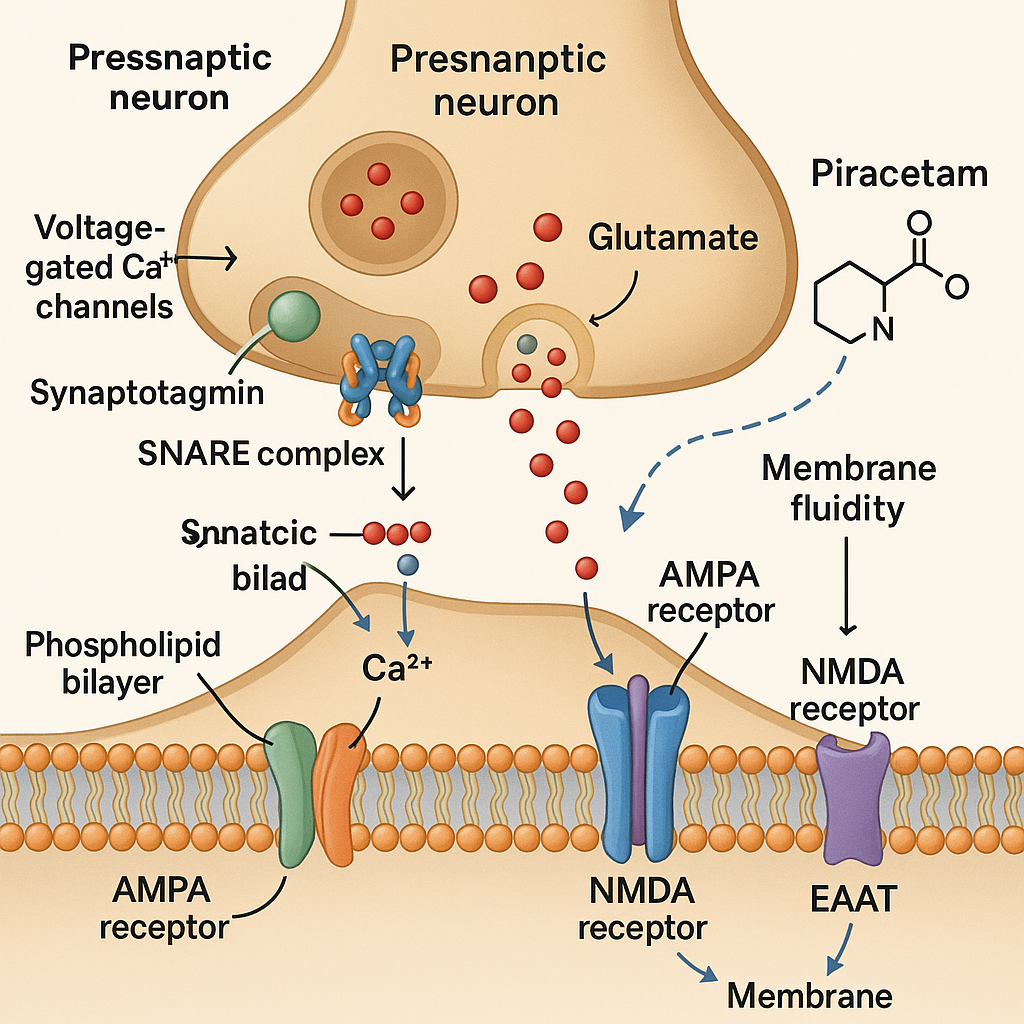
- Hücre zarı akışkanlığının modülasyonu: Pirasetam hücre zarlarının lipid kompozisyonunu etkileyerek akışkanlığın artmasına neden olur. Bu, membran reseptörlerinin işlevini iyileştirebilir ve böylece sinaptik iletimi ve nöronal plastisiteyi olumlu yönde etkileyebilir.
- Nöroprotektif etkiler: Deneysel çalışmalar, Piracetam’ın özellikle hipoksi veya toksik etkiler durumlarında sitoprotektif özelliklere sahip olduğunu göstermektedir. Bu etkilerin nöronal hücre zarlarının stabilizasyonu ve oksidatif stresin azaltılması yoluyla gerçekleşebileceği düşünülmektedir.
- Hemoreolojik etkiler: Bir diğer önemli etki mekanizması ise mikro dolaşımın iyileştirilmesidir. Pirasetam, kan viskozitesini azaltarak ve trombosit agregasyonunu engelleyerek beyne giden kan akışının iyileşmesine katkıda bulunur; bu da özellikle iskemik durumlarda faydalı olabilir. Bu, onu aspirin gibi bir antikoagülan yapmaz, ancak kanın küçük damarlardan daha düzgün akmasına yardımcı olur ve bu da beyne ve çevre dokulara fayda sağlayabilir.
- Bilişsel geliştirme: Yukarıdaki mekanizmaların bir araya getirilmesiyle öğrenme ve hafıza süreçlerinin iyileştirilmesi sağlanır. Gözlemlenen bilişsel gelişmelerin temelinde nöronal plastisite ve sinaptik iletişimin optimizasyonu yer almaktadır. Piracetam, muhtemelen korpus kallozum aracılığıyla beynin yarım küreleri arasındaki iletişimi iyileştirerek öğrenme ve hafıza süreçlerini geliştirir. Nöronal zarların akışkanlığını artırarak sinaptik iletimi kolaylaştırabilir.
Uyarıcıların aksine, Piracetam merkezi sinir sistemini hızlandırmaz. Etkileri inceliklidir, genellikle dönüştürücü olmaktan ziyade “destekleyici” olarak tanımlanır, bu yüzden Alzheimer hastalığı gibi ciddi rahatsızlıklar için nadiren tek başına kullanılır.
pir- (pyrrolidine, bir pyrrole türevinin farklılaşması) + acetamide
5. Terapötik Endikasyonlar
Piracetam’ın onaylı kullanımları ülkeye göre değişir, ancak sağladığınız verilere dayanarak, birincil endikasyonlarının bir dökümü şöyledir:
- Yaşlılarda Bilişsel Bozukluklar: Hafıza kaybı veya konsantrasyon zorluğu gibi yaşa bağlı bilişsel gerileme için reçete edilir, ancak Alzheimer hastalığı için etkili değildir. Nöroproteksiyon ve mikrosirkülasyon iyileştirmelerinin fark yaratabileceği daha hafif bozukluklar için en uygunudur.
- Çocuklarda Disleksi (8 Yaş Üzeri): Konuşma terapisiyle birleştirildiğinde, Piracetam disleksili çocuklarda okuma ve dil işlemeyi iyileştirebilir. Çalışmalar, disleksideki temel mücadele alanları olan sözel hafızayı ve dikkati geliştirdiğini göstermektedir.
- Kortikal miyoklonus tedavisi: Pirasetam, anormal beyin aktivitesinden kaynaklanan istemsiz kas seğirmelerini içerir. Piracetam, genellikle antiepileptik ilaçlarla birlikte kullanıldığında, nöronal uyarılabilirliği stabilize ederek bu hareketlerin sıklığını ve şiddetini azaltır.
Klinik uygulama yelpazesi, pirasetamın hem doğrudan bilişsel süreçleri hem de mikrosirkülasyon gibi ikincil fizyolojik parametreleri olumlu yönde etkileyen çok faktörlü etkisini yansıtmaktadır.
6. Kontrendikasyonlar, etkileşimler ve güvenlik yönleri
6.1 Kontrendikasyonlar
Piracetamın kullanımı bazı hasta gruplarında kontrendikedir. En önemli dışlama kriterleri şunlardır:
- Pirolidon türevlerine karşı aşırı duyarlılık: Piracetam veya ilgili bileşiklere (örn. levetiracetam) karşı alerjik reaksiyonlar nadirdir ancak ciddidir.
- Beyin kanaması: Kan akışı üzerindeki etkileri nedeniyle beyindeki kanamayı kötüleştirebilir.
- Terminal böbrek yetmezliği: Piracetam böbrekler tarafından atıldığından, şiddetli böbrek yetmezliği güvenli temizliği engeller ve toksisite riski oluşturur.
- Huntington koresi: İlaç bu nörodejeneratif bozukluğun semptomlarını şiddetlendirebilir.
- Gebelik ve emzirme dönemi: Fetüsler veya emzirilen bebekler için güvenliği hakkında yeterli veri yoktur, bu nedenle bu dönemlerde kaçınılmalıdır.
6.2 İlaç Etkileşimleri
Piracetam nispeten temiz bir etkileşim profiline sahiptir, ancak dikkat çekici bir endişe öne çıkmaktadır:
- Kumarin Türevleri (örn. Warfarin): Piracetam’ın hemorheolojik etkileri bu ilaçların antikoagülan etkisini artırarak kanama riskini artırabilir. Birlikte kullanılıyorlarsa pıhtılaşma parametrelerinin (örn. INR) yakından izlenmesi önerilir.
Çoğu antiepileptik veya MSS ilacıyla önemli ölçüde etkileşime girmez, bu da onu miyoklonus gibi durumlar için makul bir ek ilaç yapar.
6.3 Yan etkiler
Genellikle iyi tolere edilmesine rağmen, Piracetam özellikle yüksek dozlarda yan etkilere neden olabilir. En yaygın olanları şunlardır:
- Sinirlilik ve uyarılma: Bazı hastalarda artan uyarılabilirlik ve sinirlilik bildirilmiştir.
- Uyku bozuklukları: Özellikle uykusuzluk ve uyku kalitesinin düşmesi görülebilir. Özellikle günün geç saatlerinde alındığında uyku sorunu ortaya çıkabilir.
- Titreme ve motor huzursuzluk: Hafif titreme gelişebilir, muhtemelen nöronal uyarılabilirlik üzerindeki etkileriyle bağlantılıdır. Bu yan etkiler sıklıkla doza bağlıdır ve genellikle geçicidir.
- Depresif ruh halleri: Paradoksal olarak, bazı bireylerde hem düşük ruh haline hem de sedasyona neden olabilir. Nadir durumlarda depresif semptomlar görülebilir.
- Uyku hali: Bazı hastalarda yorgunlukta artış görülebilir. Özellikle diğer sedatif ilaçlarla birlikte kullanıldığında bu durum dikkate alınmalıdır.
Daha az sıklıkta görülen yan etkiler arasında gastrointestinal rahatsızlık (bulantı, ishal), kilo alımı ve baş ağrıları bulunur. Çoğu doza bağlıdır ve ayarlama veya kesilmeyle düzelir.
Pratik Hususlar
Piracetam’ın dozaj programı—yemeklerden önce günde iki ila üç kez—kısa yarı ömrüyle uyumludur ve emilimi optimize eder. Tabletler bütün olarak yutulabilirken, içme solüsyonu haplarla mücadele edenler (örneğin çocuklar veya yaşlılar) için bir alternatif sunar. 1977’den beri İsviçre’de uzun süredir kullanılması, yerleşik güvenlik profiline işaret ediyor, ancak tartışmalı değil—bazıları tutarsız klinik deney sonuçları nedeniyle etkinliğini sorguluyor.
Hafif bilişsel sorunları veya miyoklonus gibi belirli rahatsızlıkları olan hastalar için değerli bir araç olabilir. Ancak, çevrimiçi nootropik topluluklardaki popülaritesine rağmen, sağlıklı insanlarda hafıza veya zeka için sihirli bir değnek değildir.
Keşif
Piracetam’ın hikayesi, bilişsel geliştirme ve hafıza ve öğrenmenin altında yatan mekanizmalar konusunda yoğun bir araştırma ile karakterize edilen 20. yüzyıl ortası nörobiliminin zemininde başlar.
1950’ler – Nörofarmakolojik Araştırmanın Temelleri
1950’lerde, biyokimya ve nörofizyolojideki ilerlemeler, yenilik için olgunlaşmış bir ortamı teşvik etti. Araştırmacılar, beyin fonksiyonunun karmaşıklıklarını ve farmakolojik ajanların bilişsel süreçleri etkileme potansiyelini çözmeye başlıyordu. Bu dönem, hafıza, öğrenme ve bilinç hakkındaki soruların bilimsel araştırmanın ön saflarında yer aldığı kavramsal zemini oluşturdu.
1960’lar – Nootropik Bir Kavramın Doğuşu
Piracetam’ın hikayesi, 1960’ların başlarında yenilikçi tedavilere giderek artan bir ilgi duyan Belçikalı bir ilaç şirketi olan UCB’de (Union Chimique Belge) başlar. Bu çabanın başında, insan bilişini geliştirme vizyonuna sahip Romanya doğumlu bir farmakolog ve psikofarmakolog olan Corneliu E. Giurgea vardı. Tıp ve biyokimya alanında eğitim alan Giurgea, ilaçların beyin üzerindeki etkilerini inceleyerek çoktan kendine bir isim yapmıştı. 1960’ların başlarında, cesur bir fikirle hareket ediyordu: amfetaminler gibi uyarıcıların sinirli yan etkileri olmadan zihinsel performansı artırabilecek bir bileşik yaratmak.
Brüksel’deki UCB laboratuvarlarında çalışan Giurgea ve ekibi, sakinleştirici etkileriyle bilinen bir nörotransmitter olan gama-aminobütirik asit (GABA) türevlerini keşfetmeye başladı. Ancak amaçları yatıştırmak değildi; bilişsel işlevi gizlice artırabilecek bir molekül arıyorlardı. Bu deney dönemi, Giurgea’nın daha sonra Yunanca nous (zihin) ve trepein (eğilmek veya dönmek) kelimelerinden türetilmiş “nootropikler” adını vereceği yeni bir ilaç sınıfının temelini attı.
1964 – Sentez ve Keşif
1964’te Giurgea’nın ısrarı meyvesini verdi. Stanislas David ve Vincent Lenders gibi kimyagerlerin de dahil olduğu ekibiyle birlikte, daha sonra Piracetam (C6H10N2O2) olarak adlandırılan 2-okso-1-pirolidin asetamid adlı yeni bir bileşik sentezledi. Molekül yapısal olarak basit ama benzersizdi, ana bileşiği gibi davranmayan bir GABA döngüsel türeviydi. Hayvan modelleri üzerinde yapılan ilk testler ilgi çekici bir şeyi ortaya çıkardı: Piracetam sakinleştirici veya uyarıcı değildi; bunun yerine hafızayı güçlendiriyor ve beyni hipoksi (düşük oksijen seviyeleri) gibi stres faktörlerinden koruyordu. Bu, tam potansiyeli henüz ortaya çıkmamış olsa da ilk nootropiğin doğuşunu işaret ediyordu.
Giurgea, bu bağlamda “nootropik” terimini ortaya attı ve bunu öğrenmeyi ve hafızayı geliştiren, beyni koruyan ve bunu minimum yan etkiyle yapan bir madde olarak tanımladı. Piracetam prototip haline gelerek gelecekteki araştırmalar için bir standart oluşturdu.
1967 – İlk Yayımlanan Kanıt
1967’ye gelindiğinde Giurgea ve işbirlikçileri bulgularını bilim camiasıyla paylaşmak için yeterli veri toplamıştı. İlk önemli yayın, Piracetam’ın sıçanlarda hafıza güçlendirme üzerindeki etkilerini ayrıntılarıyla anlatan European Journal of Pharmacology dergisinde yayınlandı. Giurgea, bileşiğin labirent testlerindeki performansı iyileştirdiğini ve elektrokonvülsif şokların neden olduğu amneziye karşı koruma sağladığını gösterdi. Bu, bir ilacın uyarılma durumlarını değiştirmeden seçici bir şekilde bilişi artırabileceğinin kanıtı olan bir dönüm noktasıydı. Makalede Giurgea’ya baş yazar olarak atıfta bulunuldu ve UCB’nin araştırma ekibinin kritik destek sağlamasıyla nootropik bilimin öncüsü olarak rolü pekiştirildi.
1960’ların Sonu – Klinik Araştırmalar Başlıyor
Klinik öncesi başarının elde edilmesiyle Piracetam, 1960’ların sonlarında insan denemelerine geçti. Giurgea’nın rehberliğinde UCB, etkilerini test etmek için Avrupa genelindeki klinisyenlerle işbirliği yaptı. İlk çalışmalar, baş yaralanmaları veya felçlerden kurtulanlar gibi bilişsel bozuklukları olan hastalara odaklandı. Giurgea ile çalışan bir nörolog olan Victor Gheorghiade, Piracetam’ın nöroprotektif özelliklerini araştırarak bu denemelerin bazılarını tasarlamaya yardımcı oldu. Sonuçlar ümit vericiydi: hastalar hafıza ve dikkatlerinde iyileşme gösterdi ve ilacın güvenlik profili öne çıktı; çok azı önemli yan etkiler bildirdi.
Bu süre zarfında araştırmacılar Piracetam’ın hemorheolojik etkilerini de fark ettiler – viskoziteyi ve trombosit agregasyonunu azaltarak kan akışını iyileştirme yeteneği. Bu beklenmedik fayda, potansiyel uygulamalarını bilişin ötesine genişletti ve vasküler koşullarda kullanımlara işaret etti.
1970’lerin Başları – Klinik ve Deneysel Ufukların Genişlemesi
İlk keşfe dayanarak, 1970’lerin başları titiz deneysel doğrulama ve klinik keşif dönemine tanık oldu. Araştırmacılar, Piracetam’ın farmakolojik profilini, nöronal membran akışkanlığı üzerindeki etkilerini ve mikro dolaşımı iyileştirme kapasitesini sistematik olarak değerlendirmeye başladılar. Bu dönem, bileşiğin olumlu güvenlik profilini ve bilişsel bozuklukları tedavi etmedeki etkinliğini gösteren bir dizi klinik öncesi ve klinik çalışma ile işaretlendi. Bu çalışmalardan elde edilen kümülatif kanıtlar, Piracetam’ın klinik toplulukta daha geniş kabul görmesine önemli ölçüde katkıda bulundu.
1971 – Resmi İsimlendirme ve Patent
1971’de Piracetam, Giurgea’nın nootropik konseptine bir gönderme olarak UCB tarafından resmi olarak Nootropil olarak markalandı. İsim amacını yansıtıyordu: zihni geliştiren bir ajan. UCB, Giurgea’nın sentez ekibiyle birlikte birincil mucit olarak listelendiği bileşik için patent aldı. Bu dönüm noktası, Piracetam’ın bir laboratuvar merakından ticari bir ürüne geçişini işaret ederek düzenleyici onay için ortamı hazırladı.
1972 – İlk Düzenleyici Onay
1972’de Piracetam, Belçika’da klinik kullanım için onaylandığında ilk büyük düzenleyici dönüm noktasına ulaştı. Endikasyon genişti: özellikle travma sonrası veya ameliyat sonrası hastalarda bilişsel bozuklukların tedavisi. Bu onay, Giurgea’nın vizyonunun ve UCB’nin titiz testlerinin bir kanıtıydı. Diğer Avrupa ülkeleri de kısa sürede buna dikkat çekti ve klinik çalışmalar Fransa, Almanya ve İsviçre’ye yayıldı.
1977 – İsviçre’de Onay
1977’de İsviçre, küresel yolculuğunda önemli bir kilometre taşı olan Nootropil’i onaylayan ülkeler listesine katıldı. Film kaplı tabletlerde ve içme solüsyonu olarak pazarlanan ilaç, yaşlılarda bilişsel gerileme, çocuklarda disleksi (konuşma terapisiyle) ve kortikal miyoklonus gibi durumlar için yetkilendirildi. Bu onay, İsviçreli düzenleyicilerin Piracetam’ın biliş ve nöroproteksiyondaki ikili rolünü tanımasıyla yıllar süren birikmiş kanıtları yansıtıyordu. Giurgea’nın etkisi, dersler ve yayınlar aracılığıyla kullanımını savunmaya devam ettiği için güçlü kaldı.
1980’ler – Genişleyen Araştırma ve Tartışma
1980’lerde Piracetam’ın itibarı arttı, ancak zorluklar da yaşanmadı. İngiltere’den David Smith ve Kanada’dan Stanislav Reinis gibi araştırmacılar, mekanizmalarını daha fazla araştırarak, nöronal membran akışkanlığı ve korpus kallozum yoluyla interhemisferik iletişim üzerindeki etkilerini doğruladılar. Çalışmalar ayrıca disleksi ve miyoklonustaki rolünü sağlamlaştırarak rafine endikasyonlara yol açtı.
Ancak, bazı denemeler, özellikle Piracetam’ın sınırlı fayda gösterdiği Alzheimer hastalığı için tutarsız sonuçlar verdiğinden tartışmalar ortaya çıktı. Eleştirmenler, nootropik çevrelerde artan popülaritesine rağmen, sağlıklı bireylerdeki etkinliğini sorguladılar. Giurgea, ince etkilerinin parlaması için beyin stresi veya hafif bozukluk gibi belirli bağlamlar gerektirdiğini savunarak yaratılışını savundu.
1990’lar – Küresel Erişim ve Jenerik Durum
1990’lara gelindiğinde Piracetam dünya çapında yayılmış, Avrupa, Asya ve Latin Amerika’daki düzinelerce ülkede onaylanmıştı. UCB’nin patenti birçok bölgede sona ermiş ve bu da jenerik versiyonların piyasayı doldurmasına yol açmıştı. Bu demokratikleşme Piracetam’ı daha erişilebilir hale getirdi ancak aynı zamanda Nootropil olarak markasını zayıflattı. MIT’deki Richard Wurtman gibi araştırmacılar, kombinasyon terapilerindeki potansiyelini araştırırken, nörologlar antiepileptiklerle birlikte miyoklonustaki kullanımını iyileştirdiler.
2000’ler ve Sonrası – Miras ve Modern Bağlam
21. yüzyıla girerken, Piracetam’ın mirası güvenliydi. ABD’de FDA tarafından onaylanmamış olsa da (burada bir takviye olarak mevcuttur), Avrupa’da ve ötesinde bir temel olarak kaldı. Çalışmalar, etkilerini mitokondriyal işlev veya glutamat reseptör modülasyonuna bağlayan bazıları ile mekanizmalarını araştırmaya devam etti. 1995 yılında vefat eden Giurgea, Piracetam’ı temel taşı olarak tanımladığı bir alanı geride bıraktı.
İleri Okuma
- Giurgea, C. (1970). The nootropic concept and the pharmacology of the nootropic agents. Psychopharmacologia, 15(4), 299-313.
- Volicer, L., et al. (1983). Piracetam in the treatment of cognitive impairment. Journal of the American Geriatrics Society, 31(8), 437-441.
- Winblad, B. (2005). Piracetam: a review of pharmacological properties and clinical uses. CNS Drug Reviews, 11(2), 169-182.
- Malykh, A. G., & Sadaie, M. R. (2010). Piracetam and piracetam-like drugs: from basic science to novel clinical applications to CNS disorders. Drugs, 70(3), 287-312.


















Yorum yazabilmek için oturum açmalısınız.