Ticari adlar: Fraxiparine®, Fraxiforte®
Düşük molekül ağırlıklı heparindir.
Tıp terimleri sözlüğü

Ticari adlar: Fraxiparine®, Fraxiforte®
Düşük molekül ağırlıklı heparindir.
Sinonim: etoposide.
Ticari isim: Vepesid®
Topoisomeraz II enzimini engelleyen bir sitostatik ilaçtır.

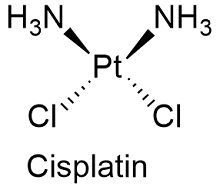
Sinonim: Cisplatin,
Ticari isimleri: Cis-GRY® Platinol®
Sisplatin, infüzyon için konsantre olarak mevcuttur. İsviçre’de çeşitli jenerikler mevcuttur. Platinol® ticaret dışıdır.
Cisplatin (PtCl2 (NH3) 2, Mr = 300.1 g / mol) veya cis-diamminedikloroplatin (II), sarı bir toz veya turuncu-sarı kristaller halinde mevcuttur ve suda az çözünür. Merkezinde platin katyon bulunan inorganik bir ağır metal kompleksi bileşiğidir.

İhtiyati tedbirlerin tamamı ürün bilgi sayfasında bulunabilir.
Oseltamivir adı, modern farmasötik adlandırma geleneklerinin tipik bir ürünüdür: jenerik ilaç isimlerinde baştaki hece/önek çoğu kez anlamsız (ayırt edici) olacak şekilde tasarlanır; buna karşılık orta/son ekler, bileşiğin sınıfı ve etkisi hakkında sınırlı ama sistematik ipuçları taşır. Bu bağlamda “-vir” bileşeni, antivirallere işaret eden yerleşik bir adlandırma unsurudur. “-ami-” ya da “-am-” ara öğesi ise nöraminidaz inhibitörleriyle ilişkili bir “infix” olarak değerlendirilir; böylece ad, kimyasal özgünlük ile farmakolojik sınıflandırmayı birlikte taşır. “Oselt-” kısmının ise özellikle anlam yüklenmemiş bir ayırt edici kök olarak seçildiği kabul edilir.
Bu adlandırma tarzı, 20. yüzyılın ikinci yarısından itibaren ilaç isimlendirmesinde benimsenen iki hedefin uzlaşmasıdır: (i) her molekül için benzersiz, karışmayı azaltan bir isim; (ii) klinisyenin ve eczacının, isme bakarak sınıf ve temel etki mekanizmasına dair hızlı bir zihinsel haritalama yapabilmesi.
Oseltamivir’in ortaya çıkışı, influenzanın yalnızca “mevsimsel” bir solunum yolu hastalığı değil, aynı zamanda küresel biyogüvenlik ve sağlık ekonomisi açısından stratejik bir tehdit olarak kavramsallaştırıldığı dönemin ürünüdür. 1990’larda moleküler virolojideki ilerlemeler, influenza virüsünün yüzey glikoproteinleri olan hemaglutinin (HA) ve nöraminidaz (NA) üzerinden hedeflenebileceğini netleştirmiş; NA’nın, virüsün konak hücre yüzeyinden ayrılıp yayılması için kritik bir enzim olduğu anlaşılmıştır. Bu bilgi, NA’yı seçici biçimde baskılayan küçük moleküllerin rasyonel tasarımını teşvik etmiştir.
Oseltamivir’in klinikleşme süreci birkaç tarihsel eksen üzerinde okunabilir:
İnfluenza virüsü, RNA genomu nedeniyle yüksek mutasyon hızına ve geniş konak yelpazesine sahip bir patojendir. Evrimsel düzlemde oseltamivir’i anlamak için dört katman birlikte düşünülmelidir:
İnfluenza virüsünün hücreye girişinde HA, konak hücre yüzeyindeki sialik asit içeren reseptörlere bağlanır. Kuşlar ve insanlar arasında sialik asit bağlarının topolojisi ve dokulardaki dağılım farklıdır; bu, zoonotik sıçrama ve adaptasyonun temel biyolojik zeminidir. NA ise, virüsün yeni oluşan partiküllerinin hücre yüzeyine ve birbirlerine yapışmasını engellemek için sialik asit kalıntılarını keser; böylece virüsün “çıkışı” ve yayılması kolaylaşır. Bu nedenle NA, influenza yaşam döngüsünün yayılım aşamasında “darboğaz” niteliği taşır.
Konak, mukus tabakası ve sialillenmiş glikanlarla virüsü fiziksel-kimyasal olarak tuzaklamaya çalışır; virüs ise NA aracılığıyla bu bariyeri aşar. Bu çift yönlü seçilim, NA’nın işlevsel zorunluluklarını korurken antijenik değişkenlik kazanmasına yol açar. Dolayısıyla NA’yı hedeflemek, evrimsel olarak “vazgeçilmez” bir işlevi baskılamaya yöneliktir; fakat aynı zamanda direnç mutasyonları açısından da seçilim baskısı yaratır.
İnfluenza A’da farklı alt tiplerin (NA alt tipleri dahil) dolaşımı, antijenik sürüklenme ve reassortment (segment değişimi) ile birleştiğinde, hem bağışıklık kaçışı hem de ilaç duyarlılığı açısından dinamik bir manzara oluşturur. Oseltamivir gibi NA inhibitörleri, uygun kullanıldığında yayılımı azaltabilir; ancak popülasyon düzeyinde yaygın ve kontrolsüz kullanım, direnç mutasyonlarının seçilimine katkıda bulunabilir. Bazı direnç mutasyonları, ilaca bağlanmayı azaltırken enzim fonksiyonunu da düşürerek “uygunluk maliyeti” yaratır; buna rağmen belirli bağlamlarda (özellikle belirli suş arka planlarında) dirençli varyantlar dolaşıma girebilir.
Su kuşları, influenza A için geniş bir gen havuzu oluşturur; insan popülasyonundaki mevsimsel dolaşım, bu geniş havuzla zaman zaman etkileşime girerek pandemik riskleri şekillendirir. Bu nedenle NA inhibitörleri, yalnızca bireysel tedavi aracı değil, aynı zamanda salgın yönetimi stratejilerinde yer alan bir biyomedikal müdahaledir.
Oseltamivir üretimi, farmasötik kimya ile endüstriyel biyoteknolojinin kesişiminde “stratejik sentez” örneklerinden biridir. Şikimik asit, aromatik amino asit biyosentezinin şikimat yolunda yer alan, kiral merkezleri uygun bir iskele sunan bir moleküldür. Bitkisel kaynaklardan (özellikle yıldız anasonu) elde edilebilmesi, başlangıçta ticari üretimde cazip bir rota sağlamıştır; ancak tarımsal üretim döngüsü, düşük izolasyon verimi ve tedarik dalgalanmaları, büyük ölçekli üretimde kırılganlık yaratmıştır. Bu kırılganlık, iki ana yanıtı hızlandırmıştır:
Bu bağlam, bir antiviral ilacın yalnızca farmakolojisinin değil, aynı zamanda ham madde jeopolitiğinin ve endüstriyel ölçeklenebilirliğinin de klinik erişilebilirliği belirlediğini gösteren öğretici bir örnektir.
Oseltamivir, klinikte oseltamivir fosfat formu ile kullanılan, ağızdan alınabilen bir prodrug’dır. Vücuda alındıktan sonra başlıca hepatik karboksilesterazlar tarafından hidrolize edilerek aktif metabolit olan oseltamivir karboksilata dönüşür. Aktif metabolit, influenza A ve B virüslerinin yüzeyindeki nöraminidaz enzimini inhibe eder. Bunun biyolojik sonucu şudur:
Bu mekanizma, influenzada tedavi zamanlamasının neden kritik olduğunu açıklar: virüs replikasyonu ve yayılımı enfeksiyonun erken döneminde en yoğundur; bu nedenle NA inhibitörlerinin klinik etkisi, genellikle semptomların başlangıcını izleyen erken saatler-günler içinde başlandığında daha belirgin olur.
Oseltamivir’in klinik yeri, basitçe “gribi geçirir” iddiasından daha nüanslıdır. Güncel yaklaşım, risk tabakalı ve zaman penceresine duyarlı bir kullanımı benimser:
Prodrug stratejisinin amacı, oral emilimi artırırken aktif inhibitörün sistemik dolaşımda yeterli düzeye ulaşmasını sağlamaktır. Oseltamivir’in klinik pratikte önem taşıyan PK/PD başlıkları şunlardır:
NA inhibitörlerine direnç, influenza yönetiminin kalıcı bir bileşenidir. Direncin biyolojik mantığı, enzimin aktif bölgesindeki veya bağlanma cebindeki değişimlerin ilacın afinite ve inhibitör kapasitesini azaltmasıdır. Bununla birlikte direnç mutasyonları çoğu zaman “uygunluk maliyeti” taşır; yani virüsün yayılım kabiliyetini azaltabilir. Fakat belirli genetik arka planlarda bu maliyet telafi edilebilir ve dirençli suşlar dolaşıma girebilir. Bu nedenle oseltamivir kullanımında üç ilke öne çıkar:
Oseltamivir genel olarak iyi tolere edilse de, klinik karar verme sürecinde güvenlilik unsurları önemlidir:
Erken Gözlemler ve Influenza Araştırmaları: İnsanlık tarihi boyunca grip salgınları binlerce can aldı. 1918 İspanyol Gribi gibi büyük pandemiler, bilim insanlarını virüsü anlamak için motive etti. 1933’te Richard Shope’in hayvanlarda ve kısa süre sonra Thomas Francis Jr. ve ekiplerinin laboratuvarda influenza virüsünü izole etmesiyle (influenza A virüsü) grip araştırmaları hız kazandı. Erken dönemlerde virüsün yüzeyindeki hemaglütinin (HA) ve nöraminidaz (NA) adındaki iki önemli proteini tanımlandı. NA enzimine dikkat edildi çünkü virüsün salgınını devam ettirebilmesi için enfekte hücreden yeni virüs parçacıklarını “serbest bırakması” gerekiyordu. 1960’lı yıllarda geliştirilen amantadin ve rimantadin gibi ilaçlar grip A’yı engelleyen ilk antiviraller oldu; ancak bu ilaçlar yalnızca influenza A’ya etkiliydi, yan etkileri yüksekti ve hızla direnç oluşumu sağladı. Bu sınırlamalar, virüs üzerindeki başka hedefler arayışını hızlandırdı. Özellikle 1970’lerde bilim insanları nöraminidazın sialik asit gibi şekere benzeyen moleküllerle etkileşerek virüsü serbest bıraktığını fark etti. Bu dönemde, sialik asit analogu olan DANA molekülünün (2-deoksi-2,3-didehidro-N-asetilneuraminik asit) NA’yı zayıf da olsa engelleyebildiği keşfedildi; bu, NA’yı hedefleyen ilaç geliştirme fikrinin tohumunu attı.
Nöraminidaz Yapısının Çözülmesi ve İlham: 1980’lerin başında nöraminidaz enziminin kristal yapısı çözüldü (Peter Colman ve Joseph Varghese liderliğinde 1983). Bu yapı, virüsün NA enzimindeki aktif merkezin üç boyutlu haritasını gösteriyordu. Araştırmacılar bilgisayar destekli ilaç tasarımıyla, bu aktif merkezde negatif yüklü bir bölge ve tutucu Glu119 kalıntısı gibi kilit amino asitler olduğunu fark ettiler. Pasif olarak bilgi alan Avustralyalı Biota şirketi ekibi (Peter Colman, Joseph Varghese ve işbirlikçileri) bu içgörüyle sialik asit tabanlı moleküller tasarladı. Örneğin moleküldeki 4. karbona bir guanidin grubu ekleyerek güçlü bir pozitif yük yerleştirdiler; bu grup, Glu119 ile güçlü bir tuz köprüsü kurdu ve etkinliği 100 kat artırdı. Böylece ilk güçlü NA inhibitörü zanamivir (Relenza) keşfedildi (1989). Zanamivir, laboratuvarlarda çok başarılı olsa da büyük bir sorun vardı: Doğrudan ağızdan emilmiyor, bu yüzden burun spreyi veya inhale formda kullanılması gerekiyordu. Yine de zanamivir, NA inhibisyonuyla grip tedavisinde işe yarayabileceğini kanıtlamış oldu. Bu başarı, benzer hedefle ancak ağızdan alınabilecek bir ilaç bulma fikrini ateşledi.
Gilead Bilim İnsanlarının İlhamı ve İlk Adımlar: 1990’ların başında ABD’li Gilead Sciences şirketinde antiviral ilaçlar geliştiren bir ekip bir kez daha bu fikre yöneldi. Gilead CEO’su John C. Martin, HIV ilaçlarındaki başarıların ardından gribe karşı da benzer etki sağlayacak bir antiviral ihtiyacının bilincindeydi. Bilim insanları arasında Norbert Bischofberger (Gilead Araştırma Başkan Yardımcısı) ve ilaç tasarımcıları (Choung Kim, Dirk Mendel ve başkaları) bu hedefte çalışmaya başladı. Önce laboratuvarda inen nöraminidaz inhibitörleri literatürü ve zanamivir yapılarını incelediler. Amaç, zanamivir kadar etkili olup vücutta kolay emilebilen bir molekül bulmaktı. Hemoglobinler arasındaki geçiş sürecini taklit eden “geçiş durumu analogu” tasarımı benimsendi: Enzim aktif merkeziyle güçlü bağ kuracak ancak daha az polar özellikte yeni bir kimyasal iskelet kullanılacaktı. Bu süreçte Japon bilim insanı Yoshikazu Hitomi gibi NA yapıları üzerinde çalışanlar da katkıda bulundu; Hitomi’nin çözdüğü nöraminidaz yapıları, Gilead ekibinin molekül tasarımı için ilham kaynağı oldu.
Gilead ekibi, sialik asitin halkası yerine daha sert bir karboksiklik halka (carbon-halyer) düşündü ve yan kısımlarına lipofil (yağda çözünebilir) gruplar ekledi. Bu tasarımla, halkadaki bazı polar –OH veya –NH gruplar çıkarılacak, yerine uzun zincirli karbon grupları eklenecekti. Tahminleri doğru çıktı: Tamamlanan molekül GS 4071 adıyla literatüre geçti. GS 4071, laboratuvarda nöraminidazı Zanamivir’e benzer güçte engelliyordu (k değerleri yaklaşık 1 nM civarında bulundu) ve Grip A/B virüslerini kültürde çok zayıflatıyordu. Ancak GS 4071’in bir problemi vardı: Kendi başına çok polar yapısına rağmen ağızdan emilim oranı düşüktü (örneğin farede %5 civarı). Bu nedenle Gilead kimyagerleri bir “prodrugu” denedi: GS 4071’in etil ester formunu geliştirdiler. Bu bileşik GS 4104 adını aldı. GS 4104, ağızdan kolayca emilip vücutta hidrojenesterazlarca hızla GS 4071’e dönüştürülüyordu. Hayvan deneyleri çok umut vericiydi: Tek bir ağız dozu GS 4104, GS 4071’i fare, köpek ve gelincik atı gibi farklı türlerde yüksek plazma düzeylerinde tutabiliyor, bunlar da NA enzimini %90 engellemeye yetecek kadar yüksekti. Ayrıca yapılan akciğer sıvısı analizlerinde GS 4071’in solunum yolu yüzeyine ulaştığı ve saatlerce etkisini sürdürdüğü görüldü.
Keşfin Duyurusu ve Kimyasal İlerlemeler: Bu gelişmeler 1996 sonbaharında açıklandı. Gilead’ın basın bülteninde, laboratuvarda çalışan Dr. Choung Kim GS 4104’ün farelerde yapılan testlerde çeşitli grip suşlarına karşı koruyucu ve tedavi edici etkisini yüzde 100 sağladığını aktardı. Norbert Bischofberger ise çalışmanın beş yılı aşkın bir çabanın sonucu olduğunu vurguladı. Basın açıklaması ilaca “yüzde 100’e varan hayatta kalma oranı” sağladığı ve “eksiksiz ölümcül veriler” elde edildiği gibi vurucu cümlelerle dikkat çekti. Gilead ekibi, GS 4104’ü “karbocyclic” (karbon halkalı) bir molekül olarak tanımladı; bu yapı, sialik asit benzeri gerçeğe çok benzese de aktif alanda yeni bölgelere uzanan bir “pentiyl” (beş karbonlu) yan zincir taşıyordu. Araştırma sırasında molekülün bağ kurduğu NA aktif bölgesinde önceki inhibitörlerden farklı boşlukların keşfedilmesi, bu ilacın tasarımına zemin hazırladı.
Kimyasalların laboratuvardan çıkarak hasta denemelerine ilerleyebilmesi için ilaç şirketi Roche ile iş birliği yapıldı. Gilead, 1996’da GS 4104’ün patentini Roche’a lisansladı. Roche dünyaya yayılmış ağını kullanarak hastalarda klinik deneyleri başlattı. 1997 ortalarında başlayan faz II-III denemeleri, 2.5 yıl gibi rekor bir sürede sonuçlandı. 1999 yılında FDA (ABD Gıda ve İlaç Dairesi) Tamiflu’nun (GS 4104’ün fosfat tuzu olan oseltamivir fosfat) yetişkin influenza tedavisi için onaylandığını duyurdu. Aynı dönemde Avrupa’da da ruhsat süreci hızla tamamlandı. Bu dönemde John Martin “Gilead’in icat ettiği bir ilaçtır” diyerek aslında bu başarının ardındaki stratejik vizyona vurgu yapıyordu.
Klinik Kullanım ve Pandemi Hazırlığı: Onaylandıktan sonra Tamiflu hızla dünyaya yayıldı. İlk yıllarda Roche’un pazar ağıyla dağıtıldı, Gilead ise araştırmalarını sürdürecek şekilde kar eden bir ortak rol üstlendi. Üretim için büyük miktarlarda şikimik asidine ihtiyaç doğdu; bu doğal bileşik geleneksel olarak Çin yıldızı kestanesi gibi bitkilerden elde ediliyordu, ancak Gilead sürdürülebilirlik için bakteri bazlı üretim yollarına yatırım yaptı. Tamiflu’nun 2005’te Endonezya’da kuş gribi (H5N1) salgını sırasında hızla “stratejik ilaç” ilan edilmesi dönüm noktası oldu. Pek çok hükümet, bağışıklıkta zayıf nüfuslar için antiviral bir son çare olarak toplu stoklama yaptı. O sırada ABD Savunma Bakanı Donald Rumsfeld’ın geçmişte Roche yönetiminde bulunması gazetelerde konuşulsa da, bilim insanları salgın yönetimi için işbirliğini önemsedi. Roche ve Gilead 2005’te patent ihtilaflarını bir kenara bırakarak ortak üretim ve planlama taahhütlerini açıkladılar; dev iş birliği kamu sağlığı bilinciyle taçlandırıldı.
Özellikle 2009 baharında patlayan domuz gribi (A/H1N1) pandemisi de Tamiflu’nun değerini vurguladı. Yeni virüs türü dünyaya yayıldığında Dünya Sağlık Örgütü ve birçok sağlık kurumu erken dönemde Tamiflu kullanımını önerdi. Klinik gözlemler, ilacın özellikle yaşlı, çocuk ve kronik hastalığı olanlarda komplikasyonları azalttığını, hastaneye yatış gereksinimini düşürdüğünü gösterdi. Eş zamanlı olarak baloxavir marboxil (bakmamavir) gibi tamamen yeni mekanizmalarla çalışan ilaçlar da piyasaya giriyordu; ancak neuraminidaz inhibitörleri hala en yaygın kullanıma sahipti. Avrupada ve Japonya’da Tamiflu öncelikli, Kuzey Amerika’da oseltamivir/zanamivir dengesi gözetilerek kullanım sürdürdü. Patentlerin sona ermesiyle 2010’lu yılların başından itibaren jenerikler pazara girmeye başladı (örneğin Cipla’nın Antiflu’su).
Bilimsel Merak ve Çağdaş Yaklaşımlar: Kırktan fazla yıldır süren araştırmalarda bilim insanları hâlâ yeni atılımlar peşindeler. COVID-19 salgını Tamiflu’nun etkili olmadığı SARS-CoV-2 virüsünde bu durumun influenza’dan farklı mekanizmaya bağlı olduğunu gösterse de, influenza A/B için antivirallerin önemi azalmadı. Son yıllarda deneysel çalışmalarda kombinasyon terapileri öne çıktı: Örneğin, Tamiflu ile antifungal itraconazole’in birlikte verilmesi laboratuvarlarda sinerjik etki verdi; bu, ilaca direnç gelişmiş grip suşlarıyla mücadelede yeni seçenekler sunabilir. Ayrıca Tamiflu molekülüne benzer yeni NA inhibitörleri üzerinde yapay zeka ve moleküler simülasyonlar kullanılarak iyileştirmeler deneniyor. Şikimik asit bazlı sentez yöntemleri bile biyoteknolojik gelişmelerle daha da optimizasyon kazanıyor.
İbuprofen, 1964 yılında Stewart Adams ve ekibi tarafından İngiltere, Nottingham’daki Boots Pure Drug Company‘de geliştirildi. İlk olarak 1969 yılında İngiltere’de Brufen® ticari adı altında pazarlandı. Başlangıçta romatoid artrit için reçete edilen ibuprofen, çeşitli endikasyonlar için hızla en yaygın kullanılan steroid olmayan anti-inflamatuar ilaçlardan (NSAID’ler) biri haline geldi. Artık film kaplı tabletler, oral süspansiyonlar, yumuşak kapsüller, granüller, kremler ve intravenöz solüsyonlar (örn. Aktren®, Neuralgin®) dahil olmak üzere çok sayıda formülasyonda mevcuttur.
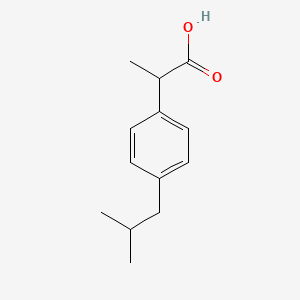
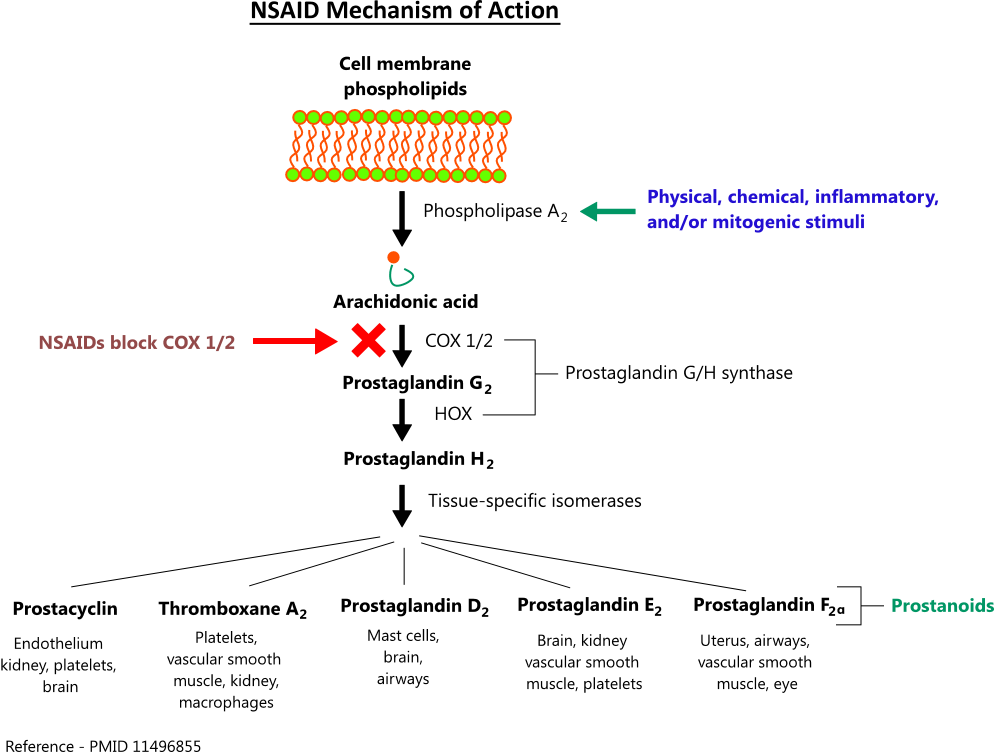
İbuprofen, prostaglandinlerin üretiminden sorumlu olan siklooksijenaz enzimlerini (COX-1 ve COX-2) inhibe ederek çalışır. Prostaglandinler iltihaplanma, ağrı ve ateşe aracılık eder, bu nedenle inhibisyonları aşağıdaki etkileri sağlar:
İbuprofen, aşağıdakiler de dahil olmak üzere çok çeşitli rahatsızlıkları tedavi etmek için kullanılır:
Ağrı:
İltihaplı rahatsızlıklar:
Ateş:
Pediatrik uygulamalar:
Yetişkinler:
Çocuklar:
Özel hususlar:
İbuprofen şu durumlarda kullanılmamalıdır:
İbuprofen CYP2C9 tarafından metabolize edilir ve şunlarla etkileşime girebilir:
En yaygın yan etkiler şunlardır:
Gastrointestinal:
Nörolojik:
Dermatolojik:
En yaygın kullanılan steroid olmayan anti-inflamatuar ilaçlardan (NSAID’ler) biri olan ibuprofenin geliştirilmesi, İngiltere, Nottingham’daki Boots Pure Drug Company‘deki araştırmacıların iltihaplı durumları tedavi etmek için kortikosteroidlere alternatifler aramasıyla 1950’lerde başladı. Kortikosteroidler etkili olsa da önemli yan etkilere neden oldu ve daha güvenli seçeneklere ihtiyaç duyulmasına yol açtı.
1961‘de, Dr. Stewart Adams ve kimyager John Nicholson da dahil olmak üzere ekibi, daha sonra ibuprofen olarak bilinen izo-bütil-propanoik-fenolik asidi başarıyla sentezledi. Bileşik, anti-inflamatuar özellikleri ve aspirin gibi mevcut tedavilere kıyasla nispeten düşük toksisitesi nedeniyle laboratuvar testlerinde umut vadetti.
Romatoid artrit hastalarına odaklanan klinik çalışmalar 1964‘te başladı. Bu denemeler, ibuprofenin aspirinden daha az gastrointestinal yan etkiyle iltihap ve ağrıyı önemli ölçüde hafiflettiğini gösterdi. Bu denemelerin başarısı, onaylanmasının yolunu açtı.
1969 yılında, ibuprofen ilk olarak Birleşik Krallık’ta Brufen® markası altında piyasaya sürüldü ve özellikle romatoid artrit için pazarlandı. Etkinliği ve güvenlik profili, onu hem doktorlar hem de hastalar arasında hızla popüler hale getirdi.
1970’ler, ibuprofenin uluslararası tanınırlık kazanmasına tanık oldu ve Gıda ve İlaç Dairesi (FDA) tarafından 1974 yılında iltihap ve ağrıyı tedavi etmek için reçeteli bir ilaç olarak ABD’de onaylandı. 1983 yılına gelindiğinde, daha düşük dozlarda reçetesiz (OTC) olarak satılmaya başlandı ve erişilebilirliği genişledi ve evde ağrı kesici olarak yerini sağlamlaştırdı.
1980’ler ve 1990’lardaki bilimsel gelişmeler, ibuprofenin etki mekanizması hakkında daha fazla şey ortaya koydu. Siklooksijenaz enzimlerini (COX-1 ve COX-2) inhibe ederek çalıştığı ve ağrı, iltihap ve ateşten sorumlu olan prostaglandin sentezini azalttığı doğrulandı. Bu anlayış sadece ibuprofenin etkinliğini doğrulamakla kalmadı, aynı zamanda diğer NSAID’lerin gelişimini de etkiledi.
2000’lerde ibuprofenin çok yönlülüğü daha da genişledi ve bazı ülkelerde prematüre bebeklerde patent duktus arteriosus (PDA) tedavisi için onaylandı. Formülasyonları üzerine yapılan araştırmalar ayrıca ibuprofen lizinat ve ibuprofen arjinat gibi daha hızlı etkili tuzların yaratılmasına yol açarak başlangıç sürelerini iyileştirdi.
Günümüzde ibuprofen, tabletler, oral süspansiyonlar, kremler ve intravenöz solüsyonlar dahil olmak üzere çeşitli formlarda mevcuttur. Dünya çapında en yaygın kullanılan ilaçlardan biri olmaya devam ediyor, bu da Boots laboratuvarlarındaki kökenlerinin ve Dr. Stewart Adams gibi bilim insanlarının özverili çalışmalarının bir kanıtı.
Prednizolon terimi, köken olarak Yunancadaki prhos (önce) kelimesiyle, Latince cortex (kabuk) sözcüğünden türetilmiştir. “Olon” eki ise, genellikle steroidlerin türevlerini tanımlamak için kullanılan bir biçimdir. Prednizolon, sentetik olarak elde edilen, güçlü anti-enflamatuar ve immünosüpresif etkileriyle tanınan bir glukokortikoiddir.
Prednizolon, sıklıkla prednizon adlı inaktif ön ilaç (prodrug) şeklinde alınır ve karaciğerde prednizolona metabolize edilerek farmakolojik olarak aktif forma dönüşür. Moleküler formülü C₂₁H₂₈O₅, molekül ağırlığı ise 360.4 g/mol’dür. Yarı ömrü ortalama 2-4 saat arasında değişmekte olup, etkisi daha uzun sürelidir.
Prednizolon, glukokortikoid reseptörlerine bağlanarak nükleer transkripsiyon faktörlerini modüle eder. Böylece:
Bu mekanizmalar sayesinde, prednizolon hem akut hem de kronik inflamasyon süreçlerinde etkili olur.
Prednizolon birçok farmasötik formda piyasada bulunmaktadır:
Prednizolon geniş bir endikasyon yelpazesine sahiptir:
Prednizolon güçlü bir ilaç olup, özellikle uzun süreli ve yüksek doz kullanımda ciddi advers etkiler ortaya çıkabilir:
Prednizolon tedavisine başlamadan önce aşağıdaki durumlar göz önünde bulundurulmalıdır:
Ayrıca prednizolon, warfarin, insülin, NSAİİ, aşılar gibi birçok ilaçla farmakodinamik ve farmakokinetik etkileşimlere girebilir. Bu nedenle dikkatli doz ayarlaması ve izlem gereklidir.
20. yüzyılın ortaları, tıpta hormonal tedavilerin devrim yarattığı bir dönemdir. 1930’lu ve 1940’lı yıllarda, adrenal korteks hormonlarının izolasyonu ve biyolojik etkilerinin anlaşılması, enflamatuvar ve otoimmün hastalıkların tedavisinde yeni bir çığır açtı. Özellikle kortizonun (1936’da Kendall ve Reichstein tarafından) keşfi, steroidlerin farmakoterapideki önemini ortaya koydu.
Ancak kortizonun ağızdan alındığında zayıf etki göstermesi, böbreküstü bezi baskılaması ve elektrolit dengesi üzerindeki olumsuz etkileri nedeniyle daha etkili ve daha güvenli alternatiflerin geliştirilmesi gerekliliği doğdu. Bu arayış, bilim insanlarını kortizon türevleri üzerinde yapısal modifikasyonlara yöneltti.
Prednizolon, 1954 yılında Schering Corporation (günümüzde Merck & Co. bünyesindedir) bünyesinde çalışan araştırmacılar tarafından sentezlendi. Bu dönemde kimyagerler, doğal kortikosteroidlerin kimyasal yapılarını modifiye ederek, daha güçlü glukokortikoid etkiye sahip, ancak mineralokortikoid etkisi daha düşük bileşikler elde etmeye çalışıyordu.
Prednizolon, bu arayışın sonucu olarak, kortizonun yapısal modifikasyonuyla elde edilen ilk başarılı 11β-hidroksillenmiş ve 1,2-çift bağ içeren türevlerden biri oldu. Bu yapısal değişiklikler:
Bu molekül, hem sistemik (tablet, enjeksiyon) hem de topikal (krem, damla vb.) formlarda kullanılabilen ilk selektif glukokortikoidlerden biri olarak dikkat çekti.
1950’lerin sonlarına doğru prednizolon, özellikle romatoid artrit, lupus eritematozus, astım, ülseratif kolit, iritis gibi iltihabi hastalıklarda sistemik tedavi ajanı olarak hızla yaygınlaştı. Kortizona kıyasla daha etkili ve daha tolere edilebilir olması, klinik çevrelerde kısa sürede benimsenmesini sağladı.
Prednizolonun, karaciğerde aktifleşen prednizonun biyoaktif formu olduğu da bu yıllarda net olarak ortaya kondu. Bu bilgi, özellikle karaciğer yetmezliği olan hastalarda doğrudan prednizolon kullanımı yönündeki tedavi stratejilerini şekillendirdi.
“Prednizolon” terimi, 1954’ten bu yana farmakoloji literatüründe kullanılmaktadır ve hâlen bu spesifik glukokortikoidi tanımlamak için geçerliliğini korumaktadır. Günümüzde de prednizolon, Dünya Sağlık Örgütü’nün (WHO) temel ilaçlar listesinde yer almakta, hem gelişmiş hem de gelişmekte olan ülkelerde yaygın olarak reçete edilmektedir.
Prednizolonun keşfi, modern steroid farmakolojisinin köşe taşlarından biridir. Yapısal olarak daha sonra geliştirilecek olan metilprednizolon, deksametazon, betametazon gibi glukokortikoidlerin de temelini oluşturmuştur. Bu nedenle prednizolon, sadece bir ilaç değil, aynı zamanda kortikosteroid biliminin gelişiminde bir mihenk taşı olarak değerlendirilebilir.
Desloratadin isminin etimolojisi, kimyasal yapısından ve ana aktif madde olan Loratadin‘den türetilişinden türetilebilir.
“Des-“:
“Loratadin”:
Bu nedenle desloratadin kelimesi tam olarak “loratadin’in demetillenmiş formu” anlamına gelir ve bu da aktif bir metabolit olarak işlevini yansıtır.
Desloratadin, H1 reseptör antagonistleri sınıfından ikinci kuşak bir antihistaminiktir. Özellikle saman nezlesi (alerjik rinit), kurdeşen (ürtiker) ve diğer alerjik reaksiyonlar gibi alerjik hastalıkların tedavisinde kullanılır. Desloratadin, periferik H1 histamin reseptörlerini seçici olarak bloke ederek, kan-beyin bariyerini önemli ölçüde geçmeden histamin aracılı alerjik reaksiyonu önler. Sonuç olarak birinci kuşak antihistaminiklere kıyasla sedasyon veya yorgunluk gibi merkezi sinir sistemi yan etkilerine daha az neden olur.
Desloratadin, loratadinin (Claritine®) birincil aktif metabolitidir ve daha uzun bir yarı ömre sahiptir. Etki süresinin uzun olması nedeniyle alerjik semptomların kontrol altına alınmasında günde bir kez alınması yeterlidir. Desloratadin, esas olarak hidroksilasyon ve ardından glukuronidasyon yoluyla aşağı akış biyotransformasyonu yoluyla daha ileri metabolize edilir.
Desloratadin oral yoldan alındıktan sonra hızla emilir ve yaklaşık üç saat sonra maksimum plazma konsantrasyonuna ulaşır. Terminal yarı ömrü yaklaşık 27 saat olup, günde bir kez alınmasına olanak sağlar. Biyoyararlanımı yüksektir ve gıda alımından bağımsızdır.
Desloratadin, ana madde olan loratadin ile karşılaştırıldığında sitokrom P450 enzimlerine (CYP3A4 ve CYP2D6) karşı daha düşük bir afiniteye sahiptir, bu da onu ilaç etkileşimlerine daha az duyarlı hale getirir. Ancak desloratadin, ağırlıklı olarak böbrekler yoluyla atılmadan önce, özellikle hidroksilasyon ve ardından glukuronik asitle konjugasyon yoluyla daha ileri metabolize edilir.
Desloratadin, aşağıdakiler de dahil olmak üzere çeşitli dozaj formlarında mevcuttur:
Yetişkinler ve 12 yaş ve üzeri çocuklar için önerilen günlük doz genellikle günde bir kez 5 mg’dır. 6-12 yaş arasındaki çocuklarda günlük doz 2,5 mg iken, 1-5 yaş arasındaki çocuklarda 1,25 mg önerilmektedir.
Desloratadin’in iyi tolere edildiği düşünülmektedir; en sık görülen yan etkiler şunlardır:
Nadir görülen ancak potansiyel olarak ciddi yan etkiler şunlardır:
Desloratadin yatıştırıcı olmadığından ve eski antihistaminiklerin aksine bilişsel performansta önemli bir bozulmaya neden olmadığından makine kullanması veya araba kullanması gereken kişiler tarafından da kullanılabilir.
Desloratadin, patent koruması sona erdikten sonra loratadinin (Claritine®) halefi olarak geliştirilmiştir. Desloratadin, loratadinin ana aktif metaboliti olarak hareket ettiği ve bazı farmakokinetik avantajlar sağladığı için yeni bir patentle tek başına bir ilaç olarak pazarlanabilir.
Loratadin büyük oranda CYP3A4 ve CYP2D6 aracılığıyla metabolize edilirken, desloratadin daha olumlu bir farmakogenetik profile sahiptir ve metabolizmada bireyler arası daha az değişkenlik vardır. Bu sayede tedavi etkinliği daha tutarlı hale gelir ve diğer ilaçlarla etkileşim riski azalır.
2001 yılında Aerius® ticari adı altında İsviçre pazarına sunuldu. Desloratadin’in jenerik versiyonları 2012 yılında piyasaya sürüldü ve bu sayede hastalar için daha geniş bir ulaşılabilirlik ve maliyet tasarrufu sağlandı. Desloratadin ile psödoefedrinin sabit kombinasyonu henüz İsviçre’de mevcut değildir, ancak benzer kombinasyonlar diğer ülkelerde pazarlanmıştır.
Desloratadin’in geliştirilmesi antihistaminiklerin tarihiyle yakından bağlantılıdır ve alerjik hastalıkların tedavisinde önemli bir ilerlemeyi temsil eder. Antihistaminiklerin, özellikle H1 reseptör antagonistlerinin keşfi, birkaç on yıl boyunca çeşitli bilimsel atılımlar ve yeniliklere tanık oldu. İkinci nesil bir ilaç olan desloratadin, 20. yüzyılın ortalarında başlayan gelişmelere dayanmaktadır.
Ketamin, modern tıbbın hem en kullanışlı hem de en tartışmalı moleküllerinden biri olarak, anesteziyoloji, acil tıp, psikiyatri ve nörobilim tarihinin kesişim noktasında yer alır.
“Ketamin” adı, molekülün yapısal özelliklerini yansıtan üç unsuru birleştirir:
Dolayısıyla “ketamin” ismi, kelime kökeni açısından “keton içeren amin” fikrini kimyasal düzeyde doğrudan yansıtır.
Bu tarihsel çizgi, ketamini önce “saha şartlarına uygun, hemodinamik açıdan ayrıksı bir anestezik”, ardından “disosiyatif parti uyuşturucusu”, en son da “hızlı etkili antidepresan” olarak farklı anlatı evrenlerine yerleştirmiştir.
Ketamin kiral bir moleküldür; asimetrik karbonu nedeniyle iki enantiyomer biçiminde bulunabilir:
Klinikte uzun yıllar boyunca rasemik karışım (R/S 1:1) kullanılmıştır. Daha sonra:
Ticari preparatlar çoğunlukla:
şeklinde, enjeksiyonluk çözelti için suda kolay çözünen, beyaz kristal tozlar halinde formüle edilir.
Ketamin, kimyasal olarak fensiklidin (PCP) türevidir. Bu akrabalık:
Ayrıca ketaminin analjezik karakteri, tarihsel olarak sentetik opioidler (örneğin pethidin) ile bazı farmakolojik analojiler üzerinden de tartışılmıştır; doğrudan opioid olmasa da opioid reseptörleriyle zayıf agonist etkileşimi bu tarihsel bağlamla uyumludur.
Ketamin, klasik anlamda “saf” bir ilaç olmaktan çok, multimodal etki profiline sahip bir nörofarmakolojik araçtır. En belirgin ve en iyi tanımlanmış etkisi, glutamat sistemi üzerinden, özellikle NMDA reseptörüne yönelik antagonizmadır; ancak bununla sınırlı değildir.
Klinik düzeyde bu durum:
olarak kendini gösterir.
Ketaminin etkileri yalnızca NMDA blokajı ile açıklanamaz; molekül, çok sayıda ek hedefle etkileşir:
Bu çoklu hedef profili, ketamini “disosiyatif anestezik”, “analjezik”, “hipnotik”, “antikonvülsan” ve “bronkodilatör” özelliklerin birleştiği bir farmakolojik “düğüme” çevirir.
Ketaminin en karakteristik klinik etki modeli, “disosiyatif anestezi” olarak adlandırılır. Bu durumda:
Nörofizyolojik olarak:
Bu çift yönlü etki, ketamine özgü rüya benzeri, halüsinatuvar ve bedenden ayrışma (out-of-body) deneyimlerinin temelini oluşturur.
Ketamin, hipnotik ajanlar arasında benzersiz bir hemodinamik profile sahiptir:
Solunum açısından:
Bu profil, ketamini özellikle acil tıpta, sahada ve pediatride önemli kılar, ancak aynı hemodinamik uyarı, koroner arter hastalığı ve miyokardiyal iskemi riski yüksek hastalarda dezavantaja döner.
Ketamin, çoklu uygulama yolları ile dikkat çeker:
Klinik olarak, anestezik doz uygulamasından sonra:
Ketamin, anestezide:
Özellikle:
gibi bağlamlarda tercih edilir.
Klinisyen jargonunda ketamin, bazen karakteristik endikasyonlarını özetlemek için “çocuklar, kediler, felaketler” için anestezik olarak anılır; bu ifade, pediatri, veterinerlik ve afet/kriz ortamlarındaki değerine vurgu yapar.
Düşük–orta dozlarda ketamin, güçlü bir analjezik olarak:
kullanılabilir.
Acil tıpta benzersiz özelliği:
Ketaminin bronkodilatör etkisi ve solunumu belirgin baskılamaması:
özellikle entübasyon ve mekanik ventilasyon stratejilerine eşlik eden, koruyucu ve köprüleyici bir ajan olarak değerlendirilmesine yol açmıştır.
Son yıllarda ketamin, psikiyatride özellikle tedaviye dirençli majör depresyon alanında yeni bir paradigmanın merkezine yerleşmiştir.
Klasik antidepresanlar:
Ketamin ise:
Antidepresan etki için çeşitli mekanizmalar tartışılır:
Bu etkiler, yalnızca semptomatik bir sedasyon değil, beyindeki ağ seviyesinde “yeniden ayar (reset)” benzeri, hızlı ama karmaşık bir yeniden yapılanma fikrini gündeme getirir.
Bu profile göre:
Ketaminin en sık ve en belirgin yan etkileri, psikotrop niteliktedir:
Bilincin çözülme ve yeniden örgütlenme süreci, bazı hastalar tarafından son derece rahatsız edici, bazıları tarafından ise “özgürleştirici” ve “transandantal” olarak betimlenir. Bu geniş yelpaze, kişilik özellikleri, beklenti, çevresel bağlam ve eşlik eden sedatif/anksiyolitik ilaçlara bağlı olarak değişir.
Benzodiazepin eklenmesi:
Ayrıca:
yan etkilerin subjektif şiddetini ve olası travmatize edici etkilerini azaltmaya yardımcı olur.
Bu noktalar genel prensip düzeyinde olup, bireysel klinik kararlar ilgili uzman hekimler tarafından verilmelidir.
Ketamin, düşük–orta dozlarda güçlü disosiyatif ve algı değiştirici etkileri nedeniyle pek çok ülkede parti uyuşturucusu olarak yayılmıştır. Sık kullanılan sahne isimleri arasında:
Kullanıcılar, ketamin deneyimini sık sık:
ile tarif ederler.
Özellikle yüksek dozlarda yaşanan, yoğun dezoryantasyon ve ölüm korkusuyla birlikte seyreden olumsuz deneyimler, kültürel terminolojide “korku gezisi” veya “bad trip” olarak tanımlanır. Bazı kullanıcılar için bu korku ve sınır deneyimi aranır hâle gelirken, diğerleri için ağır ve travmatize edici olabilir.
İngilizce literatürde sık kullanılan “K-hole” terimi, ketaminin yüksek dozlarında yaşanan:
gibi deneyimlere atıfta bulunur. Bu durum bir yandan yoğun merak uyandıran, diğer yandan ciddi riskler barındıran bir bilinç durumu olarak tanımlanır.
Ketamin, yalnızca “parti” ortamlarında değil, aynı zamanda:
gibi bağlamlarda da araştırılmış ve kullanılmaktadır.
Bu çerçevede:
Ketamin, doğrudan “evrimsel” bir molekül olmamakla birlikte, evrimsel nörobiyoloji perspektifiyle bakıldığında:
Bu açıdan:
Ketamin; kimyasal olarak PCP türevi bir sikloheksanon, farmakolojik olarak NMDA reseptör antagonisti, klinik olarak disosiyatif anestezik ve hızlı etkili antidepresan, sosyokültürel olarak ise hem “parti uyuşturucusu” hem de “bilinç değiştiren deneyim aracı” olarak çok katmanlı bir varlığa sahiptir.
Anestezide:
onu travma, pediatri, veterinerlik ve afet tıbbında vazgeçilmez kılar.
Psikiyatride:
ketamini geleceğin nöropsikiyatrik tedavilerinin kavşağına yerleştirmiştir.
Buna karşın:
ketaminin, yalnızca tıbbi denetim altında, iyi tanımlanmış protokoller çerçevesinde kullanılmasını zorunlu kılar.
Ketaminin hikâyesi, modern tıbbın laboratuvarlarından savaş alanlarına, yeraltı kulüplerinden psikiyatri kliniklerine uzanan, neredeyse bir roman gibi okunabilecek kadar çok katmanlıdır. Bu hikâyeyi, kimyasal “ata molekülü” fensiklidinden başlayarak, Calvin L. Stevens’ın Detroit’teki laboratuvarına, Edward Domino’nun Michigan’daki deneylerine, Vietnam’daki sahra hastanelerine, 1990’ların nörobilim laboratuvarlarına ve günümüzün ketamin kliniklerine kadar kronolojik ve sürükleyici bir anlatı halinde takip edebiliriz.
1950’lerin ortasında, ABD’de Parke-Davis ilaç firmasının araştırma laboratuvarlarında, o dönem için son derece cazip görünen bir bileşik sentezlendi: fensiklidin, yani PCP. O yılların hayali, barbitüratların solunum depresyonu ve dolaşım üzerindeki olumsuz etkilerini taşımayan, kısa etkili, güvenli bir intravenöz anestezik bulmaktı. PCP ilk denemelerde adeta mucize gibi görünüyordu:
Ancak kısa süre içinde karanlık yüzü ortaya çıktı. Ameliyat sonrası hastalar:
yaşıyorlardı. PCP’nin bu uzun ve şiddetli psikotomimetik etkileri, onu “ideal anestezik” adaylığından hızla düşürdü. Klinikler, dolaşımı koruyan ama zihin dünyasını altüst eden bu molekülden ürkerken, Parke-Davis’teki farmakologlar için yeni bir araştırma sorusu belirdi:
“PCP’nin hemodinamik avantajlarını koruyup, psikotik kabuslarını törpüleyen ‘daha yumuşak’ bir kardeş molekül yaratılabilir mi?”
Ketamin, işte bu soruya verilen kimyasal bir cevaptır.
1960’ların başında Parke-Davis, Detroit’teki Wayne State University ile işbirliği yaparak, yeni PCP türevleri geliştirme görevini organik kimyager Calvin L. Stevens’a verdi. Stevens, PCP iskeletini daha kısa etkili, daha öngörülebilir ve daha iyi tolere edilebilir hale getirmek için sistematik değişiklikler yapmaya koyuldu.
Nisan 1962’de, siklohekzanon iskeleti üzerine:
eklenmiş yeni bir molekül sentezledi. Bu bileşiğe laboratuvar kodu olarak CI-581 adı verildi. Kimyasal olarak:
Hayvan deneylerinde CI-581:
ile dikkat çekti. Laboratuvar defterlerine, PCP’nin kaba ve uzun etkili darbelerine karşı daha zarif, daha kısa, ama hâlâ güçlü bir “disosiyatif darbe” olarak geçti.
O sırada kimse, bu küçük şişe içindeki berrak çözeltinin, yıllar sonra hem anestezi tarihini hem de depresyon tedavisini değiştireceğini bilmiyordu.
Parke-Davis, CI-581’i hayvan çalışmalarından insan klinik çalışmalarına taşımak için, Michigan Üniversitesi’nde çalışan klinik farmakolog Edward F. Domino ile temasa geçti. Domino’nun intravenöz anestezikler üzerine klinik deneyimi vardı, ancak anestezist değildi; bu nedenle Michigan Üniversitesi Anesteziyoloji Bölümü’nden Guenter Corssen ile işbirliği kurdu. Böylece CI-581’in insanlardaki ilk sistematik değerlendirmesi, Domino–Corssen ikilisinin elinde başladı.
1964 yazında Domino, önce kendi üzerinde düşük doz bir deneme yaptı; ardından sağlıklı gönüllü ve cerrahi hastalar üzerinde kontrollü uygulamalara geçildi. Elde edilen tablo, klasik anesteziklerden radikal biçimde farklıydı:
Ancak EEG kayıtları ve hastaların ameliyat sonrası anlatıları, “sıradan narkoz”tan çok, garip bir kopukluk hâlini işaret ediyordu. Hastalar uyandıktan sonra deneyimlerini şöyle tarif ediyorlardı:
Domino, günün sonunda eve gidip yaşadıklarını eşi Toni Domino’ya anlattığında, deneyimlerin ortak noktasını “gerçeklikten ayrışma, bağlantının kopması” olarak özetledi. Rivayete göre Toni Domino, bu hâlin psikolojideki “dissociation” kavramına benzediğini söyleyerek, “Bu bir tür dissociative anesthesia olabilir” fikrini ortaya attı.
Bir yıl sonra, 1965’te yayınlanan klasik makalede Domino, Chodoff ve Corssen, CI-581’in ortaya çıkardığı bu benzersiz bilinç durumunu tanımlarken ilk kez “dissociative anesthetic” terimini kullandılar. Böylece ketaminin hem farmakolojik sınıflaması hem de sonraki on yılların terminolojisi şekillenmiş oldu.
1966’ya gelindiğinde Parke-Davis, artık CI-581 kod adını geride bırakmaya hazırdı. İnsanlarda ve veteriner hekimlikte kullanılmak üzere patente başvuruldu. Yeni ticari isim, molekülün yapısına doğrudan gönderme yapan bir birleşimdi:
Böylece “ketamine” adı doğdu.
1960’ların sonuna doğru yapılan klinik çalışmalar, ketaminin:
gösterdi. Buna karşın ameliyat sonrası sık görülen halüsinasyonlar, kabuslar ve dezoryantasyon, ketamini anesteziyologlar için hem çekici hem de tedirgin edici bir ajan hâline getiriyordu.
1970 civarında ketamin; ABD’de ve diğer birçok ülkede, insan ve veteriner hekimliğinde kullanılan bir genel anestezik olarak resmî onay aldı. Parke-Davis’in ürünü Ketalar®, sarımsı etiketli küçük flakonlarıyla ameliyathanelerde, acil servislerde ve sahra hastanelerinde yerini aldı. Anestezi tarihi, tiopental ve halotan gibi klasiklerin yanına, yeni ve alışılmadık bir ismi eklemişti.
1970’li yılların başı, ketaminin laboratuvar ve ameliyathanelerden çıkıp savaş alanına indiği dönemdi. Vietnam Savaşı sırasında ABD ordusunun sağlık birimleri için ketamin adeta biçilmiş kaftandı:
Ancak savaş alanı, bir molekülün kaderini sadece tıpta değil, kültürde de belirleyen bir laboratuvar gibidir. Ketaminin disosiyatif ve psikedelik etkileri, kısa süre içinde askerler arasında konuşulmaya başlandı. Bedenden ayrılma hissi, tünel vizyonları, “ölüme yakın deneyim” benzeri sahneler, ilacın tıbbi bağlamın ötesinde de merak uyandırmasına yol açtı.
ABD argosunda ketamin için “Special K” lakabı yerleşti. Savaş sonrası yıllarda bu lakap, sivil uyuşturucu sahnesine taşındı. Kulüplerde, yeraltı partilerinde ve rave kültüründe ketamin, kokain ve amfetaminlerden farklı, “disosiyatif” bir yolculuk vaat eden madde olarak öne çıktı.
1990’larda Larry Clark’ın “Kids (Çocuklar)” filmi, 2000’de İngiliz grup Placebo’nun “Special K” şarkısı ve birçok film/dizi, ketamini popüler kültürün karanlık ama çekici motiflerinden biri hâline getirdi. Six Feet Under dizisinde Russell’ın Claire’e anlattığı “ketamine hole” deneyimi ya da Alman filmi **“Kammerflimmern”**deki ketamin kullanım sahneleri, bu disosiyatif boşluğu – K-Hole’u – sinematik bir metafora dönüştürdü.
Artık ketamin, aynı anda hem ameliyathanenin soğuk, floresan ışığında parlayan bir anestezik, hem de gece kulüplerinin stroboskop ışıkları altında dolaşan bir “parti uyuşturucusu” idi.
Ketamin klinikte ne kadar kullanışlıysa, uyanma dönemindeki psikotrop yan etkileri de o kadar rahatsız ediciydi. Yetişkin hastalar; ameliyat sonrası:
yaşayabiliyorlardı. Bu “uyanma reaksiyonları”, pek çok anestezistin ketamine temkinli yaklaşmasına yol açıyordu.
Farmakologlar, bu sorunu çözmek için molekülün stereokimyasal yapısına yöneldiler. Ketaminin bir rasemik karışım, yani eşit miktarda iki enantiyomer (ayna görüntülü izomer) – R-ketamin ve S-ketamin (esketamin) – karışımı olduğu biliniyordu. Soru şuydu:
“Bu iki enantiyomerin etkileri birbirinden farklıysa, acaba daha ‘temiz’ olanı seçip kullanmak mümkün mü?”
1990’ların ortalarına doğru yapılan çalışmalar, S-ketaminin:
olabileceğini düşündürdü. Bunun üzerine Almanya’da 1997’de S-ketamin (esketamin) ayrı bir ilaç olarak piyasaya sürüldü; Ketanest® ve Ketanest S® gibi preparatlar Avrupa anestezi pratiğinde yerini aldı.
Anestezistler, S-ketamini özellikle:
nedeniyle tercih etmeye başladılar. Her ne kadar daha sonraki çalışmalar, rasemik ketaminle psikotrop yan etkiler arasındaki farkın her durumda dramatik olmadığını gösterse de, “daha rafine enantiyomer” fikri, ketaminin anestezideki ikinci evresini belirledi.
1990’lara gelindiğinde, ketaminin hikâyesi yeni bir istikamete yöneldi: nöropsikiyatri. Araştırmacılar, ketamini bu kez bir “tedavi ajanı” olarak değil, bir model madde olarak kullanmaya başladılar. Subanestezik dozlarda ketamin verilen sağlıklı gönüllülerde:
gibi fenomenler gözleniyordu. Bu deneyler, glutamat ve özellikle NMDA reseptörlerinin, şizofreni benzeri psikotik tabloların patofizyolojisinde rol oynayabileceği fikrini güçlendirdi. Ketamin, “glutamat/NMDA hipotezi”nin adeta canlı bir deneyi hâline geldi.
Ancak asıl büyük sürpriz, 2000’lerin başında ortaya çıktı. Tedaviye dirençli ağır depresyonu olan hastalara, çift-kör, plasebo kontrollü koşullarda düşük doz IV ketamin verildiğinde, sonuç beklenmedikti:
tek bir infüzyondan sonraki 24 saat içinde belirgin şekilde azalıyordu. Bu, klasik antidepresanların haftalar süren “etkiyi bekleme” dönemine radikal bir alternatif demekti.
Araştırmacılar, o ana kadar “problemli anestezik” ve “parti uyuşturucusu” olarak bilinen bir maddenin, en dirençli depresyon tablolarında dahi birkaç saat içinde klinik iyileşme sağlayabildiğini gördüklerinde, psikiyatri paradigmasında yeni bir sayfa açıldı. Ketamin artık üçüncü kimliğine bürünüyordu: hızlı etkili antidepresan.
2010’lu yıllarda ketamin üzerine yapılan çalışmalar adeta patladı. Çok merkezli, kontrollü araştırmalar:
gibi çeşitli psikiyatrik tablolar üzerinde ketaminin etkilerini inceledi. Birçok çalışmada:
yanıtlar rapor edildi. Tekrarlayan infüzyon protokolleriyle, bu etkinin haftalar, hatta bazı serilerde aylar düzeyinde sürdürülebileceği görüldü.
Bu arada S-ketamin (esketamin) bu kez anestezik değil, psikiyatrik ajan olarak yeniden sahneye çıktı. Enantiyomer saflaştırması ve nazal sprey formülasyonu, ayaktan tedaviye ve standartlaştırılmış dozlamaya uygun bir yol sundu. Büyük ölçekli randomize kontrollü çalışmalarla esketamin nazal sprey, tedaviye dirençli depresyonda:
değerlendirildi ve ruhsat aldı. 2019’da ABD ve Avrupa’da onaylanması, ketamin ailesini ilk kez resmî bir psikiyatrik endikasyonla tedavi algoritmalarına soktu.
Bu dönem, ketaminin artık yalnızca “off-label infüzyon” olarak değil, düzenleyici otoritelerce tanınan bir ruhsatlı antidepresan stratejisi olarak kabul gördüğü bir dönemeçti.
2020’lere girerken, ketamin daha geniş bir psikedelik rönesansın parçası hâline geldi. Psilosibin, LSD, MDMA gibi klasik psikedeliklerle birlikte, ketamin de:
araştırılmaya başlandı. Dünyanın çeşitli yerlerinde “ketamin klinikleri” açıldı; bu merkezlerde, protokollü infüzyonlar veya nazal uygulamalar, psikoterapötik çerçeveyle birleşerek yürütülüyor.
Nörobilim cephesinde güncel araştırmalar şunlara odaklanıyor:
Günümüzde ketamin; bir yandan ruhsatlı esketamin nazal sprey formu ile depresyon tedavi algoritmalarında resmî olarak yer alırken, diğer yandan infüzyon klinikleri, deneysel psikoterapi protokolleri ve temel bilim laboratuvarları aracılığıyla yeni soruların ve cevapların odağında duruyor.
Böylece, 1950’lerin Parke-Davis laboratuvarlarında fensiklidinin gölgesinde başlayan hikâye;
şeklinde, çok katmanlı bir evrime dönüşmüştür.
Bugün ketamin, aynı anda hem ameliyathanede damar yolundan enjekte edilen bir anestezik, hem gece kulüplerinde korku ve hayranlıkla anılan bir disosiyatif maddi, hem de psikiyatri polikliniğinde tedaviye dirençli depresyon için tartışılan, hızlı ama dikkatle kullanılmak zorunda olan bir antidepresandır.
Ketaminin dünya çapındaki hukuki statüsü, şaşırtıcı derecede parçalı ve katmanlıdır:
Bir yandan DSÖ tarafından “esansiyel ilaç” olarak kabul edilen, anestezide vazgeçilmez bir araç; diğer yandan pek çok ülkede uyuşturucu yasaları kapsamında sıkı kontrol edilen, parti uyuşturucusu ve psikedelik bir madde.
Bu gerilim, hem uluslararası antlaşma düzeyinde hem de ulusal ceza yasalarında izlenebilir.
Opioidler, kokain türevleri ya da amfetaminler gibi birçok madde, BM’nin 1961 Tek Sözleşmesi ve 1971 Psikotrop Maddeler Sözleşmesi eklerinde “schedule / çizelge”lere yerleştirilmiş durumdadır.
Ketamin için durum farklıdır:
Yani ketamin, uluslararası antlaşmalar düzeyinde “kontrolsüz”dür; buna rağmen DSÖ raporları, ülkelerin ulusal düzeyde sıkı kontrol uygulayabileceklerini, ancak bunun tıbbi erişimi engellememesi gerektiğini vurgular.
Bu durum, ülkelerin eline geniş bir takdir alanı bırakır:
ABD’de ketamin, 1970 tarihli Controlled Substances Act (CSA) kapsamında Schedule III kontrollü madde olarak sınıflandırılmıştır (1999’dan beri).
Bu statü şu anlamlara gelir:
Esketamin nazal sprey (Spravato®), tedaviye dirençli depresyon için FDA onaylıdır ve kendi REMS (Risk Evaluation and Mitigation Strategy) programı kapsamında sadece sertifikalı merkezlerde, gözetim altında uygulanabilir; düzenleyici olarak da ketaminle aynı Schedule III çerçevesine tabidir.
Kanada’da ketamin, Controlled Drugs and Substances Act kapsamında Schedule I’de yer alır; yani heroin, kokain gibi maddelerle aynı çizelgededir.
Avrupa’da ketaminin hukuki konumunu anlamak için hem narkotik yasalarını hem de ilaç/eczacılık mevzuatını birlikte düşünmek gerekir. AB düzeyinde doğrudan bir “ketamin çizelgesi” yoktur; ancak çoğu ülke, ulusal yasalarında ketamini kontrol altına almıştır.
Birleşik Krallık’ta ketamin, Misuse of Drugs Act 1971 kapsamında:
Bu statü:
2024–2025 döneminde, ketamin kullanımındaki rekor artış nedeniyle İçişleri Bakanlığı, ketaminin Class A (heroin, kokain, MDMA seviyesinde) yapılmasını tartışmaya açtı; ACMD’nin (Advisory Council on the Misuse of Drugs) raporu bekleniyor.
Tıbbi tarafta ketamin, hâlâ ruhsatlı bir anestezik ve analjezik; esketamin nazal sprey ise ulusal sağlık sisteminde kısıtlı kullanım onaylarına sahip.
Almanya ilginç bir istisna oluşturur:
Bu çerçevede:
Hollanda’da ketamin, esas olarak ilaç mevzuatı kapsamında değerlendirilen bir madde; pek çok diğer psikedelik gibi doğrudan Opiumwet’in en sert sınıflarında yer almaz. Bu durum:
Avrupa Uyuşturucu İzleme Merkezi (EUDA), Avrupa’da ele geçirilen ketaminin büyük kısmının Hindistan menşeli olduğunu ve Hollanda ile Belçika üzerinden dağıtıldığını bildirir.
Son yıllarda Amsterdam, medyada “Avrupa’nın ketamin başkenti” olarak anılmaya başladı; ketamin, Hollanda’da tıbbi ürün mevzuatına tabi olduğundan, klasik narkotiklerle kıyaslandığında daha “yumuşak” bir yasal statüye sahiptir; bu da organize suç örgütlerinin yasal ithalatı maske olarak kullanıp ürünü kara piyasaya kaydırmasını kolaylaştırmaktadır.
Genel eğilim; tıbbi/veteriner kullanımı korurken, eğlence amaçlı kullanıma ve yasa dışı ticarete karşı ceza hukukunu giderek sıkılaştırmak yönündedir.
Çin’de ketamin, Psikotrop Maddeler mevzuatı altında sınıflandırılmış ve en sıkı kategorilerden birine yerleştirilmiştir.
Çin, aynı zamanda ketaminin uluslararası düzeyde çizelgelenmesi yönündeki BM girişimlerinin başlıca itici güçlerinden biridir.
Hindistan, ketamini uzun süre görece gevşek düzenlemiş ülkelerden biriydi; özellikle veteriner kullanım için büyük hacimlerde ticaret serbestti.
Bu çerçevede:
Japonya’da ketamin, Narcotics and Psychotropics Control Law kapsamında 2007’den beri “narcotic” kategorisinde ulusal kontrol altındadır.
Avustralya’da ketamin, Poisons Standard’da Schedule 8 (S8) “controlled drug” olarak listelenmiştir.
Yeni Zelanda, ketamini hem tıbbi ilaç hem de yasadışı uyuşturucu olarak çifte çerçevede düzenler:
Brezilya’da ketamin, Portaria nº 344/1998 (Brezilya Kontrollü İlaç ve Maddeler Yasası) kapsamında kontrol edilen psikoaktif maddeler listesindedir:
Meksika’da ketamin:
Son yıllarda Meksika’da ketamin bazlı ruh sağlığı klinikleri artmış, ancak bunlar da ulusal ilaç yasaları ve tıbbi etik çerçevesinde sıkı denetime tabi hâle gelmiştir.
Hukuki düzenlemeler yalnızca “yasak” boyutuyla değil, tıbbi ve araştırma amaçlı kullanımı düzenleme biçimi ile de ayrışır:
Dünya çapındaki bu parçalı yapı, hem seyahat eden hastalar hem de araştırmacılar için özel dikkat gerektirir:
Dünya ölçeğinde bakıldığında, ketamin için tek bir “hukuki statü”den söz etmek mümkün değildir; bunun yerine aynı molekülün, kimi ülkede esansiyel anestezik, kimi ülkede yüksek cezalı uyuşturucu, çoğu yerde ise her ikisi birden olduğu çok katmanlı bir düzenleme mozaiği vardır. Bu mozaik, hem tıbbi erişimi koruma hem de kötüye kullanımı sınırlandırma çabalarının, hukuk düzeyinde nasıl karmaşık bir dengeye dönüştüğünü oldukça çarpıcı biçimde gösterir.
Sinonim: Theophyllin, theophylline.
Ticari jeneriği; Aerobin®, Afonilum®, Euphyllin® Bronchoretard®
Camelia sinensis (çay)bitkisinin kurutulmuş yapraklarından elde edilen veya sentetik olarak hazırlanan bir alkaloid olup, idrar söktürücü, koroner damarları genişletici ve spazm giderici bir maddedir. Ksantin derivasyonlarına aittir. Astım tedavisinde kullanılır.

1)Çalışma mekanizması

Ticaret Adı: XyloCain®, Lignocaine
Lidokain, lokal anesteziklerin amid sınıfına ait yaygın olarak kullanılan bir lokal anesteziktir. İlk olarak 1943 yılında İsveçli kimyager Nils Löfgren tarafından, klinik kullanıma sunan meslektaşı Bengt Lundqvist’in yardımıyla sentezlenmiştir. Lidokain, etkinliği ve nispeten düşük yan etki profili nedeniyle o zamandan beri hem beşeri hem de veteriner hekimlikte en yaygın kullanılan lokal anesteziklerden biri haline gelmiştir.
Lokal Anestezi:
Antiaritmik Kullanım
Nöropatik Ağrı
Erken Boşalmada Kullanım
Tarih
Günümüzde en yaygın kullanılan lokal anesteziklerden biri olan lidokainin keşfi 20. yüzyılın başlarına kadar uzanan ilginç bir geçmişe sahiptir. Keşfi, kokain üzerine yapılan araştırmalar ve daha güvenli, bağımlılık yapmayan bir lokal anestezik bulma arayışıyla yakından bağlantılıdır.
Yorum yazabilmek için oturum açmalısınız.