- Sinonim: Drug-induced fever, Arzneimittelfieber, Medikamentenfieber
- İlaçla ilişkilendirilen hipertermilerdir.
- Sıcaklık 38°-43°C arasındadır.Sıcaklığın düşmesi 48 saat ila 72 saat içinde gerçekleşir.
- Mekanizması çeşitli ve çoğunlukla belli değildir.
- Zaman zaman, Exanthem ile aynı zamanda görülür.
- İlaç verildikten sonra oluşan ateş;
- Cytokine
- Antikor
- Uzun zaman ilaç verildikten sonra oluşan ateş;
- Antibiyotik (7 –10 gün)
- Cytostatika (~6 gün)
- Kardiaka(~45 gün)
Haemoccult
- Stool guuaiac testtir.

Testin Avantajları;
- Basit ve kolay uygulanabilir.
- Kanser mortalitesini 15-30% oranında azalttığı ispatlanmıştır.
Testin Dezavantajları;
- Yetersiz hassasiyet: ∼ 30-90%
- Yalnış pozitif sonuçlar
- Kırmızı et(Dana, koyun)
- Bitki kökleri(turp v.b.)
- Yalnış negatif sonuçlar
- Vitamin C
- Pozitif bilimsel tahmin oranları
- Rektum kanseri ; 2.5-50%
- Adenom ve polyp; 16-40%
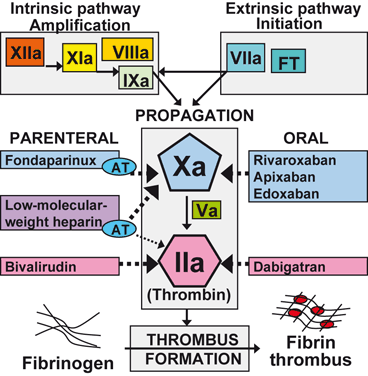
Antikoagülan
Antikoagülanlar, kan pıhtılarının oluşmasını önlemek, inme, kalp krizi ve pıhtıya bağlı diğer komplikasyon riskini azaltmak için tasarlanmış ilaçlardır. Genellikle atriyal fibrilasyon (AF), derin ven trombozu (DVT), pulmoner emboli (PE) ve inmenin önlenmesi gibi durumlar için reçete edilirler.
Antikoagülan Türleri
1. K Vitamini Antagonistleri (VKA’lar)
- Örnek: Warfarin.
- Mekanizma**: K vitaminine bağlı pıhtılaşma faktörlerini (II, VII, IX ve X) inhibe eder.
- Artılar**:
- İyi çalışılmış.
- Ucuzdur.
- Geri döndürülebilir (örn. K vitamini ile).
- Eksiler**:
- Sık izleme gerektirir (INR).
- Çok sayıda ilaç ve gıda etkileşimi.
- Şunlar İçin İdealdir**:
- Düzenli takipten geçmeye istekli hastalar.
- Uygun maliyetli seçeneklere ihtiyaç duyan hastalar.
2. Heparinler
- Örnekler: Fraksiyone edilmemiş heparin (UFH), Düşük Molekül Ağırlıklı Heparin (LMWH; örn. enoksaparin).
- Mekanizma**: Antitrombini aktive ederek pıhtılaşma faktörleri IIa (trombin) ve Xa’yı inhibe eder.
- Avantajlar**:
- Hızlı başlangıç.
- Parenteral uygulama (acil durumlarda faydalıdır).
- Geri dönüşümlüdür (örn. protamin sülfat).
- Eksiler**:
- Enjeksiyon gerektirir (intravenöz veya subkutan).
- Heparin kaynaklı trombositopeni (HIT)** riski.
- Şunlar İçin İdealdir**:
- Hastanede yatan hastalar veya perioperatif kullanım.
- Acil antikoagülasyon ihtiyaçları.
3. Doğrudan Oral Antikoagülanlar (DOAC’lar)
- Örnekler: Dabigatran (direkt trombin inhibitörü), Rivaroksaban, Apiksaban, Edoksaban (Faktör Xa inhibitörleri).
- Mekanizma**: Spesifik pıhtılaşma faktörlerini (trombin veya Faktör Xa) hedefler.
- Artılar**:
- Rutin izleme gerektirmez.
- Daha az ilaç ve gıda etkileşimi.
- Eksiler**:
- Daha yüksek maliyet.
- Sınırlı tersinirlik (idarucizumab ile dabigatran hariç).
- Şunlar İçin İdealdir**:
- Uygun, etkili antikoagülasyon arayan hastalar.
- Stabil böbrek ve karaciğer fonksiyonu olan hastalar.
4. Enjekte Edilebilir Faktör Xa İnhibitörleri
- Örnekler: Fondaparinux.
- Mekanizma**: Faktör Xa’nın spesifik inhibisyonu.
- Artılar**:
- Spesifik hedefleme.
- VKA’lar veya heparinlerden daha az etkileşim.
- Eksiler**:
- Daha pahalı.
- Belirli popülasyonlarda daha az çalışılmıştır.
- Şunlar İçin İdealdir**:
- Diğer antikoagülanları tolere edemeyen hastalar.
Antikoagülan Seçim Algoritması
1. Kullanım Endikasyonunu Belirleyin
- Atriyal fibrilasyon (AF)*: İnmeyi önleyin.
- Derin ven trombozu (DVT) veya pulmoner emboli (PE): Pıhtı yayılımını önleyin veya tedavi edin.
- İnme önleme: Genellikle AF ile ilişkilidir.
- Ameliyat sonrası profilaksi: Ortopedik cerrahi sonrası pıhtıları önleme.
2. Hasta Faktörlerini Değerlendirin
- Yaş: Yaşlı hastalarda artmış kanama riski.
- Böbrek Fonksiyonu: Ciddi böbrek yetmezliğinde DOAC’lardan ve heparinlerden kaçının.
- Karaciğer Fonksiyonu: Önemli karaciğer hastalığında DOAC ve VKA’lardan kaçının.
- Kanama veya Tromboz Geçmişi: Yatkın hastalarda daha yüksek kanama riski olan antikoagülanlardan kaçının.
- Eşlik Eden İlaçlar: İlaç etkileşimlerini değerlendirin (örn. CYP inhibitörleri veya P-gp substratları).
3. Kontrendikasyonları Dikkate Alın
- Ciddi böbrek veya karaciğer yetmezliği.
- Aktif kanama.
- Gebelik (LMWH hariç çoğu antikoagülan kontrendikedir).
- Pediatrik veya geriatrik popülasyonlar (özel dozlama gerektirir).
4. İlaca Özgü Hususlar
- VKA’lar: Düzenli izleme ve sınırlı ilaç etkileşimi olan hastalar için idealdir.
- DOAC’lar: Minimum izleme gerektiren stabil böbrek ve karaciğer fonksiyonu olan hastalar için en iyisidir.
- Heparinler: Acil durumlarda ve perioperatif ortamlarda tercih edilir.
- Faktör Xa İnhibitörleri: Diğer seçeneklere toleransı olmayan hastalarda kullanın.
İzleme ve Takip
1. K Vitamini Antagonistleri (VKA’lar)
- Sık INR takibi gereklidir (hedef aralık: çoğu endikasyon için 2.0-3.0).
- INR seviyelerine göre dozun düzenli olarak ayarlanması.
2. DOAC’lar
- Böbrek ve karaciğer fonksiyonlarının** periyodik olarak değerlendirilmesi.
- Kanama olayları için izleyin.
3. Enjekte Edilebilir Antikoagülanlar
- Fraksiyone Olmayan Heparin (UFH)**:
- Aktive Parsiyel Tromboplastin Zamanının (aPTT)** izlenmesini gerektirir.
- Düşük Molekül Ağırlıklı Heparin (LMWH)**:
- Yüksek riskli hastalar dışında rutin izleme genellikle gereksizdir.
4. Faktör Xa İnhibitörleri
- Tromboz veya kanama belirtileri açısından izleyin.
- Böbrek ve karaciğer fonksiyonlarını periyodik olarak değerlendirin.
Klinik Senaryolar
1. Derin Ven Trombozu (DVT) veya Pulmoner Emboli (PE)
Birinci basamak: Heparinler, DOAC’lar veya Faktör Xa inhibitörleri.
2. Atriyal Fibrilasyonda İnme Önleme
- Birinci basamak: DOAC’lar (örn. rivaroksaban, apiksaban).
- Alternatif: VKA’lar (izleme mümkünse).
3. Ortopedik Cerrahi Profilaksisi
- LMWH veya DOAC’ler tipik olarak kısa süreli önleme için kullanılır.
4. Böbrek veya Karaciğer Hastalığı Olan Hastalar
- DOAC’lardan kaçının; dikkatle izlenen VKA’ları veya UFH’yi düşünün.
Seçimde Dikkate Alınması Gereken Temel Hususlar
Antiplatelet ajanlar (klopidogrel)
- Klopidogrel yarılanma ömrüne (HWZ 6 saat) uygun olarak ameliyat öncesinde 5-7 gün ara verilir.
- Yüksek trombotik risk durumlarında (örn. akut koroner sendrom <6 ay), enoksaparin gibi düşük molekül ağırlıklı heparin (LMWH) ile köprüleme tedavisi önerilir.
- Ameliyat sonrası yeniden başlama ancak yara iyileşmesi kontrol edildikten sonra, tipik olarak işlemden 24-48 saat sonra gerçekleşir.
Oral antikoagülanlar (OAK)
- Direkt oral antikoagülanlar (DOAC) ve K vitamini antagonistleri ameliyattan 48 saat önce kesilir (böbrek fonksiyonlarına bağlı olarak daha uzun süre).
- LMWH köprüleme (örn. enoksaparin 1 mg/kg günde iki kez) ameliyatın bitiminden 12 saat sonra başlar.
- OAK’nin yeniden başlanması kademelidir:
- Postop 1-3. günden itibaren iyi hemostaz kontrolü ile
- Yüksek riskli hastalarda (örn. mekanik kalp kapakçıkları), derhal tam antikoagülasyon
Premedikasyonsuz tromboz profilaksisi
- Postop 1.-2. günler için LMWH (enoksaparin 40 mg günde 1×). gün[4]
- Rivaroksaban** (günde 10 mg 1×) tedavisine geçin:
- Diz OP ‘i için 2 hafta
- Kalça OP için 4 hafta
Önemli güvenlik hususları
1 İkili antiplatelet tedaviye (ASA + klopidogrel) yalnızca hayati bir endikasyon varsa devam edin
- Yüksek riskli hastalarda en fazla 1 ay süreyle üçlü tedavi (OAK + ASA + klopidogrel)
- PPI uygulaması kombine antikoagülasyon ile zorunludur.
Bu öneriler her zaman prosedürün kanama riskine ve trombotik hasta riskine göre bireysel olarak uyarlanmalıdır. Devam eden antikoagülasyon altında acil cerrahi için spesifik antagonizasyon (örn. FXa inhibitörleri için andeksanet alfa ile) düşünülmelidir.
Antikoagülanlar ve Antiplatelet Ajanlar için Endikasyonlar
Antikoagülanlar ve antiplatelet ajanlar tromboembolik olayların önlenmesi ve yönetilmesinde esastır. Birincil endikasyonlar şunları içerir:
Atriyal Fibrilasyon (AF):
- AF’li hastalarda inme ve sistemik embolinin önlenmesi.
Derin Ven Trombozu (DVT):
- Tekrarlayan DVT’nin tedavisi ve önlenmesi.
Pulmoner Emboli (PE):
- PE’nin tedavisi ve önlenmesi.
Ameliyat Sonrası Pıhtı Önleme:
- Ortopedik veya genel cerrahi sonrası venöz tromboembolizmin (VTE) önlenmesi.
Akut Koroner Sendromlar (AKS):
- Stent trombozunun önlenmesi ve miyokard enfarktüsünün (MI) yönetimi.
Doz Yükleme: Farmakokinetik ve Stratejiler
Yükleme dozları, özellikle AKS gibi akut durumlarda veya perkütan koroner girişim (PCI) gibi müdahalelerden önce “jeloaded” duruma (antikoagülan veya antiplatelet etkinin hızlı terapötik seviyeleri) ulaşmak için kritik öneme sahiptir.
1. Aspirin (Trombo ASS)
- Mekanizma**:
- Siklooksijenaz-1’i (COX-1) geri dönüşümsüz olarak inhibe ederek tromboksan A2 sentezini ve trombosit agregasyonunu önler.
- Kullanım Dozu**:
- Hızlı trombosit inhibisyonu elde etmek için genellikle tek dozda 250-300 mg oral.
- İdame Dozu**:
- Pıhtı oluşumunun sürekli önlenmesi için günde 75-100 mg.
- Klinik Kullanım**:
- Akut koroner sendromlarda ve stent yerleştirilmesinden sonra gereklidir.
2. Klopidogrel
- Mekanizma**:
- Trombositler üzerindeki P2Y12 ADP reseptörünü geri dönüşümsüz olarak inhibe eden bir tiyenopiridin antiplatelet ilaç.
- Yükleme Dozu**:
- Trombositleri hızla inhibe etmek için ağızdan 300-600 mg (AKS veya PKG için daha yüksek dozlar tercih edilir).
- İdame Dozu**:
- Günde 75 mg**.
- Klinik Kullanım**:
- Genellikle PKG sonrası veya AKS’de ikili antiplatelet tedavide (DAPT) aspirinle birlikte kullanılır.
3. Efient (Prasugrel)
- Mekanizma**:
- Klopidogrele kıyasla daha güçlü ve hızlı etkili bir P2Y12 reseptör inhibitörü.
- Yükleme Dozu**:
- PCI öncesi 60 mg oral.
- İdame Dozu**:
- Günde 10 mg**, <60 kg ağırlığındaki veya artmış kanama riski olan hastalarda 5 mg’a ayarlanır.
- Klinik Kullanım**:
- PKG uygulanan AKS hastalarında üstün etkinliği nedeniyle tercih edilir ancak daha yüksek kanama riski taşır.
“Geloaded” Durumunun Önemi
- Akut Durumlar**:
- Hızlı trombosit inhibisyonu sağlamak aşağıdaki durumlarda kritik öneme sahiptir:
- Akut Miyokard Enfarktüsü (AMI)**.
- Acil PCI** veya stent yerleştirilmesi.
- Erken stent trombozunu ve pıhtı yayılımını önler.
- Bakım Tedavisi**:
- Stent takıldıktan sonra, stent trombozu riskini azaltmak için DAPT (aspirin + klopidogrel veya prasugrel gibi bir P2Y12 inhibitörü) 6-12 ay boyunca devam ettirilir.
İzleme ve Güvenlik
Etkililik:
- Yeterli antikoagülasyonun klinik belirtilerini kontrol edin (örn. pıhtı ilerlemesinin azalması, iskemik olayların olmaması).
- Laboratuvar testleri trombosit fonksiyon testlerini içerebilir (örn. P2Y12 inhibitörleri için VerifyNow).
Güvenlik:
- Kanama belirtileri veya yan etkiler açısından izleyin.
Yan Etkiler
1. Kanama
- En Yaygın ve Ciddi Risk:
- Küçük morarma, mukozal kanama ve gastrointestinal veya intrakraniyal kanama gibi ciddi olayları içerir.
- Önleme**:
- Kanama riskini en aza indirmek için özel dozajlama.
- Diğer antikoagülanlar veya NSAİİ’ler ile birlikte kullanımdan kaçınma.
2. Morarma
- Genellikle trombosit agregasyonunun inhibisyonuna bağlı olarak ortaya çıkar.
- Yönetilebilir ve genellikle kendi kendini sınırlar ancak izlenmelidir.
3. Gastrointestinal Sorunlar
- İçerir:
- Dispepsi: Özellikle aspirin ile yaygındır.
- Gastrointestinal kanama**: Ülser veya gastrit öyküsü olan hastalarda daha yüksek risk.
- Önleme:
- Yüksek riskli hastalarda proton pompası inhibitörlerinin (PPI) birlikte uygulanması.
Klinik Hususlar
Hastaya Özel Faktörler:
- Böbrek veya karaciğer yetmezliği: Bu organlar tarafından metabolize edilen ilaçlar için dozu ayarlayın (örn. şiddetli karaciğer yetmezliğinde prasugrelden kaçının).
- Kilo ve yaş: Kanama risklerini en aza indirmek için zayıf veya yaşlı hastalarda dozları düşürün.
İkili Antiplatelet Tedavi (DAPT):
- Stent trombozunu önlemek için stent sonrası 6-12 ay boyunca gereklidir.
- DAPT erken kesilirse trombotik olay riski önemli ölçüde artar.
Hasta Danışmanlığı:
- Pıhtı oluşumunu önlemek için reçete edilen tedaviye uyumu vurgulayın.
- Hastaları kanama belirtilerini tanıma ve ne zaman tıbbi yardım almaları gerektiği konusunda eğitin.
Klinik endikasyonlar, yükleme stratejileri ve potansiyel yan etkiler dikkatle değerlendirilerek, antikoagülanlar ve antiplatelet ajanlar hastaların ihtiyaçlarına göre etkili bir şekilde uyarlanabilir ve optimal terapötik sonuçlar sağlanabilir.
Etki Mekanizması: Antikoagülanlar
Antikoagülanlar, pıhtılaşma kaskadındaki spesifik proteinleri veya enzimleri hedef alarak kan pıhtısı oluşumunu veya büyümesini önler. Antikoagülanlar bu yollara müdahale ederek inme, derin ven trombozu (DVT) ve pulmoner emboli (PE) gibi tromboembolik olay riskini azaltır. Mekanizmalar antikoagülan türüne göre değişir:
K Vitamini Antagonistleri (örn. Warfarin):
- Karaciğerde K vitaminine bağlı pıhtılaşma faktörlerinin (II, VII, IX ve X) sentezini inhibe eder.
- Pıhtılaşma sürecini birkaç gün boyunca yavaşlatır.
Heparinler (örn. UFH, LMWH):
- Pıhtılaşma faktörleri IIa (trombin) ve Xa’yı inhibe eden antitrombini aktive ederek hızlı antikoagülasyona yol açar.
Doğrudan Oral Antikoagülanlar (DOAC’lar):
- Doğrudan Faktör Xa İnhibitörleri** (örn. rivaroksaban, apiksaban): Faktör Xa’yı doğrudan bloke ederek protrombinin trombine dönüşmesini önler.
- Doğrudan Trombin İnhibitörleri (örn. dabigatran): Trombine bağlanarak fibrin oluşumundaki rolünü engeller.
Psikoz: Patofizyoloji ve Klinik Bakış
Psikoz, genellikle halüsinasyonlar, sanrılar veya düzensiz düşünce süreçleri olarak ortaya çıkan gerçeklikten kopma ile karakterizedir. Aşağıdaki gibi durumlarda ortaya çıkabilir:
- Birincil psikiyatrik bozukluklar**: Şizofreni, bipolar bozukluk, majör depresif bozukluk.
- İkincil nedenler**: Tıbbi durumlar, madde bağımlılığı veya ilaçlar.
Psikozun patofizyolojisi şunları içerir:
- Nörotransmitter Düzensizliği: Öncelikle dopamin ve serotonin yolakları.
- Nöroinflamasyon: Ortaya çıkan kanıtlar, enflamasyonun bazı vakalarda rol oynayabileceğini göstermektedir.
Antikoagülanlar ve Psikoz: Etkileşimler ve Endişeler
1. Antikoagülanların Merkezi Sinir Sistemi (MSS) Etkileri
- Bazı antikoagülanlar, özellikle warfarin, akut psikoz dahil olmak üzere nadir görülen MSS yan etkileri raporlarıyla ilişkilendirilmiştir.
- Hipotez Edilen Mekanizmalar**:
- Değişen kan viskozitesi MSS perfüzyonunu etkiler.
- Antikoagülan metabolizması veya etkileşimleri nedeniyle MSS fonksiyonu üzerinde potansiyel doğrudan etkiler.
2. Psikozda Artmış Tromboembolik Risk
- Bazı antipsikotik ilaçlar, özellikle ikinci nesil ajanlar (örn. klozapin, olanzapin) ile ilişkilendirilmiştir:
- Artmış venöz tromboembolizm (VTE) riski.
- Bu durum, her iki tedaviye de ihtiyaç duyan psikoz hastalarında antikoagülan tedaviyi zorlaştırabilir.
3. İlaç-İlaç Etkileşimleri
- Varfarin**:
- Sitokrom P450 enzim sistemi** aracılığıyla metabolizmasını değiştiren ilaçlarla etkileşime oldukça duyarlıdır.
- Klorpromazin** veya ketiapin gibi bazı antipsikotikler varfarinin antikoagülan etkisini artırabilir veya azaltabilir.
- DOAK’lar:
- Antipsikotiklerle etkileşimlere ilişkin veriler sınırlıdır, ancak özellikle böbrek veya karaciğer fonksiyon bozukluğu olan hastalarda birlikte uygulamaya dikkatle yaklaşılmalıdır.
Klinik Hususlar ve İzleme
1. Hasta Değerlendirmesi
- Tıbbi ve psikiyatrik geçmişin kapsamlı değerlendirilmesi.
- Aşağıdakiler için risk faktörlerinin belirlenmesi:
- Kanama (antikoagülanlar nedeniyle).
- Tromboembolizm (psikotik bozukluklar veya antipsikotikler nedeniyle).
2. Yan Etkiler için İzleme
- Antikoagülanlar**:
- Özellikle varfarin ile tedavi edilen hastalarda değişmiş mental durum veya psikoz dahil olmak üzere MSS etkileri belirtileri açısından izleyin.
- Antikoagülan etkinliği için düzenli kan testleri (örn. varfarin için INR, DOAC’lar için böbrek fonksiyonu).
- Antipsikotikler**:
- Metabolik sendrom, hiperlipidemi ve diğer protrombotik faktörler açısından izleyin.
3. Etkileşim Yönetimi
- Özellikle varfarin kullanan hastalarda ilaç etkileşimlerinin yakından izlenmesi.
- Klinik olarak uygunsa ve böbrek/karaciğer fonksiyonları tarafından destekleniyorsa alternatif tedaviler (örn. DOAC’lar) kullanın.
4. Eğitim ve Multidisipliner Yaklaşım
- Hastaları ve bakıcıları şu konularda eğitin:
- Kanama, tromboembolizm veya MSS yan etkileri belirtileri.
- Reçete edilen rejimlere uymanın önemi.
- Tedaviyi optimize etmek için psikiyatri, kardiyoloji ve hematoloji dahil olmak üzere multidisipliner bir ekibi dahil edin.
Araştırma İhtiyaçları ve Cevaplanmamış Sorular
- Antikoagülanlar ve psikoz arasındaki ilişki hakkında sınırlı veri mevcuttur.
- Daha ileri çalışmalara ihtiyaç vardır:
- Antikoagülanla ilişkili MSS etkilerinin mekanizmalarını aydınlatmak.
- Antikoagülanların antipsikotiklerle, özellikle de DOAC’larla kombinasyonunun güvenliğini değerlendirin.
Antikoagülan Kullanımı için Kontrendikasyonlar
Antikoagülanlar trombotik durumların önlenmesi ve tedavisinde kritik öneme sahiptir, ancak doğal kanama riskleri ve ciddi etkileşim potansiyelleri nedeniyle belirli kontrendikasyonları vardır. Yaygın kontrendikasyonlar şunları içerir:
1. Aktif Kanama
- Devam eden kanaması veya kanamaya eğilimli durumları (örn. gastrointestinal ülserler, intrakraniyal kanama) olan hastalar antikoagülan almamalıdır.
2. Yüksek Kanama Riski
- Hemofili veya şiddetli trombositopeni gibi kanama bozukluğu öyküsü olan hastalarda komplikasyon riski artmaktadır.
3. Ciddi Böbrek veya Karaciğer Rahatsızlıkları
- Böbrek Yetmezliği**:
- Antikoagülanlar, özellikle DOAC’lar ve LMWH, renal klirense bağlıdır. Ciddi böbrek fonksiyon bozukluğu ilaç birikimine ve toksisiteye yol açabilir.
- Karaciğer Bozukluğu**:
- Karaciğer fonksiyon bozukluğu, K vitamini antagonistlerinin (örn. varfarin) metabolizmasını ve pıhtılaşma faktörlerinin üretimini etkileyerek kanama risklerini artırır.
4. Alerjiler veya Aşırı Duyarlılık
- Herhangi bir antikoagülan bileşene karşı aşırı duyarlılığı olduğu bilinen hastalar (örn. heparin kaynaklı trombositopeni) bu ilaçlardan kaçınmalıdır.
5. Diğer Durumlar
- Gebelik:
- LMWH** hariç çoğu antikoagülan, teratojenik etkiler veya fetal kanama riskleri nedeniyle kontrendikedir.
- Yeni Geçirilmiş Cerrahi veya Travma**:
- Cerrahi veya travmatik yaralar, antikoagülan tedavi altında önemli kanama riski taşır.
- Kontrol Altına Alınmamış Hipertansiyon**:
- Yüksek kan basıncı, özellikle kafa içi kanama olmak üzere hemorajik komplikasyon riskini artırır.
Antikoagülanlar için İzleme Gereklilikleri
1. Varfarin
- Uluslararası Normalleştirilmiş Oran (INR)**:
- Terapötik seviyeleri (çoğu endikasyon için tipik olarak 2.0-3.0) korumak için düzenli INR takibi şarttır.
- Aşırı antikoagülasyon (INR >3.5) kanama riskini artırırken, düşük antikoagülasyon (INR <2.0) trombotik olayları riske atar.
- Sıklık**:
- Başlangıçta haftalık izleme, stabil olduğunda aylık izlemeye geçiş.
2. Heparinler
- Fraksiyone Olmayan Heparin (UFH)**:
- Aktive Parsiyel Tromboplastin Zamanı (aPTT)**: Dozu izlemek ve ayarlamak için kullanılır.
- Düşük Molekül Ağırlıklı Heparin (LMWH)**:
- Rutin izleme gereksizdir ancak yüksek riskli popülasyonlarda (örn. böbrek yetmezliği, obezite, gebelik) gerekli olabilir.
3. Doğrudan Oral Antikoagülanlar (DOAC’lar)
- Rutin izleme gerekli değildir, ancak periyodik değerlendirmeler yapılmalıdır:
- Böbrek fonksiyonu**: Rivaroksaban veya apiksaban gibi ilaçların klerensini değerlendirin.
- Karaciğer fonksiyonu**: Potansiyel hepatik metabolizma sorunlarını değerlendirin.
Antikoagülanlarla İlaç Etkileşimleri
Antikoagülanlar çok sayıda ilaç etkileşimine yatkındır ve advers olaylardan kaçınmak için dikkatli bir yönetim gerektirir.
1. Varfarin
- Metabolizma**:
- Başta CYP2C9 olmak üzere sitokrom P450 (CYP) enzim sistemi tarafından metabolize edilir.
- Etkileşen İlaçlar**:
- Antibiyotikler** (örn. siprofloksasin, amoksisilin): Bağırsak florasını bozarak K vitamini sentezini değiştirir.
- Antifungaller (örn. flukonazol): Güçlü CYP inhibitörleri, varfarin düzeylerini artırır.
- Kan Basıncı İlaçları** (örn. amiodaron): Varfarinin etkilerini güçlendirebilir.
- NSAİİ’ler ve Aspirin: Trombosit inhibisyonu nedeniyle kanama riskini artırır.
- Gıda Etkileşimleri**:
- K vitamini açısından zengin gıdalar (örn. yeşil yapraklı sebzeler) varfarinin etkilerini antagonize edebilir.
2. Heparinler
- Daha az ilaç etkileşimi, ancak antiplateletlerle (örn. aspirin, klopidogrel) kombine edildiğinde ilave kanama riskleri olabilir.
3. DOAC’lar
- P-glikoprotein Etkileşimleri:
- Amiodaron, verapamil veya ketokonazol gibi ilaçlar P-gp taşınmasını inhibe ederek DOAC konsantrasyonlarını artırır.
- CYP3A4 Etkileşimleri:
- Güçlü inhibitörler (örn. klaritromisin, ritonavir) DOAC seviyelerini yükselterek kanama riskini artırır.
- Antasitler ve Proton Pompa İnhibitörleri (PPİ’ler):
- Dabigatran emilimini etkileyebilir.
Yan Etkiler ve Önlemler
1. Yaygın Yan Etkiler
- Kanama**:
- Küçük morarmalardan hayatı tehdit eden kanamalara kadar değişen en önemli risktir.
- Gastrointestinal kanama özellikle DOAC’larda yaygındır.
- Hematolojik Etkiler:
- Fraksiyone olmayan heparin alan hastalarda heparine bağlı trombositopeni (HIT).
- Cilt Reaksiyonları**:
- Varfarine bağlı cilt nekrozu (nadir).
2. Hasta Eğitimi ve Yönetimi
- Hastaları kanama belirtileri hakkında bilgilendirin:
- Morarma, uzun süreli kanama, siyah dışkı veya hematüri.
- Tıbbi rehberlik olmadan reçetesiz NSAİİ veya aspirinden kaçınılmasını tavsiye edin.
- Tedavinin etkinliğini ve güvenliğini izlemek için düzenli takipler önerin.
Temel Hususlar
Bireyselleştirilmiş Tedavi:
- Antikoagülanları yaş, böbrek ve karaciğer fonksiyonu ve kanama riski gibi hastaya özgü faktörlere göre seçin.
Yakın İzleme:
- Varfarin sık INR kontrolleri gerektirirken, DOAC’lar periyodik böbrek ve karaciğer değerlendirmelerine ihtiyaç duyar.
Etkileşimleri Yönet:
- Advers etkileşimleri önlemek için eş zamanlı ilaçları iyice gözden geçirin.
- Hasta güvenliğini optimize etmek için gerektiğinde dozları ayarlayın veya tedavileri değiştirin.
Antikoagülanlar kardiyovasküler ve trombotik durumların yönetiminde vazgeçilmezdir. Bununla birlikte, kullanımları kontrendikasyonlar, etkileşimler ve yan etkilerle ilişkili riskleri azaltmak için dikkatli olmayı gerektirir.
Antikoagülanlara Tarihsel Bir Bakış
Antikoagülanların tarihi, ilkel uygulamalardan gelişmiş farmakolojik çözümlere doğru evrilerek yüzyılları kapsamaktadır.
1. Erken Başlangıçlar: İlkel Kan İnceltme Uygulamaları
- Eski Uygulamalar:
- Sülükler**: Kan pıhtılarını önlemek veya tedavi etmek için eski Mısır, Yunanistan ve Hindistan’da kan almak için kullanılan en eski yöntemlerden biri.
- Bitki Özleri**: Söğüt kabuğu (aspirinin öncüsü) gibi antikoagülan özelliklere sahip bitkiler geleneksel tıpta kullanılmıştır.
- Önem**:
- Bu ilk teknikler antikoagülasyonun anlaşılması için temel oluşturmuştur.
2. Keşifler Çağı: Heparin (1916-1930’lar)
- 1916:
- Keşif**: Jay McLean ve William Henry Howell, Johns Hopkins Üniversitesi’nde köpek karaciğerinden doğal olarak oluşan bir antikoagülan olan heparini izole etti.
- İsim: Yunanca karaciğer anlamına gelen “hepar” kelimesinden türetilmiştir.
- 1930s:
- Klinik Uygulama**:
- Heparin, cerrahi prosedürler ve kan transfüzyonları için pratik bir ilaç haline getirildi.
- Hızlı etki eden ve geri dönüşümlü özellikleri onu hastane kullanımı için ideal hale getirdi.
- Önemi**:
- Antikoagülasyon tedavisinde ilk önemli sıçramayı gerçekleştirdi.
3. Warfarin: Kemirgen İlacından Tıbbi Buluşa (1940’lar-1950’ler)
- 1940s:
- Keşif:
- Bozulmuş tatlı yoncada bulunan ve sığırlarda kanamaya neden olan bir bileşik olan kumarinden türetilmiştir.
- Başlangıçta fare zehiri olarak geliştirildi.
- Geliştirme:
- Wisconsin Mezunları Araştırma Vakfı (WARF) sentezine öncülük ederek “warfarin” isminin ortaya çıkmasını sağladı.
- 1950s:
- Tıbbi Kullanım**:
- Etkinliği ve güvenliği kanıtlandıktan sonra insan kullanımı için onaylandı.
- Felçleri önlemek, atriyal fibrilasyonu tedavi etmek ve tromboembolik durumları yönetmek için yaygın olarak kullanılmaya başlandı.
- Önemi**:
- Sık izleme gerektirmesine rağmen on yıllar boyunca oral antikoagülasyonun temel taşı olarak kalmıştır.
4. Modern Gelişmeler: Doğrudan Oral Antikoagülanlar (DOAC’lar)
- 2000’ler-2010’lar:
- Giriş**:
- Rivaroksaban, apiksaban, edoksaban ve dabigatran gibi DOAC’lar varfarine alternatif olarak ortaya çıktı.
- Avantajları**:
- Rutin izleme gerektirmeden sabit dozaj.
- Azaltılmış gıda ve ilaç etkileşimi riski.
- Böbrek ve karaciğer fonksiyonları stabil olan hastalarda daha kolay yönetim.
- Önem**:
- Antikoagülasyon tedavisinde devrim yaratarak tedaviyi daha hasta dostu ve erişilebilir hale getirdi.
5. Kişiselleştirilmiş Tedaviler ve Geleceğe Bakış
- Güncel Araştırma**:
- Biyoteknoloji**:
- Hedefli antikoagülasyon için bi-spesifik antikorların ve gen düzenleme araçlarının geliştirilmesi.
- Genomik:
- Antikoagülan tedaviyi bireysel hastalara uyarlamak, yan etkileri en aza indirmek ve etkinliği optimize etmek için genetik belirteçlerin araştırılması.
- Sentetik Alternatifler**:
- Yeni nesil ilaçlar, daha yüksek hassasiyet ve daha az komplikasyonla belirli yolları hedeflemeyi amaçlamaktadır.
- Gelecekteki Yönelimler**:
- İlaç etkileşimlerini azaltmaya ve daha geniş bir hasta yelpazesi için geri dönüşümlü, daha güvenli seçenekler yaratmaya vurgu.
İleri Okuma
- McLean, J. (1916). The thromboplastic action of cephalin preparation of various organs. Journal of Experimental Medicine, 23(5), 567–575. https://doi.org/10.1084/jem.23.5.567
- Howell, W. H., & Holt, E. (1918). Two new factors in blood coagulation – heparin and pro-antithrombin. American Journal of Physiology, 47(2), 328–341. https://doi.org/10.1152/ajplegacy.1918.47.2.328
- Link, K. P. (1944). The discovery of dicumarol and its sequels. Circulation, 19, 97–107. https://doi.org/10.1161/01.CIR.19.1.97
- Hirsh, Jack, et al. “Heparin and low-molecular-weight heparin: Mechanisms of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety.” Chest 114.5 (1998): 489S-510S.
- Wysowski, Diane K., et al. “Warfarin use among ambulatory patients with nonvalvular atrial fibrillation: The AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) study.” Annals of internal medicine 131.12 (1999): 927-934.
- Hirsh, J., Fuster, V., Ansell, J., & Halperin, J. L. (2003). American Heart Association/American College of Cardiology Foundation guide to warfarin therapy. Circulation, 107(12), 1692–1711. https://doi.org/10.1161/01.CIR.0000063575.17904.4E
- Eriksson, B. I., Borris, L. C., Friedman, R. J., Haas, S., Huisman, M. V., Kakkar, A. K., & Misselwitz, F. (2008). Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. New England Journal of Medicine, 358(26), 2765–2775. https://doi.org/10.1056/NEJMoa0800374
- Connolly, S. J., Ezekowitz, M. D., Yusuf, S., Eikelboom, J., Oldgren, J., Parekh, A., & Wallentin, L. (2009). Dabigatran versus warfarin in patients with atrial fibrillation. New England Journal of Medicine, 361(12), 1139–1151. https://doi.org/10.1056/NEJMoa0905561
- Montalescot, G., Wiviott, S. D., Braunwald, E., Murphy, S. A., Gibson, C. M., McCabe, C. H., Antman, E. M. (2009). “Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial”. The Lancet, 373(9665), 723-731.
- Granger, C. B., Alexander, J. H., McMurray, J. J., Lopes, R. D., Hylek, E. M., Hanna, M., & Wallentin, L. (2011). Apixaban versus warfarin in patients with atrial fibrillation. New England Journal of Medicine, 365(11), 981–992. https://doi.org/10.1056/NEJMoa1107039
- Barnes, Geoffrey D., et al. “Comparative effectiveness of direct oral anticoagulants and warfarin in patients with cancer and atrial fibrillation.” Blood advances 2.3 (2018): 200-209.
- Hylek, E. M., & Witt, D. M. (2021). Pharmacology and mechanisms of action of oral anticoagulants. UpToDate. Retrieved from https://www.uptodate.com
- Camm, A. John, et al. “2012 focused update of the ESC Guidelines for the management of atrial fibrillation.” European heart journal 33.21 (2012): 2719-2747.
- Holbrook, Anne, et al. “Evidence-based management of anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines.” Chest 141.2 (2012): e152S-e184S.
- Amsterdam, E. A., Wenger, N. K., Brindis, R. G., Casey, D. E. Jr., Ganiats, T. G., Holmes, D. R. Jr., Jaffe, A. S., Jneid, H., Kelly, R. F., Kontos, M. C., Levine, G. N., Liebson, P. R., Mukherjee, D., Peterson, E. D., Sabatine, M. S., Smalling, R. W., Zieman, S. J. (2014). “2014 AHA/ACC Guideline for the Management of Patients With Non-ST-Elevation Acute Coronary Syndromes: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines“. Circulation, 130(25), e344-e426.
- Ruff, C. T., Giugliano, R. P., Braunwald, E., Hoffman, E. B., Deenadayalu, N., Ezekowitz, M. D., & Antman, E. M. (2014). Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: A meta-analysis of randomised trials. The Lancet, 383(9921), 955–962. https://doi.org/10.1016/S0140-6736(13)62343-0
- Van Os, Jim, et al. “Psychosis as a transdiagnostic and extended phenotype in the general population.” World Psychiatry 15.2 (2016): 118-124.
- Reardon, M. J., Adams, D. H., Kleiman, N. S., Coselli, J. S., Deeb, G. M., Gleason, T. G., & Popma, J. J. (2017). Anticoagulants in the modern era: DOACs and warfarin. Circulation Research, 120(10), 1522–1533. https://doi.org/10.1161/CIRCRESAHA.116.310364
Geftinib
Cetuximab
Trastuzumab
Ticari ad: Herceptin (Roche)
erbB2‘ye karşı monoklonal antikor.Eğer hücre fazla miktarda erbB2 salgılıyorsa
kullanılması tavsiye edilir. Göğüs kanserinin yanı sıra mide kanserinin tedavisinde de başarılı sonuçlar alınmıştır.
Yan etkileri
- Baş ağrısı,
- Diyare,
- Mide bulantısı,
- Titreme,
- Ateş,
- Kalp problemleri,
- Enfeksiyon,
- Uykusuzluk,
- Öksürme,
- Deride kızarıklık.
Imatinib
Ticari adlar: Glivec®
- Tirozin kinasz inhibitördür(TKI).

Kimyasal
Yapısı ve özellikleri
İmatinib (C29H31N7O, Mr = 493,6 g/mol) ilacın içinde beyazdan kahverengiye veya sarıya kadar değişen renklerde kristal toz halinde imatinib mesilat olarak bulunur. Bir 2-phenylaminopyrimidine türevidir.

Çalışma mekanizması
Kronik myeloid löseminde olduğu gibi bazı durumlarda mutasyon geçirmiş hücreler,
BCR-ABL’yi üretir. Bu füzyon proteini ABL’ye kıyasla aktif Tirozin kinazın etkinliğini güçlendirir. Bu sebeple de kanda kontrolsüz beyaz kan hücrelerin artışı gözlemlenir. Imanitib ise hücre gelişimini tetikleyen tirozin kinazeyi engeller.
Bazı bireylerde BCR-ABL-Gen’de meydana gelen mutasyon sebebiyle imatinib’e dirençli hale gelmişlerdir, Bu gibi durumlara alternatif olarak Dasatinib, Nilotinib tavsiye edilir.

Endikasyonlar:
Kronik miyeloid lösemi (Ph+CML) tedavisi için.
Diğer endikasyonlar arasında akut lenfoblastik lösemi (Ph+ALL), bazı gastrointestinal tümörler (GIST, gastrointestinal stromal tümörler), deri tümörleri, hipereozinofilik sendrom, atipik miyelodisplastik / miyeloproliferatif bozukluklar ve agresif sistemik mastositoz yer almaktadır.
Ürün bilgilerine göre dozajlanır. Tabletler genellikle günde bir kez yemek ve büyük bir bardak su ile alınır. Günlük 800 mg’lık dozlar için tabletler günde iki kez alınmalıdır.
Kontrendikasyonlar
- Aşırı Duyarlılık
Tüm önlemler için ürün bilgilerine bakın.
Etkileşimler
İmatinib bir CYP3A4 substratı ve bir CYP3A4, CYP2D6, CYP2C9 ve CYP2C19 inhibitörüdür. Karşılık gelen etkileşimler dikkate alınmalıdır. İmatinib parasetamolün O-glukuronidasyonunu inhibe eder. Parasetamol kronik olarak alınırken dikkatli olunmalıdır.
Olumsuz etkiler
En yaygın olası yan etkiler arasında bulantı, kusma, ishal, dispepsi ve karın ağrısı gibi sindirim semptomları, ödem, yorgunluk, kilo alımı, baş ağrısı, kas krampları, kas ve eklem ağrısı, kemik ağrısı, kan sayımında değişiklikler ve deri döküntüsü yer almaktadır.
Ligand
- Latincede; ligare kelimesinden gelir.
- Biyokimyada; substanzın(küçük molekülün) bir biyomolekülle biyolojik amaca hizmet etmek için bir komplex oluşturmalarıdır.
Epidermal büyüme faktörü reseptörü
epidermal growth factor receptor (EGFR; ErbB-1; HER1 insanda) hücre yüzey rezeptörüdür. hücre dışı protein ligandlarının epidermal growth factor family (EGF-family) ailesinin üyelerini tanımak için özelleşmişti
- EGF reseptörü, EGF’nin bağlanması ile aktif hale gelip, hücre içinde bir dizi kimyasal tepkimeyi gerçekleştirir.Bu tepkimeler, hücrenin hayatta kalması için önemlidir.
- Tümör hücrelerinde ise, bu hayati yolların onkogen veya tümör baskılayıcı genler tarafından mutasyona uğramıştır.
- Büyüme faktörlerin fazla salınması; TGF-α’nin fazla salgılanmasından dolayı, hücre otokrin büyüme uyarısı ile hücre organizmadan bağımsız olarak uyarıp, gelişir.
- Reseptörlerin fazla olması; EGF moleküllerin reseptöre bağlanıp, sinyal yaratma olasılığını arttırır.Bu olay, akciğer ve bağırsak kanserinde sık rastlanır.
Eğer hücre fazla büyüme faktörüne ve reseptörüne sahipse, etkili bir otokrin büyüme uyarısı oluşur.
- erbB2 proteinin fazla salgılanması; Normal hücrelerde neredeyse hiç salgılanmaz.Örneğin göğüs kanserinde; erbB2’nin ligandı yoktur.Bu yüzden EGFR (=erbB1) ile Heterodimer oluşturur.
- Reseptör Moleküllerin mutasyona uğraması; Bu durumda, hücre kendini aktif edebilir.Mutasyonlu reseptör sayesinde aşırı gelişen hücreler, reseptörün engellenmesi durumunda büyümeleri durur.
- Ras genlerinin mutasyonu; Ras geninin 12. ve 13. kodonlarında oluşan nokta mutasyonları yüzünden, GTP’den GDP’e hidrolizini hücre gerçekleştiremiyor.Ras, insandaki dayanıklı tümörlerin en sık onkojenidir.Bu yüzden hastalara hücre içi sinyal yollarına müdahelede bulunabilmek için , ağır tedavi yöntemleri uygulanır.
- bcr-abl ‘dan oluşan füzyon proteini; Oluşan Kinaseler onkojen olarak aktifdir.Tedavi olarak Imatinib(GLIVEC®) = Kinase inhibitör kullanılır.
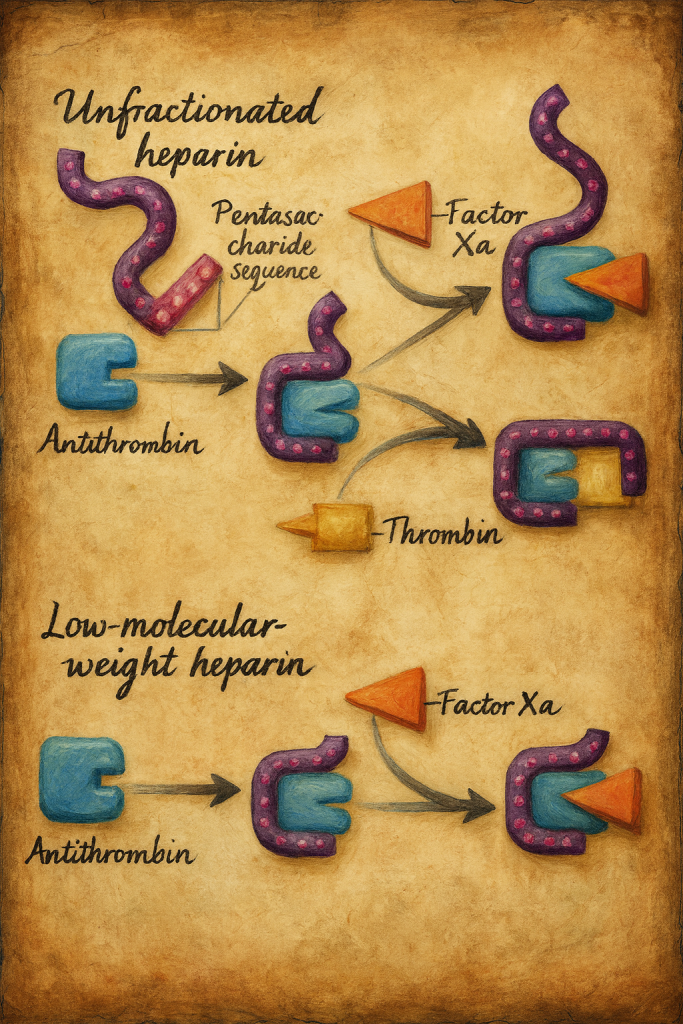
Düşük molekül ağırlıklı heparin (DMAH)
Tanım ve sınıflandırma
Düşük moleküler ağırlıklı heparinler (DMAH), fraksiyone edilmemiş heparinin (FMH) kimyasal veya enzimatik depolimerizasyonuyla elde edilen, ortalama molekül kütlesi yaklaşık 3.000–6.000 Da arasında değişen antitrombotik ajanlardır. Ürünler, üretim süreçlerine bağlı olarak farklı oligosakkarit dağılımlarına ve anti-Xa/anti-IIa aktivite oranlarına sahiptir. Klinik pratikte en sık kullanılan temsilciler arasında enoksaparin, dalteparin, tinzaparin, nadroparin, bemiparin, reviparin ve sertoparin yer alır. Her bir preparat biyobenzer değildir; dolayısıyla değişim (“switching”) farmakokinetik/-dinamik farklar doğurabilir.
- DMAH’ler, VTE profilaksisi ve tedavisinde, ayrıca AKS ve belirli renal/dializ senaryolarında birinci basamak antikoagülanlardandır.
- Etkilerini AT üzerinden başlıca faktör Xa inhibisyonuyla gösterir; doz-yanıt öngörülebilirdir ve rutin laboratuvar izlemi gerekmez.
- En ciddi advers olay kanamadır; HIT riski FMH’ye göre daha düşük olsa da klinik açıdan önemini korur.
- Böbrek fonksiyonu, vücut ağırlığı, yaş, gebelik ve eşlik eden ilaçlar doz ve izlem stratejilerini belirler.
- Protamin yalnızca kısmi nötralizasyon sağlar; girişimler ve nöraksiyal tekniklerde zamanlama kritik önemdedir.
Farmakodinamik: Etki mekanizması
DMAH’lerin antikoagülan etkisi, özgül pentasakkarit dizisinin antitrombin (AT) ile yüksek afiniteyle bağlanmasına dayanır. AT aktivasyonu, başta faktör Xa olmak üzere serin proteaz koagülasyon faktörlerinin inhibisyonunu hızlandırır. FMH’ye kıyasla DMAH’ler trombin (faktör IIa) üzerinde daha zayıf, faktör Xa üzerinde ise daha belirgin inhibisyon oluşturur; tipik anti-Xa/anti-IIa oranı yaklaşık 2:1 ile 4:1 arasındadır (preparata özgü değişkenlik gösterir). Daha düşük nonspesifik protein bağlanması, daha az endotel/makrofaj etkileşimi ve düşük plazma proteinlerine bağlanma, doz-yanıt ilişkisinin daha öngörülebilir olmasını sağlar.
Farmakokinetik özellikler
- Uygulama yolu: En sık subkutan; seçilmiş durumlarda intravenöz yükleme/infüzyon yapılabilir.
- Biyoyararlanım: Subkutan uygulamada ~%90’ın üzerindedir; FMH’ye kıyasla yüksek ve tutarlıdır.
- Zirve etki zamanı: 3–5 saat içinde anti-Xa aktivitesi tepe noktasına ulaşır.
- Eliminasyon: Başlıca renal; kreatinin klerensi azaldıkça birikim riski artar.
- Yarı ömür: Yaklaşık 3–6 saat (preparata ve doza bağlı).
- İzlem: Rutinde aPTT izlemi gerekmez; anti-Xa düzey izlemi yalnızca özel popülasyonlarda önerilir.
Endikasyonlar
- Venöz tromboembolizmin (VTE) profilaksisi:
- Büyük ortopedik cerrahi (kalça/knee artroplastisi, kalça kırığı cerrahisi).
- Büyük abdominal/pelvik kanser cerrahisi.
- Akut tıbbi yatışlarda immobil hastalar, kalp yetersizliği, ciddi enfeksiyon, inme sonrası immobilite.
- VTE tedavisi:
- Derin ven trombozu (DVT) ve pulmoner emboli (PE) için hastane içi veya ayaktan tedavi protokolleri.
- Akut koroner sendromlar (AKS):
- Özellikle NSTEMI/unstabil angina’da antitrombotik tedavinin parçası olarak; bazı STEMI stratejilerinde fibrinolitiklerle kombine.
- Kanser ilişkili tromboz:
- Özellikle gastrointestinal/genitoüriner kanserlerde kanama riski dikkate alınarak birinci seçeneklerden biri olmaya devam etmektedir; doğrudan oral antikoagülanlarla bireyselleştirme yapılır.
- Hemodiyaliz devresi antikoagülasyonu ve köprüleme (“bridging”):
- Geçici oral antikoagülan kesintilerinde veya mekanik kapak/AF gibi durumlarda seçilmiş köprüleme senaryoları.
Dozlama ilkeleri ve uygulama
- Ağırlık temelli dozlama: Terapötik uygulamada gerçek vücut ağırlığına göre belirlenir; profilakside sabit düşük doz rejimleri kullanılır.
- Böbrek fonksiyonu: Orta-ağır renal yetersizlikte doz azaltımı ve/veya anti-Xa izlemi gerekebilir. Kreatinin klerensi ciddi azalmış hastalarda preparat seçimi ve dozlama özellikle dikkat gerektirir.
- Obezite ve düşük vücut ağırlığı: Obez hastalarda doz genellikle gerçek vücut ağırlığına göre hesaplanır; aşırı obezite veya <50 kg gibi uç ağırlıklarda anti-Xa izlemi düşünülebilir.
- Gebelik: Plasentayı geçmez; DVT/PE tedavisi ve profilaksisinde tercih edilen antikoagülanlardandır. Üçüncü trimester ve peripartum dönemde planlama, doğum şekli ve bölgesel anestezi zamanlamasıyla koordine edilmelidir.
- Pediatri ve ileri yaş: Çocuklarda off-label protokoller ve sıkı izlem; ileri yaşta artmış kanama riski nedeniyle bireyselleştirme.
Uygulama tekniği: Subkutan enjeksiyon abdominal duvar, uyluk veya üst kolun yağ dokusuna, genellikle 90° açıyla, rotasyon prensibiyle yapılır. İM uygulamadan kaçınılır. Önceden doldurulmuş şırıngalardaki hava kabarcığı dışarı atılmamalıdır.
İzlem ve laboratuvar
- Rutin test gereksinimi yoktur. DMAH, aPTT’yi güvenilir yansıtmaz.
- Anti-Xa düzeyi: Özel durumlarda kullanılabilir (gebelik, aşırı obezite veya düşük ağırlık, ileri renal yetmezlik, pediatrik hastalar, beklenmeyen kanama veya rekürren tromboz). Zirve örneği genellikle dozdan 4 saat sonra alınır.
- Tam kan sayımı ve trombositler: Başlangıçta ve erken dönemde trombositopeni açısından izlem önerilir.
- Karaciğer fonksiyon testleri ve potasyum: Geçici transaminaz yükselmeleri ve hiperkalemi açısından klinik gereklilik varsa kontrol edilebilir.
Kontrendikasyonlar ve dikkat edilmesi gereken klinik durumlar
- Aktif majör kanama, yakın zamanda hemorajik inme, klinik olarak anlamlı trombositopeni.
- Heparine bağlı trombositopeni (HIT) öyküsü; çapraz reaktivite olasılığı nedeniyle tüm heparin türevlerinden kaçınılır.
- Ciddi kontrolsüz hipertansiyon, aktif peptik ülser, yakın major cerrahi/ travma durumları klinik bağlama göre değerlendirilir.
- Nöraksiyal anestezi/analjezi: Epidural/spinal hematom riski mevcuttur; blok öncesi ve kateter çekimi sonrası güvenli aralıklar preparata ve doza göre planlanmalı, nörolojik takip yapılmalıdır.
İlaç etkileşimleri
- Antiplateletler (ör. aspirin, P2Y12 inhibitörleri), diğer antikoagülanlar, trombolitikler ve non-selektif NSAİİ’lerle birlikte kanama riski artar.
- Potasyum tutucu ilaçlarla birlikte hiperkalemi riski teorik olarak yükselebilir.
- Laboratuvar düzeyinde, bazı koagülasyon testleri ve karaciğer enzim ölçümlerinde yalancı veya klinik önemsiz değişiklikler görülebilir.
İstenmeyen etkiler
- Kanama: En sık ve en ciddi advers etkidir; yaş, renal fonksiyon bozukluğu, eşlik eden ilaçlar ve invazif işlemlerle risk artar.
- Trombositopeni: Tip 1 (nonimmün, geçici) ve daha önemlisi Tip 2 (immün, PF4-IgG aracılı HIT). Tipik olarak 5–10. günlerde ortaya çıkar; trombozla komplike olabilir. Yönetim: tüm heparinlerin kesilmesi ve non-heparin antikoagülan başlanması.
- Karaciğer enzim yüksekliği: Sıklıkla asemptomatik ve geri dönüşlüdür.
- Lokal reaksiyonlar: Enjeksiyon bölgesinde ağrı, ekimoz, nodül; nadiren cilt nekrozu.
- Osteoporoz: Uzun süreli, yüksek kümülatif dozlarda kemik mineral yoğunluğunda azalma riski, FMH’ye göre daha düşüktür ancak göz ardı edilmemelidir.
- Alopeci ve hiperkalemi: Nadir; hiperkalemi, heparin kaynaklı hipoaldosteronizme bağlanır.
Aşırı doz ve tersine çevirme
- Protamin sülfat DMAH’in anti-IIa etkisini büyük ölçüde, anti-Xa etkisini ise kısmen nötralize eder. Yakın zamanlı dozlara sınırlı ve zamanla azalan etkinlik söz konusudur. Dirençli kanamalarda destekleyici tedavi, cerrahi hemostaz ve hedefe yönelik kan ürünleri kullanımı gerekebilir. Spesifik ve tam bir antidot yoktur.
DMAH ile FMH ve DOAK’ların karşılaştırılması
- FMH’ye karşı: DMAH’ler daha öngörülebilir farmakokinetik, daha yüksek subkutan biyoyararlanım, daha düşük HIT ve osteoporoz riski, daha az laboratuvar izlem gereksinimi sunar. FMH hızlı geri döndürülebilirliği ve kısa yarı ömrü nedeniyle yoğun bakım ve prosedürel ortamlarda yerini korur.
- DOAK’lara karşı: DOAK’lar oral kullanım ve belirgin hasta konforu sağlar. Bununla birlikte DMAH’ler gebelik, ileri böbrek yetersizliği, belirli kanser alt tipleri ve invazif girişimlerin yakınında zamanlama esnekliği gibi alanlarda avantajlı olabilir. Seçim, endikasyon, komorbidite ve kanama/tromboz dengesine göre bireyselleştirilmelidir.
Kanser hastalarında özel hususlar
Gastrointestinal ve genitoüriner kanserlerde mukozal kanama yatkınlığı göz önüne alınarak DMAH sıklıkla tercih edilir. Metastatik hastalık, trombositopeni, kemoterapiyle etkileşimler ve kateter varlığı karar verme sürecini etkiler. Tedavi süresi tipik olarak en az 3–6 aydır; aktif kanser varlığında daha uzun süreler gündeme gelir.
Perioperatif yönetim ve girişimler
- Düşük doz profilaksi çoğu ameliyat sonrası erken mobilizasyonla kombine edilir.
- Terapötik doz kullanan hastalar için cerrahi riske ve renal fonksiyona göre kesme/yeniden başlama zamanlaması planlanır.
- Nöraksiyal teknikler için güvenli aralıklar titizlikle korunur; postoperatif nörolojik takip zorunludur.
Pratik uygulama ipuçları
- Önceden doldurulmuş şırıngalar kullanılıyorsa doz doğrulanmalı; enjeksiyon bölgesinde masaj yapılmamalıdır.
- Çoklu risk faktörleri olan hastalarda kanama ve düşme riskine yönelik profilaktik stratejiler (bası çorapları, mobilizasyon, PPI gerekliliği) değerlendirilmelidir.
- Uzun süreli tedavilerde kemik sağlığı, demir eksikliği ve cilt bakımı gözden geçirilmelidir.
Depolama ve stabilite
Önceden doldurulmuş şırıngalar oda sıcaklığında veya üretici önerilerine göre saklanır; dondurulmamalı ve aşırı ısıdan korunmalıdır. Son kullanma tarihi ve ambalaj bütünlüğü her uygulamada kontrol edilmelidir.
Keşif
Düşük moleküler ağırlıklı heparinlerin (DMAH) öyküsü, yalnızca bir ilacın doğuşu değil; biyokimyanın, endüstriyel farmasötiklerin, klinik metodolojinin ve hasta güvenliğinin bir asır boyunca nasıl birlikte evrildiğinin vazgeçilmez bir panoramasıdır. Anlatı, 20. yüzyılın başlarında pıhtılaşmanın sırlarını aralayan birkaç meraklı bilim insanıyla başlar; 1970’ler ile 1980’lerin başında şekillenen “pentasakkarit çağında” keskinleşir; 1990’larda klinik kılavuzları dönüştürür; 2000’ler ve 2010’larda tedarik zinciri ve kalite dersleriyle sarsılır; 2020’lerde ise immün-tromboz ve sentez biyoteknolojisiyle yeni bir bilimsel ufka açılır.
İlk Kıvılcım: Heparinin Keşfi ve Temellerin Atılması
1916’da Baltimore’da Jay McLean ve danışmanı William Howell’ın damar içi pıhtılaşma ile ilişkili “karaciğer kaynaklı” etkin maddeleri ayırma çabaları, heparin denen, şaşırtıcı biçimde pıhtılaşmayı engelleyen bir polisakkarit karışımını gündeme getirdi. Kısa zamanda Toronto’da Charles Best ve Stockholm’de Erik Jorpes’in katkılarıyla heparin saflaştırma, standardizasyon ve üretim adımları biçimlendi; heparin, 1930’lardan itibaren klinik araca dönüştü. 1970’lere gelindiğinde Londra’da Vijay Kakkar, düşük doz heparinin ameliyat sonrası venöz tromboembolizmi önlemede sistematik kullanımını yaygınlaştırarak heparini “profilaksinin dili” hâline getirdi. Bu sahne, DMAH fikrinin filizleneceği zemini hazırladı: heparin heterojen, uzun zincirli ve izlem gerektiren bir moleküldü; acaba daha kısa, daha öngörülebilir fraksiyonlarla aynı fayda, daha az zahmetle elde edilebilir miydi?
Dönüm Noktası: 1976’da Londra, 1976–1983 Arası “Pentasakkarit Çağı”
1976’da Londra’dan Johnson ve çalışma arkadaşlarının yayımladığı erken bir dizi çalışma, heparinin anti-Xa etkisinin alt birimlerine ayrıldığında nasıl farklılaştığını göstererek “düşük moleküler ağırlık” yaklaşımını bilimsel sahneye taşıdı. Aynı dönemde üç bağımsız ekip, heparinin antitrombin ile sıkı bağ kuran belirli bir yapısal motif taşıdığını saptadı. Uppsala’da Ulf Lindahl’ın ekibi ve Milano’da Bo Casu’nun ekibi, antitrombinin yüksek afiniteyle tanıdığı bölgenin bir pentasakkarit dizisi olduğunu kimyasal olarak ayıkladı; bu dizideki kritik “3-O-sülfatlanmış glukozamin” işaret taşı niteliğindeydi. Paris’te Choay grubundan Pierre Petitou ve meslektaşları, 1983’te bu pentasakkarit dizisini organik sentezle üretmeyi başararak, heparin evreninde “doğal karışım” çağından “tasarlanmış diziler” çağına kapı araladı. Aynı yıllarda S. T. Olson ve diğerleri antitrombinin konformasyon değişikliklerini berraklaştırırken, Hemker ve çalışma arkadaşları anti-Xa ve anti-IIa etkinliğin zincir uzunluğu ve bağlanma dinamikleriyle ilişkisini klinik farmakolojiye tercüme ediyordu. Kısa zincirlerin (DMAH) anti-Xa ağırlıklı, daha öngörülebilir ve subkutan uygulanabilir profili, klinik açısından cezbediciydi.
Sanayinin Atölyesi: Depolimerizasyon Kimyası ve Ticari Preparatlar
Bilimsel motifler, endüstrinin reaktörlerinde şekil buldu. Heparinin “daha küçük, daha ayarlanmış” fragmanlara dönüştürülmesi için farklı depolimerizasyon yolları geliştirildi:
- Nitroz asit ile deaminatif yarılma ve ardından indirgeme: Dalteparin ve nadroparin gibi preparatların endüstriyel yolunu açtı.
- Benzilasyon ve alkalin depolimerizasyon: Enoksaparin için karakteristik iz bırakıcı işlemler dizisini oluşturdu.
- Heparinaz ile enzimatik yarılma: Tinzaparin gibi ürünlerin biyokimyasal “nazik” üretim hattını temsil etti.
- Peroksidatif ya da fotokimyasal parçalama: Daha sınırlı ticari kullanım görse de yöntem yelpazesini genişletti.
Bu kimyasal ve enzimatik yollar, 1980’lerin ortasından 1990’lara uzanan süreçte dalteparin (KabiVitrum/İsveç), enoksaparin ve nadroparin (Choay/Sanofi/Fransa), tinzaparin (LEO Pharma/Danimarka) gibi markalaşmış DMAH’leri kliniğe taşıdı. Ulla Hedner gibi klinik farmakologlar, yeni fraksiyonların antitrombotik etkinlik ve güvenlilik profilini titizlikle haritaladı. Her bir DMAH, üretim yöntemi ve oligosakkarit dağılımına bağlı “parmak izi”ne sahipti; bu nedenle “aynı sınıf”ın ilaçları biyobenzer değil, yakın akraba fakat farklı bireyler gibiydi.
Klinik Kanıtların Yükselişi: 1980’lerden 2000’lere
1980’lerin başından itibaren, günlük tek doz subkutan tedaviyle venöz tromboembolizm (VTE) tedavisi ve profilaksisinin hastane dışına da taşınabildiği gösterildi. 1990’larda, ortopedik ve abdominal cerrahi sonrası profilakside DMAH’ler standartları yeniden tanımladı; aynı dönemde dalteparin ve enoksaparin, akut koroner sendromlarda (özellikle NSTEMI/unstabil anjina) “antitrombotik omurganın” önemli bir parçası hâline geldi. Kanser ilişkili trombozda ise rekürrens ve kanama dengesini gözeten çalışmalar, DMAH’leri uzun süreli tedavinin güvenilir seçenekleri arasına yerleştirdi. Klinik metodoloji olgunlaştıkça, anti-Xa/anti-IIa oranı, biyoyararlanım ve yarılanma ömrü gibi farmakolojik nüanslar sonuç odaklı uç noktalarla (DVT/PE rekürrensi, majör kanama, mortalite) bağlandı; kılavuzlar, “rutin aPTT izlemi gerektirmeyen, öngörülebilir antikoagülasyon” fikrini temel kabul etti.
Bir Krizden Dersler: 2008 Ham Heparin Kontaminasyonu ve Kalite Çağı
2008’de heparin tedarik zincirinde ortaya çıkan “aşırı sülfatlanmış kondroitin sülfat” kontaminasyonu, yalnızca farmakoekonomi ve tedarik yönetimi açısından değil, karmaşık biyolojik ilaçlar için analitik standardizasyon ve düzenleyici gözetimin güçlendirilmesi açısından da kalıcı bir dönüm noktası oldu. Bu tecrübe, DMAH’lerin yapısal mikroheterojenitesini çözümlemeye yönelik ileri spektrometri ve NMR tabanlı platformların, farmakope tanımları ve karşılaştırılabilirlik kılavuzlarıyla birlikte gelişmesini hızlandırdı.
Tasarlanan Moleküller: Pentasakkaritten Sentetik ve Kemo-Enzimatik Ufuklara
1983’te pentasakkarit dizisinin sentezlenmesi, daha sonra fondaparinuks gibi saf, tek moleküllü anti-Xa ajanlarının önünü açtı; bu ajanlar DMAH değilse de DMAH’lerin keşif hattının “tasarım ilacı”na evrilen kolunu temsil etti. 2000’lerden sonra kemo-enzimatik yaklaşımlar, glikozaminoglikan biyosentez enzimlerini kullanarak “sentetik DMAH” olasılığını laboratuvar gerçekliğine yaklaştırdı. Amaç, doğal kaynak bağımlılığını azaltırken, antikoagülasyonun yanında inflamasyon, kemokin etkileşimi ve doku onarımı gibi pleyotropik etkileri de incelikle ayarlayabilmekti.
İmmün-Trombozun Anatomisi: 2020’ler ve Yeni Sorular
COVID-19 pandemisiyle birlikte immünotromboz, nötrofil ekstrasellüler tuzakları (NET’ler) ve endotelyal glikokaliks hasarı ekseninde heparinlerin antikoagülan ötesi rolleri yeniden gündeme geldi. DMAH’lerin anti-inflamatuvar ve antiviral bağlamda dolaylı etkileri, sepsisten ARDS’ye uzanan geniş bir zeminde tartışıldı. Aynı dönemde heparine bağlı trombositopeni (HIT) patobiyolojisi—platelet faktör 4 (PF4) ile polianyon etkileşiminin incelikleri—daha yüksek çözünürlükte haritalandı; DMAH’lerin HIT riskini FMH’ye göre azaltan yapısal nedenleri daha iyi anlaşılır oldu. Obezite, gebelik ve böbrek yetersizliği gibi özel popülasyonlarda anti-Xa izlemi, bireyselleştirilmiş dozlama ve gerçek yaşam verileri, “bir sınıf-çok fenotip” gerçeğini kuvvetlendirdi.
Kişiler ve Okullar: Bilimsel Coğrafyanın Hatırlattıkları
Bu hikâyenin kaşifleri tek bir laboratuvara sığmaz. Baltimore’da McLean ve Howell ile başlayan çizgi, Toronto’da Best, Stockholm’de Jorpes ve Uppsala’da Lindahl ile kimyasal-biyokimyasal derinliğe kavuştu. Milano’da Casu’nun yapısal çözümlemeleri, Paris’te Choay ekibinden Petitou’nun sentetik sıçramasıyla birleşti. Londra’da Johnson ve Kakkar, klinik metodolojiyi ve düşük molekül fikrini sivriltti. İsveç’te KabiVitrum (daha sonra Sobi çizgisi) dalteparinin, Danimarka’da LEO Pharma tinzaparin’in yolunu açarken; Fransa’da Choay/Sanofi damarı enoksaparin ve nadroparin ile sınıfın küresel erişimini genişletti. Bu harita, yapı-işlev şifresinin çözümünü endüstriyel ölçek ve klinik ispatla kaynaştıran bir ağdır.
Bugünün Araştırma Masası: Nereye Doğru?
Güncel araştırmalar üç eksende yoğunlaşıyor:
- Tam tanımlı/sentetik analoglar ve kemo-enzimatik biyosentezle, güvenlik-etkinlik-tedarik dengesini optimize etmek;
- Mikroheterojenite-fenotip eşlemesiyle, DMAH alt fraksiyonlarının anti-Xa/anti-IIa diyalektiğini hasta alt gruplarına göre ayarlamak;
- Non-antikoagülan etkiler—kemokin ve büyüme faktörü etkileşimlerinden nöron-glia korumasına kadar—için hedefe yönelik glikozaminoglikan mühendisliği. Bu gündemin arka planında ileri kütle spektrometrisinden çok boyutlu NMR’a, yüksek çözünürlüklü yapı-fonksiyon eşlemesine kadar rafine analitikler çalışıyor.
İleri Okuma
- Lindahl U., Thunberg L. — Evidence for a 3-O-sulfated D-glucosamine residue in the antithrombin-binding sequence of heparin. Proc Natl Acad Sci USA, 77(11): 6551–6555, 1980.
- Bienkowski M.J., et al. — Structural characterization of the oligosaccharides formed by nitrous acid depolymerization of heparin. J Biol Chem, 260(13): 7158–7164, 1985.
- Buckley M.M., et al. — Enoxaparin (PK 10169): pharmacology and clinical applications. Drugs, 44(4): 465–497, 1992.
- Levine M.N., Gent M., Hirsh J. — A comparison of low-molecular-weight heparin with unfractionated heparin for the treatment of proximal deep-vein thrombosis. N Engl J Med, 331(10): 648–655, 1994.
- Bergqvist D. — Low molecular weight heparins. J Intern Med, 240(4): 233–240, 1996.
- Warkentin T.E., Kelton J.G. — Heparin-induced thrombocytopenia. Annu Rev Med, 48: 395–406, 1997.
- Hirsh J., Levine M.N. — Low-Molecular-Weight Heparin. Circulation, 98(15): 1575–1582, 1998.
- Hedner U. — Tinzaparin: a heparinase-digested LMWH. Pathophysiol Haemost Thromb, 30(3): 143–147, 2000.
- Geerts W.H., Pineo G.F., Heit J.A. — Prevention of venous thromboembolism. Chest, 119(1 Suppl): 132S–175S, 2001.
- Hirsh J., Raschke R. — Guide to Anticoagulant Therapy: Heparin. Circulation, 103(24): 2994–3018, 2001.
- Petitou M., van Boeckel C. — The synthetic pentasaccharide fondaparinux. Haematologica/Thromb Res overview, 2002.
- Petitou M., et al. — 1976–1983, a critical period in the history of heparin. Carbohydrate Research, 338: 2459–2472, 2003.
- Samama M.M. — Evaluation of fondaparinux: pharmacological properties and clinical profile. Thromb Res, 109(1): 1–11, 2003.
- Hirsh J., Raschke R. — Heparin and low-molecular-weight heparin: mechanisms and monitoring. Hematology Am Soc Hematol Educ Program, 2004(1): 497–508, 2004.
- Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. — Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis (8th ed.). Chest, 133(6 Suppl): 141S–159S, 2007.
- Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. — Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis (9th ed.). Chest, 141(2 Suppl): e24S–e43S, 2012.
- Bates S.M., Greer I.A., Middeldorp S., Veenstra D.L., Prabulos A.M., Vandvik P.O. — VTE, thrombophilia, antithrombotic therapy, and pregnancy. Chest, 141(2 Suppl): e691S–e736S, 2012.
- Konstantinides S.V., Torbicki A., Agnelli G. — 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 35(43): 3033–3080, 2014.
- Arachchillage D.R.J., Laffan M. — Pathogenesis and management of heparin-induced thrombocytopenia. Br J Haematol, 173(2): 199–207, 2016.
- Hemker H.C. — A century of heparin: past, present and future. J Thromb Haemost, 14(12): 2329–2338, 2016.
- Chandarajoti K., Liu J., Pawlinski R. — Design and synthesis of new synthetic LMWHs. J Thromb Haemost, 14(6): 1135–1145, 2016.
- Torri G. — Heparin centenary – an ever-young life-saving drug. Int J Cardiol, 223: 265–273, 2016.
- Oduah E.I., et al. — Heparin: Past, Present, and Future. Pharmaceuticals, 9(3): 38, 2016.
- ASH (American Society of Hematology) — Guidelines for management of venous thromboembolism: prophylaxis and treatment. Blood Adv, 2(22): 3257–3291, 2018.
- Horlocker T.T., Vandermeuelen E., Kopp S.L., et al. — Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy (ASRA guidelines). Reg Anesth Pain Med, 43(3): 263–309, 2018.
- Konstantinides S.V., Meyer G., Becattini C. — 2019 ESC Guidelines for acute pulmonary embolism. Eur Heart J, 41(4): 543–603, 2019.
- Zhang Y. — Clinical use of fondaparinux: a synthetic heparin pentasaccharide. Trends Cardiovasc Med, 29(8): 491–498, 2019.
- Vedantham S., Goldhaber S.Z., Julian J.A. — Pharmacomechanical catheter-directed thrombolysis for DVT (ATTRACT trial analyses and updates). Circulation, 141(8): 586–597, 2020.
- Dey S., et al. — Programmable one-pot synthesis of heparin oligosaccharides. Org Lett/PNAS-linked methods perspective, 2020.
- Ortel T.L., Neumann I., Ageno W. — American Society of Hematology 2020/2021 guidelines: VTE treatment and secondary prevention. Blood Adv, 5(4): 927–974, 2021.
- Kearon C., Akl E.A., Ornelas J. — CHEST guideline and expert panel report: Antithrombotic therapy for VTE disease (updates). Chest, 160(6): e545–e608, 2021.
- Van Mieghem N.M., Nathoe H.M., et al. — Anticoagulation in special populations (pregnancy, kidney disease, cancer). Eur Heart J Supplements, 24(Suppl A): A1–A12, 2022.
- Key N.S., Khorana A.A., Kuderer N.M. — Cancer-associated thrombosis: updated guidance on anticoagulation. J Thromb Haemost, 21(3): 571–589, 2023.
- Hogwood J., Gray E., Mulloy B. — Pharmacology of Heparin and Related Drugs: An Update. Pharmacol Rev, 75(3): 543–620, 2023.
- Ball C.M. — The history of heparin. R I Med J (historical overview), 2024.


 tümörlerde etkilidir.EGFR dışındaki diğer reseptörleride hedef olarak kullanılır.(VEGFR, FGFR,)
tümörlerde etkilidir.EGFR dışındaki diğer reseptörleride hedef olarak kullanılır.(VEGFR, FGFR,) K-Ras gen
K-Ras gen
Yorum yazabilmek için oturum açmalısınız.