Tinetti Denge ve Yürüyüş Değerlendirmesi** olarak da bilinen Tinetti Hareketlilik Testi (TMT), 1986 yılında Dr. Mary Tinetti tarafından geliştirilmiştir ve yaşlı bireylerde hareketlilik ve düşme riskini değerlendirmek için geriatrik bakımda yaygın olarak kullanılan bir araç olmaya devam etmektedir. Yaralanma ve bağımsızlık kaybı potansiyeli nedeniyle yaşlı yetişkinler arasında yaygın bir endişe kaynağı olan düşme riski taşıyan hastaların belirlenmesinde özellikle etkilidir. Test basittir, özel ekipman gerektirmez ve klinik ortamlarda veya evde uygulanabilir.
Testin Amacı
Tinetti Hareketlilik Testinin birincil amacı, hareketliliğin iki kritik bileşeni olan hastanın yürüyüşünü ve dengesini değerlendirmektir. Yaşlı yetişkinlerde düşmeler genellikle bu alanlardaki bozukluklardan kaynaklanır ve her ikisini de sistematik olarak değerlendirerek, sağlık uzmanları düşmeyi önleme stratejileri ve olası müdahaleler hakkında bilinçli kararlar verebilir. Özellikle şunlar için kullanılır:
- Düşme riski yüksek, orta veya düşük olanların belirlenmesi.
- Fizik tedavi, denge eğitimi veya yardımcı cihazların kullanımı gibi müdahalelere rehberlik etmek.
- Denge ve hareketliliği geliştirmeyi amaçlayan tedavi veya müdahalelerin ilerlemesini izlemek.
Testin Yapısı
Tinetti Hareketlilik Testi iki ana bileşenden oluşmaktadır:
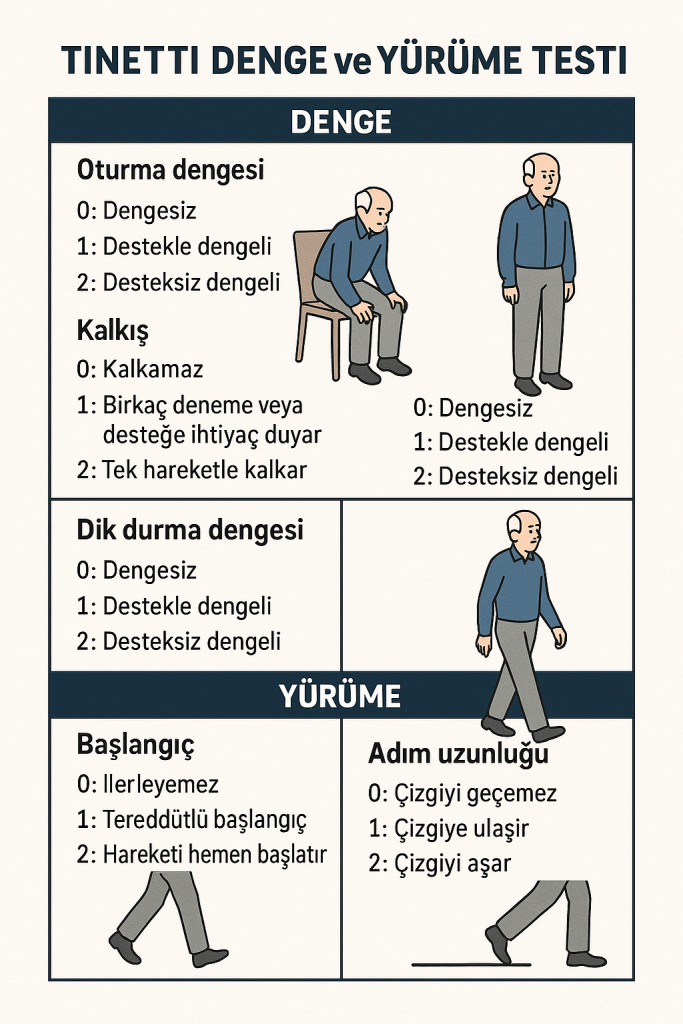
Denge Testi (toplam 16 puan):
Denge değerlendirmesi, hastanın bir dizi görevi ne kadar güvenli bir şekilde yerine getirebildiğini değerlendirir. Bu görevler oturmak, ayağa kalkmak ve dönmek gibi günlük yaşam için gerekli olan basit hareketleri içerir. Her görev, hastanın hareketi ne kadar iyi yapabildiğine bağlı olarak 0’dan (ciddi bozukluğu gösterir) 2’ye (normal işlevi gösterir) kadar puanlanır. Denge bölümündeki görevler şunları içerir:
- Oturma dengesi
- Sandalyeden kalkmak
- Ayağa kalkma girişimleri (hasta ilk denemede ayağa kalkmakta zorlanıyorsa)
- Anında ayakta durma dengesi (ayakta durmanın ilk birkaç saniyesi içinde)
- Ayakta denge (destek olmadan birkaç saniye ayakta durma)
- Dürtme dengesi (hastanın hafifçe itildiğinde dengesini koruyabilmesi)
- Ayakta dengede dururken gözler kapalı
- Dönüş dengesi (sendelemeden 360 derece dönebilme yeteneği)
- Oturmak (güvenli bir şekilde oturma pozisyonuna dönmek) Bu bölümden en fazla 16 puan alınabilir.
Yürüyüş Testi (toplam 12 puan):
Testin ikinci bölümü hastanın yürüme kabiliyetine odaklanır. Hasta kısa bir mesafede, tipik olarak 3 metre civarında, rahat bir tempoda yürürken yürüyüş değerlendirilir. Değerlendirme adım uzunluğu, adım simetrisi ve yürüme hızına odaklanır. Denge bölümünde olduğu gibi, görevler 0 ila 2 arasında puanlanır ve daha yüksek puanlar daha istikrarlı ve etkili yürüyüş modellerini gösterir. Yürüyüş bölümündeki görevler şunları içerir:
- Yürüyüşün başlatılması (hasta hemen ve düzgün bir şekilde yürümeye başlıyor mu?)
- Adım uzunluğu ve yüksekliği
- Adım simetrisi (her adımın mesafesi ve yüksekliği benzer mi?)
- Adım sürekliliği (yürüyüş sürekli mi yoksa kesintiler var mı?)
- Yol sapması (hasta düz bir çizgide yürüyebiliyor mu?)
- Gövde stabilitesi
- Yürüme hızı (tutarlı, güvenli ve birey için uygun mu?) Yürüyüş değerlendirmesi için en fazla 12 puan alınabilir.
Puanlama Sistemi
- Birleşik test için mümkün olan maksimum puan 28 puandır (denge için 16 ve yürüyüş için 12).
- Risk Tabakalandırması**:
- ≤18 puanlar yüksek düşme riski olduğunu gösterir.
- 19 ile 23 arasındaki puanlar orta derecede düşme riski olduğunu gösterir.
- ≥24 puanlar düşük düşme riskini gösterir.
Test Versiyonları ve Değişiklikleri
İlk yayınlandığından bu yana, farklı hasta popülasyonlarına veya klinik ihtiyaçlara uyması için Tinetti Mobilite Testinin çeşitli modifikasyonları ve versiyonları geliştirilmiştir:
- Kısaltılmış Versiyonlar: Bazı versiyonlar, değerlendirme için gereken süreyi azaltmak amacıyla denge ya da yürüme bölümüne odaklanmaktadır.
- Genişletilmiş Versiyonlar: Hastanın hareketliliğinin daha kapsamlı bir görünümünü sağlamak için bazı versiyonlara engellerden kaçınma veya zamanlı yürüme gibi ek görevler dahil edilmiştir.
Klinik Uygulamalar
- Düşme Önleme: Testin en önemli kullanım alanlarından biri, yaşlı yetişkinler için düşmeyi önleme stratejileridir. Klinisyenlerin denge egzersizlerinden, yürüme eğitiminden veya yürüteç veya baston gibi yardımcı cihazların kullanımından faydalanabilecek kişileri belirlemelerine yardımcı olur.
- Rehabilitasyon: Tinetti testi ayrıca felç, kalça kırığı veya hareketliliği etkileyen diğer durumlardan iyileşen hastalarda denge ve yürüyüşü iyileştirmeyi amaçlayan rehabilitasyon programlarındaki ilerlemeyi izlemek için de kullanılır.
- Ev Güvenliği Değerlendirmeleri: Test, hastaların tanıdık ortamlarda ne kadar güvenli hareket ettiklerini değerlendirmek ve yaşam koşullarına özgü risklerin belirlenmesine yardımcı olmak için ev ortamlarında yapılabilir.
Pratik Hususlar
– Kullanım Kolaylığı: Tinetti testinin avantajlarından biri, gelişmiş ekipman gerektirmemesi ve bu sayede hastanelerden huzurevlerine ve hatta hastaların evlerine kadar çeşitli sağlık ortamlarında erişilebilir olmasıdır.
– Test Süresi: Testin uygulanması tipik olarak 10-15 dakika sürer, bu da onu klinisyenlerin düzenli geriatrik değerlendirmelere dahil etmeleri için pratik bir araç haline getirir.
– Sınırlamalar: Test, yaşlı popülasyonlarda düşme riskini tespit etmek için oldukça etkili olsa da, çeşitli görevler için talimatları anlamak ve takip etmek zor olabileceğinden, bilişsel bozukluğu olan hastalarda daha az yararlı olabilir.
Keşif
1986’da Dr. Mary Tinetti tarafından tanıtılan Tinetti Hareketlilik Testi (TMT), geriatrik bakımda düşmeyi önleme çabalarında devrim yarattı. Düşmeler uzun zamandır yaşlı yetişkinler arasında yaralanma, hastaneye yatış ve hatta ölümün önde gelen nedenlerinden biri olarak kabul ediliyordu. Ancak, düşme riskini değerlendirmek veya en savunmasız olanları belirlemek için standartlaştırılmış bir yöntem yoktu. Yaşlıların bakımını iyileştirmeye kendini adamış bir geriatrist olan Dr. Tinetti, rutin tıbbi muayenelerin düşme riskine önemli katkıda bulunan denge ve yürüyüşle ilgili ince ama kritik sorunları genellikle gözden kaçırdığını fark etti. Bu boşluğu gidermeye kararlı bir şekilde, klinik uygulamada düşmeyi önleme konusunda hızla temel bir araç haline gelen TMT’yi geliştirdi.
1. Tinetti Hareketlilik Testinin Geliştirilmesi (1986)
Dr. Tinetti’nin TMT’yi yaratma ilhamı, muayenehanesindeki yaşlı hastalarla yaşadığı deneyimlerden kaynaklandı. Bu hastaların çoğu sık sık düşüyordu, ancak tipik sağlık değerlendirmeleri genellikle bunun nedenini açıklayamıyordu. Sağlıklı görünmelerine rağmen, birçok birey rutin tıbbi değerlendirmelerde fark edilmeyen denge ve yürüyüşteki ince bozukluklardan muzdaripti. Dr. Tinetti, küçük hareketlilik eksikliklerinin bile düşme riskini önemli ölçüde artırabileceğini ve bu eksikliklerin geleneksel muayenelerde nadiren ele alındığını fark etti. Bu durum onu, özellikle denge ve yürüyüşü değerlendirecek yapılandırılmış, kanıta dayalı bir araç geliştirmeye yöneltti: Tinetti Mobilite Testi.
TMT, iki temel bileşene odaklanarak bir hastanın genel hareketliliğini ölçmek için tasarlanmış iki bölümlü bir değerlendirmedir: denge ve yürüme. Denge bölümünde** hastalardan oturma, ayakta durma ve dönme gibi basit ama önemli günlük hareketleri yapmaları istenir. Bu görevler 0 (işlev bozukluğunu gösterir) ile 2 (normal işlevi gösterir) arasında bir ölçekte puanlanır ve mümkün olan maksimum puan 16’dır. Yürüyüş bölümü** adım uzunluğu, simetri ve hareketin düzgünlüğü gibi faktörlere dikkat ederek hastanın yürüme becerisini değerlendirir. Bu bölüm maksimum 12 puan kazandırarak toplam puanı 28’e çıkarabilir. Testin uygulanması basittir, özel bir ekipman gerektirmez ve sadece 10-15 dakika sürer, bu da onu hastaneler, klinikler ve bakım evleri gibi çeşitli sağlık ortamlarında pratik hale getirir.
Dr. Tinetti’nin testi geliştirmesinde, belirgin bir neden olmaksızın çok sayıda düşme yaşayan belirli bir hastanın etkisi büyük olmuştur. Rutin kontroller sırasında bu hasta sağlıklı görünüyordu ve yüksek düşme riskine işaret edecek önemli bir tıbbi durumu yoktu. Bununla birlikte, Dr. Tinetti daha yakından gözlemlediğinde, hastanın denge ve yürüyüşle ilgili küçük zorluklar sergilediğini fark etti – örneğin, dönerken hafif dengesizlik ve yürürken düzensiz bir adım. Görünüşte önemsiz olan bu sorunlar standart değerlendirmeler sırasında göz ardı edilmişti, ancak aslında hastanın düşmesine katkıda bulunan temel unsurlardı. Bu farkındalık, Dr. Tinetti’yi TMT’yi yaratmaya sevk ederek benzer gizli risklerin erken tespit edilebilmesini ve daha fazla yaralanmaya yol açmadan ele alınabilmesini sağladı.
2. Risk Tabakalandırması ve Kişiye Özel Müdahaleler (1980’lerin sonu)
TMT’nin piyasaya sürülmesinin ardından Dr. Tinetti, bir risk tabakalandırma sistemi ekleyerek testi daha da geliştirdi. Bu yenilik, sağlık hizmeti sağlayıcılarının hastaları toplam TMT puanlarına göre farklı kategorilerde sınıflandırmasına olanak tanıdı: Düşük, orta veya yüksek düşme riski. 18 veya daha düşük** puan alan hastalar yüksek riskli, 19 ile 23 arasında puan alan hastalar orta riskli ve 24 veya daha yüksek puan alan hastalar düşük riskli olarak kabul edildi. Bu sınıflandırma sistemi, müdahalelerin yönlendirilmesinde çok önemliydi. Yüksek riskli hastalara denge eğitimi, fizik tedavi veya evde çevresel değişiklikler (örneğin, takılma tehlikelerini ortadan kaldırmak veya tutunma çubukları takmak) gibi daha yoğun önleyici tedbirler sağlanabilir. Bu arada, düşük riskli hastalar daha az sıklıkla izlenerek sağlık hizmeti kaynaklarının verimli bir şekilde tahsis edilmesi sağlanabilir.
Düşme riskinin önlenmesine** yönelik bu pratik ve etkili yaklaşım, geriatrik bakımı dönüştürmüştür. Tabakalandırma sistemi, klinisyenlerin izlemesi için net kılavuzlar sağlayarak müdahaleleri her hastanın özel ihtiyaçlarına göre uyarlamalarına olanak tanıdı. Sağlık hizmeti sağlayıcıları, risk altındaki kişileri doğru bir şekilde belirleyerek düşmeleri önlemek için proaktif adımlar atabilir ve böylece yaşlı yetişkinler arasında hastaneye yatışları, yaralanmaları ve uzun süreli sakatlıkları azaltabilir.
3. Geriatrik Bakımda Yaygın Benimseme ve Etki (1990’lar)
1990’lar boyunca, Tinetti Hareketlilik Testi geriatrik bakım ortamlarında yaygın bir şekilde benimsenmiştir. Hastaneler, rehabilitasyon merkezleri, huzurevleri ve evde sağlık hizmetleri TMT’yi Kapsamlı Geriatrik Değerlendirmenin (CGA) standart bir parçası olarak kullanmaya başladı. CGA, yaşlı hastaların tıbbi, psikolojik ve işlevsel yeteneklerini değerlendiren multidisipliner bir yaklaşımdır ve TMT, fiziksel işlev ve hareketliliğin değerlendirilmesinin ayrılmaz bir parçası haline gelmiştir. Kullanım kolaylığı, düşmeleri öngörmedeki etkinliği ile birleşince, klinik ortamlarda hayati bir araç haline geldi.
Bu dönemde sağlık çalışanları, hasta sonuçlarının iyileştirilmesinde hareketlilik değerlendirmelerinin önemini giderek daha fazla fark etti. TMT sadece düşmelerin önlenmesine yardımcı olmakla kalmadı, aynı zamanda rehabilitasyon sırasında veya ameliyatlar gibi müdahalelerden sonra hastaların ilerlemesinin izlenmesinde de önemli bir rol oynadı. Örneğin, kalça veya diz replasmanlarından sonra TMT, zaman içinde yürüyüş ve dengedeki gelişmeleri izlemek, rehabilitasyon çabalarına rehberlik etmek ve bir hastanın bağımsız yaşama ne zaman güvenli bir şekilde dönebileceği konusunda karar vermek için kullanılabilir.
4. TMT’nin Evrimi ve Uyarlamaları (2000’ler-Günümüz)
Tinetti Hareketlilik Testi, piyasaya sürülmesini takip eden on yıllar içinde farklı popülasyonlara ve klinik ihtiyaçlara uyacak şekilde çeşitli uyarlamalara ve değişikliklere uğramıştır. Testin kısaltılmış versiyonları, yalnızca denge veya yürüyüşe odaklanacak şekilde geliştirilmiş ve zaman kısıtlamalarının söz konusu olduğu ortamlarda daha hızlı değerlendirmeler yapılmasını sağlamıştır. Ayrıca test, bilişsel bozuklukları veya nörolojik rahatsızlıkları olan hastalarda kullanılmak üzere uyarlanmış ve klinisyenlerin orijinal test talimatlarını anlamakta veya takip etmekte zorluk çekebilecek popülasyonlarda hareketliliği değerlendirmelerine olanak sağlamıştır.
Testin etkisi artmaya devam etmiş ve dünya çapında düşme riski değerlendirmesi için bir ölçüt haline gelmiştir. Çok sayıda çalışma TMT’nin öngörücü gücünü doğrulamıştır ve geriatrik bakımda en yaygın kullanılan araçlardan biri olmaya devam etmektedir. Tinetti Mobilite Testi’nin basitliği, güvenilirliği ve etkinliği, özellikle yaşlı yetişkin nüfusu küresel olarak artmaya devam ederken, sağlık alanındaki kalıcı mirasını sağlamıştır.
İleri Okuma
Academic References
- Tinetti, M. E., Williams, T. F., & Mayewski, R. (1986). “Fall risk index for elderly patients based on number of chronic disabilities.” The American Journal of Medicine, 80(3), 429-434. doi:10.1016/0002-9343(86)90717-5.
- Tinetti, M. E., Speechley, M., & Ginter, S. F. (1988). “Risk factors for falls among elderly persons living in the community.” The New England Journal of Medicine, 319(26), 1701-1707. doi:10.1056/NEJM198812293192604.
- Boulgarides, L. K., McGinty, S. M., Willett, J. A., & Barnes, C. W. (2003). “Use of clinical and impairment-based tests to predict falls by community-dwelling older adults.” Physical Therapy, 83(4), 328-339. doi:10.1093/ptj/83.4.328.
- Whitney, J. C., Lord, S. R., & Close, J. C. (2005). “Streamlining assessment and intervention in a falls clinic using the Tinetti balance assessment tool.” Age and Ageing, 34(6), 567-571. doi:10.1093/ageing/afi190.
- Thomas, S., Mackintosh, S., & Halbert, J. (2010). “Does the ‘Otago exercise programme’ reduce mortality and falls in older adults? A systematic review and meta-analysis.” Age and Ageing, 39(6), 681-687. doi:10.1093/ageing/afq102




Yorum yazabilmek için oturum açmalısınız.