Antik çağdan erken modern döneme: “ıslak akciğer” fikrinin sezgisel doğuşu
En eski metinlerde akciğer ödemi adıyla bir teşhis bulmazsınız; ama hekimler, ani nefes darlığı, hırıltı-çatırdama benzeri sesler, “boğulur gibi olma” ve bazen köpüklü balgamla giden tablolara çok erken dönemlerden beri dikkat kesilmişlerdi. Bu dönemlerin temel sınırlılığı, akciğeri yaşayan bir organ olarak değil, ancak ölüm sonrası görülebilen bir doku olarak inceleyebilmeleriydi. Dolayısıyla “akciğerin suyla dolması” düşüncesi, klinik gözlemle patolojik bulgunun birbirine tam bağlanamadığı bir sezgi halinde kaldı.
Rönesans ve sonrası anatomik patolojinin gelişmesiyle birlikte akciğerlerin “ağırlaşmış, su gibi sıvı sızdıran” görünümü daha sistematik tanımlanmaya başladı. Yine de bu erken patoloji dili, neden-sonuç zincirini kurmakta zorlanıyordu: kalp mi suçluydu, akciğer mi, kan mı, yoksa “genel bir su fazlalığı” mı?
1816–1819: Laennec ve kulağın bilime dönüşmesi
Akciğer ödeminin modern keşif yolculuğunda gerçek dönüm noktalarından biri René Théophile Hyacinthe Laennec’in oskültasyonu bir sanat olmaktan çıkarıp bir yöntem haline getirmesidir. Stetoskop fikrini olgunlaştırdığı yıllarda Laennec, akciğerin içindeki “ince kabarcıkların patlar gibi” duyulan sesini tanımladı; bugün “ince krepitan raller” dediğimiz bulgu, onun kulak hafızasında bir imzaya dönüştü. O dönemin dahiyane tarafı şuydu: Laennec akciğerin içindeki sıvının miktarını ölçemiyordu, ama sesin karakterinden alveol düzeyinde bir “ıslanma” ve “hava-sıvı etkileşimi” sezebiliyordu. Klinik muayenenin bu şekilde standardize edilmesi, akciğer ödemini ilk kez “tekrarlanabilir bir klinik olgu” mertebesine taşıdı: başkaları da aynı sesi duyabilir, aynı hastada benzer gidişi izleyebilirdi.
Bu yıllar aynı zamanda, kalp-akciğer ilişkisini kavramanın eşiğidir. Laennec’in çevresinde akciğer bulgularının kalp hastalıklarıyla nasıl iç içe geçtiği tartışılıyordu. “Kalp büyüklüğü, üfürüm, nefes darlığı ve akciğer sesleri” bir araya geldiğinde, hekimlerin zihninde yeni bir hipotez belirdi: bazı “ıslak akciğer” tablolarında itici güç akciğerin kendisi değil, kalbin pompasındaki yetersizlik olabilir.
1895–1930’lar: Röntgenin doğuşu ve görünür hâle gelen interstisyum
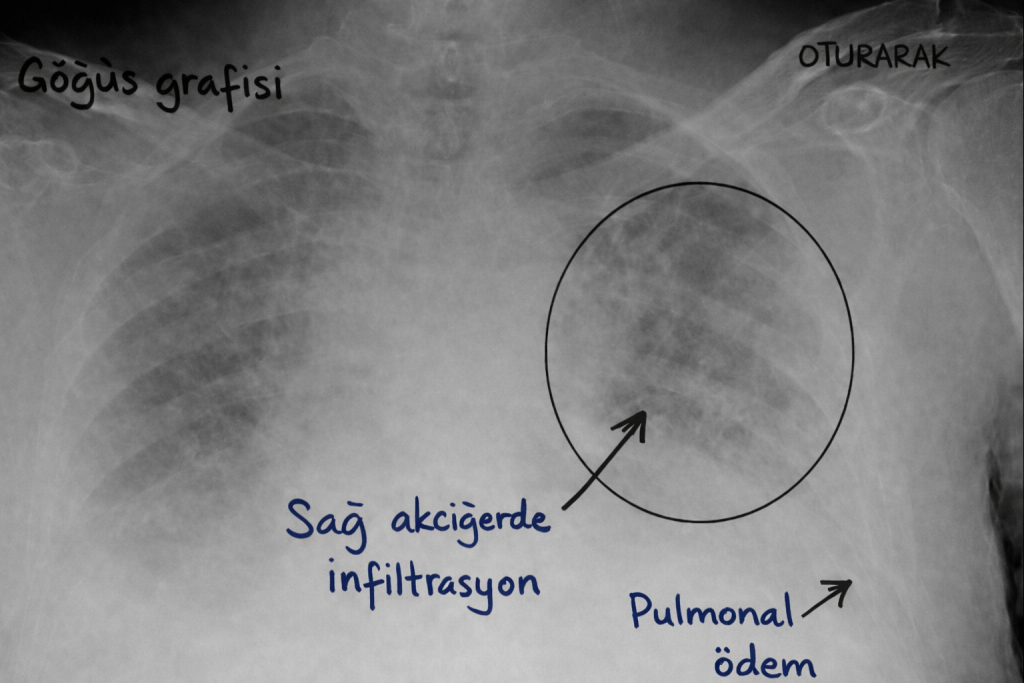
Wilhelm Conrad Röntgen’in X-ışınını tanımlamasından sonra göğüs radyografisi hızla klinik pratiğe girdi. Bu teknoloji, akciğer ödeminin keşif öyküsünde ikinci büyük kırılmayı yarattı: artık ödem, yalnızca seslerle ve ölüm sonrası bulgularla değil, yaşayan insanda görüntüyle de izlenebilecekti.
Bu dönemin yıldızlarından biri Sir Peter James Kerley’dir. 1933’te yayımladığı çalışmalarla, bugün “Kerley çizgileri” olarak bildiğimiz ince septal çizgilenmeleri tarif etti. Kerley’nin katkısı, akciğer ödemini sadece “alveoller suyla doldu” basitliğinde değil, interstisyumun ve lenfatik-kompartımanların katıldığı bir süreç olarak düşünmeye zorlamasıdır. Septaların kalınlaşması, peribronşiyal manşonlaşma ve plevral efüzyon gibi bulgular, ödemin “önce interstisyuma yerleşip sonra alveole taştığı” fikrini radyolojik bir hikâyeye dönüştürdü.
Bu sırada klinisyenlerin merakı pratik bir soruya odaklanmıştı: Hangi hastada bu gölgeler kalpten kaynaklanıyor, hangisinde akciğerin bariyeri bozuluyor? Görüntü, soruyu büyütmüş; ama yanıt için fizyolojiye ihtiyaç doğurmuştu.
1896: Starling ve sıvı hareketinin denkleme dönüşmesi
Ernest Henry Starling’in 1896’da ortaya koyduğu kapiller sıvı alışverişi fikri, akciğer ödeminin keşfinde “neden” sorusunu ilk kez matematiksel bir dile çevirdi. Bu, dramatik bir zihinsel sıçramaydı: Ödem, artık sadece “fazla su” değil; hidrostatik basınç, onkotik basınç ve bariyer özellikleri arasındaki dengenin bozulmasıydı.
Starling’in çerçevesi iki önemli sonucu beraberinde getirdi.
Birincisi, akciğer ödeminin kalp yetmezliğinde neden bu kadar sık görüldüğünü açıklamaya başladı: pulmoner venöz basınç yükselirse kapiller filtrasyon artar.
İkincisi, “kalp normal olsa bile ödem olur mu?” sorusunu meşrulaştırdı: eğer bariyer geçirgenliği artarsa, basınç çok yükselmeden de sıvı geçebilir.
O andan sonra klinik gözlem ile temel bilim arasındaki ilişki değişti. Hekimler, bir hastayı dinlerken ve röntgenine bakarken, akıllarında artık “hangi kuvvet baskın?” sorusunu taşıyordu.
1929–1956: Kalbin içine giren hekimler ve kalp-akciğer dolaşımının gerçek ölçümü
Bir hikâyenin kahramanı bazen tek başına risk alan bir kişidir: 1929’da Werner Forssmann, kendi kalbine kateter ilerleterek “kalbin içine girilebileceğini” kanıtladı. Bu eylem, cesur olduğu kadar epistemolojik bir kırılmaydı: Kalp ve pulmoner dolaşım artık dolaylı tahminlerle değil, doğrudan basınç ölçümleriyle konuşacaktı.
1940’larda André Frédéric Cournand ve Dickinson W. Richards, sağ kalp kateterizasyonunu klinik araştırmanın güvenilir bir aracına dönüştürdüler. Pulmoner arter basınçları, oksijen saturasyonları ve dolaşım dinamikleri üzerinden kalp-akciğer etkileşimi nicel hâle geldi. Bu emek, 1956’da Nobel düzeyinde tanındı ve akciğer ödemi açısından şu anlamı taşıdı: “Pulmoner venöz basınç yükselmesi” artık kavramsal bir tahmin değil, ölçülebilen bir gerçeklikti.
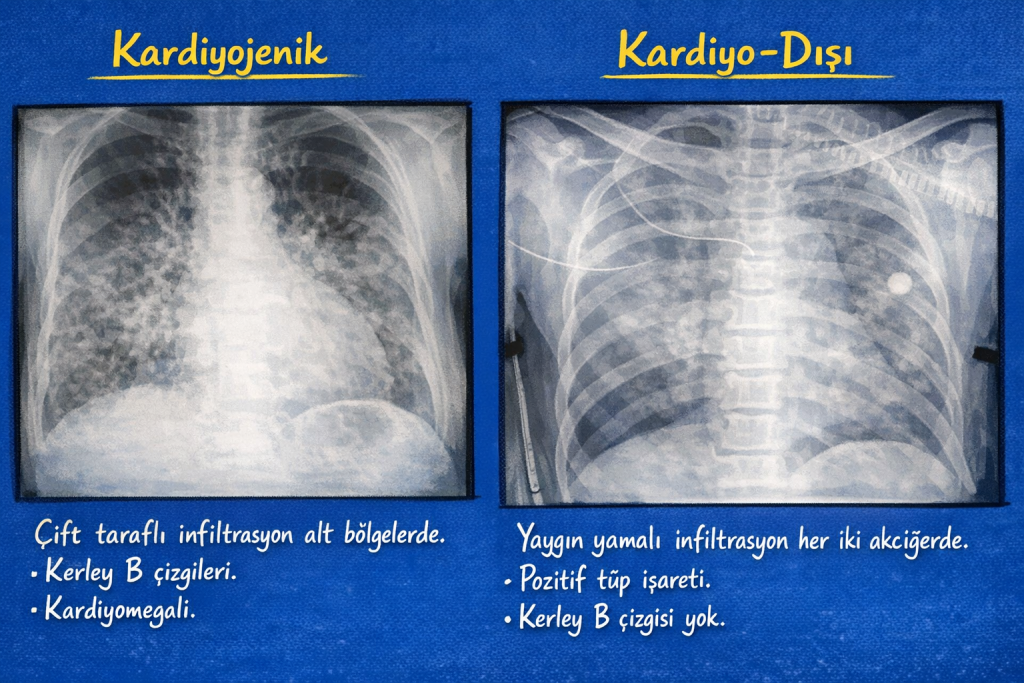
Bu yıllarda akciğer ödemi iki farklı doğaya ayrılmaya başladı:
- Basınçla sürüklenen, kalp kaynaklı, hidrostatik ödem
- Bariyer bozulmasıyla gelişen, kalp dışı, geçirgenlik ödemi
1960–1961: Yükseklik ödemi ve sağlıklı insanda “kardiyojen olmayan” akciğer ödeminin sarsıcı kanıtı
Birçok klinik paradigma, en iyi “istisna” ile kırılır. Yüksek irtifada tamamen sağlıklı kişilerin kısa sürede ağır solunum yetmezliğine girmesi, klasik “kalp yetmezliği = akciğer ödemi” eşlemesini sarstı. Charles Houston’ın olguları ve ardından Hultgren ile çalışma arkadaşlarının 1961’deki kapsamlı tanımlamaları, akciğer ödeminin kalpten bağımsız bir biyolojiye sahip olabileceğini güçlü biçimde ortaya koydu.
Bu fenomenin bilimsel cazibesi şuradaydı: Kalp normaldi, ama akciğer “sızdırıyordu”. Böylece araştırmacılar, hipoksinin pulmoner damar yatağında yarattığı heterojen vazokonstriksiyon ve kapiller stres gibi kavramlara yöneldi. Yükseklik ödemi, geçirgenlik artışının tek biçimli “enflamasyon” olmadan da gerçekleşebileceğini düşündürerek mekanizma repertuarını genişletti.
1967: Ashbaugh, Petty ve “ARDS” kavramının doğumu
1967’de David G. Ashbaugh, D. Boyd Bigelow, Thomas L. Petty ve Bernard E. Levine’in yayımladığı olgu serisi, modern yoğun bakım tıbbının en etkili kavramlarından birini doğurdu: erişkinde akut solunum sıkıntısı sendromu. Bu tanımlama, akciğer ödemi hikâyesinde üçüncü büyük kırılmadır; çünkü burada ödem, artık kalp yetmezliğinin bir komplikasyonu değil, yaygın alveol-kapiller hasarın merkez belirtisi olarak sahneye çıkıyordu.
ARDS anlatısı hekimlere şunu öğretti:
- Bazı akciğer ödemleri “proteinli”, “enflamatuvar” ve “yaygın bariyer hasarı” karakterlidir.
- Bu tabloda sadece sıvıyı azaltmak yetmez; ventilasyonun kendisi hasarı büyütebilir.
- Akciğer, mekanik bir organ gibi davranır; basınç ve hacimle incinebilir.
Bu noktadan sonra akciğer ödemi araştırmasının ana ekseni genişledi: hemodinamik ölçümler kadar ventilatör stratejileri, alveoler sıvı klirensi ve bariyer biyolojisi de merkeze oturdu.
1970’ler: Swan–Ganz kateteri, yoğun bakımda “wedge basıncı” ve ödemin bedside fizyolojisi
1970’te Swan–Ganz balon uçlu pulmoner arter kateterinin klinik kullanıma girmesi, akciğer ödeminin günlük pratikte “anlık fizyolojiye” dönüşmesini sağladı. Pulmoner kapiller wedge basıncı, sol atriyal dolum basıncının bir vekili olarak kullanıldığında, hidrostatik ödem ile geçirgenlik ödemi ayrımında çok çekici bir araç oldu. Bu dönem, yoğun bakımın “monitörle düşünen” bir disipline evrilmesinin de dönemidir: sıvı verilir, basınç yükselir mi; diüretik verilir, wedge düşer mi; oksijenasyon düzelir mi?
Sonraki yıllarda, pulmoner arter kateterinin herkes için faydalı olup olmadığı tartışmaları büyüdü; teknoloji geri çekilmedi ama daha seçici kullanılır hâle geldi. Bu tartışma bile keşif hikâyesinin bir parçasıdır: “ölçmek” her zaman “iyileştirmek” değildir; ama doğru şeyi ölçmeyi öğrenmek bilimin ilerleyişidir.
1980’ler–2000’ler: Akciğerde suyu ölçmek, alveolden suyu geri çekmek
1980’lerden itibaren araştırmacılar, akciğer ödemini sadece basınçlarla değil “akciğerdeki gerçek su miktarıyla” konuşmak istedi. Termodilüsyon teknikleriyle ekstravasküler akciğer suyu ölçümü kavramı gelişti; bu, özellikle ağır kritik hastada ödemin seyrini nicel izleme fikrini güçlendirdi.
Aynı dönemde alveoler epitelin pasif bir zar değil, aktif bir “sıvı temizleme” organı olduğu fikri olgunlaştı. Alveoler sodyum transportu ve buna bağlı su reabsorpsiyonu, ödemin çözülmesinde merkezi rol kazandı. Bu yaklaşım, keşif hikâyesine yeni bir dramatik gerilim ekledi: iki hasta aynı miktarda ödemle başlasa bile, biri hızla toparlayabilir, diğeri kötüleşebilir; çünkü belirleyici olan yalnızca sızıntı değil, temizleme kapasitesidir.
2000: ARDSNet ve “ventilatörün de bir ilaç olduğu” gerçeği
2000 yılında düşük tidal volüm ventilasyon stratejisini gösteren ARDSNet çalışması, ARDS’li hastalarda mortaliteyi azaltarak bir paradigmayı klinik standarda dönüştürdü. Bu gelişme, akciğer ödeminin keşif hikâyesinde şu açıdan önemlidir: ARDS’de problem yalnızca “ödem” değildir; ödemli, kırılgan akciğeri nasıl havalandırdığınız da hastalığın kaderini belirler. Ventilatör ayarları, bariyer hasarını büyütüp sızıntıyı artırabilir; doğru ayarlarla ise hasar zinciri kırılabilir.
2012: Berlin tanımı ve ARDS’nin daha keskin bir çerçeveye oturması
ARDS’nin tanı kriterleri yıllar içinde değişmişti; 2012’de Berlin tanımı, klinik heterojenliği daha düzenli sınıflandırma hedefiyle ortaya çıktı. Tanımın keşif hikâyesindeki rolü şudur: aynı adı taşıyan hastaların aslında çok farklı biyolojilere sahip olabileceği kabul edildi ve bu farklılıklar şiddet kategorileriyle daha sistematik ele alınmaya başlandı.
2012: “Revised Starling” ve glikokaliksin sahneye çıkışı
Starling’in denklemi yüz yıl boyunca öğretildi; fakat 2010’lardan itibaren endotelin glikokaliks tabakasının damar geçirgenliği ve sıvı hareketinde beklenenden daha kritik rol oynadığı anlaşıldı. Woodcock ve çalışma arkadaşlarının “revize Starling” yaklaşımı, klinik sıvı tedavisi düşüncesini de etkiledi: damar içi sıvı yüklemesi, yalnızca basınçları değil, bariyerin mikroyapısını da etkileyebilir; bazı durumlarda sızıntıyı artırıp ödemi ağırlaştırabilir.
Bu nokta, keşif hikâyesinde incelikli bir dönüşümdür: eskiden ödemi “kapiller basınç” ve “plazma proteinleri” ile açıklamaya alışkınken, artık “damar duvarının şekerli tüy gibi örtüsü”nün hasarını ve bunun sızıntıya etkisini konuşuyoruz.
2013: PROSEVA ve yerçekimini tedaviye dönüştürmek
2013’te prone pozisyonun ağır ARDS’de mortaliteyi azalttığını gösteren PROSEVA çalışması, keşif hikâyesine neredeyse şiirsel bir unsur ekledi: akciğer ödemi ve konsolidasyonun heterojen dağılımını, yalnızca ilaçlarla değil, hastanın yönünü değiştirerek yönetmek. Bu, anatomik-fizyolojik bir içgörünün klinik pratiğe büyük etkisidir: akciğer, yerçekimi altında davranan bir organ; öyleyse yerçekimini tedavinin parçası yapabilirsiniz.
2009–2018: ECMO’nun geri dönüşü ve “zaman kazanma sanatı”
Şiddetli ARDS’de veno-venöz ECMO, uzun bir tartışma tarihinden sonra özellikle 2009’daki CESAR çalışması ve 2018’deki EOLIA ile yeniden gündemin merkezine yerleşti. ECMO’nun akciğer ödemi keşif hikâyesindeki felsefi rolü nettir: bazen asıl tedavi akciğerin kendisini zorlamak değil, ona “iyileşmesi için zaman” kazandırmaktır. Bu yaklaşım, ödemin biyolojik çözülme süreçlerine saygı duyan bir yoğun bakım stratejisidir.
2020’ler: COVID-19, akciğer suyu, mikrovasküler hasar ve “tek hastalık değil, fenotipler” fikrinin güçlenmesi
COVID-19 pandemisi, ARDS ve akciğer ödemi araştırmasını hızlandıran dev bir doğal deney gibi çalıştı. Bir yandan ekstravasküler akciğer suyu ölçümü, bir yandan mikrovasküler hasar ve endotel disfonksiyonu tartışmaları yeniden ivme kazandı. Bu dönemde öne çıkan düşünce şuydu: aynı radyolojik görünüme sahip hastalarda bile biyolojik sürücüler farklı olabilir; kiminde endotel ağırlıklı sızıntı, kiminde inflamasyon paterni, kiminde tromboinflamasyon baskın.
Bu, keşif hikâyesinin olgunluk evresidir: tek bir “ARDS ilacı” aramak yerine, ARDS’nin alt tiplerini yakalamaya çalışmak.
2023–2026: Akciğer ödemini sayısallaştırma, yapay zekâ ile yatak başı görüntüleme, biyobelirteçlerle endotel okuması
Günümüzde keşif yolculuğu iki paralel hatta ilerliyor:
1) Ödemin nicel ölçümü ve görüntülemenin standardizasyonu
Radyografi, BT, MR, nükleer yöntemler ve özellikle akciğer ultrasonografisiyle ödemin miktarını daha nesnel ölçme girişimleri hızlandı. Sistematik derlemeler, bu yöntemlerin doğrulama düzeylerini, klinik karar vermeye katkılarını ve seri ölçümlerde kullanılabilirliğini tartışıyor. Ama en pratik devrim, bedside akciğer ultrasonu: B-çizgileriyle interstisyel sıvıyı hızla izlemek, tedaviye yanıtı görmek ve taburculuk öncesi rezidüel konjesyonu değerlendirmek artık daha rutin bir hedef.
2) Bariyer biyolojisinin biyobelirteçlere ve “fenotipleme”ye taşınması
Endotelyal glikokaliks hasarı, angiopoietin ekseni, syndecan-1 gibi belirteçler; damar duvarının “sızdırma eğilimini” biyokimyasal olarak okumaya aday hale geldi. Aynı dönemde makine öğrenmesiyle ARDS alt fenotiplerini tanımlama çalışmaları büyüyor: klinik veriler, ventilasyon parametreleri, laboratuvar profilleri ve bazen alveoler örneklerdeki protein panelleri kullanılarak “hangi hasta hangi biyolojik kümeye daha yakın?” sorusu yanıtlanmaya çalışılıyor.
Bu iki hat birleştiğinde, hikâye şuraya varıyor: gelecek, akciğer ödemini “görünen gölge” olarak değil, ölçülebilen su yükü + bariyer hasarı imzası + fenotipik risk haritası olarak okuyabilmekte.
Ve böylece keşif öyküsü, Laennec’in kulağıyla başlayan bir meraktan, günümüzde yapay zekânın kılavuzluk ettiği ultrason probuna; Starling’in denklemiyle başlayan bir fikirden, glikokaliksin moleküler yıpranmasını izleyen biyobelirteçlere; Kerley’nin çizgilerinden, çok-modlu sayısal konjesyon skorlarına uzanır. Akciğer ödemi hâlâ “akciğerin ıslanması”dır, ama artık bunun kaç farklı yolla olabileceğini ve hangi yolun hangi tedaviyi çağırdığını giderek daha iyi biliyoruz.












Yorum yazabilmek için oturum açmalısınız.