Tanım ve tarihçe
Desmin, tip III intermediyer filament (İF) ailesinin kas dokusuna özgü üyesidir. Hem iskelet kasında hem miyokardda hem de düz kaslarda sitoplazmik filament ağı oluşturarak, sarkomerlerin mimarisinin korunmasında ve kas hücresinin mekanik bütünlüğünde merkezi bir rol üstlenir. Antidesmin antikorlarıyla immünohistokimyasal (İHK) boyanma, çizgili ve düz kas farklılaşmasının güçlü bir göstergesidir ve belirli mezenkimal tümörlerin ayırıcı tanısında çekirdek biyobelirteçler arasında yer alır.
- Desmin tip III intermediyer filament olup hücre iskeletinin temel bir bileşenidir.
- Antidesmin antikorları ile pozitiflik, rhabdomyosarkom ve leiomyosarkom tanısında yüksek değer taşır, ancak her iki tümörde de nihai özgüllük için tamamlayıcı belirteçler (myogenin/MyoD1; h-kaldesmon) gereklidir.
- Panel yaklaşımı, morfoloji ve klinik bağlam ile birlikte yorumlanmadıkça yalın desmin pozitifliği yanlış sonuca götürebilir.
Genetik ve protein yapısı
Desmin, DES geni tarafından kodlanır (kromozom 2q). Diğer İF proteinleri gibi üç ana bölgeden oluşur: (i) N-uç “head” bölgesi; (ii) alfa-sarmal yapı sergileyen çubuk (“rod”) bölgesi; (iii) C-uç “tail” bölgesi. Monomerler antiparalel dimerler ve tetramerler oluşturarak “unit-length filament” ara basamağı üzerinden ~10 nm çapında olgun filamentlere polimerize olur. Filament oluşumu, fosforilasyon gibi post-translasyonel modifikasyonlarla ve şaperon proteinler (özellikle αB-kristalin) ile ince ayarlanır.
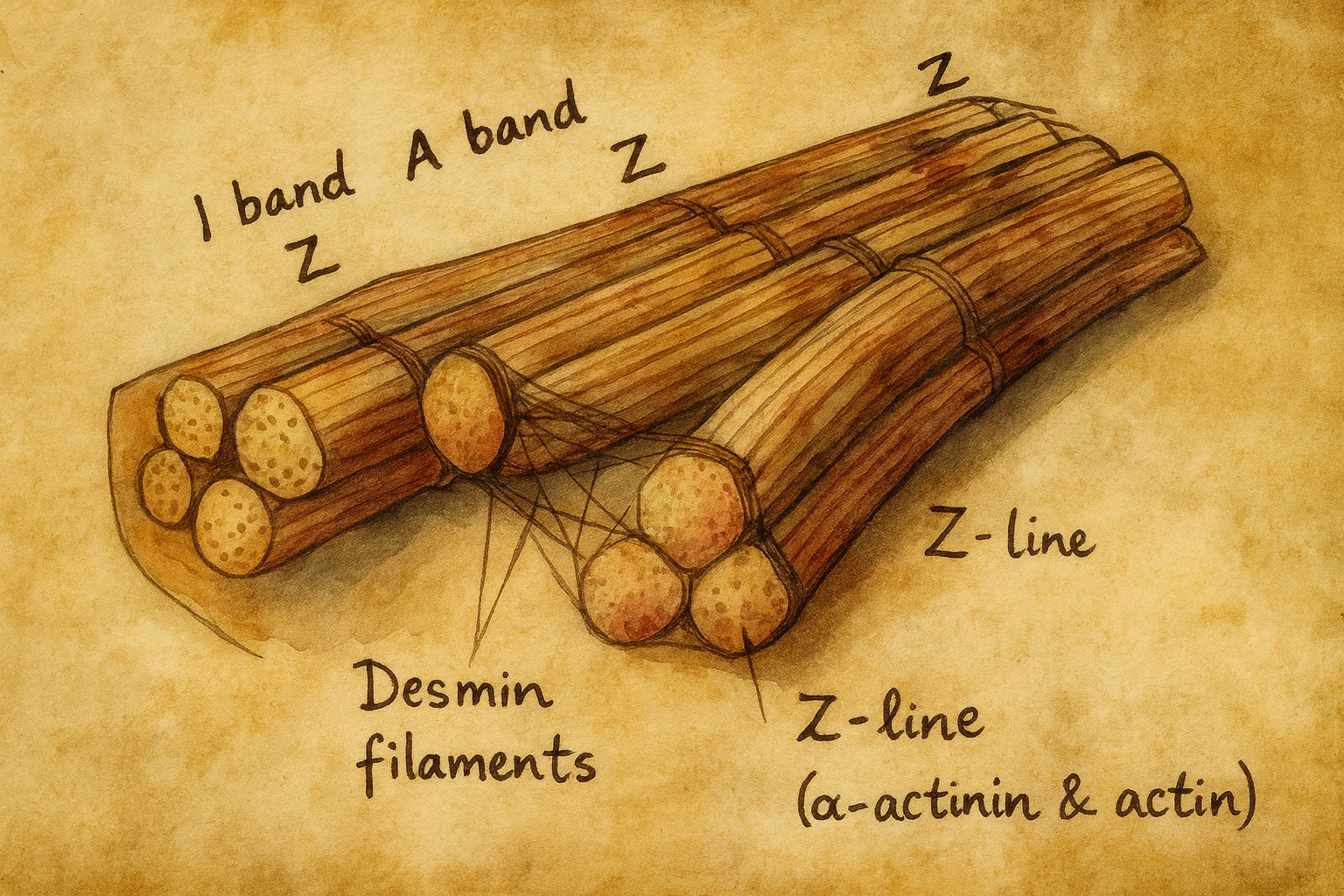
Hücresel lokalizasyon ve bağlanma ortakları
Kas hücresinde desmin, Z-diskleri birbirine ve hücre zarı üzerindeki kostamerik yapılara bağlayan üç boyutlu bir ağ kurar. Plectin, synemin, sarkoglikan-distrofin kompleksi ve desmoplakin gibi bağlantı proteinleriyle etkileşerek sarkomerler, mitokondriler ve çekirdek arasında mekanik ve sinyal iletimi köprüleri oluşturur. Bu organizasyon, kas lifinin tekrarlayan kasılma-stres döngülerinde yapısal kararlılığını sağlar ve organel konumlanması ile metabolik verimliliği destekler.
Fizyolojik işlevler
- Mekanik bütünlük ve kuvvet iletimi: Z-disklerin hizalanmasını sağlarken, myofibriller arası eşgüdümü kolaylaştırır.
- Sinyal iletimi ve mekanotransdüksiyon: İskelet ve kalp kasında gerilime bağlı sinyal yollarını (örn. MAPK, PKC) etkileyerek adaptif yanıtları modüle eder.
- Organel mimarisi: Mitokondri yerleşimi ve şekillenmesi üzerinde belirgin etkisi vardır; desmin kaybı mitokondriyal kümelenme ve enerji dengesinde bozulmaya yol açabilir.
Ekspresyon paterni ve regülasyon
Desmin, çizgili kas (iskelet ve kalp) ile düz kas farklılaşmasının erken evrelerinden itibaren ortaya çıkar; olgun kasda yaygın ve yoğun sitoplazmik ağ halinde izlenir. Myoblasttan myotuba geçişte desmin artışı belirgindir. Düz kasta desmin genellikle diffüz; myofibroblastlarda ise zayıf-odaksal ekspresyon görülebilir. Fosforilasyon (PKA/PKC/CaMKII), proteolitik kesim ve O-GlcNAc değişimleri filament dinamiğini ve ağın yeniden düzenlenmesini belirler.
Patogenez ile ilişkiler
DES gen mutasyonları “desmin ilişkili miyofibriller miyopati” spektrumuna girer; distal-proksimal kas zayıflığı, kardiyomiyopati ve ileti bozukluklarıyla seyredebilir. Elektron mikroskobisinde Z-disk düzeyinde birikimler ve granüler/filamentöz inklüzyonlar tipiktir. αB-kristalin ve plectin gibi ortak proteinlerin kusurları da desmin ağının bozulmasına yol açabilir.
Tanısal patolojide desmin
Desmin, mezenkimal tümörlerde kas farklılaşmasının en temel İHK göstergelerinden biridir.
Boyanma özellikleri
- Patern: Diffüz sitoplazmik filamentöz boyanma; bazı tümörlerde perinükleer “dot-like” odaklar.
- Klonlar ve teknik: Klinik rutinde D33 ve benzeri klonlar; formalinle fikse/parafin bloklarda uygun antijen geri kazanımı sonrası güvenilir sinyal verir.
- Yorumlama: “Pozitiflik” tek başına çizgili kas kökenini ispatlamaz; panel yaklaşımı esastır.
Rhabdomyosarkom (RMS)
- İfade: Çoğu RMS’te desmin pozitiftir ve sıklıkla kuvvetli-diffüzdür.
- Spesifite: Desmin kas yönelimini destekler; iskelet kasına özgü çekirdeksel transkripsiyon faktörleri myogenin ve MyoD1 ise RMS için daha spesifiktir ve tanıda altın standart panelin parçasıdır.
- Alt tip notları: Embriyonal ve alveoler varyantlarda desmin genellikle kuvvetlidir; iğsi/sklerozan tipte ekspresyon değişken olabilir.
- Ayırıcı tanı: Ewing sarkomu, sinovyal sarkom ve nöral krest kökenli küçük-çaplı mavi hücreli tümörler, desmin açısından çoğunlukla negatiftir; bu nedenle desmin-myogenin/MyoD1 kombinasyonu RMS’i güçlü şekilde destekler.
Leiomyosarkom (LMS)
- İfade: Düz kas farklılaşmasının karakteristik İHK profili SMA (α-düz kas aktini) + desmin + h-kaldesmon üçlüsüdür. LMS’lerin büyük kısmında desmin pozitiftir; en seçici düz kas belirteci ise h-kaldesmon kabul edilir.
- Lokalizasyon farkları: Retroperitoneal/abdominal LMS’lerde patern diffüz; damar kaynaklı tümörlerde değişken olabilir.
- Ayırıcı tanı: Myofibroblastik lezyonlar (örn. inflamatuvar myofibroblastik tümör) SMA pozitif, desmin değişken/odaksal olabilir ve h-kaldesmon genellikle negatiftir; bu, gerçek düz kas farklılaşmasından ayırmada kritiktir.
Diğer tümörler ve tuzaklar
- Desmoplastik küçük yuvarlak hücreli tümör perinükleer “dot-like” desmin paterni gösterebilir; polifenotipik İHK profiliyle tanınır.
- GIST: Nadiren fokal desmin pozitifliği görülebilir; ancak KIT (CD117)/DOG1 pozitifliği GIST lehinedir.
- Fibromatozis/myofibrom: Zayıf-odaksal desmin yanlış yorumlamaya yol açabilir; morfoloji ve panel (SMA, kaldesmon, β-katenin nükleer vb.) ile birlikte değerlendirilmelidir.
- Rejeneratif kas ve travma: Non-neoplastik kas rejenerasyonunda yoğun desmin artışı görülebilir; örnekleme bağlamı önemlidir.
Uygulama ilkeleri: İHK panel yaklaşımı
- RMS şüphesi: Desmin (+), myogenin (+), MyoD1 (+) → güçlü destek; PAN-sitokeratin (−), CD99 (değişken), NKX2.2 (−).
- LMS şüphesi: SMA (+), desmin (+), h-kaldesmon (+) → düz kas lehine; S100 (−/fokal), SOX10 (−), STAT6 (−), KIT/DOG1 (−).
- Panel rasyonalitesi: Desmin kas farklılaşmasının “geniş kapı” belirtecidir; spesifik yönlendirme için myogenin/MyoD1 (iskelet kası) ve h-kaldesmon (düz kas) gereklidir.
Moleküler patoloji ile entegrasyon
RMS’de (özellikle alveoler tip) PAX3/7-FOXO1 füzyonları; LMS’de belirgin ve tutarlı bir tek sürücü füzyon örüntüsü yoktur. İHK ile elde edilen kas fenotipi, morfoloji ve moleküler profili birleştirerek alt tip tayini ve risk sınıflaması güçlendirilebilir.
Teknik ve preanalitik değişkenler
Fiksasyon süresi, antijen geri kazanım koşulları ve dokunun otoliz derecesi desmin sinyalini etkiler. Otuz dakika ile 24 saat arası nötral tamponlu formalin fiksasyonu genellikle optimaldir. Nekrotik alanlardan kaçınma ve uygun internal pozitif kontroller (yakın kas lifleri, damar düz kası) yorum güvenliğini artırır.
Klinik yansımalar
Desmin temelli tanısal doğrulama, tümör sınıflamasını ve tedavi algoritmalarını doğrudan etkiler. RMS’de kas farklılaşmasının objektif gösterimi protokolleri belirlerken, LMS’de düz kas fenotipinin teyidi cerrahi yaklaşım, hedef dışı tedavilerden kaçınma ve prognozun değerlendirilmesine katkı sağlar.
Keşif
Desmin’in hikâyesi, hücre iskeletinin üçüncü kolu olan intermediyer filamentlerin kas hücresinde bıraktığı ilk izlenimle başlar. 1960’ların sonlarından itibaren elektron mikroskopisi, kas hücrelerinde 100 Å (≈10 nm) çaplı iplikçikleri yakaladığında, bu yeni fibrillerin ne olduğu tam olarak bilinmiyordu; bilinen iki “dev” vardı: mikrofilamentler (aktin) ve mikrotübüller. Kas hücresinde görülen bu üçüncü filament ailesi, bir süre “10-nm filamanlar” olarak anıldı; işlevleri belirsiz, fakat varlıkları tartışmasızdı.
1970’lerin ortasında, kas biyolojisinin deneysel dilini iyi konuşan araştırmacılar, bu iplikçiklerin kimliğini çözmek üzere kas dokusunu adeta “iskeletine” kadar soydular. 1976’da Peter Cooke, damar ve düz kas üzerinde yaptığı morfolojik çalışmalarla bu filamentöz iskeletin kas hücresindeki yaygınlığını ve mimarisini ikna edici biçimde sergiledi; kas hücresinin kontraktil aparatının yanında, ondan bağımsız ve onu tamamlayan bir “taşıyıcı ağ” vardı. Aynı yıl Elias Lazarides ve Bruce D. Hubbard, tavuk taşlığı gibi zengin düz kas kaynaklarından elde ettikleri 100 Å’lık filament altbirimini immünolojik olarak karakterize ettiler: kuvvetli üre koşullarında çözünebilen, ≈50 kDa’lık yeni bir protein, aktin ve miyozinden farklı ama kas hücresine derinden bağlı bir yapı taşı.
Bu bağ vurgusu, kısa sürede bir ada dönüştü. Yunanca δεσμός (desmos: bağ, düğüm) kökünden hareketle Lazarides ve Hubbard, proteine “desmin” adını verdiler. Aynı dönemde Joseph V. Small ve Andrzej Sobieszek, düz kastan saflaştırdıkları benzer ara filament proteinine “skeletin” adını önerdi; birkaç yıl boyunca literatürde iki isim yan yana dolaştı. Fakat “desmin”in hem biyokimyasal tutarlılığı hem de “bağ” fikrini kasın mimarisiyle özdeşleştirmesi, terimi baskın hâle getirdi. Kısacası, kavramsal yarışmayı “desmin” kazandı; çünkü isim, proteinin varlık gerekçesini anlatıyordu: sarkomerleri, z-diskleri, kostamerleri ve zarı birbirine bağlayan bir ağ kurmak.
1980’lerin başında, ara filamentlerin “üç parçalı” tasarım ilkesi —N-uç “head”, ortada uzun α-sarmal “rod”, C-uç “tail”— desmin üzerinde çözüldü. Bu yalnızca bir anatomik betimleme değildi; polimerizasyonun, yan-yana paketlenmenin ve “unit-length filament”ten olgun 10-nm filamentlere uzanan öz-montajın kuralları da belirlendi. Tripartit mimarinin keşfi, desminin neden bazen kusursuz kablolar gibi, bazen de stres altında yeniden örülen bir ağ gibi davrandığını açıklamaya başladı. Aynı yıllarda, desminin yalnızca çizgili ve kalp kasında değil, düz kasın da başat ara filament komponenti olduğu gösterildi; böylece desmin, “kas” kimliğinin moleküler amblemi hâline geldi.
1989’da insan DES geninin klonlanmasıyla öykü moleküler düzleme indi. Kod dizisi, baş-çubuk-kuyruk bölge düzenini ve koiled-koil fiziğini genetik dilden okunabilir kıldı; promotör düzenlenmesi ve miyogenez boyunca ekspresyon paternleri haritalandı. Ardından 1990’larda genetik mühendisliğin “Fonksiyon nedir?” sorusuna verdiği en net yanıtlardan biri geldi: desmin “knockout” (DES-/-) fareler. Bu hayvanlar, başlangıçta şaşırtıcı biçimde yaşayabilir ve üreyebilirdi; ancak büyüdükçe kalp ve iskelet kasında myofibrillerin yan-yana hizalanması bozuluyor, z-diskler arası eşgüdüm kayıyor, mitokondriler kümeleniyor ve kas dokusu dejenerasyona uğruyordu. “Desmin ne işe yarar?” sorusu, canlı hayvan modelinde berrak bir yanıt bulmuştu: kas dokusunda mekaniği süreklileştiren, kuvveti sarkomerden zara ve çekirdeğe köprüleyen, organellerin konumunu ve dayanıklılığını belirleyen bir “bağ örgüsü”.
İnsanda ilk desminopati olguları 1990’ların sonuna doğru tanımlandığında, temel bilim ve klinik patoloji nihayet aynı cümlede buluştu. DES genindeki mutasyonların, iskelet ve kalp kasını birlikte hedef alan myofibriller miyopatilerden ileti bozukluklu kardiyomiyopatilere uzanan geniş bir fenotip ürettiği gösterildi. Kas biyopsilerinde desminin birikim ve agregasyon paterni, ışık ve elektron mikroskopisinde z-disk düzeyindeki düzensizliklerle örtüşüyordu. Kader ortağı şaperon proteini αB-kristalinle ilişkisi giderek önem kazandı: desmin ağının sağlam kalması yalnızca polimer fizikleriyle değil, stres proteinleri ve proteostazla da ilgiliydi.
2000’lerde hikâye, enerji biyolojisine ve mekano-sinyal iletimine doğru derinleşti. Desminin mitokondri dağılımını ve solunum kapasitesini etkilediği; sarkomer-kostamer-nükleus hattında MAPK/PKC gibi yolların akışını biçimlendirdiği gösterildi. Kalpte ve iskelet kasında tekrarlayan gerilme-gevşeme döngülerine dayanıklılığı, desmin ağının yeniden düzenlenme kinetiği ve “çapraz konuşma”sıyla (aktin, mikrotübül ve nükleer lamina) sağlanıyordu. “Statik iskelet” tasviri yerini “dinamik bağ danteli”ne bıraktı.
2010’lardan itibaren desmin, post-translasyonel modifikasyonların (PTM) rafine bir “filament kodu”na sahip olduğu anlaşılan örnek proteinlerinden biri oldu. Baş-bölgesindeki serin/treonin fosforilasyonları, CaMKII-bağımlı işaretler ve O-GlcNAcylation arasındaki karşılıklı etkileşimlerin, filament montajı-dağılması ve sitoskeletal bölümlenme üzerinde zamansal-mekânsal kontrol kurduğu gösterildi. Bu çerçeve, kalp yetersizliği ve metabolik stres gibi durumlarda desminin neden bazen ağdan kopup agregasyona gittiğini, bazen de hücreyi kurtarıcı yanıtlarla stabil tuttuğunu açıklayan anahtar bir şemaya dönüştü.
Aynı dönemde moleküler ve klinik spektrum genişledi: “aynı aile içinde farklı kalp fenotipleri” üreten sıcak-bölgelerdeki (özellikle 1A alt-bölgesi) DES varyantları, iletim sistemi etkilenmesi ve ani kardiyak ölüm riskine uzanan çizgide haritalandı. Klinik elektrofizyolojiyle genetik arasındaki köprü güçlendi; fenotipik heterojenite, yalnızca mutasyonun konumuna değil, hücre iskeleti şaperonlarına, proteostaza ve PTM manzarasına da bağlandı. 2020’lerde, mozaik taşıyıcılığın bile desminopatilerde rol oynayabileceği gösterildi; bu da genetik danışmanlığın düz çizgisel öngörülerinin yeniden düşünülmesi anlamına geliyordu.
Tedavi ufku ise iki paralel patikadan ilerledi. Bir yanda, AAV-temelli gen aktarımı ve promotor hedeflemesi gibi stratejilerle “eksik desmini yerine koyma” veya hatalı ağı modüle etme girişimleri, fare modellerinde özellikle desminin tamamen yokluğunda kalpte anlamlı iyileşmeler gösterebildi. Diğer yanda, “fazla/yanlış desmin”in agregasyona eğilimli olduğu varyantlarda yalnızca daha çok desmin vermenin çözüm olmadığını; ağın doğru katlanması, doğru bağlanması ve doğru PTM imzasına kavuşması gerektiğini ortaya koyan çalışmalar, şaperon-modülasyon ve proteostaz hedeflerini gündeme taşıdı. Kısacası, desmin ailesinin klinikteki sorunları, “protein miktarı”ndan ziyade “protein kalitesi ve bağlamsal düzenlenmesi” meselesine dönüştü.
Patolojide desmin bugün de güçlü bir biyobelirteçtir. Rhabdomyosarkom ve leiomyosarkomda pozitif immünohistokimyasal boyanma, kas farklılaşmasının yol gösterici kanıtıdır; fakat güncel uygulama, desminin tek başına hüküm vermediğini bilir. İskelet kası farklılaşması için çekirdeksel myogenin ve MyoD1, düz kas için h-kaldesmon ve SMA ile oluşturulan panel, desminin “geniş kapı” duyarlılığını, “ince kapı” özgüllükle tamamlar. Bu bakımdan desmin, tanıda “ilk ipucu” olmayı günümüz moleküler patolojisiyle uyumlu biçimde sürdürür.
Bugün desmin araştırmaları, üç eksenin kesişiminde ilerliyor. Birincisi, PTM-kodunun çözülmesi: fosforilasyon-O-GlcNAcylation dengesinin filament mimarisine ve kalp ritim-kuvvet fizyolojisine etkileri, çok katmanlı omik yaklaşımlarla haritalanıyor. İkincisi, genetik-klinik spektrumun nüansları: mozaiklik, penetrans ve aile içi değişkenlik gibi konular yeni kohortlarda yeniden tanımlanıyor. Üçüncüsü, hedefli tedaviler: AAV temelli gen aktarımının doz-güvenlik sınırları, kardiyak özgüllüğü artıran promotorlar ve şaperon/otofaji yollarını “yeniden eğiten” farmakolojik stratejiler birlikte sınanıyor. Desminin adının ima ettiği “bağ”, bugün yalnızca z-disk ile sarkolemma arasında değil; temel bilim, patoloji, kardiyoloji ve gen tedavisi arasında da kuruluyor.