Tanım ve sınıflandırma
Düşük moleküler ağırlıklı heparinler (DMAH), fraksiyone edilmemiş heparinin (FMH) kimyasal veya enzimatik depolimerizasyonuyla elde edilen, ortalama molekül kütlesi yaklaşık 3.000–6.000 Da arasında değişen antitrombotik ajanlardır. Ürünler, üretim süreçlerine bağlı olarak farklı oligosakkarit dağılımlarına ve anti-Xa/anti-IIa aktivite oranlarına sahiptir. Klinik pratikte en sık kullanılan temsilciler arasında enoksaparin, dalteparin, tinzaparin, nadroparin, bemiparin, reviparin ve sertoparin yer alır. Her bir preparat biyobenzer değildir; dolayısıyla değişim (“switching”) farmakokinetik/-dinamik farklar doğurabilir.
- DMAH’ler, VTE profilaksisi ve tedavisinde, ayrıca AKS ve belirli renal/dializ senaryolarında birinci basamak antikoagülanlardandır.
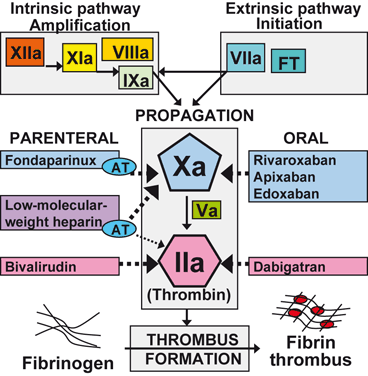
- Etkilerini AT üzerinden başlıca faktör Xa inhibisyonuyla gösterir; doz-yanıt öngörülebilirdir ve rutin laboratuvar izlemi gerekmez.
- En ciddi advers olay kanamadır; HIT riski FMH’ye göre daha düşük olsa da klinik açıdan önemini korur.
- Böbrek fonksiyonu, vücut ağırlığı, yaş, gebelik ve eşlik eden ilaçlar doz ve izlem stratejilerini belirler.
- Protamin yalnızca kısmi nötralizasyon sağlar; girişimler ve nöraksiyal tekniklerde zamanlama kritik önemdedir.
Farmakodinamik: Etki mekanizması
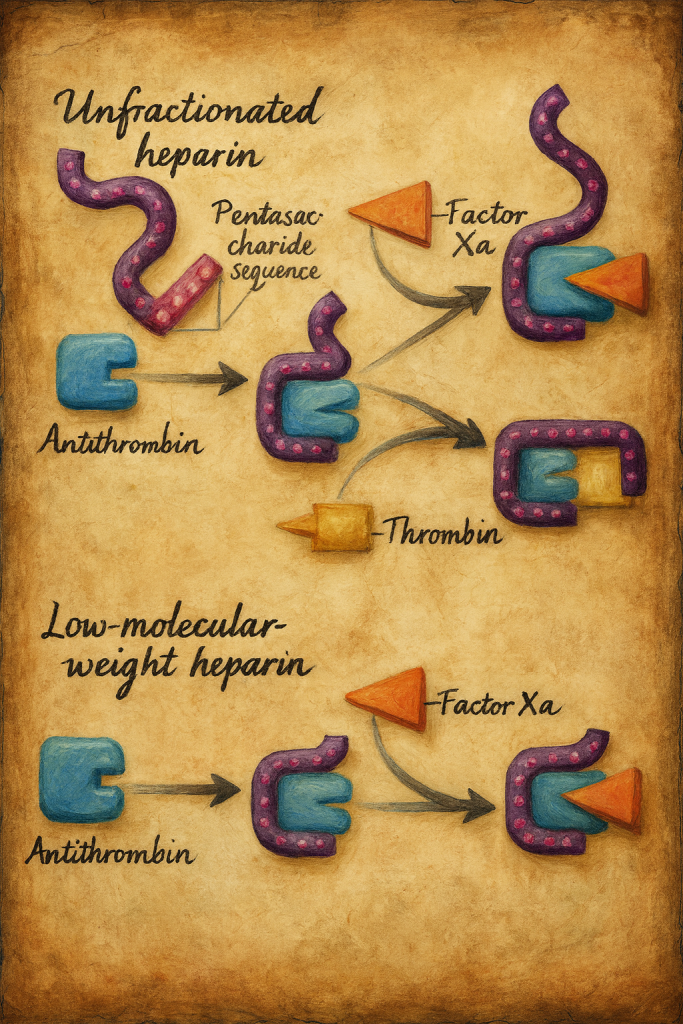
DMAH’lerin antikoagülan etkisi, özgül pentasakkarit dizisinin antitrombin (AT) ile yüksek afiniteyle bağlanmasına dayanır. AT aktivasyonu, başta faktör Xa olmak üzere serin proteaz koagülasyon faktörlerinin inhibisyonunu hızlandırır. FMH’ye kıyasla DMAH’ler trombin (faktör IIa) üzerinde daha zayıf, faktör Xa üzerinde ise daha belirgin inhibisyon oluşturur; tipik anti-Xa/anti-IIa oranı yaklaşık 2:1 ile 4:1 arasındadır (preparata özgü değişkenlik gösterir). Daha düşük nonspesifik protein bağlanması, daha az endotel/makrofaj etkileşimi ve düşük plazma proteinlerine bağlanma, doz-yanıt ilişkisinin daha öngörülebilir olmasını sağlar.
Farmakokinetik özellikler
- Uygulama yolu: En sık subkutan; seçilmiş durumlarda intravenöz yükleme/infüzyon yapılabilir.
- Biyoyararlanım: Subkutan uygulamada ~%90’ın üzerindedir; FMH’ye kıyasla yüksek ve tutarlıdır.
- Zirve etki zamanı: 3–5 saat içinde anti-Xa aktivitesi tepe noktasına ulaşır.
- Eliminasyon: Başlıca renal; kreatinin klerensi azaldıkça birikim riski artar.
- Yarı ömür: Yaklaşık 3–6 saat (preparata ve doza bağlı).
- İzlem: Rutinde aPTT izlemi gerekmez; anti-Xa düzey izlemi yalnızca özel popülasyonlarda önerilir.
Endikasyonlar
- Venöz tromboembolizmin (VTE) profilaksisi:
- Büyük ortopedik cerrahi (kalça/knee artroplastisi, kalça kırığı cerrahisi).
- Büyük abdominal/pelvik kanser cerrahisi.
- Akut tıbbi yatışlarda immobil hastalar, kalp yetersizliği, ciddi enfeksiyon, inme sonrası immobilite.
- VTE tedavisi:
- Derin ven trombozu (DVT) ve pulmoner emboli (PE) için hastane içi veya ayaktan tedavi protokolleri.
- Akut koroner sendromlar (AKS):
- Özellikle NSTEMI/unstabil angina’da antitrombotik tedavinin parçası olarak; bazı STEMI stratejilerinde fibrinolitiklerle kombine.
- Kanser ilişkili tromboz:
- Özellikle gastrointestinal/genitoüriner kanserlerde kanama riski dikkate alınarak birinci seçeneklerden biri olmaya devam etmektedir; doğrudan oral antikoagülanlarla bireyselleştirme yapılır.
- Hemodiyaliz devresi antikoagülasyonu ve köprüleme (“bridging”):
- Geçici oral antikoagülan kesintilerinde veya mekanik kapak/AF gibi durumlarda seçilmiş köprüleme senaryoları.
Dozlama ilkeleri ve uygulama
- Ağırlık temelli dozlama: Terapötik uygulamada gerçek vücut ağırlığına göre belirlenir; profilakside sabit düşük doz rejimleri kullanılır.
- Böbrek fonksiyonu: Orta-ağır renal yetersizlikte doz azaltımı ve/veya anti-Xa izlemi gerekebilir. Kreatinin klerensi ciddi azalmış hastalarda preparat seçimi ve dozlama özellikle dikkat gerektirir.
- Obezite ve düşük vücut ağırlığı: Obez hastalarda doz genellikle gerçek vücut ağırlığına göre hesaplanır; aşırı obezite veya <50 kg gibi uç ağırlıklarda anti-Xa izlemi düşünülebilir.
- Gebelik: Plasentayı geçmez; DVT/PE tedavisi ve profilaksisinde tercih edilen antikoagülanlardandır. Üçüncü trimester ve peripartum dönemde planlama, doğum şekli ve bölgesel anestezi zamanlamasıyla koordine edilmelidir.
- Pediatri ve ileri yaş: Çocuklarda off-label protokoller ve sıkı izlem; ileri yaşta artmış kanama riski nedeniyle bireyselleştirme.
Uygulama tekniği: Subkutan enjeksiyon abdominal duvar, uyluk veya üst kolun yağ dokusuna, genellikle 90° açıyla, rotasyon prensibiyle yapılır. İM uygulamadan kaçınılır. Önceden doldurulmuş şırıngalardaki hava kabarcığı dışarı atılmamalıdır.
İzlem ve laboratuvar
- Rutin test gereksinimi yoktur. DMAH, aPTT’yi güvenilir yansıtmaz.
- Anti-Xa düzeyi: Özel durumlarda kullanılabilir (gebelik, aşırı obezite veya düşük ağırlık, ileri renal yetmezlik, pediatrik hastalar, beklenmeyen kanama veya rekürren tromboz). Zirve örneği genellikle dozdan 4 saat sonra alınır.
- Tam kan sayımı ve trombositler: Başlangıçta ve erken dönemde trombositopeni açısından izlem önerilir.
- Karaciğer fonksiyon testleri ve potasyum: Geçici transaminaz yükselmeleri ve hiperkalemi açısından klinik gereklilik varsa kontrol edilebilir.
Kontrendikasyonlar ve dikkat edilmesi gereken klinik durumlar
- Aktif majör kanama, yakın zamanda hemorajik inme, klinik olarak anlamlı trombositopeni.
- Heparine bağlı trombositopeni (HIT) öyküsü; çapraz reaktivite olasılığı nedeniyle tüm heparin türevlerinden kaçınılır.
- Ciddi kontrolsüz hipertansiyon, aktif peptik ülser, yakın major cerrahi/ travma durumları klinik bağlama göre değerlendirilir.
- Nöraksiyal anestezi/analjezi: Epidural/spinal hematom riski mevcuttur; blok öncesi ve kateter çekimi sonrası güvenli aralıklar preparata ve doza göre planlanmalı, nörolojik takip yapılmalıdır.
İlaç etkileşimleri
- Antiplateletler (ör. aspirin, P2Y12 inhibitörleri), diğer antikoagülanlar, trombolitikler ve non-selektif NSAİİ’lerle birlikte kanama riski artar.
- Potasyum tutucu ilaçlarla birlikte hiperkalemi riski teorik olarak yükselebilir.
- Laboratuvar düzeyinde, bazı koagülasyon testleri ve karaciğer enzim ölçümlerinde yalancı veya klinik önemsiz değişiklikler görülebilir.
İstenmeyen etkiler
- Kanama: En sık ve en ciddi advers etkidir; yaş, renal fonksiyon bozukluğu, eşlik eden ilaçlar ve invazif işlemlerle risk artar.
- Trombositopeni: Tip 1 (nonimmün, geçici) ve daha önemlisi Tip 2 (immün, PF4-IgG aracılı HIT). Tipik olarak 5–10. günlerde ortaya çıkar; trombozla komplike olabilir. Yönetim: tüm heparinlerin kesilmesi ve non-heparin antikoagülan başlanması.
- Karaciğer enzim yüksekliği: Sıklıkla asemptomatik ve geri dönüşlüdür.
- Lokal reaksiyonlar: Enjeksiyon bölgesinde ağrı, ekimoz, nodül; nadiren cilt nekrozu.
- Osteoporoz: Uzun süreli, yüksek kümülatif dozlarda kemik mineral yoğunluğunda azalma riski, FMH’ye göre daha düşüktür ancak göz ardı edilmemelidir.
- Alopeci ve hiperkalemi: Nadir; hiperkalemi, heparin kaynaklı hipoaldosteronizme bağlanır.
Aşırı doz ve tersine çevirme
- Protamin sülfat DMAH’in anti-IIa etkisini büyük ölçüde, anti-Xa etkisini ise kısmen nötralize eder. Yakın zamanlı dozlara sınırlı ve zamanla azalan etkinlik söz konusudur. Dirençli kanamalarda destekleyici tedavi, cerrahi hemostaz ve hedefe yönelik kan ürünleri kullanımı gerekebilir. Spesifik ve tam bir antidot yoktur.
DMAH ile FMH ve DOAK’ların karşılaştırılması
- FMH’ye karşı: DMAH’ler daha öngörülebilir farmakokinetik, daha yüksek subkutan biyoyararlanım, daha düşük HIT ve osteoporoz riski, daha az laboratuvar izlem gereksinimi sunar. FMH hızlı geri döndürülebilirliği ve kısa yarı ömrü nedeniyle yoğun bakım ve prosedürel ortamlarda yerini korur.
- DOAK’lara karşı: DOAK’lar oral kullanım ve belirgin hasta konforu sağlar. Bununla birlikte DMAH’ler gebelik, ileri böbrek yetersizliği, belirli kanser alt tipleri ve invazif girişimlerin yakınında zamanlama esnekliği gibi alanlarda avantajlı olabilir. Seçim, endikasyon, komorbidite ve kanama/tromboz dengesine göre bireyselleştirilmelidir.
Kanser hastalarında özel hususlar
Gastrointestinal ve genitoüriner kanserlerde mukozal kanama yatkınlığı göz önüne alınarak DMAH sıklıkla tercih edilir. Metastatik hastalık, trombositopeni, kemoterapiyle etkileşimler ve kateter varlığı karar verme sürecini etkiler. Tedavi süresi tipik olarak en az 3–6 aydır; aktif kanser varlığında daha uzun süreler gündeme gelir.
Perioperatif yönetim ve girişimler
- Düşük doz profilaksi çoğu ameliyat sonrası erken mobilizasyonla kombine edilir.
- Terapötik doz kullanan hastalar için cerrahi riske ve renal fonksiyona göre kesme/yeniden başlama zamanlaması planlanır.
- Nöraksiyal teknikler için güvenli aralıklar titizlikle korunur; postoperatif nörolojik takip zorunludur.
Pratik uygulama ipuçları
- Önceden doldurulmuş şırıngalar kullanılıyorsa doz doğrulanmalı; enjeksiyon bölgesinde masaj yapılmamalıdır.
- Çoklu risk faktörleri olan hastalarda kanama ve düşme riskine yönelik profilaktik stratejiler (bası çorapları, mobilizasyon, PPI gerekliliği) değerlendirilmelidir.
- Uzun süreli tedavilerde kemik sağlığı, demir eksikliği ve cilt bakımı gözden geçirilmelidir.
Depolama ve stabilite
Önceden doldurulmuş şırıngalar oda sıcaklığında veya üretici önerilerine göre saklanır; dondurulmamalı ve aşırı ısıdan korunmalıdır. Son kullanma tarihi ve ambalaj bütünlüğü her uygulamada kontrol edilmelidir.
Keşif
Düşük moleküler ağırlıklı heparinlerin (DMAH) öyküsü, yalnızca bir ilacın doğuşu değil; biyokimyanın, endüstriyel farmasötiklerin, klinik metodolojinin ve hasta güvenliğinin bir asır boyunca nasıl birlikte evrildiğinin vazgeçilmez bir panoramasıdır. Anlatı, 20. yüzyılın başlarında pıhtılaşmanın sırlarını aralayan birkaç meraklı bilim insanıyla başlar; 1970’ler ile 1980’lerin başında şekillenen “pentasakkarit çağında” keskinleşir; 1990’larda klinik kılavuzları dönüştürür; 2000’ler ve 2010’larda tedarik zinciri ve kalite dersleriyle sarsılır; 2020’lerde ise immün-tromboz ve sentez biyoteknolojisiyle yeni bir bilimsel ufka açılır.
İlk Kıvılcım: Heparinin Keşfi ve Temellerin Atılması
1916’da Baltimore’da Jay McLean ve danışmanı William Howell’ın damar içi pıhtılaşma ile ilişkili “karaciğer kaynaklı” etkin maddeleri ayırma çabaları, heparin denen, şaşırtıcı biçimde pıhtılaşmayı engelleyen bir polisakkarit karışımını gündeme getirdi. Kısa zamanda Toronto’da Charles Best ve Stockholm’de Erik Jorpes’in katkılarıyla heparin saflaştırma, standardizasyon ve üretim adımları biçimlendi; heparin, 1930’lardan itibaren klinik araca dönüştü. 1970’lere gelindiğinde Londra’da Vijay Kakkar, düşük doz heparinin ameliyat sonrası venöz tromboembolizmi önlemede sistematik kullanımını yaygınlaştırarak heparini “profilaksinin dili” hâline getirdi. Bu sahne, DMAH fikrinin filizleneceği zemini hazırladı: heparin heterojen, uzun zincirli ve izlem gerektiren bir moleküldü; acaba daha kısa, daha öngörülebilir fraksiyonlarla aynı fayda, daha az zahmetle elde edilebilir miydi?
Dönüm Noktası: 1976’da Londra, 1976–1983 Arası “Pentasakkarit Çağı”
1976’da Londra’dan Johnson ve çalışma arkadaşlarının yayımladığı erken bir dizi çalışma, heparinin anti-Xa etkisinin alt birimlerine ayrıldığında nasıl farklılaştığını göstererek “düşük moleküler ağırlık” yaklaşımını bilimsel sahneye taşıdı. Aynı dönemde üç bağımsız ekip, heparinin antitrombin ile sıkı bağ kuran belirli bir yapısal motif taşıdığını saptadı. Uppsala’da Ulf Lindahl’ın ekibi ve Milano’da Bo Casu’nun ekibi, antitrombinin yüksek afiniteyle tanıdığı bölgenin bir pentasakkarit dizisi olduğunu kimyasal olarak ayıkladı; bu dizideki kritik “3-O-sülfatlanmış glukozamin” işaret taşı niteliğindeydi. Paris’te Choay grubundan Pierre Petitou ve meslektaşları, 1983’te bu pentasakkarit dizisini organik sentezle üretmeyi başararak, heparin evreninde “doğal karışım” çağından “tasarlanmış diziler” çağına kapı araladı. Aynı yıllarda S. T. Olson ve diğerleri antitrombinin konformasyon değişikliklerini berraklaştırırken, Hemker ve çalışma arkadaşları anti-Xa ve anti-IIa etkinliğin zincir uzunluğu ve bağlanma dinamikleriyle ilişkisini klinik farmakolojiye tercüme ediyordu. Kısa zincirlerin (DMAH) anti-Xa ağırlıklı, daha öngörülebilir ve subkutan uygulanabilir profili, klinik açısından cezbediciydi.
Sanayinin Atölyesi: Depolimerizasyon Kimyası ve Ticari Preparatlar
Bilimsel motifler, endüstrinin reaktörlerinde şekil buldu. Heparinin “daha küçük, daha ayarlanmış” fragmanlara dönüştürülmesi için farklı depolimerizasyon yolları geliştirildi:
- Nitroz asit ile deaminatif yarılma ve ardından indirgeme: Dalteparin ve nadroparin gibi preparatların endüstriyel yolunu açtı.
- Benzilasyon ve alkalin depolimerizasyon: Enoksaparin için karakteristik iz bırakıcı işlemler dizisini oluşturdu.
- Heparinaz ile enzimatik yarılma: Tinzaparin gibi ürünlerin biyokimyasal “nazik” üretim hattını temsil etti.
- Peroksidatif ya da fotokimyasal parçalama: Daha sınırlı ticari kullanım görse de yöntem yelpazesini genişletti.
Bu kimyasal ve enzimatik yollar, 1980’lerin ortasından 1990’lara uzanan süreçte dalteparin (KabiVitrum/İsveç), enoksaparin ve nadroparin (Choay/Sanofi/Fransa), tinzaparin (LEO Pharma/Danimarka) gibi markalaşmış DMAH’leri kliniğe taşıdı. Ulla Hedner gibi klinik farmakologlar, yeni fraksiyonların antitrombotik etkinlik ve güvenlilik profilini titizlikle haritaladı. Her bir DMAH, üretim yöntemi ve oligosakkarit dağılımına bağlı “parmak izi”ne sahipti; bu nedenle “aynı sınıf”ın ilaçları biyobenzer değil, yakın akraba fakat farklı bireyler gibiydi.
Klinik Kanıtların Yükselişi: 1980’lerden 2000’lere
1980’lerin başından itibaren, günlük tek doz subkutan tedaviyle venöz tromboembolizm (VTE) tedavisi ve profilaksisinin hastane dışına da taşınabildiği gösterildi. 1990’larda, ortopedik ve abdominal cerrahi sonrası profilakside DMAH’ler standartları yeniden tanımladı; aynı dönemde dalteparin ve enoksaparin, akut koroner sendromlarda (özellikle NSTEMI/unstabil anjina) “antitrombotik omurganın” önemli bir parçası hâline geldi. Kanser ilişkili trombozda ise rekürrens ve kanama dengesini gözeten çalışmalar, DMAH’leri uzun süreli tedavinin güvenilir seçenekleri arasına yerleştirdi. Klinik metodoloji olgunlaştıkça, anti-Xa/anti-IIa oranı, biyoyararlanım ve yarılanma ömrü gibi farmakolojik nüanslar sonuç odaklı uç noktalarla (DVT/PE rekürrensi, majör kanama, mortalite) bağlandı; kılavuzlar, “rutin aPTT izlemi gerektirmeyen, öngörülebilir antikoagülasyon” fikrini temel kabul etti.
Bir Krizden Dersler: 2008 Ham Heparin Kontaminasyonu ve Kalite Çağı
2008’de heparin tedarik zincirinde ortaya çıkan “aşırı sülfatlanmış kondroitin sülfat” kontaminasyonu, yalnızca farmakoekonomi ve tedarik yönetimi açısından değil, karmaşık biyolojik ilaçlar için analitik standardizasyon ve düzenleyici gözetimin güçlendirilmesi açısından da kalıcı bir dönüm noktası oldu. Bu tecrübe, DMAH’lerin yapısal mikroheterojenitesini çözümlemeye yönelik ileri spektrometri ve NMR tabanlı platformların, farmakope tanımları ve karşılaştırılabilirlik kılavuzlarıyla birlikte gelişmesini hızlandırdı.
Tasarlanan Moleküller: Pentasakkaritten Sentetik ve Kemo-Enzimatik Ufuklara
1983’te pentasakkarit dizisinin sentezlenmesi, daha sonra fondaparinuks gibi saf, tek moleküllü anti-Xa ajanlarının önünü açtı; bu ajanlar DMAH değilse de DMAH’lerin keşif hattının “tasarım ilacı”na evrilen kolunu temsil etti. 2000’lerden sonra kemo-enzimatik yaklaşımlar, glikozaminoglikan biyosentez enzimlerini kullanarak “sentetik DMAH” olasılığını laboratuvar gerçekliğine yaklaştırdı. Amaç, doğal kaynak bağımlılığını azaltırken, antikoagülasyonun yanında inflamasyon, kemokin etkileşimi ve doku onarımı gibi pleyotropik etkileri de incelikle ayarlayabilmekti.
İmmün-Trombozun Anatomisi: 2020’ler ve Yeni Sorular
COVID-19 pandemisiyle birlikte immünotromboz, nötrofil ekstrasellüler tuzakları (NET’ler) ve endotelyal glikokaliks hasarı ekseninde heparinlerin antikoagülan ötesi rolleri yeniden gündeme geldi. DMAH’lerin anti-inflamatuvar ve antiviral bağlamda dolaylı etkileri, sepsisten ARDS’ye uzanan geniş bir zeminde tartışıldı. Aynı dönemde heparine bağlı trombositopeni (HIT) patobiyolojisi—platelet faktör 4 (PF4) ile polianyon etkileşiminin incelikleri—daha yüksek çözünürlükte haritalandı; DMAH’lerin HIT riskini FMH’ye göre azaltan yapısal nedenleri daha iyi anlaşılır oldu. Obezite, gebelik ve böbrek yetersizliği gibi özel popülasyonlarda anti-Xa izlemi, bireyselleştirilmiş dozlama ve gerçek yaşam verileri, “bir sınıf-çok fenotip” gerçeğini kuvvetlendirdi.
Kişiler ve Okullar: Bilimsel Coğrafyanın Hatırlattıkları
Bu hikâyenin kaşifleri tek bir laboratuvara sığmaz. Baltimore’da McLean ve Howell ile başlayan çizgi, Toronto’da Best, Stockholm’de Jorpes ve Uppsala’da Lindahl ile kimyasal-biyokimyasal derinliğe kavuştu. Milano’da Casu’nun yapısal çözümlemeleri, Paris’te Choay ekibinden Petitou’nun sentetik sıçramasıyla birleşti. Londra’da Johnson ve Kakkar, klinik metodolojiyi ve düşük molekül fikrini sivriltti. İsveç’te KabiVitrum (daha sonra Sobi çizgisi) dalteparinin, Danimarka’da LEO Pharma tinzaparin’in yolunu açarken; Fransa’da Choay/Sanofi damarı enoksaparin ve nadroparin ile sınıfın küresel erişimini genişletti. Bu harita, yapı-işlev şifresinin çözümünü endüstriyel ölçek ve klinik ispatla kaynaştıran bir ağdır.
Bugünün Araştırma Masası: Nereye Doğru?
Güncel araştırmalar üç eksende yoğunlaşıyor:
- Tam tanımlı/sentetik analoglar ve kemo-enzimatik biyosentezle, güvenlik-etkinlik-tedarik dengesini optimize etmek;
- Mikroheterojenite-fenotip eşlemesiyle, DMAH alt fraksiyonlarının anti-Xa/anti-IIa diyalektiğini hasta alt gruplarına göre ayarlamak;
- Non-antikoagülan etkiler—kemokin ve büyüme faktörü etkileşimlerinden nöron-glia korumasına kadar—için hedefe yönelik glikozaminoglikan mühendisliği. Bu gündemin arka planında ileri kütle spektrometrisinden çok boyutlu NMR’a, yüksek çözünürlüklü yapı-fonksiyon eşlemesine kadar rafine analitikler çalışıyor.
İleri Okuma
- Lindahl U., Thunberg L. — Evidence for a 3-O-sulfated D-glucosamine residue in the antithrombin-binding sequence of heparin. Proc Natl Acad Sci USA, 77(11): 6551–6555, 1980.
- Bienkowski M.J., et al. — Structural characterization of the oligosaccharides formed by nitrous acid depolymerization of heparin. J Biol Chem, 260(13): 7158–7164, 1985.
- Buckley M.M., et al. — Enoxaparin (PK 10169): pharmacology and clinical applications. Drugs, 44(4): 465–497, 1992.
- Levine M.N., Gent M., Hirsh J. — A comparison of low-molecular-weight heparin with unfractionated heparin for the treatment of proximal deep-vein thrombosis. N Engl J Med, 331(10): 648–655, 1994.
- Bergqvist D. — Low molecular weight heparins. J Intern Med, 240(4): 233–240, 1996.
- Warkentin T.E., Kelton J.G. — Heparin-induced thrombocytopenia. Annu Rev Med, 48: 395–406, 1997.
- Hirsh J., Levine M.N. — Low-Molecular-Weight Heparin. Circulation, 98(15): 1575–1582, 1998.
- Hedner U. — Tinzaparin: a heparinase-digested LMWH. Pathophysiol Haemost Thromb, 30(3): 143–147, 2000.
- Geerts W.H., Pineo G.F., Heit J.A. — Prevention of venous thromboembolism. Chest, 119(1 Suppl): 132S–175S, 2001.
- Hirsh J., Raschke R. — Guide to Anticoagulant Therapy: Heparin. Circulation, 103(24): 2994–3018, 2001.
- Petitou M., van Boeckel C. — The synthetic pentasaccharide fondaparinux. Haematologica/Thromb Res overview, 2002.
- Petitou M., et al. — 1976–1983, a critical period in the history of heparin. Carbohydrate Research, 338: 2459–2472, 2003.
- Samama M.M. — Evaluation of fondaparinux: pharmacological properties and clinical profile. Thromb Res, 109(1): 1–11, 2003.
- Hirsh J., Raschke R. — Heparin and low-molecular-weight heparin: mechanisms and monitoring. Hematology Am Soc Hematol Educ Program, 2004(1): 497–508, 2004.
- Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. — Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis (8th ed.). Chest, 133(6 Suppl): 141S–159S, 2007.
- Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. — Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis (9th ed.). Chest, 141(2 Suppl): e24S–e43S, 2012.
- Bates S.M., Greer I.A., Middeldorp S., Veenstra D.L., Prabulos A.M., Vandvik P.O. — VTE, thrombophilia, antithrombotic therapy, and pregnancy. Chest, 141(2 Suppl): e691S–e736S, 2012.
- Konstantinides S.V., Torbicki A., Agnelli G. — 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J, 35(43): 3033–3080, 2014.
- Arachchillage D.R.J., Laffan M. — Pathogenesis and management of heparin-induced thrombocytopenia. Br J Haematol, 173(2): 199–207, 2016.
- Hemker H.C. — A century of heparin: past, present and future. J Thromb Haemost, 14(12): 2329–2338, 2016.
- Chandarajoti K., Liu J., Pawlinski R. — Design and synthesis of new synthetic LMWHs. J Thromb Haemost, 14(6): 1135–1145, 2016.
- Torri G. — Heparin centenary – an ever-young life-saving drug. Int J Cardiol, 223: 265–273, 2016.
- Oduah E.I., et al. — Heparin: Past, Present, and Future. Pharmaceuticals, 9(3): 38, 2016.
- ASH (American Society of Hematology) — Guidelines for management of venous thromboembolism: prophylaxis and treatment. Blood Adv, 2(22): 3257–3291, 2018.
- Horlocker T.T., Vandermeuelen E., Kopp S.L., et al. — Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy (ASRA guidelines). Reg Anesth Pain Med, 43(3): 263–309, 2018.
- Konstantinides S.V., Meyer G., Becattini C. — 2019 ESC Guidelines for acute pulmonary embolism. Eur Heart J, 41(4): 543–603, 2019.
- Zhang Y. — Clinical use of fondaparinux: a synthetic heparin pentasaccharide. Trends Cardiovasc Med, 29(8): 491–498, 2019.
- Vedantham S., Goldhaber S.Z., Julian J.A. — Pharmacomechanical catheter-directed thrombolysis for DVT (ATTRACT trial analyses and updates). Circulation, 141(8): 586–597, 2020.
- Dey S., et al. — Programmable one-pot synthesis of heparin oligosaccharides. Org Lett/PNAS-linked methods perspective, 2020.
- Ortel T.L., Neumann I., Ageno W. — American Society of Hematology 2020/2021 guidelines: VTE treatment and secondary prevention. Blood Adv, 5(4): 927–974, 2021.
- Kearon C., Akl E.A., Ornelas J. — CHEST guideline and expert panel report: Antithrombotic therapy for VTE disease (updates). Chest, 160(6): e545–e608, 2021.
- Van Mieghem N.M., Nathoe H.M., et al. — Anticoagulation in special populations (pregnancy, kidney disease, cancer). Eur Heart J Supplements, 24(Suppl A): A1–A12, 2022.
- Key N.S., Khorana A.A., Kuderer N.M. — Cancer-associated thrombosis: updated guidance on anticoagulation. J Thromb Haemost, 21(3): 571–589, 2023.
- Hogwood J., Gray E., Mulloy B. — Pharmacology of Heparin and Related Drugs: An Update. Pharmacol Rev, 75(3): 543–620, 2023.
- Ball C.M. — The history of heparin. R I Med J (historical overview), 2024.