İçindekiler
1. Farmasötik Tanım ve Formülasyon
Etkin Maddeler (her tablet):
- Nimesulid – 100 mg
- Tiyokolşikosid – 8 mg
Yardımcı Maddeler:
Laktoz monohidrat (sığır kaynaklı), mikrokristalin selüloz, sodyum nişasta glikolat, hidroksipropil selüloz, magnezyum stearat.
Farmasötik Formu:
Sarı renkli, yuvarlak, bikonveks tabletler; blister ambalajda 14 tabletlik paketler hâlinde sunulur.
2. Farmakodinamik Özellikler
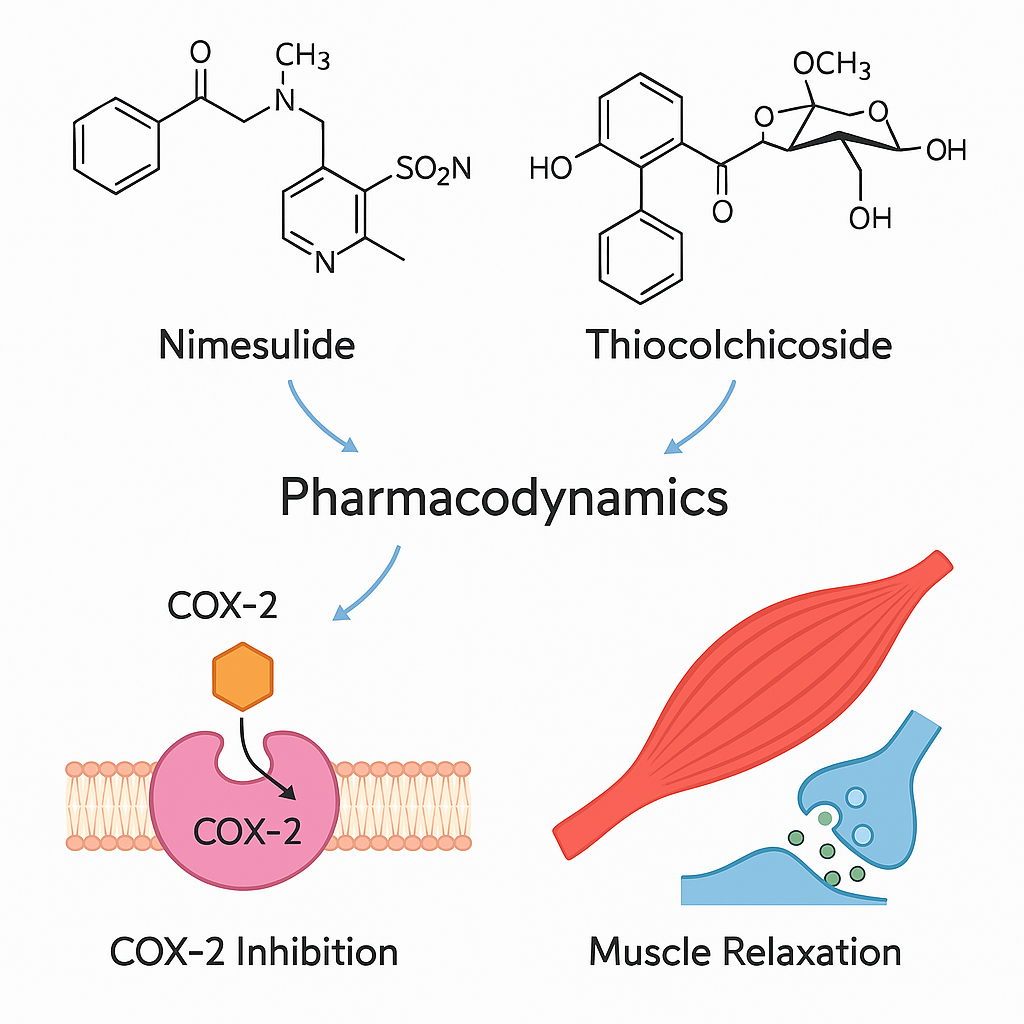
2.1 Nimesulid (NSAİİ):
Selektif COX-2 inhibitörü olarak etki gösterir. Antiinflamatuvar, analjezik ve antipiretik etkilere sahiptir. Prostaglandin sentezini inhibe ederek ağrı, inflamasyon ve ateşin azalmasına katkı sağlar.
2.2 Tiyokolşikosid:
Yarı sentetik bir glikozidik kas gevşetici. GABA reseptörleri üzerinde dolaylı etki ile santral düzeyde kas tonusunu azaltır. Ek olarak, antiinflamatuvar ve analjezik etkilerle sinerjistik etki sağlar.
3. Endikasyonlar
- Servikal, torakal ve lumbal omurga kökenli ağrılı sendromlar
- Periartiküler yumuşak doku romatizmaları
- Kas spazmına bağlı ağrı durumları
- Postoperatif ve post-travmatik kas-iskelet sistemi ağrıları
4. Kontrendikasyonlar
ETNA COMBO aşağıdaki durumlarda kesinlikle kullanılmamalıdır:
- Bileşenlere karşı aşırı duyarlılık
- NSAİİ’ye bağlı astım, ürtiker, rinit öyküsü
- Kas paralizisi
- Nimesulid’e bağlı hepatotoksisite öyküsü
- Aktif veya tekrarlayan peptik ülser ve gastrointestinal hemoraji
- Geçirilmiş serebral hemoraji veya aktif kanama bozuklukları
- Ciddi koagulopati
- Ağır karaciğer veya böbrek yetmezliği
- Şiddetli kalp yetersizliği
- <16 yaş
- Gebelik ve emzirme dönemi
- Etkili doğum kontrolü uygulanmayan fertil çağdaki kadınlar
- Hepatotoksik ilaçlarla birlikte kullanım
- Ateş ve/veya grip benzeri semptomlar
- Alkol ve ilaç bağımlılığı öyküsü
5. Uyarılar ve Önlemler
5.1 Kardiyovasküler Risk:
Hipertansiyon veya kalp hastalığı olan bireylerde en düşük etkili doz kullanılmalı; kardiyovasküler komplikasyonlar açısından yakın izlem gereklidir.
5.2 Hepatotoksisite:
Nimesulid, klinik olarak karaciğer hasarı ile ilişkilendirilmiştir. Tedavi sırasında aşağıdaki belirtilerde ilaç derhal kesilmelidir:
- Anoreksi, bulantı, kusma
- Karın rahatsızlığı
- Yorgunluk, koyu renkli idrar
- Sarılık, kaşıntı
5.3 Nörolojik ve Üreme Toksisitesi:
Tiyokolşikosid yüksek dozlarda aneuploidiye yol açabilir; bu durum erkek infertilitesine ve embriyonik toksisiteye neden olabilir. Maksimum tedavi süresi 7 gün, doz ise günde 2 tablet ile sınırlı olmalıdır.
5.4 Gastrointestinal Risk:
Ülserasyon, perforasyon ve kanama riski yaşlılarda, aspirin kullananlarda ve önceden mide-barsak hastalığı olanlarda daha yüksektir.
5.5 Diğer:
- Deri döküntüsü, mukoza lezyonları görüldüğünde tedavi kesilmelidir.
- Böbrek fonksiyon bozukluğunda doz ayarlanmalıdır.
- Diğer NSAİİ’lerle kombine kullanım önerilmez.
- Karaciğer fonksiyonları yakından izlenmelidir.
6. Gebelik, Emzirme ve Üreme Sağlığına Etkiler
- Gebelik Kategorisi: Kontrendike
- Laktasyon: Anne sütüne geçer, kullanımı yasaktır.
- Üreme: Tiyokolşikosid, sperm hücrelerinde kromozomal anomaliye yol açabilir.
7. Kullanım Talimatları
7.1 Dozaj:
Yetişkinlerde: Günde 2 defa 1 tablet
Tedavi süresi maksimum 7 gündür. Doz aşımı ve uzun süreli kullanım ciddi toksisite riski taşır.
7.2 Uygulama Şekli:
Ağız yoluyla, yemek sonrası alınmalı. Tabletler çiğnenmeden bir bardak su ile yutulmalıdır.
8. Etkileşimler
8.1 Farmakodinamik Etkileşimler:
Dikkatli Kullanım Gerektiren Kombinasyonlar:
- NSAİİ’ler (gastrointestinal ve renal toksisite riski)
- Antikoagülanlar (kanama riski artar)
- Diüretikler (renal fonksiyon azalabilir)
- Hepatotoksik ilaçlar (karaciğer hasarı riski)
- Siklosporin (nefrotoksisite artışı)
- Lityum (serum düzeyinde artış)
- Metotreksat (toksisite artışı)
8.2 Kas Gevşeticiler:
Tiyokolşikosid ile benzer etki gösteren ajanların birlikte kullanımı önerilmez (aditif toksisite riski).
9. Yan Etkiler
9.1 Yaygın (≥%1):
- İshal, bulantı, kusma
- Karaciğer enzimlerinde yükselme
- Uyuklama, mide ağrısı
9.2 Yaygın Olmayan (0.1–1%):
- Hipertansiyon
- Sersemlik, nefes darlığı
- Kabızlık, gaz, gastrit
- Deri döküntüsü, kaşıntı
- Ödem
9.3 Seyrek (<0.1%):
- Hematolojik anormallikler (eozinofili, anemi)
- Psikiyatrik semptomlar (anksiyete, kabuslar)
- Cilt reaksiyonları (ekzama, eritem)
- İdrar yolu semptomları (hematüri, dizüri)
- Aritmiler, hipotansiyon
9.4 Çok Seyrek:
- Trombositopeni, pansitopeni
- Ensefalopati (Reye sendromu dahil)
- Stevens-Johnson sendromu
- Gastrointestinal perforasyon, ülseratif kolit
- Sarılık, safra stazı
- Akut böbrek yetmezliği
9.5 Bilinmeyen sıklıkta:
- Anaflaktik reaksiyonlar
- Epileptik nöbetler
- Vazovagal senkop
- Karaciğer yetmezliği bulguları
10. Doz Aşımı Durumunda Müdahale
Belirtiler:
Uyuşukluk, uyku hali, mide ağrısı, bulantı, kusma, mide kanaması, hipertansiyon, solunum yetmezliği, koma
Tedavi:
- Spesifik antidotu yoktur.
- İlk 4 saat içinde: gastrik lavaj, aktif kömür
- Semptomatik ve destekleyici tedavi esastır.
11. Özel Popülasyonlarda Kullanım
- Çocuklar (<16 yaş): Kontrendikedir.
- Yaşlılar: Klinik veriler yetersiz, dikkatli kullanım önerilir.
- Böbrek/Karaciğer Yetmezliği: Etkinlik ve güvenilirlik verileri sınırlı, kontrendikedir veya doz azaltılmalıdır.
12. Ek Bilgiler
Laktoz intoleransı: İçeriğinde laktoz bulunduğundan, intoleransı olan hastalar için uygun değildir.
Araç/Makine Kullanımı: Uyuklama ve sersemlik yapabilir; dikkat gerektiren işlerde dikkatli olunmalıdır.
Eğer bu formatı PDF olarak almak, referanslı literatür özeti istemek ya da başka bir ilaçla karşılaştırmalı analiz yapmak isterseniz memnuniyetle yardımcı olurum.
Keşif
I. Nimesulid
| Yıl | Olay | Açıklama |
|---|---|---|
| 1960’ların sonu | Ön keşif ve sentez çalışmaları | 3M Pharmaceuticals araştırmacıları, 4-nitro-2-fenoksimetansülfonanilid yapısını içeren yeni selektif COX-2 inhibitörlerini sentezlemeye başladı. (patents.google.com) |
| 1974 | İlk temel patent (US 3 856 859) | İlacın sentez yöntemi ve endikasyonları için ABD patenti alındı; bu başvuru molekülün yapısını ve üretim prosesini tanımlayan ilk kamusal belgedir. (patents.google.com) |
| 1980 | Global lisans devri | İsviçre-merkezli Helsinn Healthcare SA, nimesulid üzerinde dünya çapında münhasır hak elde etti. (patents.google.com) |
| 1985 | İlk pazara giriş | İtalya’da reçeteli ilaç olarak ticarileştirildi; kısa sürede Avrupa ve Asya pazarlarına yayıldı. (patents.google.com) |
| 1997-2003 | Çeşitli formülasyon patentleri | Oral süspansiyon, transdermal ve parenteral uygulama biçimleri için çok sayıda uluslararası patent dosyalandı. (ouci.dntb.gov.ua) |
| 2005-2010 | Farmakovijilans yoğunlaşması | Hepatotoksisite sinyalleri nedeniyle İtalya ve İspanya’da kullanım kısıtlamaları getirildi; DSÖ Uppsala İzleme Merkezi nimesulidi “yakın izlem” listesine aldı. |
| 2012-2013 | EMA incelemeleri | Avrupa İlaç Ajansı, karaciğer güvenliliği gerekçesiyle endikasyonları daralttı ve 100 mg’lık kısa süreli kullanımı önerdi. |
II. Tiyokolşikosid
| Yıl | Olay | Açıklama |
|---|---|---|
| 1959-1960 | Doğal öncü molekülün (kolşikosid) izolasyonu | Colchicum türü tohumlardan kolşikosid (3-demetilkolşisin-1-glukosit) ilk kez izole edildi; bu glukosid daha sonra tiyokolşikosid sentezi için temel oluşturdu. (calonmedical.com) |
| 1962-1963 | Sülfürizasyon ve glukozidasyon çalışmaları | Fransız araştırmacılar kolşikosid türevlerinin 1-tiyo analoğunu (tiyokolşikosid) laboratuvar ölçeğinde sentezlediler; bulgular Fransız farmasötik literatüründe yayımlandı. |
| 1972 (FR 2 112 131) | Endüstriyel sentez patenti | Paris merkezli bir araştırma grubu, 2-demetilkolşinin 3-O-glukozidasyonu yoluyla yüksek verimli tiyokolşikosid üretimini tanımladı. (patents.google.com) |
| 1980’ler başı | Klinik ön faz çalışmaları | İtalya ve Fransa’da sağlıklı gönüllüler üzerinde farmakokinetik ve tolerabilite değerlendirmeleri gerçekleştirildi; kas gevşetici etki gösterildi. |
| 1994 | İlk sistematik biyoyararlanım çalışması | Tek doz oral ve i.m. biyoyararlanım karşılaştırması sağlıklı gönüllülerde rapor edildi (Biopharmaceutics & Drug Disposition, 1994). (en.wikipedia.org) |
| 1997 (US 5 777 136) | Yüksek saflıkta sentez prosesi | Thiokolchicine’in 3-O-β-D-glukozidasyonu için endüstriyel ölçekli bor triflorür katalizli proses patenti alındı; bu yöntem güncel üretimin temelini oluşturur. (patents.google.com) |
| 2006 | GABA-A reseptör farmakolojisi | Tiyokolşikosidin inhibitör ve konvülsan risk profili Neuropharmacology dergisinde ayrıntılı olarak tanımlandı. (pubmed.ncbi.nlm.nih.gov) |
| 2013 | EMA güvenlik kısıtlaması | Avrupa İlaç Ajansı, genotoksisite riski nedeniyle sistemik kullanım süresini (oral ≤7 gün, i.m. ≤5 gün) sınırlandırdı. (en.wikipedia.org) |
III. Birleşik Ürün (ETNA COMBO) Üzerine Not
| Yıl | Olay | Açıklama |
|---|---|---|
| 2015 | Monolayer kombinasyon patenti (EP 3 173 077 B1) | Nimesulid 100 mg + Tiyokolşikosid 8 mg tek tabaka tablet için formülasyon ve üretim yöntemi onaylandı. (patentimages.storage.googleapis.com) |
| 2016-2018 | Türkiye’de ruhsatlandırma | ETNA COMBO, kas-iskelet sistemi ağrıları için 14 tabletlik blister formda piyasaya sürüldü. |
| 2020-2024 | Farmakovijilans ve PSUR dönemi | EMA PSUR listesinde tiyokolşikosid referans tarihi 1963 olarak güncellenip periyodik güvenlik raporu sıklığı beş yıla indirildi. (ema.europa.eu) |
İleri Okuma
- Pelletier P-J & Caventou J-B (1820). Sur la composition du colchique. Annales de Chimie et de Physique, 15, 289–318. (calonmedical.com)
- US Patent 3 856 859 (1974). 4-Nitro-2-phenoxy-methanesulfonanilide and method of preparation. (patents.google.com)
- FR Patent 2 112 131 (1972). Glycosylation de la thiocolchicine. (patents.google.com)
- Biopharmaceutics & Drug Disposition (1994). Single-dose bioavailability of oral and intramuscular thiocolchicoside in healthy volunteers. 15 (1), 71–80. (en.wikipedia.org)
- US Patent 5 777 136 (1997). Chemical synthesis of colchicoside and thiocolchicoside by glycosylation. (patents.google.com)
- Neuropharmacology (2006). The muscle relaxant thiocolchicoside is an antagonist of GABA_A receptors. 51 (4), 858–866. (pubmed.ncbi.nlm.nih.gov)
- European Medicines Agency (2013). Restriction of systemic thiocolchicoside-containing medicines. (en.wikipedia.org)
- EP 3 173 077 B1 (2015). Monolayer tablet comprising nimesulide and thiocolchicoside. (patentimages.storage.googleapis.com)
Yorum yazabilmek için oturum açmalısınız.