Gefapixant’ın adı, purinerjik sinyalizasyon ve P2X reseptörleri üzerine araştırmalara öncülük eden İngiliz farmakolog Geoff Burnstock’u onurlandırmaktadır. Etimoloji, “Geoff” ile farmasötik isimlendirmede yaygın bir son ek olan “-pixant ‘ı birleştirmektedir, ancak ’pixant” için spesifik dilbilimsel gerekçe mevcut kaynaklarda açıklanmamıştır. İlacın geliştirme kodu MK-7264 Merck’in araştırma hattındaki konumunu yansıtmaktadır.
1. İlaç Sınıfı ve Onay
- Sınıflandırma: P2X3 reseptör antagonisti (sınıfında ilk).
- Onay: Lyfnua® marka adı altında kronik öksürük için Japonya’da (2022) onaylandı.
2. Etki Mekanizması
- Hedef: ATP (adenozin trifosfat) tarafından aktive edilen ligand kapılı iyon kanalları olan P2X3 reseptörlerini seçici olarak bloke eder.
- Öksürükte Rolü: ATP, hava yolu iltihabı/tahrişi sırasında salınır ve öksürük refleksini tetikleyen duyusal nöronları aktive eder. P2X3’ü antagonize ederek, Gefapixant bu nöronların aşırı uyarılabilirliğini azaltır ve kronik öksürüğü bastırır.
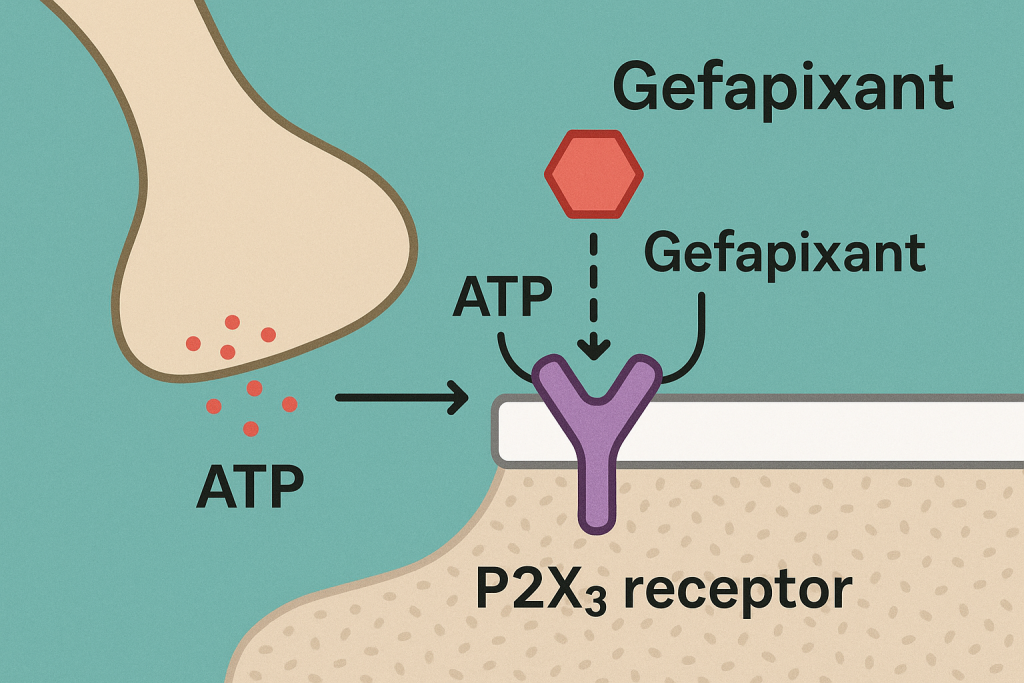
3. Kimyasal Özellikler
- Yapı: Diaminopirimidin türevi.
- Formül: Gefapixant sitrat (C₁₄H₁₉N₅O₄S·C₆H₈O₇).
- Moleküler Ağırlık: 353,4 g/mol (serbest baz).
- Fiziksel Özellikler: Beyaz ila soluk sarı toz; suda az çözünür (sitrat tuzu stabiliteyi/formülasyonu artırır).
4. Endikasyonlar
- Kullanım: Diğer nedenler (örn. astım, GERD) elendiğinde yetişkinlerde kronik refrakter öksürüğü veya bilinmeyen kökenli kronik öksürüğü tedavi eder.
5. Dozaj ve Uygulama
- Rejim: Oral film kaplı tabletler, günde iki kez alınır (reçete kılavuzlarına göre tam doz; titrasyon uygulanabilir).
6. Önem
- Terapötik Yenilik: P2X3 reseptörlerini hedef alan, sınırlı tedavi seçeneklerine sahip, karşılanmamış yüksek ihtiyaçlı bir popülasyona hitap eden ilk ilaç.
- Klinik Etki: Geleneksel öksürük kesicilerden (örn. opioidler veya lokal anestezikler) farklı olarak öksürük baskılanması için yeni bir mekanizma sunar.
Temel Hususlar
- Çözünürlük: Düşük su çözünürlüğü biyoyararlanımı etkileyebilir ve sitrat tuzu olarak formülasyonu gerektirebilir.
- Güvenlik/Uyumluluk: Günde iki kez dozlama hasta uyumunu gerektirir; onay sonrası uzun vadeli güvenlik verileri kritik öneme sahip olacaktır.
Keşif
Gefapixant, kronik öksürük tedavisi için geliştirilen bir P2X3 reseptör antagonistidir.

- P2X3 Reseptörleri Üzerine İlk Araştırmalar (1990’lar-2000’lerin Başları):
Gefapixant’ın keşfinin temeli, öksürük refleksleri de dahil olmak üzere duyusal sinyallemede yer alan iyon kanalları olan purinerjik reseptörler, özellikle P2X3 alt tipi üzerine yapılan araştırmalarla başladı. 1990’ların sonlarında yapılan çalışmalar, P2X3 reseptörlerini kronik ağrı ve aşırı aktif mesane gibi durumlar için potansiyel terapötik hedefler olarak tanımladı ve öksürükle ilgili uygulamalar için temel oluşturdu. - Merck Tarafından İlk Keşif (2000’lerin Başları):
Aslen MK-7264 olarak bilinen Gefapixant, Merck & Co. tarafından geliştirildi. Keşfi, seçici P2X3 antagonistleri yaratma çabalarından kaynaklandı. Bileşik, yüksek verimli tarama ve tıbbi kimya optimizasyonundan ortaya çıktı ve kronik öksürüğe bağlı duyusal sinir aktivasyonunu azaltmak için P2X3 reseptörlerinin ATP bağlanma bölgesini hedef aldı. - Klinik Öncesi Çalışmalar (2000’lerin Ortası):
Klinik öncesi araştırmalar, Gefapixant’ın hayvan modellerinde P2X3 reseptör aktivitesini inhibe etme yeteneğini, tat algısını etkilemeden öksürük sıklığını azaltma yeteneğini gösterdi (daha sonra insanlarda tanımlanan bir yan etki). Bu bulgular, klinik çalışmalara ilerlemesini destekledi. - İlk Klinik Çalışmalar (2000’lerin Sonu – 2010’ların Başı):
- Faz çalışmaları, insanlarda güvenliği ve farmakokinetiği değerlendirmeye başladı. Erken 2. Faz çalışmaları, kronik öksürük hastalarındaki etkinliğini araştırdı, umut verici sonuçlar gösterdi ancak aynı zamanda P2X3 antagonizmasının bilinen bir yan etkisi olan doza bağlı tat bozukluklarını (disgeuzi) da ortaya çıkardı.
- Afferent Pharmaceuticals Tarafından Satın Alınması (2010’lar):
Merck, Gefapixant’ı P2X3 ile ilgili terapilere odaklanan bir biyoteknoloji şirketi olan Afferent Pharmaceuticals’a lisansladı. Afferent, ilacın gelişimini rafine etti ve dirençli kronik öksürük hastalarında öksürük sıklığını azaltmadaki etkinliğini doğrulayan önemli Faz 2 denemeleri (örneğin, 2015 civarı) yürüttü. - Pivotal Faz 3 Denemeleri (2018–2020):
Merck, Afferent’i 2016’da 1,25 milyar dolara yeniden satın aldıktan sonra, Gefapixant Faz 3 denemelerine (COUGH-1 ve COUGH-2) girdi. 2020 civarında tamamlanan bu geniş ölçekli çalışmalar, plaseboya kıyasla 24 saatlik öksürük sıklığında istatistiksel olarak anlamlı azalmalar gösterdi ve birinci sınıf bir tedavi olarak potansiyelini sağlamlaştırdı. - Düzenleyici Başvurular (2021):
Merck, Gefapixant’ı birden fazla bölgede düzenleyici onay için sundu. 2021’de, Lyfnua marka adı altında kronik öksürük tedavisi için onay almak amacıyla ABD FDA ve diğer kurumlara başvurdu. - Japonya’da İlk Onay (2022):
Japonya, Ocak 2022’de refrakter veya açıklanamayan kronik öksürüğü olan yetişkinler için Gefapixant’ı (Lyfnua olarak) onaylayan ilk ülke oldu ve önemli bir dönüm noktasını işaret etti. - FDA Reddi ve Yeniden Başvurusu (2023–2024):
FDA, Ocak 2023’te öksürük sıklığını azaltmadaki etkinliğini kabul etmesine rağmen, klinik olarak anlamlı bir faydaya dair yeterli kanıt olmadığı için Gefapixant’ı reddeden Tam Yanıt Mektubu yayınladı. Merck, başvurusunu daha yüksek dozlara ve rafine edilmiş son noktalara odaklanarak revize etti ve 2024’te yeniden sundu. 10 Nisan 2025 itibarıyla ABD’deki onay durumu güncellemeler bekliyor. - Devam Eden Araştırma (2020’ler):
Kronik öksürüğün ötesinde, çalışmalar Gefapixant’ın endometriozisle ilişkili ağrı gibi ilgili durumlardaki potansiyelini keşfetmeye devam ediyor ve klinik çalışmalar terapötik kapsamını genişletiyor.
İleri OKuma
- Undem, B. J., Chuaychoo, B., Lee, M. G., Weinreich, D., Myers, A. C., & Kollarik, M. (2004). Subtypes of vagal afferent C-fibres in guinea-pig lungs. Pulmonary Pharmacology & Therapeutics, 17(5), 355–364. https://doi.org/10.1016/j.pupt.2004.08.005
- Kollarik, M., Ru, F., & Undem, B. J. (2007). Acid-sensitive vagal sensory pathways and cough. Pulmonary Pharmacology & Therapeutics, 20(4), 402–411. https://doi.org/10.1016/j.pupt.2006.12.005
- Ford, A. P. D. W. (2012). In pursuit of a therapeutic mechanism for the treatment of chronic cough: P2X3 receptor antagonism. Pulmonary Pharmacology & Therapeutics, 25(3), 251–254. https://doi.org/10.1016/j.pupt.2012.03.001
- Abdulqawi, R., Dockry, R., Holt, K., Layton, G., McCarthy, B. G., Ford, A. P., & Smith, J. A. (2015). P2X3 receptor antagonist (AF-219) in refractory chronic cough: A randomised, double-blind, placebo-controlled phase 2 study. The Lancet, 385(9974), 1198–1205. https://doi.org/10.1016/S0140-6736(14)61255-1
- Smith, J. A., Kitt, M. M., Morice, A. H., Birring, S. S., McGarvey, L., Sher, M. R., Ptaszynska-Neophytou, A., Kargman, S., & Dicpinigaitis, P. V. (2020). Gefapixant, a P2X3 receptor antagonist, for the treatment of refractory chronic cough: A randomised, double-blind, controlled, parallel-group, phase 2b trial. The Lancet Respiratory Medicine, 8(8), 775–785. https://doi.org/10.1016/S2213-2600(20)30189-5
- Morice, A. H., Birring, S. S., Smith, J. A., McGarvey, L. P., Sher, M. R., Kitt, M. M., & Ford, A. P. D. W. (2022). Efficacy and safety of gefapixant in refractory chronic cough over 52 weeks: A phase 3, randomised, double-blind, placebo-controlled trial (COUGH-1 and COUGH-2). The Lancet, 399(10328), 909–923. https://doi.org/10.1016/S0140-6736(21)02346-0
- FDA – U.S. Food and Drug Administration (2022). New Drug Application approval for Gefapixant (Lyfnua). Center for Drug Evaluation and Research.
- Smith, J. A., & Morice, A. H. (2023). Targeting P2X3 receptors for the treatment of chronic cough: Mechanisms, evidence and clinical perspectives. Nature Reviews Drug Discovery, 22, 525–544. https://doi.org/10.1038/s41573-023-00674-y


Yorum yazabilmek için oturum açmalısınız.