İçindekiler
1. Tanım ve Genel Özellikler
Hidromorfon, opioid analjezikler sınıfına ait yarı sentetik bir morfin türevidir. Moleküler formülü C₁₇H₁₉NO₃ ve moleküler ağırlığı 285.3 g/mol’dür. Morfinden türetilmiş bu bileşik, kimyasal olarak morfinin 6-hidroksi grubunun keton (oxo) grubuna oksidasyonu ve çift bağların hidrojene edilmesiyle elde edilir. Farmasötik olarak hidromorfon hidroklorür tuzu şeklinde kullanılır; bu form suda kolayca çözünebilen, beyaz, kristalimsi bir tozdur.
Hidromorfon, İsviçre’de 1996 yılından bu yana onaylıdır ve ticari isimler arasında Palladon®, Jurnista®, Hydromorphoni HCl Streuli® ve Hydal® yer almaktadır.
2. Farmasötik Formlar
Hidromorfon, aşağıdaki farmasötik formlarda mevcuttur:
- Sürekli salımlı tabletler
- Sürekli salımlı kapsüller ve klasik kapsüller
- Enjeksiyon çözeltisi (intravenöz, subkutan veya intramüsküler uygulama için)
- İnfüzyon çözeltisi
- Oral damlalar (özellikle titrasyon veya pediatrik/geriatrik hastalar için)
Geciktirilmiş salım formları genellikle günde bir veya iki kez, klasik (anında salım) formlar ise daha sık alınmaktadır.
3. Etki Mekanizması
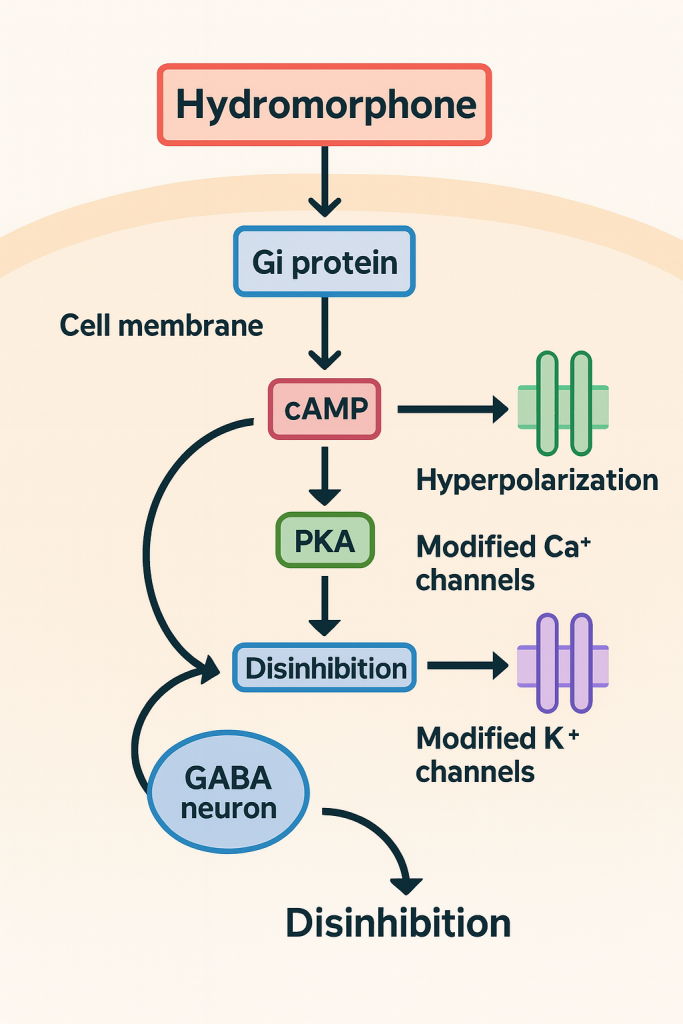
Hidromorfon, µ-opioid reseptörlerine (MOR) yüksek afiniteli bir agonist olarak bağlanır. Bu bağlanma sonucunda aşağıdaki farmakodinamik etkiler ortaya çıkar:
- Analjezik etki: Santral sinir sisteminde ağrı iletiminin inhibisyonu
- Sedatif etki: Bilinç düzeyinde azalma ve sakinleştirici etki
- Anksiyolitik etki: Kaygı düzeyinde azalma
- Antitüsif etki: Medulladaki öksürük merkezinin inhibisyonu
Hidromorfon, morfine kıyasla yaklaşık 5 kat daha potent olup, buna karşın etki süresi daha kısadır. Saf bir agonisttir; antagonist etkisi yoktur ve tavan etkisi göstermeden doz bağımlı etki sunar.
4. Farmakokinetik Özellikler
- Absorpsiyon: Oral biyoyararlanımı yüksektir, ancak bireyler arası değişkenlik gösterebilir.
- Dağılım: Vücut dokularına hızlı dağılım gösterir; plazma proteinlerine bağlanma oranı orta düzeydedir.
- Metabolizma: Başlıca glukuronidasyon yoluyla karaciğerde metabolize edilir (hidromorfon-3-glukuronid oluşur). CYP450 izoenzimleriyle anlamlı bir etkileşimi yoktur.
- Eliminasyon: Renal yolla atılır. Yarı ömrü yaklaşık 2-3 saat, kontrollü salım formlarında 10-15 saat civarındadır.
5. Endikasyonlar
Hidromorfon, orta ila şiddetli düzeyde akut ve kronik ağrıların tedavisinde endikedir. Klinik kullanımı şu durumları kapsar:
- Onkolojik ağrılar (örn. tümör ağrısı)
- Postoperatif ağrı
- Travmatik ağrılar
- Ortopedik hastalıklarla ilişkili ağrılar
- Nöropatik ağrılar
- Terminal dönemde palyatif analjezi
- Ayrıca, güçlü bir antitüsif olarak da kullanılabilir, ancak bu endikasyon için Almanya gibi ülkelerde kodein ve dihidrokodein daha yaygındır.
6. Dozaj ve Uygulama
Hidromorfon dozu, hastanın ağrı düzeyi, opioid toleransı, yaş, renal/hepatik fonksiyonları gibi bireysel faktörlere göre kişiselleştirilerek ayarlanır.
- Geciktirilmiş salım formları: Genellikle günde 1-2 kez alınır (örneğin, Jurnista® yalnızca günde bir kez uygulanır).
- Anında salım formları: Daha sık aralıklarla (örneğin her 4-6 saatte bir) alınabilir.
- Parenteral uygulama: Akut durumlar ve yoğun bakım hastalarında kullanılır.
7. Yan Etkiler
Hidromorfon kullanımında sık rastlanan advers etkiler şunlardır:
- Gastrointestinal: Kabızlık, bulantı, kusma, karın ağrısı, ağız kuruluğu, iştahsızlık
- Santral sinir sistemi: Baş dönmesi, uyuşukluk, sedasyon, konfüzyon, uykusuzluk, anksiyete
- Cilt: Kaşıntı, terleme
- Ürogenital: Üriner retansiyon
- Kardiyovasküler: Hipotansiyon
- Bağımlılık potansiyeli: Uzun süreli kullanımlarda tolerans, bağımlılık ve yoksunluk semptomları gelişebilir.
8. Kontrendikasyonlar
Hidromorfon aşağıdaki durumlarda kontrendikedir:
- Etkin maddeye veya formülasyondaki herhangi bir yardımcı maddeye karşı alerji
- Solunum depresyonu
- Şiddetli bronşiyal obstrüksiyon (örneğin şiddetli astım veya KOAH)
- Paralitik ileus
- Akut alkol entoksikasyonu
9. İlaç Etkileşimleri
Hidromorfon, sedatif etkili diğer ajanlarla birlikte kullanıldığında merkezi sinir sistemi depresyonu riskini artırabilir. Etkileşim potansiyeli taşıyan başlıca gruplar:
- Benzodiazepinler (örn. diazepam, lorazepam)
- Barbitüratlar
- Fenotiyazinler (örn. prometazin)
- Trisiklik antidepresanlar (örn. amitriptilin)
- Sedatif antihistaminikler (örn. difenhidramin)
- Kas gevşeticiler
- Anestezik ajanlar
- Etanol (alkol): Etkileri sinerjistik olarak artabilir; ciddi solunum depresyonu ve koma riski oluşabilir.
10. Kötüye Kullanım Riski
Hidromorfon, özellikle enjeksiyon formları yoluyla euforik etkiler arayan kişiler tarafından kötüye kullanılabilir. Bu nedenle, bağımlılık riski yüksek olan hastalarda dikkatli izlem önerilir. Kontrollü salım formları (örneğin Jurnista®) bu riski azaltmak üzere tasarlanmıştır.
Keşif
1924 – İlk Sentez
- Hidromorfon ilk kez 1924 yılında Almanya’da Knoll AG (daha sonra BASF’ye katılmıştır) bünyesindeki kimyagerler tarafından morfinin hidrojenasyon ve oksidasyonu yoluyla yarı sentetik olarak sentezlendi.
- Bu süreçte, morfinin 6-hidroksi grubunun ketona (oxo) çevrilmesi ve 7,8-çift bağın hidrojene edilmesiyle dihidromorfinon (hidromorfon) elde edildi.
1926 – Dilaudid® Markasıyla Ticari Tanıtım
- Knoll tarafından Dilaudid® markasıyla pazara sunuldu.
- “Dilaudid” ismi, “di-hydro-morphinone” kelimesinden türetilmiştir.
- İlk kullanım alanı: şiddetli akut ağrılar, doğum sonrası ağrılar, ameliyat sonrası analjezi.
Klinik ve Farmakolojik Gelişmeler
1930’lar – ABD’ye İhracat ve Klinik Popülarite
- Dilaudid, ABD pazarına girdi.
- Özellikle morfinin neden olduğu bulantı, kusma, histamin salınımı ve kaşıntı gibi advers etkilerin daha az gözlenmesi nedeniyle klinik olarak avantajlı bulundu.
1950’ler – Oral Formların Geliştirilmesi
- Parenteral formlar dışında oral tablet ve damla formları geliştirildi.
- Özellikle kanser ağrısı ve kronik ağrılar için uzun süreli kullanıma olanak sağladı.
Modern Dönemde Farmasötik Gelişimler
1990’lar – Sürekli Salımlı Formülasyonlar
- 1996: Hidromorfon, İsviçre’de Jurnista® adıyla sürekli salımlı form olarak onaylandı.
- Bu formülasyon sayesinde günde bir defalık doz yeterli oldu, hasta uyumu arttı.
2000’ler – Genetik ve Biyobelirteç Araştırmaları
- CYP450 enzimleriyle anlamlı bir etkileşimin olmaması ve esas olarak glukuronidasyon yoluyla metabolize edilmesi, onu genetik varyasyonlardan daha az etkilenen bir opioid haline getirdi.
- Bu özellik, polimorfizme bağlı bireysel yanıt farklılıklarının daha az olduğu anlamına gelir.
2006 – Palladon® Retard Formülasyonu
- Mundipharma tarafından geliştirilen Palladon® retard, 12 saatlik uzun etkili formuyla, özellikle kanser hastaları için önemli bir tedavi seçeneği oldu.
Kötüye Kullanım ve Yasal Düzenlemeler
2000–2010 – ABD’de Opioid Krizi ve Sınırlamalar
- Hidromorfon, abuse potential (kötüye kullanım potansiyeli) yüksek bir madde olarak kontrollü maddeler listesine alındı.
- Bu dönemde hem oral hem de IV formları euforik etkiler için kötüye kullanıldı.
- Kontrollü salım formlarına tamper-resistant (kurcalamaya dayanıklı) teknoloji eklendi.
Günümüzdeki Kullanımı ve Klinik Değeri
- Hidromorfon, günümüzde halen morfin intoleransı olan hastalarda, böbrek yetmezliğinde (morfinin toksik metabolitleri biriktiği için tercih edilir) ve yüksek potent analjezik ihtiyacı olan kanser hastalarında kullanılmaktadır.
- Jurnista®, Palladon®, Dilaudid®, Hydal® gibi ticari isimlerle piyasada mevcuttur.
İleri Okuma
- Fraser, H. F., & Isbell, H. (1935). Comparative addiction liability of morphine, hydromorphone, and codeine. Public Health Reports, 50(38), 1179–1190.
- Eddy, N. B., & Halbach, H. (1950). Synthetic substances with morphine-like effect: Clinical use and abuse. Bulletin of the World Health Organization, 2(1–2), 1–22.
- Knaus, E. E., et al. (1996). Hydromorphone: Clinical pharmacokinetics and metabolism. Clinical Pharmacokinetics, 31(6), 351–372.
- Christrup, L. L. (1997). Morphine metabolites. Acta Anaesthesiologica Scandinavica, 41(1 Pt 2), 116–122.
- Smith, M. T. (2000). Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clinical and Experimental Pharmacology and Physiology, 27(7), 524–528.
- Mercadante, S. (2002). Pharmacological strategies in opioid conversion. Supportive Care in Cancer, 10(5), 369–374.
- Leppert, W. (2009). Pain management in patients with cancer: focus on opioid analgesics. Current Pain and Headache Reports, 13(5), 293–301.
- Atkinson, T. J., et al. (2014). Opioid conversion: A critical review of hydromorphone and long-acting formulations. Journal of Pain & Palliative Care Pharmacotherapy, 28(3), 223–234.
- Mercadante, S., & Bruera, E. (2016). Opioid switching in cancer pain: From the beginning to nowadays. Critical Reviews in Oncology/Hematology, 99, 241–248.
- Nocon, A., & Weber, M. (2022). Hydromorphone: Pharmacokinetics, safety, and efficacy in pain management. Drugs, 82(5), 521–534.


Yorum yazabilmek için oturum açmalısınız.