Etimoloji
İnfliximab adı, Uluslararası Mülkiyetsiz İsimler (INN) sistemi tarafından tanımlanan monoklonal antikorlar (mAb’ler) için kullanılan standartlaştırılmış adlandırmayı takip eder:
- İnflix-: İlacın otoimmün hastalıklarda iltihabı azaltma birincil terapötik hedefini yansıtan “iltihaplanma”dan türetilmiştir.
- -xi-: Monoklonal antikorun kimer olduğunu, yani hem insan hem de fare (fare) protein bileşenlerini içerdiğini belirtir.
- -mab: Bir tür biyolojik terapötik olan “monoklonal antikor” anlamına gelen bir ek.
Bu nedenle, “infliximab” adı, iltihapla mücadele etmek için tasarlanmış kimer monoklonal antikor olarak yorumlanabilir.
Marka adı Remicade muhtemelen ilacın amaçlanan etkileri ve pazar çekiciliği ile olan ilişkisi nedeniyle seçilmiştir:
- Remi-: Muhtemelen “remisyon” kelimesinden türetilmiştir ve ilacın Crohn hastalığı ve romatoid artrit gibi hastalıklarda remisyonu başlatma ve sürdürme yeteneğini vurgulamaktadır.
- -cade: Muhtemelen bir bariyer veya kaskad’a işaret eder ve ilacın TNF-α tarafından başlatılan inflamatuar kaskadı engelleme veya durdurma rolünü sembolize eder.
Genel olarak, “Remicade” remisyon sağlayan ve inflamasyona karşı bir bariyer görevi gören bir ürünü ima eder.
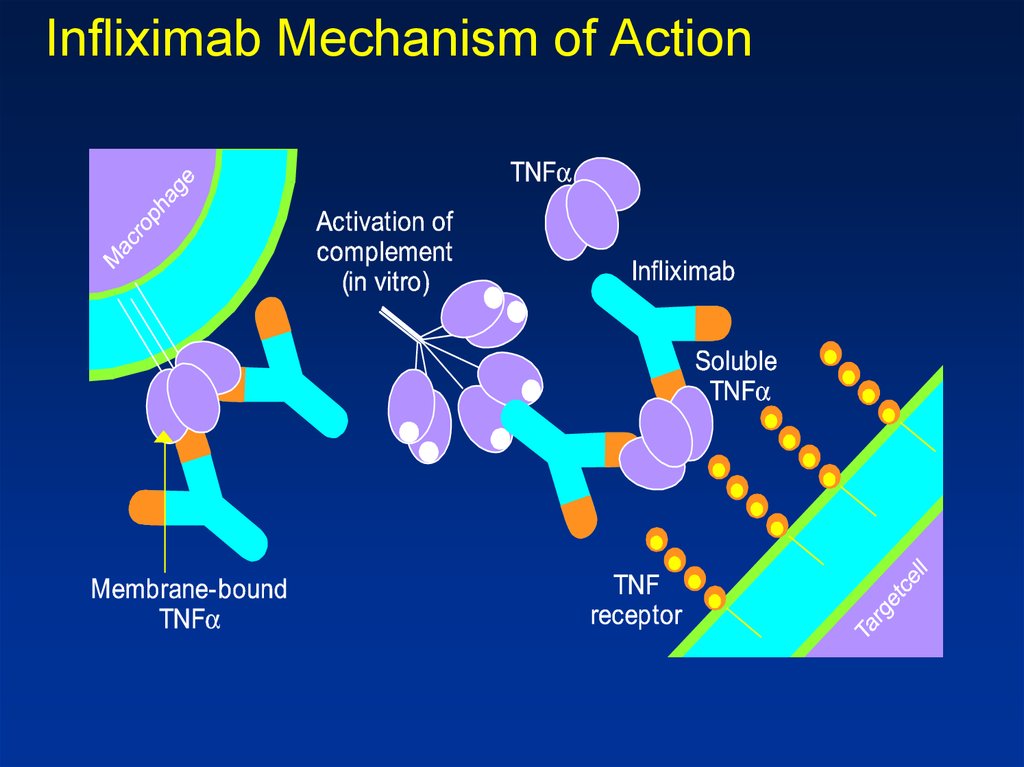
Diğerlerinin yanı sıra Remicade® ticari adı altında pazarlanan infliximab, çeşitli otoimmün hastalıklarda rol oynayan proinflamatuar bir sitokin olan tümör nekroz faktörü-alfa’yı (TNF-α) hedef alan bir kimerik monoklonal antikor. TNF-α’ya bağlanarak infliximab, TNF reseptörleriyle etkileşimini inhibe eder ve böylece inflamatuar yanıtları hafifletir. Bu mekanizma infliximab’ı seçici bir immünosüpresif ve antiinflamatuar ajan olarak sınıflandırır.
İçindekiler
Farmakolojik Özellikler
Infliximab, yaklaşık 149,1 kDa moleküler kütleye sahip, insan sabit ve fare değişken bölgelerinden oluşan bir kimerik IgG1κ monoklonal antikorudur. Bir fare hücre hattında rekombinant DNA teknolojisi ile üretilir. Antikor, TNF-α’nın hem çözünür hem de transmembran formlarına yüksek afiniteli bağlanma sergileyerek aktivitelerini nötralize eder. Farmakokinetik çalışmalar, infliximab’ın yaklaşık 8 ila 9 günlük uzun bir yarı ömre sahip olduğunu ve aralıklı dozlama programlarına izin verdiğini göstermektedir.
Klinik Endikasyonlar
Infliximab, aşağıdakiler de dahil olmak üzere çeşitli otoimmün durumların tedavisi için onaylanmıştır:
- Romatoid Artrit: Orta ila şiddetli derecede aktif hastalığı olan yetişkin hastalarda belirti ve semptomları azaltmak ve yapısal hasarın ilerlemesini engellemek için metotreksat ile birlikte kullanılır.
- Crohn Hastalığı: Konvansiyonel tedaviye yetersiz yanıt veren orta ila şiddetli derecede aktif hastalığı olan yetişkin ve pediatrik hastalarda (6 yaş ve üzeri) belirti ve semptomları azaltmak ve klinik remisyonu başlatmak ve sürdürmek için endikedir.
- Ülseratif Kolit: Konvansiyonel tedaviye yetersiz yanıt veren orta ila şiddetli derecede aktif hastalığı olan yetişkin ve pediatrik hastalarda (6 yaş ve üzeri) klinik remisyonu başlatmak ve sürdürmek için onaylanmıştır.
- Ankilozan Spondilit: Aktif hastalığı olan hastalarda belirti ve semptomları azaltmak için kullanılır.
- Psoriatik Artrit: Aktif artritin belirti ve semptomlarını azaltmak ve yapısal hasarın ilerlemesini engellemek için kullanılır.
- Plak Psoriazis: Sistemik tedavi adayı olan kronik şiddetli (yani yaygın ve/veya sakatlayıcı) plak psoriazisi olan yetişkin hastaların tedavisinde endikedir.
Uygulama ve Dozaj
Infliximab intravenöz infüzyon yoluyla uygulanır. Spesifik dozaj ve infüzyon programı endikasyona ve hasta yanıtına bağlıdır. Tipik olarak, ilk yükleme rejimini düzenli aralıklarla bakım infüzyonları izler. Örneğin, romatoid artritte, ilk doz uygulanır, ardından 2. ve 6. haftalarda ek dozlar ve ardından her 8 haftada bir uygulanır. İnfüzyonla ilişkili reaksiyonları en aza indirmek için antihistaminikler, asetaminofen ve/veya kortikosteroidlerle ön ilaçlama düşünülebilir.
Kontrendikasyonlar
Infliximab şu hastalarda kontrendikedir:
- İnfliximab’a veya fare proteinleri dahil bileşenlerinden herhangi birine karşı daha önce şiddetli aşırı duyarlılık reaksiyonları.
- Orta ila şiddetli kalp yetmezliği (New York Kalp Derneği [NYHA] sınıf III/IV).
- Aktif tüberküloz veya sepsis, apseler ve fırsatçı enfeksiyonlar gibi diğer ciddi enfeksiyonlar.
Uyarılar ve Önlemler
- Ciddi Enfeksiyonlar: İnfliximab alan hastalarda hastaneye yatışa veya ölüme yol açabilecek ciddi enfeksiyonlar geliştirme riski artmıştır. Bunlara bakteriyel, mikobakteriyel, invaziv fungal, viral ve diğer fırsatçı enfeksiyonlar dahildir. Tedaviye başlamadan önce hastalar aktif veya latent tüberküloz enfeksiyonu açısından değerlendirilmelidir. Tedavi sırasında ve sonrasında enfeksiyon belirtileri ve semptomlarının izlenmesi esastır.
- Kötü huylu tümörler: İnfliximab dahil TNF blokerleri ile tedavi edilen çocuk ve ergen hastalarda lenfomalar ve bazıları ölümcül olan diğer kötü huylu tümörler bildirilmiştir. Özellikle kötü huylu tümör öyküsü olan veya tedavi sırasında kötü huylu tümör geliştiren hastalarda tedaviye başlandığında kötü huylu tümör riski göz önünde bulundurulmalıdır.
- Hepatit B Virüsü Reaktivasyonu: Hepatit B virüsünün (HBV) kronik taşıyıcısı olan ve TNF blokerleri alan hastalarda reaktivasyon meydana gelmiştir. Bazı vakalar ölümcül olmuştur. Hastalar tedaviye başlamadan önce HBV enfeksiyonu açısından test edilmeli ve tedavi sırasında ve sonrasında birkaç ay boyunca izlenmelidir.
- Kalp Yetmezliği: İnfliximab dahil TNF blokerleri ile kötüleşme ve yeni başlayan kalp yetmezliği bildirilmiştir. Kalp yetmezliği olan hastalarda infliximab tedavisi düşünülürken dikkatli olunması ve yakından takip edilmeleri önerilir.
- Hematolojik Reaksiyonlar: İnfliximab alan hastalarda pansitopeni, lökopeni, nötropeni ve trombositopeni bildirilmiştir. Hastalara, kan diskrazilerini düşündüren belirti ve semptomlar geliştirirlerse derhal tıbbi yardım almaları önerilmelidir.
- Aşırı Duyarlılık Reaksiyonları: İnfliximab, anafilaksi, ürtiker, diyare dahil olmak üzere aşırı duyarlılık reaksiyonlarıyla ilişkilendirilmiştir.
Keşif
TNF-α’nın Erken Anlaşılması
İnfliximab için temel çalışmalar, tümör nekroz faktörü-alfa’nın (TNF-α) ilk olarak tümör hücrelerinde nekrozu indükleme yeteneğine sahip bir sitokin olarak tanımlandığı 1970’lerde başladı. 1980’lere gelindiğinde, otoimmün hastalıklarda inflamasyon ve doku hasarını teşvik etmedeki kritik rolü giderek daha belirgin hale geldi. Araştırmacılar romatoid artrit ve Crohn hastalığı gibi hastalıklarda yüksek TNF-α seviyeleri gözlemlediler ve bu da onu potansiyel bir terapötik hedef olarak gösterdi.
TNF-α Blokajı Kavramı
TNF-α’nın rolüne ilişkin anlayış üzerine inşa edilen 1980’lerin ortalarındaki klinik öncesi çalışmalar, TNF-α’yı bloke etmenin hayvan modellerinde iltihabı azaltabileceğini gösterdi. Bu bulgular, TNF-α’yı hedeflemenin kronik iltihapla karakterize edilen durumlar için terapötik faydalar sağlayabileceği fikrini doğruladı.
Monoklonal Antikor Teknolojisi Devrimi
1975 yılında geliştirilen ve 1986 yılında tanınan Nobel Ödüllü hibridoma teknolojisi, monoklonal antikorların üretilmesine olanak sağladı. Bu çığır açan gelişme, TNF-α’yı nötralize etmek için özel olarak tasarlanmış antikorlar geliştirmek için araçlar sağladı ve seçici immünosüpresyonu mümkün kıldı. Çabalar, insanlarda TNF-α’yı etkili bir şekilde inhibe edebilecek bir monoklonal antikor yaratmaya yöneldi.
Infliximab’ın Geliştirilmesi
Centocor’daki (şimdi Janssen Biotech’in bir parçası) araştırmacılar, TNF-α’yı hedef almak için insan ve fare bileşenlerini birleştiren bir kimerik monoklonal antikorun geliştirilmesine öncülük ettiler. Daha sonra infliximab olarak adlandırılan bu antikor, hem çözünür hem de membrana bağlı TNF-α’yı yüksek afiniteyle bağlayacak ve TNF reseptörleriyle etkileşimini önleyecek şekilde tasarlandı.
1991‘de infliximab ilk olarak klinik öncesi çalışmalarda test edildi ve burada önemli anti-inflamatuar etkiler gösterdi. 1993‘te etkinliği ve güvenliği romatoid artrit ve Crohn hastalığı için insan klinik çalışmalarında değerlendirilmeye başlandı.
Klinik Önemli Önemli Noktalar
- 1998: İnfliximab, orta ila şiddetli hastalığı olan hastalarda remisyonu başlatma ve sürdürme yeteneğini gösteren başarılı Faz III klinik denemelerinin ardından, Crohn hastalığının tedavisi için FDA onayı alan ilk anti-TNF-α tedavisi oldu.
- 1999: Klinik çalışmalar infliximab’ın eklem iltihabını azalttığını ve hastalığın ilerlemesini yavaşlattığını gösterdikten sonra, metotreksat ile birlikte romatoid artrit için onay alındı.
- Sonraki yıllarda, infliximab’ın endikasyonları ülseratif kolit, ankilozan spondilit, psoriatik artrit ve plak psoriazisi içerecek şekilde genişledi ve onu otoimmün hastalıkların tedavisinde bir köşe taşı haline getirdi.
Biyobenzerlerin Tanıtımı
2015’te, infliximab için ilk biyobenzerler, patent ayrıcalığının sona ermesini ve maliyet etkin biyolojik tedavilere olan artan talebi yansıtarak tanıtıldı. Bu biyobenzerler, TNF-α blokajını küresel olarak daha erişilebilir hale getirdi.
Miras ve Etki
Infliximab, yalnızca otoimmün hastalıkların tedavisini dönüştürmekle kalmadı, aynı zamanda TNF-α ve diğer inflamatuar yolları hedef alan sonraki biyolojikler için de temel oluşturdu. Geliştirilmesi, biyoteknoloji ve immünolojide önemli bir dönüm noktası olarak kabul ediliyor ve dünya çapında milyonlarca hastaya rahatlama sağlıyor.
İleri Okuma
- Brennan, F. M., & Feldmann, M. (1992). Cytokines in autoimmunity. Current Opinion in Immunology, 4(6), 754–759.
- Maini, R. N., St. Clair, E. W., Breedveld, F., Furst, D., Kalden, J., Weisman, M., … & Feldmann, M. (1999). Infliximab (chimeric anti-tumour necrosis factor α monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. The Lancet, 354(9194), 1932–1939.
- Rutgeerts, P., D’Haens, G., Targan, S., Vasiliauskas, E., Hanauer, S. B., Present, D. H., … & Mayer, L. (1999). Efficacy and safety of anti–tumor necrosis factor antibody (infliximab) therapy in Crohn’s disease. The New England Journal of Medicine, 340(18), 1398–1405.
- European Medicines Agency. (1999). Summary of product characteristics: Infliximab (Remicade®).
- Feldmann, M., & Maini, R. N. (2001). Anti-TNF alpha therapy of rheumatoid arthritis: What have we learned?. Annual Review of Immunology, 19, 163–196.
- van den Brande, J. M. H., Braat, H., van den Brink, G. R., Versteeg, H. H., Bauer, C. A., Hoedemaeker, I., … & Peppelenbosch, M. P. (2003). Infliximab induces apoptosis of monocytes and T lymphocytes in vivo and in vitro. Gastroenterology, 124(7), 1774–1785.
- Kay, J., & Calabrese, L. (2004). The role of interleukin-1 and tumor necrosis factor-alpha in the pathogenesis of rheumatoid arthritis and the therapeutic implications. Arthritis Research & Therapy, 6(3), 1–14.
- Tracey, D., Klareskog, L., Sasso, E. H., Salfeld, J. G., & Tak, P. P. (2008). Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacology & Therapeutics, 117(2), 244–279.
- Bares, R., & Maier, H. (2015). Biosimilars in clinical practice: The infliximab case. Zeitschrift für Rheumatologie, 74(1), 22–28.
- Keating, G. M. (2016). Biosimilar infliximab (CT-P13): a review of its use in autoimmune inflammatory diseases. BioDrugs, 30(5), 469–480.
