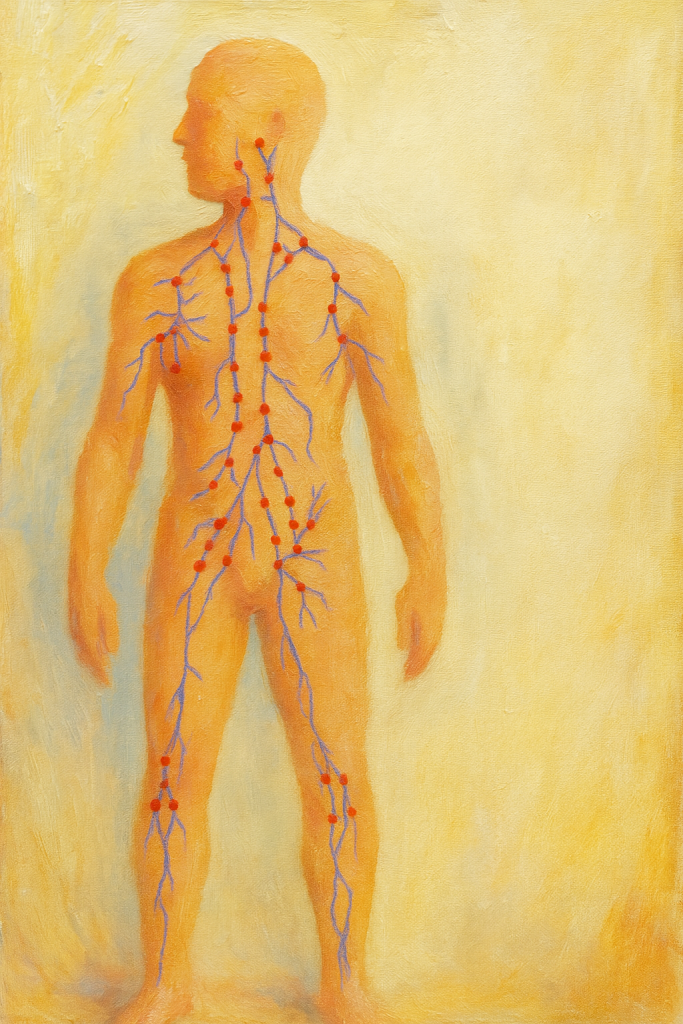
Lenf düğümleri (Nodus lymphaticus), lenf sisteminde bulunan ve bağışıklık savunmasında önemli rol oynayan küçük oval yapılardır. Genellikle lenf bezi olarak da anılırlar. Vücutta çoğunlukla gevşek yağ veya bağ dokusu içinde yer alır, çapları birkaç milimetreden 2–3 santimetreye kadar değişir. İçerilerindeki bağışıklık hücreleri sayesinde, lenf sıvısını süzerek mikroplar ve kanser hücreleri gibi yabancı maddeleri tutar ve bunlara karşı bağışıklık yanıtının oluşmasını sağlar. Her lenf düğümüne birden çok afferent (gelen) lenf damarı ile sıvı girer, düğüm içinde süzülen lenf ise genellikle tek bir efferent (giden) damar aracılığıyla çıkar.
Lenf düğümlerinin sağlıklı boyutta kalması, bağışıklık sistemi dengesinin bir göstergesidir. Ancak enfeksiyon veya hastalık durumunda lenf düğümleri büyüyebilir; bu duruma lenfadenopati denir. Lenf düğümü büyümesinin arkada yatan nedenler çeşitlidir ve dikkatli değerlendirilmesi gerekir.
İçindekiler
Anatomik Özellikler
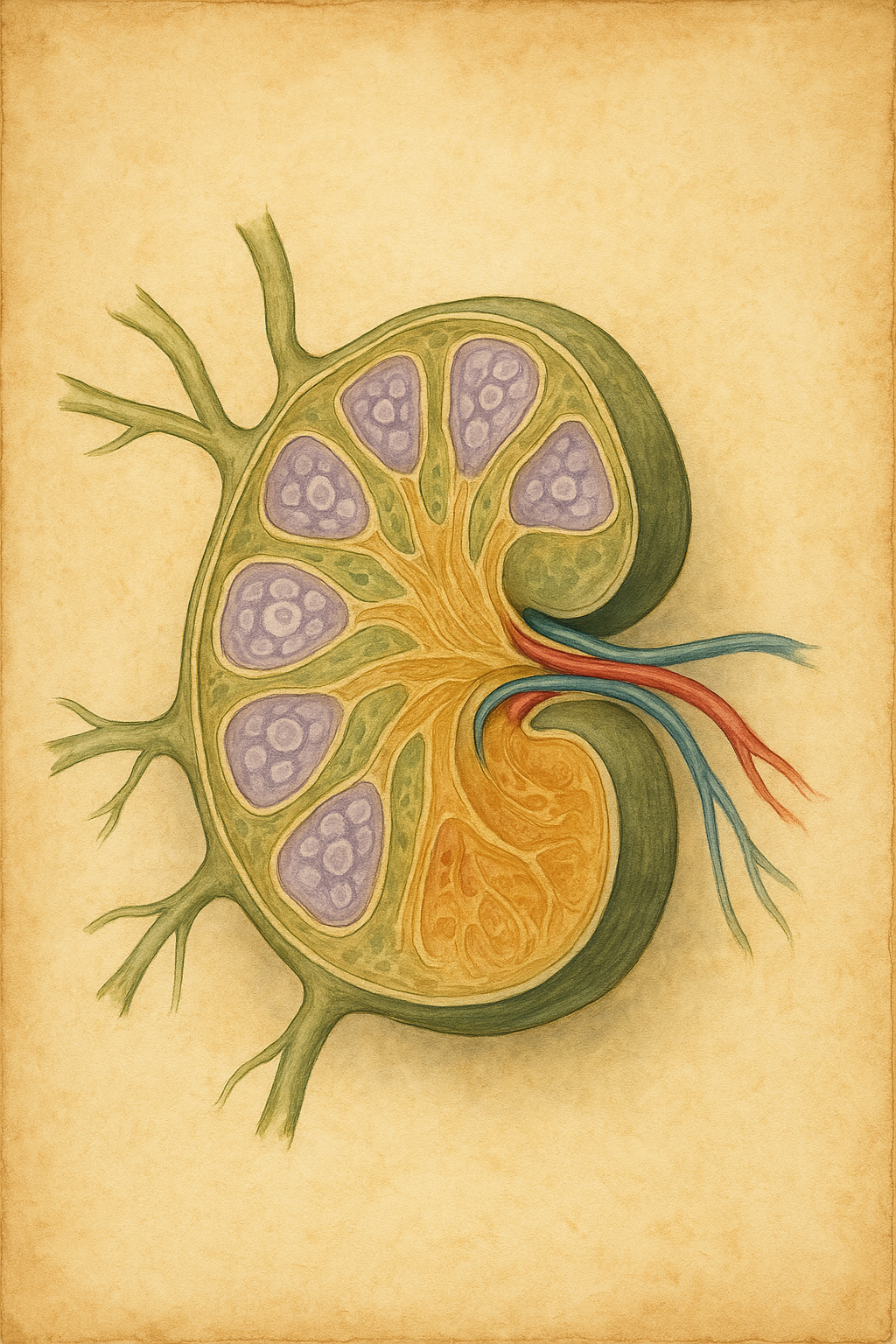
Lenf düğümleri genellikle fasulye (oval) biçimindedir. Dışarıdan ince bir fibröz kapsülle kaplıdırlar ve kapsülün içinde iki ana bölüm yer alır: dışta korteks, içte ise medulla. Kortekste B lenfositlerinin biriktiği foliküller bulunur; foliküller antijen uyarısıyla germinal merkezler oluşturur. Medullada ise makrofajlar ve plazma hücreleri gibi çeşitli hücreler yer alır. Lenf düğümünün içbükey yüzünde, lenf damarlarının ve kan damarlarının giriş-çıkış yaptığı bir girinti (hilus) vardır.,
Lenf sıvısı afferent damarlarla lenf düğümünün dışbükey kapsül altındaki boşluğa (subkapsüler sinüs) girer. Buradan kortikal sinüslere, ardından medüller sinüslere akar; bu boşluklar, yabancı partikülleri yakalayan makrofajlarla doludur. Süzülen lenf, medulladaki sinüslerden geçerek hilus yoluyla bir veya birden fazla efferent lenf damarıyla düğümden çıkar. Bu süreç sırasında lenfositler aktive olur, antikor üreten plazma hücrelerine veya gelecekte hafıza işlevi görecek bellek hücrelerine dönüşür.
Lenf Düğümlerinin Topografik Dağılımı
Lenf düğümleri vücutta belirli bölgeler etrafında kümeler halinde bulunur. Baş ve gövdeye yakın yerleşen gruplar, hastalıkların kaynağının tespitinde önemli ipuçları verebilir. Başlıca lenf düğümü bölgeleri şunlardır:
- Baş ve Yüz Bölgesi: Oksipital (kafa arkası), retroauriküler (kulak arkasındaki), preauriküler (kulak önündeki) ve parotidal (kulak altı/yanağa yakın) bezler; ayrıca mandibula altı (submandibuler) ve çene altı (submental) lenf düğümleri.
- Boyun (Servikal) Bölge: Yüzeyel servikal (köprücük kemiği üstü ve boyun yanlarında) ile derin servikal grubu. Örneğin sternokleidomastoid kas çevresinde sıralı nodlar bulunur.
- Koltuk Altı (Aksilla): Altı ana grupta düzenlenmiştir. Pektoral (ön yüz), interpektoral (Rotter düğümleri), santral, apikal (tepe), brakiyal (kol basısı çevresinde) ve subskapular (arka koltuk altı) grupları önemli aksiller lenf düğümü alanlarıdır.
- Göğüs (Toraks) Bölgesi: Mediastinal lenf düğümleri (örneğin trakeobronşiyal-grup), interkostal (kaburgalar arası), parasternaller ve suprasternaller (göğüs ortası ve köprücük kemiği üstünde) yer alır.
- Karın ve Pelvis: Karın içi topları arasında, özellikle karaciğer çevresinde (keliak arter bölgesi), mezenterik arter yolları boyunca (süperior ve inferior mezenterik grupları) ve pelviste (içi ve dışı iliak arter boyuncu) lenf düğümleri bulunur.
- Kasık (İnguinal) Bölgesi: Yüzeyel ve derin inguinal lenf nodları, alt ekstremite ve genital bölgeden gelen lenfleri toplar.
Vücutta toplam lenf düğümü sayısı genellikle 400–700 civarı olarak belirtilir. Boyun, koltuk altı ve kasıkta toplanan bazı düğümler elle de hissedilebilir (örneğin, yüzeyel servikal, aksiller ve inguinal nodlar).
Lenfadenopati: Klinik Önemi ve Nedenleri
Lenf düğümlerinin büyümesi (lenfadenopati), lokal bir durumdan genelleşmiş (sistemik) bir sürece kadar farklı senaryolarda ortaya çıkabilir. Çoğu zaman artan boyut, vücudun bir enfeksiyonla verdiği yanıtı gösterir. Ancak bazı durumlarda büyüme daha ciddi hastalıkların habercisi olabilir. Lenf düğümü büyümesine yol açan başlıca faktörler şunlardır:
- Enfeksiyonlar: Üst solunum yolu enfeksiyonları (grip, soğuk algınlığı), mononükleoz (EBV), diş ve boğaz iltihapları gibi durumlar, o bölgedeki lenf düğümlerinin aktif hale gelmesine neden olur. Örneğin bademcik ve diş kaynaklı apselerde boyun bölgesindeki nodlarda şişme görülür. Enfeksiyon durumunda büyüme genellikle ağrılı, yumuşak ve hareketli olur.
- Enflamatuar ve Otoimmün Hastalıklar: Lupus (SLE), romatoid artrit gibi sistemik otoimmün durumlar, vücutta yaygın lenf düğümü büyümelerine yol açabilir. Bu vakalarda bezler genellikle ağrısızdır ve iltihabi süreçlerin bir parçası olarak şişer.
- Maligniteler:
- Metastatik Kanser: Vücudun belli kanser türlerinde lenf düğümleri ilk yayılma istasyonlarından olabilir. Örneğin baş-boyun kanserlerinde (ağız boşluğu, boğaz, gırtlak bölgesi), akciğer kanserlerinde veya meme kanserinde ilgili lenf bölgeleri (servikal, mediastinal, aksiller) büyüyebilir. Bu nodlar sert, sabit ve ağrısız olma eğilimindedir.
- Lenfoma ve Lösemi: Hodgkin ve Non-Hodgkin lenfoma gibi kan hücresi kanserleri doğrudan lenf nodlarını tutar. Bu durumlarda genellikle boyunda veya koltuk altlarında sert, kronik büyümeler gözlenir. Lösemi de kemik iliğiyle birlikte lenfatik sistemde yaygın değişikliklere yol açabilir.
- Tüberküloz (TB): Özellikle tüberkülin taşıyıcılarında, lenf nodlarında granülomatöz iltihap (skrofula veya “Kral hastalığı”) meydana gelebilir. Boyun bölgesindeki TB lenfadenitleri sık görülür ve genellikle ağrısız, sert kitleler oluşturur.
- Sarkoidoz: Granülomatöz bir hastalık olan sarkoidozda lenf düğümlerinde büyüme (özellikle mediastinal ve servikal) görülebilir. Eşlik eden akciğer tutulumu da sık rastlanır.
Lenf nodu büyümesinin özellikleri ayırıcı tanıda yol göstericidir. Akut başlangıçlı, şiş, ağrılı düğüm artışı genellikle enfeksiyon kaynaklıdır ve inflamasyonla birlikte seyreder. Buna karşılık, ağrısız ve giderek büyüyen nodlar, özellikle inflamasyon belirtileri olmadan gelişiyorsa malignite şüphesini artırır. Bu durumlarda görüntüleme yöntemleri veya biyopsi ile detaylı inceleme yapmak gerekir. Ayrıca, büyüme lokal (sadece bir bölgede) olabileceği gibi sistemik (vücudun birçok yerinde) de olabilir; yaygın büyümelerde genellikle viral enfeksiyonlar veya hematolojik hastalıklar akla gelir.
Teşhis ve Değerlendirme
Lenf düğümü şişliği saptandığında detaylı bir değerlendirme yapılır. İlk olarak anamnezde hastanın genel durumu ve ilgili öyküler alınır, ardından fizik muayene ve gerekli görüntüleme yöntemleri uygulanır.
- Anamnez: Lokalizasyon (şişliğin yeri), süresi ve başlangıcı sorgulanır. Hastanın ateşi, gece terlemesi, kilo kaybı gibi “B-semptomlar” (kanser veya tüberküloz şüphesini artıran bulgular) değerlendirilir. Eşlik eden semptomlar (öksürük, diş ağrısı, kulak veya boğaz ağrısı gibi enfeksiyon belirtileri) not edilir. Hastanın geçmiş hastalıkları (diyabet, HIV enfeksiyonu, bilinen maligniteler) ve ilaç kullanımı (ör. penisilin, sefalosporin, allopurinol, kaptopril gibi ilaçlar bazı vakalarda lenf nodu reaksiyonuna yol açabilir) sorgulanır. Hayvan teması (kedi tırmalaması hastalığı gibi), son dönem yolculuklar veya bulaşıcı hastalık öyküsü de öğrenilir.
- Fizik Muayene: Öncelikle genel durum değerlendirilir, karaciğer ve dalak büyüklükleri muayene edilir (hepatosplenomegali eşlik edebilir). Sonra tüm periferik lenf düğümleri sistematik olarak gözden geçirilir:
- İnspeksiyon: Yüzeyel bölgelerde gözlelenebilen (boyun, koltuk altı, kasık) şişlikler kontrol edilir.
- Palpasyon: Düğümler elle tek tek hissedilerek boyut, kıvam (yumuşak, sert), hareketlilik ve ağrılı olup olmadığı değerlendirilir. Normalde hissedilebilir boyutta küçük nodlar kabul edilir; her hissedilen nod anormal sayılır. Sert, çakılı veya ağrısız nodlar şüphe uyandırır.
- Görüntüleme ve Diğer Tetkikler:
- Ultrasonografi: Yüzeyel lenf nodları için ilk basamak görüntüleme yöntemi olarak kullanılır. Benign görünümlü nodlar tipik olarak uzunlamasına oval formda olup net sınırlıdır ve merkezindeki yağ hilusu korunmuştur. İç kısım ekojujometrik açıdan homojendir. Enflamasyon veya reaktif büyümede bazen düğüm boyutu artabilir ancak şekil korunur. Malign nodlar ise yuvarlaklaşır, sınırları düzensizleşir ve hilus yağı görünümü kaybolur. Merkezi nekroz (kireçlenme veya hiperekoik alanlar) veya anormal damarlanma görülebilir.
- Bilgisayarlı Tomografi (BT) ve Manyetik Rezonans (MR): Derindeki lenf düğümlerini ve mediastinal/pelvik nodal durumu değerlendirmek için kullanılır. Metastaz veya lenfoma şüphinde tümör yayılımı bu yöntemlerle izlenir.
- Biyopsi: Şüpheli durumlarda kesin tanı için ince iğne aspirasyon biyopsisi veya eksizyonel biyopsi yapılabilir. Özellikle malignite olasılığında histopatolojik inceleme gerekir.
- Laboratuvar Testleri: Gerekli görülürse enfeksiyon etkenlerine yönelik testler (kan sayımı, monospot testi, HIV, tüberküloz testleri, serolojik testler) ile otoimmün hastalık markerları veya genel kan testleri istenebilir.
Teşhis sürecinde büyüklük ve biçim de dikkat edilmesi gereken kriterlerdir. Örneğin boyundaki bir lenf nodu genellikle 1 cm’den, aksiller ve inguinal düğümler ise 1.5–2 cm’den daha büyükse anormal kabul edilir. Normalde lenf nodu uzunlamasına ekseninin çapına oranı 2:1’den büyüktür; oran yakınsa (yani nod kalınlaşırsa) malignite şüphesi artar. Ayrıca yağlı hilusun kaybolması, iç damarlarda anormallik ve düzensiz yapı da malignite lehine bulgulardır.
Lenf düğümleri vücudun enfeksiyonlarla savaşında ve anormal hücreleri yakalamada ana görev üstlendiğinden, durumlar netleşene kadar büyüme kaynağına ulaşmak için bu aşamalı değerlendirme kritik önemdedir. Uygun tedavi ve izlem, olası bir enfeksiyon süreciyle birlikte malignite ya da başka hastalıkların erken tanısını sağlayarak hastanın prognozunu etkiler.
Keşif
1. Antik ve Klasik Dönemler – Eski Yunan, Roma ve İslam Dünyasında Gözlemler
M.Ö. yaklaşık 1600’lü yıllarda Antik Mısır tıp metinlerinde koltukaltı ve kasık gibi bölgelerdeki şişliklerden söz edilmiştir; günümüz araştırmacıları bu şişliklerin ilk lenf düğümü betimlemeleri olabileceğini düşünmektedir. Eski Yunan’da Hipokrat (MÖ 5. yy) “Bezler Üzerine” adlı eserinde koltukaltı, boyun, kasık ve karın içine dağılmış birçok bezden bahsetmiş, bezlerin içinden geçen sıvıya khloë (chiros) veya ikhol adını vermiştir. Aristoteles ise hayvanlarda incelediği ince lifler arasında renksiz bir sıvıdan söz etmiş (bu “sanies” olarak anılmıştır). Roma döneminde Galen bağırsaklardaki yağlı sıvının (ciro) karaciğere gidip kana dönüştüğünü savunmuş, uzun süre bu görüş tıp dünyasında kabul görmüştür.
Bizans İmparatorluğu’nda Paulus Aegineta (7. yy) bademcik ameliyatları sırasında boyun bölgesindeki iltihaplı bezleri tarif etmiştir; bu gözlem, bugün hastalıkta şişmiş bir lenf düğümüne karşılık gelmektedir. Aynı dönemde İslam tıbbının önde gelen isimlerinden İbn-i Sina (11. yy) paraziter kaynaklı fil hastalığını (elefantiazis) tanımlamış, buna bağlı lenfatik ödemleri detaylandırmıştır. Tüm bu bilgiler ışığında, Antik ve Orta Çağ hekimliği boyunca Galen’in lenfatik akışın karaciğere bağlı olduğu görüşü uzun süre değişmeden egemen kalmıştır.
2. Rönesans ve Erken Modern Dönem – Anatominin Yeniden Keşfi ve Tanımlamalar
Rönesans’ta insan kadavra incelemeleri tekrar önem kazandı. Andreas Vesalius (1514–1564) De humani corporis fabrica (1543) adlı eserinde Galen’in pek çok hatasını düzeltti ve mezenterde “glandula” benzeri küçük yapılar tarif etti. Niccolò Massa (1536) böbrek çevresinde ince beyaz damarlara işaret etti. Gabriele Falloppio (1523–1562) infaz edilen mahkumların bağırsak mesenterisinde sarımsı sıvı taşıyan damarlar gördü. Bartolomeo Eustachi (1500–1574) ise hayvanlarda disseksiyon yaparak torasik kanalı ilk kez betimledi (bu damara vena alba thoracis adını verdi). Bu anatomistler, Galen’in anatominin merkezi olarak gösterdiği karaciğer çıkışlı dolaşım fikrine yenilikler ekledi.
- Andreas Vesalius (16. yy): İnsan anatomisini adım adım söküp tanımladı; mezenterdeki küçük bezcikleri tarif etti.
- Niccolò Massa (16. yy): İlk defa böbrek çevresinde ince, beyaz-sarı renkli damarlar gözlemledi.
- Gabriele Falloppio (16. yy): Bağırsak duvarından çıkan, sarı sıvı taşıyan damarları tanımladı.
- Bartolomeo Eustachi (16. yy): Hayvan diseksiyonlarında torasik kanalı gösterdi, lenf dolaşımının varlığını ortaya koydu.
3. 17. ve 18. Yüzyıllar – Mikroskobik Anatomi ve Fizyolojik İşlev Tartışmaları
17. yüzyıl “lenfatik araştırmaların altın çağı” olarak bilinir. 1622’de İtalyan Gaspare Aselli beslenmiş köpeklerde bağırsaktan çıkan süt gibi bir sıvıyı taşıyan beyaz damarlar buldu ve bunlara vena lactea (lacteal ven) adını verdi. 1651’de Fransız Pierre Pecquet “cisterna chyli”yi ve torasik kanalı tanımladı; bu sayede bağırsaklardan gelen yağlı sıvının karaciğer yerine dolaşıma katıldığı anlaşıldı. Aynı dönemde Danimarkalı Thomas Bartholin ve İsveçli Olaus Rudbeck insan cadavralarında lenf damarlarını sistematik olarak haritaladı; Bartholin “lenf damarları” (vasa lymphatica) terimini ilk kez kullandı ve uzunca süredir kabul gören Galen görüşüne esprili bir dille karşı çıkarak “karaciğer cenazesi” olarak nitelendirdi. 17. yüzyılın sonlarına doğru Marcello Malpighi mikroskop yardımıyla dalağın kırmızı ve beyaz pulplarını ayırdı, böylece dalaktaki lenfoid dokunun varlığını gösterdi. Hollandalı Frederik Ruysch da 1660’larda lenf damarlarındaki tek yönlü kapakçıkları keşfetti; bu buluş, lenf akımının mantığını anlamaya yardımcı oldu. 1784’te İtalyan anatomist Paolo Mascagni tüm vücudun lenfatik sistemini detaylı illüstrasyonlarla ortaya koydu.
- Gaspare Aselli (1622): Mezenterik damarlarında süt gibi bir akışkan taşıyan “lacteal” kanalları keşfetti.
- Pierre Pecquet (1651): Cisterna chyli ve torasik kanalı tarif ederek chyle’in dolaşıma katılımını ortaya çıkardı.
- Thomas Bartholin & Olaus Rudbeck (1652-53): İnsan lenf damarlarının toplu haritasını çıkardı; Bartholin lenfatik damar adıyla yeni terimler getirdi.
- Marcello Malpighi (1660’lar): Mikroskopla dalakta kırmızı ve beyaz pulpları tanımladı, lenfatik doku varlığını gösterdi.
- Frederik Ruysch (17. yy sonu): Lenf damarlarında tek yönlü kapakçıkları saptadı.
- Paolo Mascagni (1784): Lenfatik sistemin kapsamlı bir atlasını yayımladı, tüm sistemin haritasını çizdi.
4. 19. Yüzyıl – Histolojik İnceleme ve Patolojik Sınıflamalar
19. yüzyılda laboratuvar teknikleri hızla gelişti. Rudolf Virchow (1821–1902), hücre patolojisi kuramı çerçevesinde lenf düğümlerini “filtre” olarak değerlendirdi ve “lenfoma” ile “lenfosarkom” terimlerini kullandı. 1832’de İngiliz Thomas Hodgkin ilk kez lenf bezlerinin malign (habis) büyümesiyle karakterize yeni bir hastalığı tanımladı (bugünkü Hodgkin hastalığı). Alman mikroskopçüler Albert von Kölliker ve Robert Koch lenfatik sistemin hücresel yanını aydınlattı: Kölliker (1854) lenf kılcallarının ve nodüllerin mikroskobik yapısını inceledi, Koch (1882) ise tüberküloz basilini keşfederek tüberkülozlu lenf bezi enfeksiyonlarını anlamaya katkıda bulundu. Bu yüzyıl sonunda Ehrlich, Wright ve meslektaşları tarafından geliştirilen boyama yöntemleriyle lenfosit, mikrofaj gibi hücreler ayrıştırılabilmiştir.
- Rudolf Virchow (1850’ler): Lenf nodlarını kanser yayılımında bariyer olarak ele aldı; “lenfoma” kavramının öncülerindendi.
- Thomas Hodgkin (1832): Lenf bezlerinde görülen habis büyümeyi ilk kez tanımladı (Hodgkin hastalığı).
- Albert von Kölliker (1854): Mikroskobik analizle lenf damarlarının yapısını ortaya koydu.
- Robert Koch (1882): Tüberküloz basilini keşfederek veremli lenf bezlerini anlamaya yardımcı oldu.
- Boyama teknikleri: Ehrlich, Wright vb. geliştirilen anilin boyaları lenfosit ve retiküler hücre gibi hücre tiplerini görünür kıldı.
5. 20. Yüzyıl ve Moleküler Dönem – İmmünolojik Roller ve Tanı Yöntemleri
20. yüzyılda bağışıklık sistemine ilişkin kavrayış olgunlaştı. Lenfosit ve antikorun keşfiyle lenf düğümlerinin akyuvarların eğitim noktaları olduğu anlaşıldı. Bu dönemde Hodgkin dışı lenfomalar tanımlandı ve sınıflandırıldı; Rappaport’tan WHO’ya uzanan modern lenfoma sınıflamalarıyla hastalıklar alt tiplere ayrıldı. Tanı araçlarında büyük atılımlar oldu: 1950’lerde ultrasonografi (USG), 1970’lerde bilgisayarlı tomografi (BT) ve manyetik rezonans görüntüleme (MRG) rutinleşti, pozron emisyon tomografisi (PET) ise tümörlerin yayılımını göstermede kullanıldı. İnce iğne aspirasyonu, çekirdek biyopsi ve sentinel lenf nodu biyopsisi gibi yöntemler yaygınlaştı. 1970–80’lerde akım sitometri ve immünohistokimya ile lenfosit alt grupları (CD4, CD8, CD19 vb.) belirlenebildi; PCR ve gen dizileme teknikleriyle lenfomaların genetik altyapısı çözümlenmeye başlandı. Böylece “lenfadenopati” klinik tanımlaması netleşti ve büyümüş düğümlerin enfeksiyon, otoimmünite veya malignite kaynaklı olup olmadığı sistematik olarak sınıflanmaya başlandı.
- Görüntüleme yöntemleri: USG (1950’ler), BT/MRG (1970’ler), PET/BT (1990’lar) gibi teknikler lenf nodu değerlendirmede devrim yarattı.
- Biyopsi ve sınıflandırma: İnce iğne aspirasyonu, çekirdek biyopsi ve sentinel nod biyopsisi 20. yüzyıl sonunda tanıda altın standart haline geldi; Hodgkin ve Non-Hodgkin lenfomaları için uluslararası sınıflamalar geliştirildi.
- Flow sitometri & immünohistokimya (1970–80’ler): CD antijenleri sayesinde lenfosit alt tipleri ve lenfoma fenotipleri açıkça tanımlandı.
- Moleküler testler: PCR, gen sekanslama ve gen ekspresyon analizleri lenf düğümlerindeki genetik mutasyon ve imzaları ortaya koydu.
- Lenfadenopati anlayışı: Lenf nodu büyümeleri enfeksiyonel, inflamatuar veya neoplastik nedenlere göre ayrıştırılarak klinik pratiğe girdi.
6. Günümüz Perspektifi – Çağdaş İmmünoloji, Kanser Biyolojisi, İmmünoterapiler ve Yapay Zekâ
- yüzyılda lenf düğümleri, adaptif bağışıklık sisteminin merkez üsleri olarak ele alınmaktadır. Bu düğümlerde T hücreleri eğitim görür, dendritik hücreler antijen sunar ve B hücrelerinden antikor üretilir. Kanser biyolojisinde lenf nodu tutulumu, hastalığın evrelenmesinde en önemli kriterlerden biridir. Modern immünoterapiler (PD-1/PD-L1 inhibitörleri, CAR-T hücre tedavileri vb.) lenf düğümlerindeki immün yanıt mekanizmalarını doğrudan etkiler. Örneğin tümör antijenleri bu düğümlerdeki alt gruplar tarafından tanınır, immünolojik hafıza ve yanıt burada şekillenir. Son yıllarda yapay zekâ destekli görüntüleme ve patoloji yöntemleri önemli gelişmeler sundu: Derin öğrenme algoritmaları tıbbi görüntülerde metastatik lenf nodlarını daha yüksek doğrulukla tanıyabilirken, dijital patoloji platformları biyopsi kesitlerinde hücre sınıflandırmasını otomatikleştiriyor. Tek hücre RNA dizileme ve moleküler analizler, lenf düğümü mikroçevresindeki farklı hücre topluluklarını ve tümör belirteçlerini detaylı olarak ortaya koymaktadır.
- Bağışıklık Sistemi Merkezleri: Lenf düğümleri, T ve B hücrelerinin eğitim aldığı, antijen sunumunun yoğun olarak gerçekleştiği organlardır.
- Kanser Metastazı: Tümör hücreleri sıklıkla ilk olarak lenf düğümlerine yayılır; bu nedenle lenf nodu tutulumuna göre kanser evrelemesi ve tedavi planlaması yapılır.
- İmmünoterapiler: PD-1/PD-L1 inhibitörleri, CAR-T gibi yeni kanser tedavileri, lenf düğümlerindeki immün etkileşimleri hedef alır ve yanıtı güçlendirir.
- Yapay Zekâ ve Dijital Patoloji: Derin öğrenme algoritmaları radyolojik görüntülerde metastatik lenf nodlarını tespit ediyor, dijital patoloji araçları biyopsi kesitlerindeki hücre desenlerini otomatik analiz ederek tanıya yardımcı oluyor.
- Moleküler ve Tek Hücre Teknolojileri: Tek hücre dizileme ve gen ekspresyon analizleri sayesinde lenf düğümünün farklı hücre alt popülasyonları ve tümör belirteçleri haritalanıyor, hastalık mekanizmaları her gün daha iyi aydınlatılıyor.
Bu tarihsel süreç gösteriyor ki, günümüzde lenf düğümleri pasif bir “süzgeç” olmanın ötesine geçmiştir; onlar bağışıklığın merkez üssü, kanserin yayılım kilidi ve yeni tedavi stratejilerinin odak noktası haline gelmiştir.
İleri Okuma
- Cunningham MJ, Johnson JT, Myers EN, Schramm VL Jr, Thearle PB. Cervical lymph node metastasis after local excision of early squamous cell carcinoma of the oral cavity. Am J Surg. 1986;152(4):361-366.
- Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med. 2007;357(21):2153-2165.
- Fontanilla JM, Barnes A, von Reyn CF. Current diagnosis and management of peripheral tuberculous lymphadenitis. Clin Infect Dis. 2011;53(6):555-562.
- Howell JM, Auer-Grzesiak I, Zhang J, Andrews CN, Stewart D, Urbanski SJ. Increasing incidence rates, distribution and histological characteristics of primary gastrointestinal lymphoma in a North American population. Can J Gastroenterol. 2012;26(7):452-456.
- Teixeira UB, Dedivitis RA, Guimarães AV, Matos LL, Kulcsar MAV, Cernea CR. Clinical prognostic factors in malignant tumors of the salivary glands. Braz J Otorhinolaryngol. 2017;83(4):420-426.

Yorum yazabilmek için oturum açmalısınız.