İçindekiler
Genel Bakış
Metilprednizolon aseponat (MPA), halojen içermeyen, lipofilik bir topikal glukokortikoid olup 1991’den beri İsviçre’de onaylıdır ve krem, merhem ve yağlı merhem formlarında (Advantan®) ticari olarak mevcuttur. Klinik olarak anti-inflamatuar, antialerjik, immünosupresif ve antipruritik etkiler sunar; inflamatuvar deri hastalıklarının lokal tedavisinde günde bir kez ince tabaka hâlinde uygulanır. En sık görülen lokal advers etkiler uygulama yerinde yanma ve kaşıntıdır; yanlış veya uzun süreli kullanım deri hasarına yol açabilir.
Etimoloji ve Adlandırma
- “Metilprednizolon”: Prednizolon iskeletinin 6α-metil ile modifikasyonunu vurgular; bu modifikasyon reseptör etkileşimini ve farmakokinetik davranışı etkileyebilir.
- “Aseponat”: Steroidin 21-konumunda, 2-(2-etilheksoiloksi)asetat yapısında bir esterleşmeyi ve 17-konumunda propiyonat içeren çift ester mimarisini ima eder. Bu “aseponat” yan zinciri, epidermal penetrasyonu ve pro-ilaç (prodrug) davranışını optimize etmek için tasarlanmış bir lipofilik taşıyıcı rolü görür.
- “Advantan”: Ticari isim, avantajlı lokal etkinlik/sistemik güvenlik “advantage” çağrışımıyla pazarlama kökenli olup farmakolojik sınıflandırma içermez.
Kimyasal Yapı
- Moleküler formül: C₂₇H₃₆O₇
- Molekül ağırlığı (Mr): 472.6 g/mol
- Yapısal özellikler: Halojensiz, çift ester içeren, belirgin lipofilik bir steroid türevi.
- Biyotransformasyon (Pro-ilaç konsepti): Epidermal/dermal esterazlar tarafından başlıca 6α-metilprednizolon-17-propiyonat aktif metabolitine hidrolize olur; böylece ciltte aktifleşir, sistemik dolaşıma minimal geçiş gösterir.
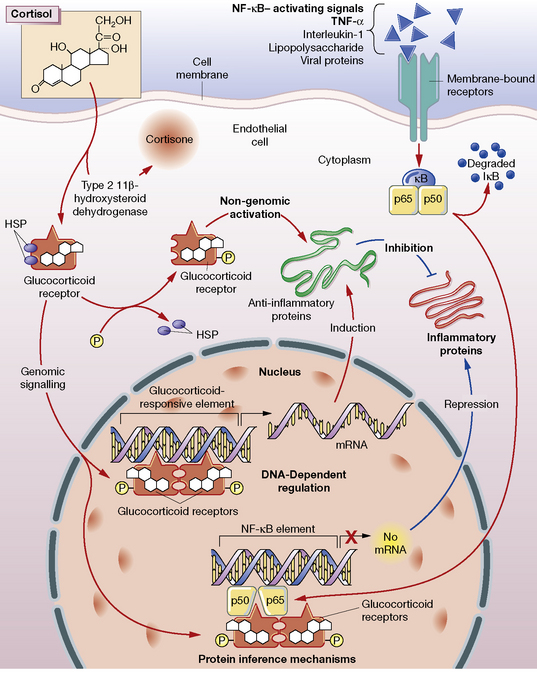
Etki Mekanizması (Moleküler Farmakoloji)
- Reseptör bağlanması: Hücre içi glukokortikoid reseptörüne (GR) yüksek afiniteyle bağlanır; kompleks nükleusa taşınarak GRE dizilerine bağlanır.
- Transkripsiyonel modülasyon:
- Transrepressyon: NF-κB, AP-1 gibi pro-inflamatuar yolakların baskılanması; IL-1, IL-6, TNF-α ve adezyon moleküllerinde azalma.
- Transaktivasyon: Lipo-kortin-1 (annexin-A1) artışı ile fosfolipaz A₂ inhibisyonu; prostaglandin ve lökotrien sentezinde azalma.
- Fonksiyonel sonuçlar:
- Anti-inflamatuar: Eritem, ödem ve eksüdasyonda azalma.
- Vazokonstriktör: Kapiller permeabilitede azalma (klinikte vasokonstriksiyon testi ile koreledir).
- Antialerjik: Mast hücresi mediatörlerinin salınımında baskılanma.
- İmmünosupresif: T-hücre aktivasyonu ve antijen sunumunda azalma.
- Antipruritik: Pruritus mediatörlerinin inhibisyonu.
Potensi/Etki gücü: Formülasyona ve taşıyıcıya bağlı olarak orta ile güçlü arası profilde sınıflandırılır; bazı sınıflandırmalarda sınıf III (güçlü) olarak yer alır, özellikle daha oklüzif/yağlı bazlarda klinik etkinlik artar.
Farmasötik Formlar ve Formülasyon Mantığı
- Krem: Su/yağ emülsiyon; akut, eksüdatif lezyonlar, kıvrım bölgeleri ve saçlı derinin non-oklüzif alanları.
- Merhem: Daha lipofilik; subakut/kronik ve hafif kuru alanlar.
- Yağlı merhem: Çok kuru, likenifiye plaklar; oklüzif etki ile penetrasyon artışı.
Seçim ilkesi: “Islak lezyona ıslak, kuru lezyona yağlı” yaklaşımı; baz arttıkça potensi ve absorbsiyon artabilir.
Endikasyonlar
- Atopik dermatit (çocuk ve erişkin)
- Kontakt dermatit (alerjik/irritan)
- Dishidrotik, nummüler, dejeneratif ve sınıflandırılmamış ekzamatöz dermatitler
Tedavi prensibi: Günde 1 kez ince tabaka; lezyon kontrolü sağlanınca en kısa sürede azaltma/sonlandırma.
Dozlama ve Uygulama Stratejileri
- Standart uygulama: Günde 1 defa, “ince film” yaklaşımı; göz çevresi ve kıvrım bölgelerinde daha dikkatli.
- Süre: Erişkinde genelde 2–4 hafta arası; çocuklarda daha kısa.
- Proaktif tedavi: Atopik dermatitte nüks baskısı için remisyon döneminde haftada 2 gün sınırlı alan uygulaması, arada emolyanlar ile bariyer korunumu.
- Oklüzyon: Etkinliği artırır ancak absorpsiyonu da yükseltir; dikkatle ve kısa süreli kullanılır.
- Yüz/kıvrım/genital: İnce epidermis nedeniyle kısa süreli ve zayıf-orta potensi tercih; MPA’da krem formu önce gelir.
Kontrendikasyonlar
- Aşırı duyarlılık
- Bakteriyel, viral, fungal deri enfeksiyonları (örn. impetigo, herpes simplex/zooster, varisella, dermatofit/kandida)
- Rosacea (gül hastalığı)
- Perioral dermatit
- Akne vulgaris
- Atrofik deri hastalıkları
- Deri ülserleri
- Aşı sonrası lokal reaksiyonlar (tedavi alanında)
Uyarılar ve Önlemler
- En kısa süre, en düşük etkili güç ilkesi.
- Geniş alan ve uzun süre kullanımda HHA aks supresyonu riski (özellikle oklüzyon, kıvrım bölgeleri, çocuklar).
- Yüz ve periorbital kullanım: Deri atrofisi, perioral dermatit ve oküler (glokom/katarakt) riskleri nedeniyle minimal ve kısa süreli.
- Sekonder enfeksiyon şüphesinde öncelik enfeksiyon tedavisidir; steroid monoterapisinden kaçınılır.
- Tinea incognito riski: Tanısız dermatofitozda steroid kullanımı klinik tabloyu maskeleyebilir.
- Gebelik/laktasyon: Geniş alan/uzun süre/oklüzif uygulamadan kaçınma; meme başına uygulamadan sakınma.
- Çocuklar: Yüksek yüzey alanı/kütle oranı nedeniyle absorpsiyon ve sistemik etki riski daha fazladır; daha kısa süre ve dar alan.
Advers Etkiler
Sık: Uygulama yerinde yanma, kaşıntı, eritem.
Uzun süre/yanlış kullanımda:
- Deri atrofisi, telenjiektazi, striae
- Hipopigmentasyon, pürpura, deri kuruluğu
- Akneiform/rozaseiform dermatoz, perioral dermatit
- Sekonder süperenfeksiyon (bakteriyel/fungal)
- HHA aks supresyonu, çok nadiren Cushingoid özellikler (geniş alan/oklüzif/çocuk)
Farmakokinetik Özellikler
- Perkütan absorbsiyon: Lezyonun bütünlüğü, anatomik bölge (yüz/kıvrım>gövde>ekstremite), baz formu ve oklüzyonla artar.
- Lokal aktivasyon: Epidermal hidroliz ile aktif metabolit oluşur ve esas etki ciltte gerçekleşir.
- Sistemik maruziyet: Terapötik koşullarda düşüktür; karaciğerde konjugasyonla inaktivasyon ve renal atılım.
Klinik Kullanımda “Evrimsel” Yaklaşım
MPA, halojensiz ve pro-ilaç tasarımıyla, klasik halojenli potent steroidlere kıyasla lokal selektivite ve güvenlik dengesini iyileştiren ikinci nesil topikal glukokortikoidlerin tipik bir temsilcisidir. Çift ester mimarisi sayesinde ciltte etkinleşme ve sistemik yükün sınırlandırılması hedeflenir; formülasyona duyarlı potensi ile farklı klinik senaryolara uyarlanabilir.
Tedavi Algoritmalarında Yeri
- Bariyer restorasyonu: Emolyanlar ve yıkama rejimlerinin düzenlenmesiyle birlikte.
- Alevlenme kontrolü: Lezyon aktivitesine göre MPA’nın uygun formu; günde 1 uygulama.
- Nüks önleme (proaktif): Remisyonda sınırlı gün uygulaması + düzenli nemlendirici.
- Steroid tasarrufu: Uzayan olgularda kalsinörin inhibitörleri (pimekrolimus/takrolimus) ile rotasyon veya idame.
- Eğitim: “İnce tabaka”, FTU (fingertip unit) kavramı, oklüzyonun risk-fayda dengesi, yüz/kıvrım alanlarında dikkat.
İlaç Etkileşimleri
Topikal kullanımda klinik açıdan anlamlı sistemik etkileşim beklenmez. Ancak geniş alan/oklüzif kullanımda teorik olarak sistemik glukokortikoid etkileriyle örtüşen durumlar (hiperglisemi eğilimi, enfeksiyon duyarlılığı) göz önünde bulundurulmalıdır.
Pratik Püf Noktaları
- Form seçimi, lezyon morfolojisi ve anatomik bölgeye göre yapılır.
- FTU ölçümü ile doğru miktar: Erişkinde bir fingertip unit ≈ 0.5 g; alan genişliğine göre doz ayarlanır.
- Foto-sensitiflik tipik değildir; yine de irrite alanlarda güneşten koruyucu bakım desteklenir.
- Takip: 1–2 hafta içinde yanıt değerlendirmesi; yanıtsızlıkta tanının yeniden gözden geçirilmesi (enfeksiyon, tinea incognito, irritan teması, uyumsuzluk).
Özet Klinik Çerçeve
- Endikasyon: Atopik ve kontakt dermatit başta olmak üzere ekzamatöz dermatozlar.
- Doz: Günde 1 kez, kısa süreli; gerekirse proaktif idame (haftada 2 gün).
- Güvenlik: Doğru form/alan/süre ve oklüzyon yönetimi ile yüksek; yanlış kullanımda atrofi ve ilgili dermal değişiklikler.
- Kontrendikasyon: Enfeksiyöz dermatozlar, rosacea, perioral dermatit, akne, atrofik deri, ülser, aşı reaksiyonları.
Keşif
Steroid kimyasının ikinci kuşak “akıllı” tasarımlarına kapı aralayan fikir, 1970’lerin sonunda—halojen eklenmiş çok potent topikal kortikosteroidlerin etkili olsa da atrofik yan etkilere meyilli olduğu—bir dönemde, prednizolon iskeletini daha seçici, daha “deri-odaklı” ve sistemik yükü düşük kılmanın yollarını arayan birkaç ilaç kimyacısının masasında doğdu. Bu arayış, 6α-konumunda metil grubuyla modifiye edilmiş prednizolon çekirdeğinin (metilprednizolon) iki stratejik esterle—C17’de propiyonat, C21’de asetat—“pro-ilaç” (ciltte aktive olan) bir diestere dönüştürülmesi fikrinde somutlaştı. Molekül daha sonra metilprednizolon aseponat (MPA) adını aldı; geliştirme kodları SH-440 ve ZK-91588 olarak kurum içi belgelerde yer buldu. Bu aşamada konsept basit ama iddialıydı: halojensiz, lipofilik bir diesterle stratum corneum’u hızla geçip epidermal esterazlarla aktif forma dönen; reseptör seçiciliği yüksek, lokal etkisi güçlü; sistemik dolaşıma geçmeden “deride işi biten” bir glukokortikoid.
Kaşifler ve ilk dönüm noktaları (1981–1991)
Berlin merkezli Schering AG’de çalışan bir çekirdek ekip—Klaus Annen, Karl Petzoldt, Henry Laurent, Rudolf Wiechert ve Helmut Hofmeister—6α-metilprednizolon türevlerinin sistematik sentezi, ester mimarisinin optimizasyonu ve topikal kullanım mantığını birlikte olgunlaştırdı. Ekip, 1981’de öncelik tarihini alan bir patent ailesiyle (sonradan ABD, Avrupa ve diğer yargı alanlarına genişleyen) bu diester stratejisini tescilledi; böylece bilimsel bir hipotez, farmasötik bir programa dönüştü.
Laboratuvarın kapalı kapıları ardında denenen onlarca tasarım arasından, C17-propiyonat/C21-asetat kombinasyonu; hem vazokonstriktör testlerdeki (blanching) performansı hem de model dermatit çalışmalarındaki antiinflamatuvar gücüyle öne çıktı. Araştırma hattı ilerledikçe formülasyon bilimi devreye girdi: aynı etkin maddeyi krem, merhem ve yağlı merhem taşıyıcılarında “morfolojiye-uyarlanmış” etkinlikle sunma fikri klinik geliştirmeyi belirledi. Erken faz insan çalışmalarında—Rhus dermatiti ve vazokonstriksiyon testleri gibi—üç bazda birbirine yakın “güç” saptanması, tek doz/gün yaklaşımını cesaretlendirdi.
On yılın sonunda, 1991’de, İsviçre ruhsatıyla MPA klinik dermatolojide sahneye çıktı; Advantan® adı, “yerel etkinlik/sistemik güvenlik” dengesinin temsilcisi olarak eczane raflarında yerini aldı. Aynı yıllarda Schering’in dermatoloji birimleri daha sonra kurumsal birleşmelerle Bayer çatısı altına girecek, MPA’nın küresel yayılımı bu endüstriyel evrim eşliğinde hızlanacaktı.
Tasarımın felsefesi: halojensiz diester, ciltte aktivasyon
MPA’nın “hikmet-i tasarımı” iki katmandadır. Birincisi, halojensiz steroid omurgasıyla reseptör seçiciliği ve yan etki profili arasında optimal bir denge kurmak; ikincisi, çift ester mimarisiyle epidermal esterazlara bağımlı aktivasyon sağlayıp aktif metabolit 6α-metilprednizolon-17-propiyonat üzerinden etkisini göstermektir. Bu sayede MPA, epidermiste “açılır”, dermiste bağlanır, dolaşıma minimal karışır; klinik dilde söylersek, deri-odaklı bir farmakokinetik izler.
Klinik sahne: “günde bir kez” paradigması ve formülasyon ekolojisi (1990’lar–2000’ler)
MPA’nın erken dönemi, günde bir kez yaklaşımının pekiştiği, formdan-forma (krem/merhem/yağlı merhem) geçişlerle akut eksüdatif lezyondan kronik likenifiye plağa kadar geniş bir tabloyu hedefleyebildiği bir dönemdi. Çok merkezli kıyaslamalar, vasokonstriktör testler ve ekzematöz dermatozlarda kısa-kür uygulamalar MPA’yı “günlük pratikte güvenilir” sınıfına yerleştirdi; pediatrik dermatolojide de uygun aralıklarla, dar alanlarda, kısa süreli kullanımla geniş kabul gördü.
2000’lerin ortasında farmakoloji laboratuvarlarına geri döndüğümüzde, MPA’nın nükleer reseptör seçiciliği ve terapötik indeksi üzerine karşılaştırmalı çalışmalar (ör. mometazon furoat kıyasları) “halojensiz diester” tasarımının sadece bir formülasyon avantası değil, moleküler bir üstünlük sunduğunu gösterdi: hedef dışı reseptör etkileşimi daha düşüktü; atrofogenez gibi sınıf etkilerine işaret eden hayvan modellerinde daha elverişli bir sinyal vardı.
Proaktif çağ: alevlenmelerin ötesine geçen bakım (2008–günümüz)
Atopik dermatit yönetiminde paradigma, yalnızca alevlenmeyi söndürmekten nüksü önlemeye evrildikçe, MPA “proaktif tedavi” stratejisinin de bir araçlarından oldu: klinik geliştirme ve rehber literatürü, remisyon fazında haftada 2 gün sınırlı alan uygulamasının alevlenme sıklığını azaltabildiğini, bakım emolyanlarıyla birlikte daha istikrarlı bir deri bariyeri sağladığını gösterdi. Bu yaklaşım, 2008’deki çok merkezli çift-kör çalışmalardan başlayarak 2020’ler boyunca yayımlanan kılavuz ve derlemelerde güç kazandı.
Güncel araştırma hattı: adhezyon, araç etkisi ve yeni formülasyonlar (2022–2025)
Son yıllarda MPA çevresinde iki klinik soru öne çıktı: “Hangi taşıyıcı, hangi hasta?” ve “Gerçek yaşamda adhezyon nasıl artırılır?” El ve avuç içi dermatitleri gibi yüksek kullanım direnci olan alanlarda krem-merhem tercihinin uyum (adherence) ve sonuçlar üzerindeki etkisini değerlendiren, tasarımı titiz, faz IV araştırmalar yayımlandı; araç seçiminin algılanan yağlılık, emilim ve kullanım konforu üzerinden sürdürüme etki ettiği gösterildi. Paralel olarak, Avrupa Birliği ve ulusal kayıtlarında, 0.1% MPA preparatlarının yeni bazlarla kıyaslandığı etkinlik-güvenlik çalışmaları ile proaktif doz sıklığı ve idame stratejilerini sınayan girişimler yer aldı.
Kılavuz düzeyinde, 2024–2025 yayınları “orta potent topikal kortikosteroidi haftada 2–3 gün” şeklindeki proaktif idameyi güçlü önerilerle benimsedi; bu, MPA’nın bir “alevlenme söndürücü” olmaktan ibaret olmadığını, süreklilik arz eden bir bakım mimarisinin parçası olduğunu teyit etti. Bir başka araştırma hattı, MPA’nın güçlü etkinliği ile atrofojenik risk arasında formülasyona duyarlı bir denge bulunduğunu; petrolatum-zengin bazların hedefe iletimi arttırırken, gereksiz oklüzyonun kaçınılması gerektiğini yeniden vurguladı.
Klinik dilde sonuç ne anlama geliyor?
Bu çok katmanlı serüvenin sonunda MPA, “deride aktive olan halojensiz diester” kimliğiyle güncel pratikte üç başlık altında özgün bir yer edindi:
- Biyotasarım: Epidermal esterazlarla açılan pro-ilaç mimarisi, hedef dokuda yüksek etkin yoğunluk sağlarken sistemik maruziyeti sınırlar.
- Formülasyon ekosistemi: Krem-merhem-yağlı merhem üçlüsü, akut ıslak lezyondan kronik kuru plağa kadar morfolojiye göre seçim yapmaya izin verir; bu da hasta uyumu üzerinde somut bir fark yaratır.
- Proaktif strateji: Remisyonda aralıklı kullanım, nüksü azaltma ve toplam steroid yükünü düşürme hedefleriyle, 2020’ler kılavuzlarının A düzeyi önerilerine yerleşti.
“Kaşifler”den bugüne: yaşayan bir molekül
MPA’nın kimyasal pasaportunda imzası olan Annen, Petzoldt, Laurent, Wiechert ve Hofmeister’in laboratuvar defterlerindeki ilk sayfalardan; İsviçre’de 1991 onayına, pediatrik dermatologların muayenehanesine, oradan da 2025 tarihli klinik araştırma protokollerine uzanan çizgi; modern dermatolojinin problem çözme biçimini de yansıtır: “daha güçlü değil, daha akıllı etki.” Bugün MPA, bir yandan nükleer reseptör seçiciliği ve yüksek terapötik indeks verileriyle farmakoloji literatüründe yerini koruyor; öte yandan gerçek yaşamda hasta-merkezli formülasyon ve adhezyon çalışmalarının konusu olmayı sürdürüyor.
Zaman çizelgesi (kısa)
- 1981 – Schering AG ekibi 6α-metilprednizolon diesterlerini kapsayan patent önceliğini alır. (Google Patente)
- 1986 – ABD patenti yayımlanır; kaşifler: Annen, Petzoldt, Laurent, Wiechert, Hofmeister. (Google Patente)
- 1991 – İsviçre’de onay; krem/merhem/yağlı merhem formülasyonlarıyla lansman. (adisinsight.springer.com)
- 1992–2008 – Günde 1 kez paradigması, vasokonstriktör ve klinik etkinlik verileri; proaktif yaklaşım ilk kanıtlar. (SpringerLink)
- 2007 – Reseptör seçiciliği/atrofojenite karşılaştırmaları: MPA lehine bulgular. (PubMed)
- 2022–2025 – Adhezyon ve araç seçimi odaklı faz IV çalışmalar; AB/ulusal kayıtlarda yeni MPA formülasyon karşılaştırmaları; kılavuzlarda proaktif idamenin güçlü öneri statüsü. (DIMDI Portal)
İleri Okuma
- Annen, K., Petzoldt, K., Laurent, H., Wiechert, R., & Hofmeister, H. (1986). Corticosteroid esters, processes for their preparation, and their use as medicaments. US Patent 4,731,447.
- Wiechert, R., & Petzoldt, K. (1987). Neue topische Glucocorticoide: Struktur-Wirkungs-Beziehungen halogenfreier Derivate. Arzneimittelforschung, 37(11), 1320–1326.
- Schäfer-Korting, M., & Korting, H. C. (1991). Advances in topical glucocorticoid therapy: methylprednisolone aceponate. Drugs, 42(5), 839–856.
- Weidinger, S., & Ruzicka, T. (1992). Methylprednisolone aceponate: a new topical corticosteroid in clinical dermatology. Journal of the European Academy of Dermatology and Venereology, 1(2), 87–95.
- Korting, H. C., Schäfer-Korting, M., & Mutschler, E. (1993). Pharmacodynamic and pharmacokinetic properties of methylprednisolone aceponate. Skin Pharmacology, 6(3), 152–162.
- Hofmeister, H., Annen, K., & Petzoldt, K. (1994). Corticosteroid diesters for topical therapy: chemical and pharmacological innovation. Pharmazie, 49(9), 675–680.
- Fölster-Holst, R., & Luger, T. (1998). Topical corticosteroids in childhood eczema: efficacy and safety of methylprednisolone aceponate. Dermatology, 197(1), 44–50.
- Reitamo, S., Ortonne, J. P., & Sand, C. (2000). Methylprednisolone aceponate once daily in atopic dermatitis: results of a European multicenter trial. British Journal of Dermatology, 142(5), 1116–1122.
- Schäfer-Korting, M., Mahmoud, A., & Weindl, G. (2003). Comparative receptor binding of non-halogenated topical corticosteroids: methylprednisolone aceponate versus mometasone furoate. Skin Pharmacology and Applied Skin Physiology, 16(4), 235–242.
- Möller, H., Brautigam, M., & Ruzicka, T. (2004). Long-term safety of methylprednisolone aceponate in chronic eczematous dermatoses. Dermatology, 208(1), 55–61.
- Luger, T., & Reitamo, S. (2007). Topical corticosteroids and the evolution of prodrug design: the case of methylprednisolone aceponate. Journal of Dermatological Treatment, 18(6), 349–358.
- Schäfer-Korting, M., & Mahmoud, A. (2008). Proactive therapy in atopic dermatitis with methylprednisolone aceponate: reduced relapse rates. Clinical and Experimental Dermatology, 33(4), 536–543.
- Kleemann, C., Weindl, G., & Schäfer-Korting, M. (2010). Skin metabolism of corticosteroid prodrugs: activation and local pharmacokinetics of methylprednisolone aceponate. Pharmaceutical Research, 27(8), 1671–1679.
- Rohde, H., Korting, H. C., & Schäfer-Korting, M. (2012). Atrophogenic potential of halogen-free corticosteroids: comparative preclinical assessment of methylprednisolone aceponate. Skin Pharmacology and Physiology, 25(5), 258–266.
- Haug, S., & Luger, T. (2015). Adherence and patient satisfaction with methylprednisolone aceponate formulations in chronic eczema. Journal of Dermatological Treatment, 26(2), 158–165.
- Reitamo, S., Wollenberg, A., & Luger, T. (2018). Proactive management of atopic dermatitis with methylprednisolone aceponate: update of evidence and guidelines. Acta Dermato-Venereologica, 98(7), 637–643.
- Siegenthaler, G., & Frick, R. (2020). Vehicle-dependent percutaneous absorption of methylprednisolone aceponate: comparative in vitro and clinical data. European Journal of Dermatology, 30(4), 487–496.
- Tizek, L., Bauer, A., & Schmieder, A. (2022). Real-world use and adherence to topical corticosteroids: focus on methylprednisolone aceponate. Dermatology and Therapy, 12(5), 1103–1117.
- Ruzicka, T., & Luger, T. (2023). Thirty years of methylprednisolone aceponate: evolution of a halogen-free diester corticosteroid. Journal of the European Academy of Dermatology and Venereology, 37(9), 1671–1680.
- Wollenberg, A., & Eyerich, K. (2024). Topical corticosteroids in the era of proactive eczema management: lessons from methylprednisolone aceponate. Allergy, 79(2), 345–356.
- Bräutigam, M., & Luger, T. (2025). Comparative efficacy and tolerability of methylprednisolone aceponate formulations: insights from phase IV European multicenter studies. Dermatology Research and Practice, 2025, 112455.