Osteoindüktivite ve osteojenisite, kemik biyolojisinin iki “kurucu” kavramı gibi düşünülebilir: biri kemik oluşumunu başlatma/uyandırma gücünü, diğeri ise bizzat kemik yapabilme kapasitesini anlatır.
İçindekiler
1) Etimoloji ve kavramsal çerçeve
Osteo- / -genik / -indüktif
- Osteo-: Eski Yunanca osteon (ὀστέον) = “kemik”.
- -genik: Yunanca -genēs (γενής) ve kök olarak gignesthai (γίγνεσθαι) = “doğmak, meydana gelmek, üretmek”. Tıpta “üreten/oluşturan” anlamı taşır.
- İndüksiyon / indüktif: Latince inducere = “içeri götürmek, sebep olmak, başlatmak”. Biyolojide “bir süreci tetiklemek/başlatmak” nüansını taşır.
Bu etimoloji bile tek başına güçlü bir ayrım önerir:
- Osteojenik (osteogenic): “Kemik üreten/kemik oluşturan.”
- Osteoindüktif (osteoinductive): “Kemik oluşumunu başlatan/kemik oluşumunu indükleyen.”
2) “Osteoindüktivite” nedir?
Osteoindüktivite, bir materyalin veya biyolojik sinyal ortamının, normalde kemik yapmayan bir bölgede bile (ektopik ortamda) yeni kemik oluşumunu başlatabilmesi demektir. Buradaki kilit kelime “başlatma”dır: ortamda kemik hücresi olmasa bile, uygun öncül hücreleri (özellikle mezenkimal kök hücreleri) kemik hattına yönlendirebilecek bir “biyolojik komut” üretir ya da taşır.
Osteoindüktivitenin biyolojik mantığı
Kemik oluşumu bir “program” gibi çalışır:
- Öncül hücre kaynağı (mezenkimal kök hücre / osteoprogenitör havuz),
- Sinyal (kemik yönünde farklılaşmayı başlatan büyüme faktörleri, morfogenler),
- İskele ve mikro-çevre (hücrelerin tutunacağı ve damarların gireceği yapı),
- Mekanik ve metabolik izin (kanlanma, oksijen, mikro-stres, mineral dengesi).
Osteoindüktif etki, özellikle (2) numaralı basamağı “yakma” kapasitesidir: osteoblast soyuna geçişi başlatır.
Biyomalzemelerde osteoindüktivite
Klinikte “osteogreft” veya “kemik yerine geçen materyal” konuşulurken üç ayrı özellik yan yana gelir:
- Osteokondüktif (osteoconductive): Hücrelerin üzerine tırmanabileceği bir iskeleyi sağlar (ör. gözenekli seramikler gibi). “Yol” verir, ama “yola çık” demez.
- Osteoindüktif (osteoinductive): Hücrelere “kemik ol” diye biyolojik talimat verir (ör. uygun koşullarda BMP taşıyan sistemler).
- Osteojenik (osteogenic): Materyalin içinde veya üzerinde zaten canlı kemik yapıcı hücreler vardır (ör. hücre içeren otogreft).
Bu üçlü ayrım, özellikle kemik grefti seçimi ve biyomalzeme tasarımı açısından temel bir “kavramsal harita”dır.
3) “Osteojenik bir kemik hastalığı mıdır?” sorusunun kavramsal yanıtı
Hayır. “Osteojenik” tek başına bir “hastalık adı” değildir; bir özellik/sıfattır. Tıpta “osteojenik” kelimesi çoğu zaman:
- “Kemik oluşturan” (hücre/aktivite),
- “Kemik kaynaklı” (örn. osteojenik tümör ifadesi tarihsel kullanımda görülebilir),
- “Kemik yapımını artıran” (örn. osteojenik yüklenme)
anlamlarında kullanılır.
Buradaki karışıklık genellikle iki kelimenin benzerliğinden doğar:
- Osteojenik (sıfat)
- Osteogenez / osteogenezis (kemik oluşumu süreci)
ve bununla ilişkili Osteogenezis imperfekta (hastalık adı).
Osteogenezis imperfekta (OI) nedir?
Osteogenezis imperfekta, “kusurlu kemik oluşumu” anlamına gelir:
- Osteogenezis: kemik oluşumu,
- İmperfekta: Latince “kusurlu, eksik, mükemmel olmayan”.
OI, klasik olarak Tip I kollajen biyosenteziyle ilişkili genetik bozukluklar nedeniyle, kemik matriksinin kalitesinin bozulduğu; kırılganlık, deformite, büyüme sorunları ve değişken sistemik bulgularla seyreden kalıtsal bir bağ dokusu-kemik hastalığı spektrumudur. Yani hastalık adı “osteojenik” değil; osteogenezis (kemik oluşumu) sözcüğünü içerir ve patoloji “kemik oluşumunun niteliğinde bozulma” fikrine dayanır.
Bu nedenle:
- Osteojenik = özellik/süreçle ilgili sıfat
- Osteogenezis imperfekta = belirli genetik hastalık
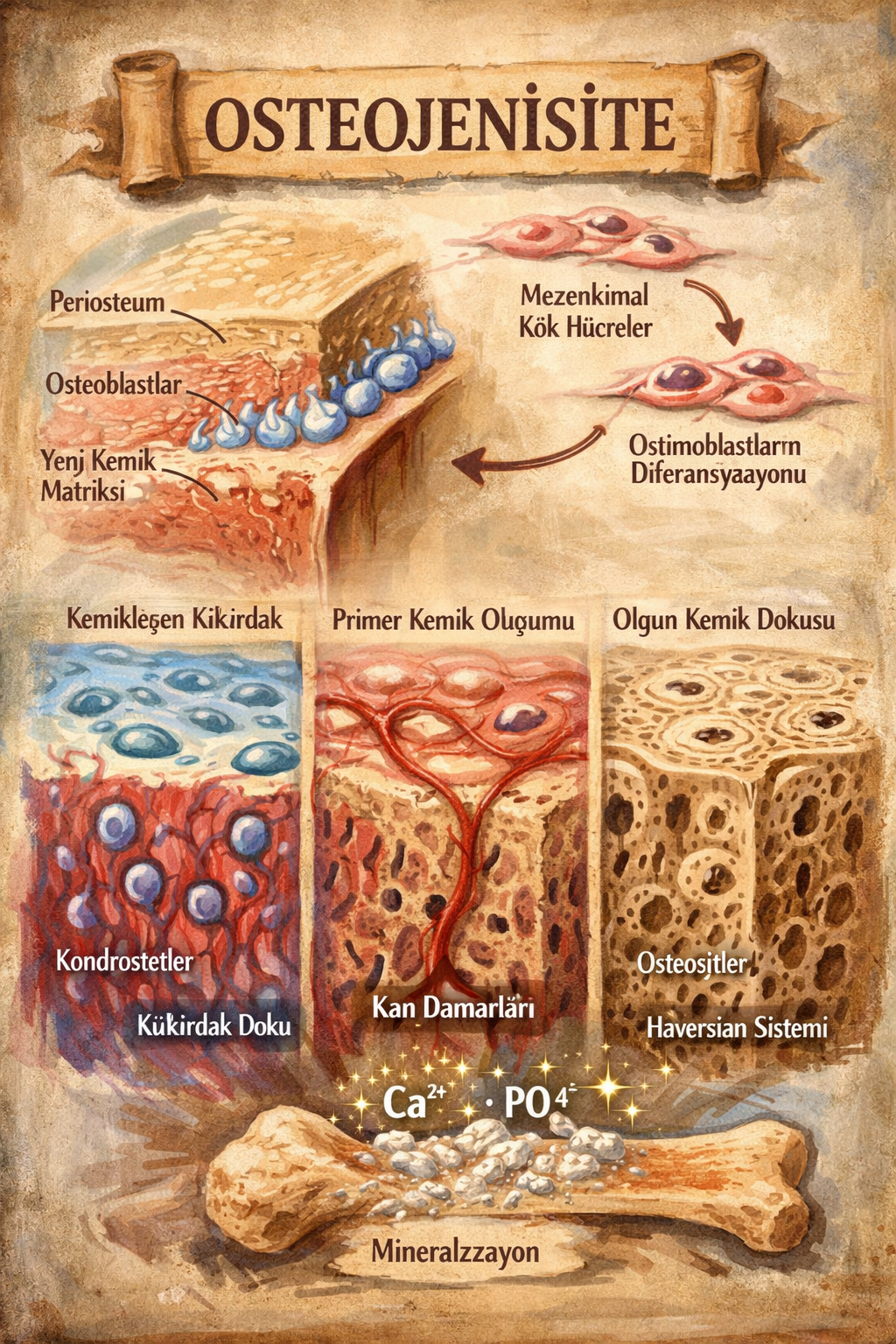
4) Osteojenisite (osteogenic capacity) nedir?
Osteojenisite, kemik dokusu üretme kapasitesidir; en “somut” haliyle, osteoblastların yeni osteoid (kemik matriksi) sentezleyip mineralize edebilmesi demektir.
Klinik ve biyomalzeme dilinde osteojenisite çoğu zaman şu anlamlarda kullanılır:
- Bir greftin içinde canlı osteojenik hücreler bulunması (özellikle otogreft),
- Bir tedavinin kemik yapıcı hücreleri fonksiyonel olarak artırması,
- Bir aktivitenin kemik yapım dengesini pozitif yönde kaydırması.
Önemli ayrım:
- Osteoindüktif etki: “Hücreyi kemik hattına yönlendirir.”
- Osteojenik etki: “Kemik yapacak hücreyi sağlar veya kemik yapımını fiilen yürütür.”
Bir başka deyişle osteoindüksiyon daha çok “komuta zinciri”, osteojenisite daha çok “iş gücü ve üretim bandı” gibidir.
5) Osteojenik hücreler nerede bulunur? Osteoprogenitör (osteojenik) hücrelerin biyolojisi
Osteoprogenitör (osteojenik) hücreler
Osteoprogenitör hücreler, kemik yapıcı soyun erken öncülleridir; çoğunlukla mezenkimal kök hücre havuzundan türeyen ve uygun sinyaller altında osteoblast yönünde farklılaşabilen hücreler olarak düşünülür.
Başlıca anatomik “nişler” (hücresel yerleşim bölgeleri)
- Periost (kemik zarı): Özellikle iç kambiyum tabakasında osteoprogenitör kapasite yüksektir; kırık iyileşmesinde periost, adeta “yerel rejenerasyon organı” gibi davranır.
- Endost (kemik iç yüzeyi): Kortikal kemiğin iç yüzeyini ve trabeküler yüzeyleri döşeyen endosteal bölgede öncül hücreler ve osteoblastlar bulunur.
- Kemik iliği stroması: Mezenkimal kök hücreler ve stromal öncüller; osteoblast soyunun önemli kaynağıdır.
- Vasküler/perivasküler alanlar: Damarlara komşu perisit-benzeri hücrelerin osteojenik potansiyeli, modern kemik biyolojisinin güçlü temalarındandır (kanlanma ile osteogenez arasındaki sıkı bağın hücresel karşılığı).
Osteoblast → osteosit dönüşümü
Osteoblastlar matriksi üretir; bir kısmı matriks içine “gömülerek” osteosite dönüşür. Osteosit, kemikte yalnızca “pasif bir hücre” değil; kemik dokusunun mekanik duyusunu, mineral metabolizmasını ve yeniden şekillenmeyi yöneten merkezi bir “ağ düğümü”dür.
6) Osteojenik aktiviteler nelerdir?
“Osteojenik aktivite” kavramı iki düzeyde ele alınır:
- Biyomekanik düzey: Kemik dokusunun yüklenmeye verdiği adaptif yanıt
- Hücresel-moleküler düzey: Osteoblast aktivitesi, osteoklast aktivitesi ve osteosit aracılı sinyal ağları
6.1. Ağırlık taşıyan ve darbeli yüklenme (osteojenik yükleme)
Kemik, “kullanıldıkça güçlenen” bir dokudur; ancak bu sloganın arkasında oldukça seçici bir biyoloji yatar. Osteojenik yüklenme, kemik yapıcı sistemi uyaracak “eşik ve örüntüde” mekanik gerilim anlamına gelir. Burada belirleyici olan sadece ağırlık değil; yükün:
- Büyüklüğü (strain düzeyi),
- Hızı (yükleme oranı),
- Yön değişkenliği (çok yönlü stres),
- Aralıklı oluşu (dinlenme araları),
- Tekrarlanma paterni
gibi özellikleridir.
Bu yüzden:
- Sadece uzun süreli düşük şiddetli yük (ör. çok uzun, tekdüze yürüyüş) sınırlı uyarı oluşturabilirken,
- Daha kısa süreli, aralıklı, yön değiştiren, sıçrama/darbe içeren aktiviteler daha belirgin osteojenik sinyal üretebilir.
6.2. Mekanotransdüksiyon: Kemik “nasıl hisseder”?
Kemik dokusu mekanik yükü kimyasal dile çevirir. Bu çeviride osteosit ağı, laküno-kanaliküler sistemdeki sıvı akışı ve hücre iskeleti gerilimi kritik rol oynar. Sonuçta:
- Osteoblast aktivitesi artabilir,
- Osteoklast aktivitesi baskılanabilir,
- Yeniden şekillenme birimleri hedeflenen bölgelere yönlendirilebilir.
Bu biyolojik “mekanik-duyu” sistemi, uzun süreli yatak istirahati, immobilizasyon veya mikrogravite koşullarında neden kemik kaybı olduğunu da açıklar: yükten arınma, kemik için “iş yok, üretimi azalt” sinyali üretir.
6.3. Klinik olarak osteojenik sayılan aktivite örnekleri (genel ilkeler)
- Zıplama/sıçrama içeren aktiviteler (uygun bireylerde),
- Direnç egzersizleri (kas kuvveti → kemik üzerine çekme kuvveti),
- Çok yönlü saha sporları (yön değişimi, ivmelenme, frenleme),
- Kısa-yoğun aralıklı yüklenmeler (dinlenme aralarıyla).
Bunlar bir “reçete” değildir; osteoporoz, kırık riski, kardiyovasküler durum, nörolojik denge sorunları gibi değişkenler bireysel düzeltme gerektirir. Yine de prensip açıktır: kemik, monoton yükten çok, anlamlı ve değişken mekanik bilgiye yanıt verir.
7) Osteoindüksiyon ve osteojenisite kemik iyileşmesinde nasıl birleşir?
Kırık iyileşmesi veya kemik defekti onarımında başarılı sonuç genellikle şu üçlünün birlikte sağlanmasına bağlıdır:
- Osteojenik hücre kaynağı (osteoblast/öncüller),
- Osteoindüktif sinyal (farklılaşmayı başlatan biyolojik komutlar),
- Osteokondüktif iskele (hücrelerin organize olacağı yapı).
Doğada bu üçlü çoğu zaman periost ve kırık hematomu içinde kendiliğinden “paketlenmiş” halde bulunur: hematom inflamasyonu sadece hasarın yan ürünü değil, aynı zamanda rejenerasyonun başlangıç düğmesidir; periost ise hem hücre kaynağı hem de biyomekanik ve vasküler düzenleyici bir ortam sunar.
8) Evrimsel bakış: Neden kemik bu kadar “uyarılabilir” bir doku?
Kemik, omurgalı evriminde yalnızca bir “sert iskelet” değil, aynı zamanda:
- Hareketin biyomekaniğine uyum sağlayan dinamik bir yapı,
- Mineral deposu (özellikle kalsiyum-fosfat homeostazı),
- Kan yapımının nişi (kemik iliği mikroçevresi),
- Büyüme ve gelişimin kayıt defteri
haline gelmiştir.
Bu çoklu görev, kemiğin “değişmez bir taş” olmasına izin vermez; tam tersine kemik, çevresel talepleri (yüklenme, beslenme, hormonal durum, gebelik-laktasyon, hastalık) biyolojik kararlara çeviren bir organ gibi davranır. Osteoindüksiyon bu esnekliğin “başlatma mekanizması”; osteojenisite ise “yapım kapasitesi” olarak evrimsel bir iş bölümü hissi verir: biri doğru zamanda doğru hücre programını açar, diğeri o programı üretime dönüştürür.
9) Kavramların kısa ama kesin ayrımı (karışıklığı önleyen tanımlar)
- Osteoindüktif: Kemik oluşumunu başlatan; öncül hücreleri osteoblast soyuna yönlendiren.
- Osteokondüktif: Kemik büyümesi için iskele sağlayan; hücrelerin tutunmasına ve damar girişine izin veren.
- Osteojenik: Kemik yapan hücreleri içeren veya kemik yapımını fiilen gerçekleştiren kapasite.
- Osteojenik (hastalık?): Hastalık adı değildir.
- Osteogenezis imperfekta: Genetik, “kusurlu kemik oluşumu” spektrumudur; “osteogenez” terimini içerir ama “osteojenik” sıfatıyla aynı şey değildir.
Keşif
Osteojenisite kavramının tarihsel serüveni, tek bir keşif anından ziyade, yaklaşık üç yüzyıla yayılan, anatomi, embriyoloji, mekanik, hücre biyolojisi ve moleküler genetiğin iç içe geçtiği çok katmanlı bir düşünsel evrim olarak okunmalıdır. Bu hikâye, kemiğin “cansız bir destek dokusu” değil, çevresiyle sürekli diyalog hâlinde olan dinamik bir biyolojik sistem olduğunun yavaş yavaş fark edilmesiyle şekillenir.
1. Anatomik sezgilerden biyolojik kavrama: 18. yüzyıl
Osteojenisiteye giden yol, modern hücresel biyolojiden çok önce, kemiğin canlı bir doku olduğuna dair ilk sezgilerle başlar.
18. yüzyılın ortalarında John Hunter, kemiğin kırık sonrası iyileşmesini ve dişlerin çene kemiğiyle ilişkisini incelerken, kemikte “yenilenme” ve “üretim” fikrini açıkça dile getiren ilk hekim-anatomistlerden biri olur. Hunter için kemik, sadece şekil veren bir iskelet elemanı değil; kanlanan, tepki veren ve kendini onaran bir dokudur. Her ne kadar “osteojenisite” terimini kullanmasa da, kemiğin üretici kapasitesi fikri bu dönemde ilk kez bilimsel zemine oturur.
2. Hücresel bakışın doğuşu: 19. yüzyıl
- yüzyıl, histolojinin gelişmesiyle birlikte kemiğin mikroskobik dünyasının açıldığı dönemdir. Osteoblast ve osteoklast kavramları bu yüzyılda tanımlanır; kemik yapımı ve yıkımının ayrı hücresel aktörler tarafından yürütüldüğü anlaşılır.
Bu dönemde osteojenisite artık belirsiz bir “canlılık özelliği” olmaktan çıkar; belirli hücrelerin belirli bir fonksiyonu olarak düşünülmeye başlanır. Osteoblast, kemiğin “üreten” hücresi olarak tanımlandığında, osteojenisite de örtük biçimde “osteoblastik kapasite” ile özdeşleşir.
3. Mekanik düşüncenin eklenmesi: Wolff ve adaptasyon fikri
- yüzyılın sonlarında Julius Wolff, kemiğin iç mimarisinin mekanik yüklere göre değiştiğini sistematik biçimde tanımlar. Daha sonra “Wolff yasası” olarak adlandırılacak bu yaklaşım, osteojenisite kavramına yeni bir boyut ekler:
Kemik sadece hücrelerin içsel programına göre değil, mekanik çevresine yanıt vererek üretilir.
Bu noktada osteojenisite artık sabit bir özellik değildir; yüklenme, kullanım ve çevresel streslerle artıp azalabilen dinamik bir kapasite olarak düşünülmeye başlanır. Kemiğin “üretme gücü”, organizmanın yaşam tarzıyla doğrudan ilişkilendirilir.
4. Biyomekanik-hücresel sentez: 20. yüzyılın ilk yarısı
- yüzyılın başlarında Wilhelm Roux ve onu izleyen araştırmacılar, mekanik uyaranların embriyolojik ve hücresel gelişimi nasıl yönlendirdiğini tartışır. Kemik dokusu, artık yalnızca erişkin organizmanın adaptif yapısı değil; gelişim sırasında da mekanik sinyallerle şekillenen bir sistem olarak ele alınır.
Bu dönem, osteojenisitenin:
- hücresel köken,
- gelişimsel zamanlama,
- mekanik uyaran
üçgeninde düşünülmeye başlandığı bir kavşak noktasıdır.
5. Osteojenisite–osteoindüksiyon ayrımının doğuşu
- yüzyılın ortalarına gelindiğinde, kemik biyolojisinde kavramsal bir netleşme ihtiyacı doğar. Bu kırılma noktası, Marshall R. Urist ile özdeşleşir.
Urist, ektopik ortamlarda kemik oluşumunu gözlemlediğinde, kemik yapımında iki farklı ama ilişkili süreç olduğunu fark eder:
- Bir yanda, kemik yapabilen hücrelerin fiilî üretim kapasitesi (osteojenisite),
- Diğer yanda, kemik yapmayan hücreleri kemik hattına yönlendiren başlatıcı sinyaller (osteoindüksiyon).
Bu ayrım, osteojenisiteyi ilk kez net biçimde “kemik üretme kapasitesi” olarak tanımlar ve onu osteoindüktiviteden kavramsal olarak ayırır. Böylece osteojenisite, yalnızca “kemik oluşması” değil, kim tarafından ve nasıl üretildiği sorusunun yanıtı hâline gelir.
6. Yeniden şekillenme paradigması: 20. yüzyılın ikinci yarısı
Bu dönemde Harold M. Frost, kemiğin yaşam boyu süren yeniden şekillenmesini açıklamak için “mekanostat” modelini geliştirir. Osteojenisite artık:
- sistemik hormonlar,
- lokal mekanik yük,
- hücresel duyusal ağlar
tarafından sürekli ayarlanan bir biyolojik çıktı olarak ele alınır.
Bu yaklaşım, osteojenisiteyi statik bir hücresel yetenek olmaktan çıkarır; organizmanın ihtiyaçlarına göre ayarlanan bir yanıt sistemi olarak konumlandırır. Kemik, bu bakışta hem sensör hem üretici hem de arşivdir.
7. Moleküler çağ: 21. yüzyıl
Günümüzde osteojenisite, hücre düzeyinin ötesinde, moleküler ağlar üzerinden tanımlanır. Mezenkimal kök hücrelerin osteoblast yönüne farklılaşması; transkripsiyon faktörleri, sinyal yolakları ve epigenetik düzenlemelerle açıklanır. Osteojenisite artık şu sorular etrafında ele alınır:
- Hangi genetik programlar osteoblast kimliğini başlatır?
- Mekanik yük hücre çekirdeğine nasıl çevrilir?
- Yaşlanma, inflamasyon ve metabolik hastalıklar osteojenik kapasiteyi neden düşürür?
- Osteojenisite terapötik olarak artırılabilir mi?
Bu çağda osteojenisite, ortopediden endokrinolojiye, rejeneratif tıptan uzay biyolojisine kadar uzanan geniş bir araştırma alanının merkez kavramlarından biri hâline gelir.
8. Güncel araştırma ufku
Bugün osteojenisite:
- kök hücre temelli rejeneratif yaklaşımlarda,
- biyomalzeme ve doku mühendisliğinde,
- osteoporoz ve kırık iyileşmesi stratejilerinde,
- mikrogravite ve immobilizasyon çalışmalarında
aktif olarak araştırılan bir biyolojik kapasite olarak ele alınır.
Artık osteojenisite, yalnızca “kemik yapma” yeteneği değil; organizmanın çevresel, mekanik ve moleküler bilgiyi kemik dokusuna dönüştürme becerisi olarak anlaşılır. Bu tarihsel çizgi, osteojenisite kavramının basit bir hücresel fonksiyondan, bütüncül bir biyolojik ilkeye dönüşümünü gözler önüne serer.
İleri Okuma
- Frost, H. M. (2004). A 2003 Update of Bone Physiology and Wolff’s Law for Clinicians. The Angle Orthodontist, 74(1), 3–15.
- Ruff, C., Holt, B., Trinkaus, E. (2006). Who’s afraid of the big bad Wolff?: “Wolff’s law” and bone functional adaptation. American Journal of Physical Anthropology, 129(4), 484–498.
- Robling, A. G., Castillo, A. B., Turner, C. H. (2006). Biomechanical and molecular regulation of bone remodeling. Annual Review of Biomedical Engineering, 8, 455–498. https://doi.org/10.1146/annurev.bioeng.8.061505.095721
- Karsenty, G., Kronenberg, H. M., Settembre, C. (2009). Genetic control of bone formation. Annual Review of Cell and Developmental Biology, 25, 629–648. https://doi.org/10.1146/annurev.cellbio.042308.113308
- Raggatt, L. J., Partridge, N. C. (2010). Cellular and molecular mechanisms of bone remodeling. Journal of Biological Chemistry, 285(33), 25103–25108. https://doi.org/10.1074/jbc.R109.041087
- Florencio-Silva, R., Sasso, G. R. da S., Sasso-Cerri, E., Simões, M. J., Cerri, P. S. (2015). Biology of Bone Tissue: Structure, Function, and Factors That Influence Bone Cells. BioMed Research International, 2015, 421746. https://doi.org/10.1155/2015/421746
- Marini, J. C., Forlino, A., Bächinger, H. P., et al. (2017). Osteogenesis imperfecta. Nature Reviews Disease Primers, 3, 17052. https://doi.org/10.1038/nrdp.2017.52
- Einhorn, T. A., Gerstenfeld, L. C. (2015). Fracture healing: mechanisms and interventions. Nature Reviews Rheumatology, 11(1), 45–54. https://doi.org/10.1038/nrrheum.2014.164
- Urist, M. R. (1965). Bone: Formation by Autoinduction. Science, 150(3698), 893–899. https://doi.org/10.1126/science.150.3698.893
- Habraken, W. J. E. M., Wolke, J. G. C., Jansen, J. A. (2007). Ceramic composites as matrices and scaffolds for drug delivery in tissue engineering. Advanced Drug Delivery Reviews, 59(4–5), 234–248. https://doi.org/10.1016/j.addr.2007.03.011