“Periosteum” terimi Grekçe’den türemiştir:
- Peri (περί) – “çevresinde”
- Osteon (ὀστέον) – “kemik”
Terimleri ise doğrudan “kemik derisi/zarı” anlamındadır ve kavramın histolojik gerçekliğini yalın ama etkileyici biçimde ifade eder.
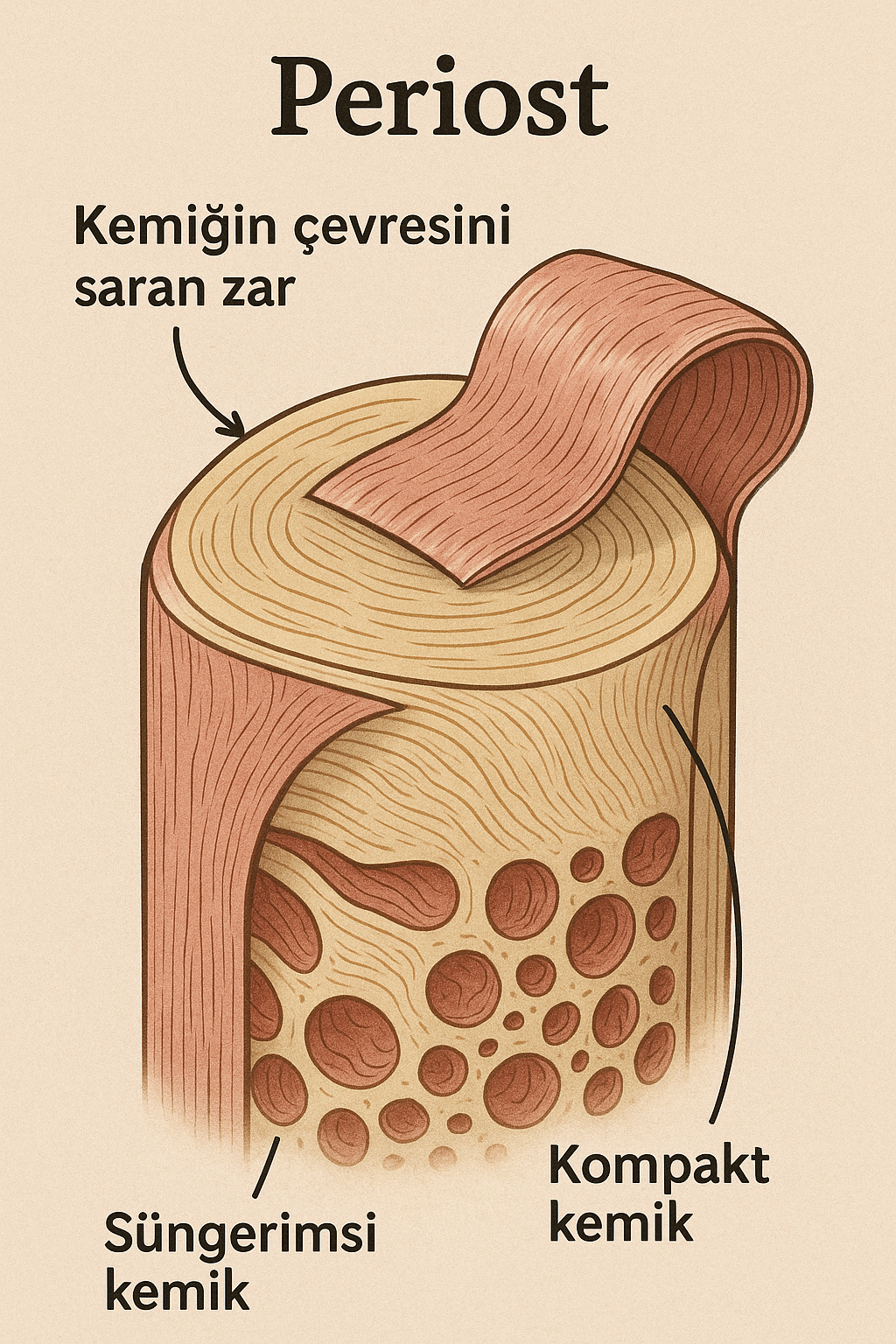
Anlamı itibarıyla “kemiğin çevresini saran zar” olarak tanımlanabilir. Ancak periosteum yalnızca anatomik bir örtü değildir; çok katmanlı yapısı, zengin damar ve sinir ağı, hücresel çeşitliliği ve fizyolojik rolleri ile kemik biyolojisinin merkezi bir aktörüdür.
İçindekiler
1. Histolojik Yapı ve Katmanlar
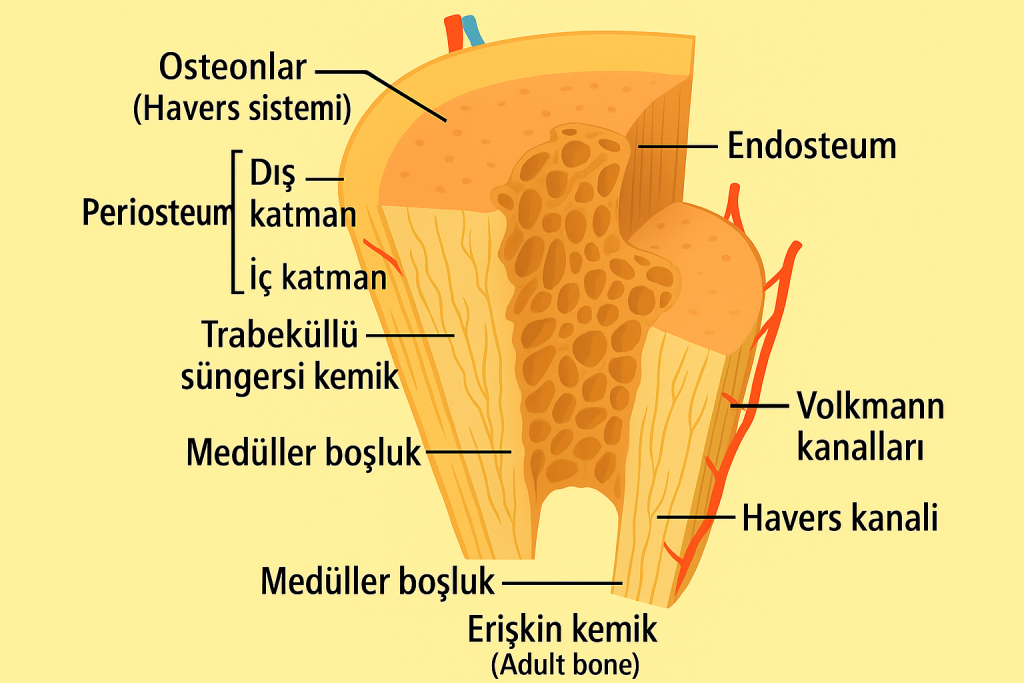
Periosteum iki temel tabakadan oluşur:
- Dış (fibröz) tabaka: Kollajen lifler açısından zengin, yoğun düzensiz bağ dokusundan oluşur. Mekanik koruma sağlar. Bu katman, kasların, tendonların ve bağların kemiğe tutunma noktalarını içerir. Sharpey lifleri olarak adlandırılan yapılar, bu bağ dokusunu kemik dokusuna fiziksel olarak entegre eder.
- İç (kambiyal veya osteogenik) tabaka: Osteoblastlar, osteoklastlar ve osteoprogenitör hücreler bakımından zengindir. Bu tabaka kemik onarımı, remodelingi ve yeni kemik oluşumu süreçlerinde temel rol oynar.
2. Embriyolojik Köken
Periosteum, embriyogenez sürecinde mezoderm kökenlidir. Mezenkimal kök hücrelerin farklılaşması sonucu oluşur. Uzun kemiklerin intramembranöz ve endokondral ossifikasyonu sırasında periosteal tabaka gelişir ve kemikleşmenin periferik olarak ilerlemesini sağlar. Özellikle endokondral ossifikasyonda periosteal kemik manşeti (periosteal collar), ilk mineralize yapı olarak belirir.
3. Fizyolojik Fonksiyonları
Periosteum çok yönlü işlevlere sahiptir:
- Kemik büyümesi ve remodelingi: Osteoblastik aktivite sayesinde çocukluk ve ergenlik dönemlerinde kemik kalınlığında artış sağlar (appositional growth).
- Rejenerasyon ve onarım: Kırık sonrası kemik iyileşmesinde periosteumdan kaynaklanan progenitör hücreler aktif rol oynar.
- Beslenme: Periosteum, kemik yüzeyinin vaskülarizasyonunda önemli bir kaynaktır. Özellikle kortikal kemiğin dış üçte birlik kısmının beslenmesinde kritik bir rol oynar.
- Duyu: Periosteum, yoğun sinir sonlanmaları içerir. Bu nedenle kemik yüzeyine yönelik travmalar ağrılıdır.
4. Klinik Önemi ve Patolojik Durumlar
4.1. Kırık iyileşmesi
Kırık hattında periosteum’un korunmuş olması, iyileşme prognozunu doğrudan etkiler. Özellikle çocuklarda kalın ve vasküler periosteum, hızlı ve efektif bir iyileşme sağlar.
4.2. Periostit
Periosteum’un inflamasyonu olup genellikle travma, enfeksiyon veya kronik aşırı kullanımla ilişkilidir. Radyolojik olarak “periosteal reaksiyon” şeklinde belirir. Örneğin, shin splint sendromunda tibianın periosteal hattı tutulur.
4.3. Tümöral süreçler
Osteosarkom gibi agresif kemik tümörlerinde periosteum, “sunburst” ya da “Codman üçgeni” gibi patognomonik radyolojik bulgulara neden olan periosteal tepkiler gösterebilir.
4.4. Ortopedik cerrahi
Kemik grefti uygulamalarında periosteum’un alınması veya korunması, greftin entegrasyonunu doğrudan etkiler. Aynı şekilde, periosteal kaldırma işlemleri rejeneratif tıpta yeni kemik oluşumunu uyarmak için kullanılır.
5. Karşılaştırmalı Anatomi ve Evrimsel Perspektif
Omurgalılar arasında periosteum oldukça konservedir. Ancak bazı türlerde (örneğin amfibilerde) periosteal organizasyon farklılık gösterebilir. Evrimsel olarak, periosteum’un osteojenik kapasitesi, karasal yaşama geçişte iskeletin mekanik dayanıklılığı ve yeniden yapılanması açısından avantaj sağlamıştır.
6. Modern Araştırmalar ve Biyoteknolojik Uygulamalar
Periosteum, günümüzde doku mühendisliği ve rejeneratif tıp alanlarında büyük bir ilgi odağıdır. Özellikle periosteal-derived stem cells (PDSCs), kemik ve kıkırdak dokusu üretimi için umut vaat eden hücresel kaynaklardır. Ayrıca biyobozunur iskeletlerle kombine edilen periosteal greftler, kemik rejenerasyonunda deneysel olarak kullanılmaktadır.
Keşif
Periosteum’un yani kemik zarının keşfi ve bilimsel kavramsallaştırılması, antikçağdan günümüze kadar uzanan çok katmanlı ve aşamalı bir süreci yansıtır. Bu sürecin temel özelliği, başlangıçta gözleme dayalı anatomik sezgilerin, zamanla mikroskopik düzeyde histolojik ve hücresel analizlerle yer değiştirmesidir. Kavramın ilk kez ne zaman tanımlandığını kesin olarak belirlemek zor olsa da, klasik tıbbın öncüleri olan Hipokrat ve Galen gibi isimler, kemiği çevreleyen bir zardan bahsederek erken dönem algılamaların temelini atmıştır.
Antik Yunan tıbbında, özellikle MÖ 4. yüzyılda yaşamış olan Hipokrat’ın metinlerinde kemiklerin bir tür “dış tabaka” ile sarıldığından söz edilir. Ancak bu yapıya bugünkü anlamda “periosteum” adı verilmez; daha çok gözleme dayalı fonksiyonel çıkarımlar içerir. Hipokrat, özellikle travmatik kemik yaralanmalarında bu zarın kesilmesiyle iyileşmenin zorlaştığını gözlemlemişti. Onun eserlerinde bu dokunun kemik sağlığına katkıda bulunan bir yapı olduğu sezinlenir.
Roma dönemi hekimi Galen (MS 2. yüzyıl), anatomiye olan ilgisiyle bu alandaki bilgileri sistematize etmeye başlamış, kemikleri saran “zar”ın damar taşıdığına ve bu sayede kemiğin beslenmesine katkı sağladığına dikkat çekmiştir. Galen’in metinlerinde bu zar, kemik dokudan bağımsız ama onunla entegre çalışan canlı bir yapı olarak tanımlanır. Ancak mikroskobun henüz icat edilmemiş olması, yapının hücresel veya çok katmanlı doğasının anlaşılamamasına neden olmuştur.
Ortaçağ boyunca bu bilgi tekrarlanmış, ancak detaylandırılmamıştır. Modern anlamda periosteum’un tanımlanması, mikroskopik anatominin gelişmeye başladığı Rönesans sonrasına denk gelir. Özellikle 17. yüzyılda Marcello Malpighi (1628–1694) gibi öncü mikroskopistlerin doku düzeyinde çalışmaları, periosteum’un sadece mekanik değil, fizyolojik olarak da etkin bir doku olduğunu ortaya koymuştur. Malpighi’nin çalışmaları, dokuların katmanlı yapısına dair ilk sistematik yaklaşımları içermekteydi. Bu dönemde, periosteum’un damar içerdiği ve bu damarların kemiğe yayıldığı gözlemlenmiştir.
- yüzyıla gelindiğinde, periosteum’un kemik büyümesindeki ve rejenerasyondaki rolü tartışılmaya başlanmıştır. Özellikle John Hunter (1728–1793), periosteum üzerine yaptığı ampirik çalışmalarla dikkat çeker. Hunter, periosteum’un kemiğin gelişiminde ve kırık sonrası iyileşmesindeki merkezî rolünü deneysel olarak gösterebilen ilk isimlerden biri olmuştur. Bu dönemde, kemiğin sadece sabit bir yapı değil, dinamik olarak kendini yenileyebilen bir doku olduğu anlayışı yerleşmeye başlamıştır. Periosteum da bu süreçte aktif hücresel bileşenler içeren bir doku olarak tanınır hâle gelmiştir.
- yüzyılda histoloji bilimindeki gelişmeler, periosteum’un iki ana katmandan oluştuğunu netleştirmiştir: dış fibröz tabaka ve iç osteojenik tabaka. Bu ayrım ilk kez Kölliker ve Virchow gibi Alman patologlar tarafından yapılmış, iç tabakanın osteoblastlar içerdiği ve yeni kemik oluşumunda aktif rol oynadığı gösterilmiştir. Özellikle Rudolf Virchow, periosteum’un patolojik durumlarda kemik formasyonuna olan katkısını vurgulamış ve “periosteal reaksiyon” kavramının patolojik anatomiye girmesine öncülük etmiştir.
- yüzyılda ise periosteum’un önemi yalnızca anatomik değil, aynı zamanda biyolojik bir aktör olarak yeniden tanımlanmıştır. Hücresel düzeyde yapılan çalışmalarda periosteum’un mezenkimal kök hücreler içerdiği ve bu hücrelerin osteoblastlara dönüşerek kemik üretimi sağladığı anlaşılmıştır. Özellikle travmatoloji, ortopedi ve doku mühendisliği gibi alanlarda periosteum, iyileştirici potansiyeliyle ön plana çıkmıştır. Kemik greftlerinde periosteum’un korunmasının iyileşmeyi hızlandırdığı klinik olarak kanıtlanmıştır.
Günümüzde ise periosteum yalnızca klasik bir “kemik zarı” değil, bir kök hücre rezervuarı, bir biyomekanik etkileşim ağı ve bir sinirsel-immünolojik arayüz olarak tanımlanmaktadır. Bu evrimsel ve bilimsel yolculuk, periosteum’un antik sezgilerden başlayarak modern biyotıp düzeyinde bir araştırma nesnesine dönüşmesini açıkça gözler önüne serer.
İleri Okuma
- Kronenberg, H. M. (2003). Developmental regulation of the growth plate. Nature Reviews Endocrinology, 4(1), 11–20.
- Einhorn, T. A. (2005). The science of fracture healing. The Journal of Orthopaedic Trauma, 19(10 Suppl), S4–S6.
- Colnot, C. (2009). Skeletal cell fate decisions within periosteum and bone marrow during bone regeneration. Journal of Bone and Mineral Research, 24(2), 274–282.
- Duchamp de Lageneste, O. et al. (2018). Periosteum contains skeletal stem cells with high bone regenerative potential controlled by Periostin. Nature Communications, 9, 773.
- Roberts, T. T., & Rosenbaum, A. J. (2012). Bone grafts, bone substitutes and orthobiologics: the bridge between basic science and clinical advancements in fracture healing. Organogenesis, 8(4), 114–124.