İçindekiler
1. Kavramsal Tanım ve Tarihsel Gelişim
Preimplantasyon Genetik Tanı (PGD), tüp bebek (IVF) tedavisi sırasında elde edilen embriyolarda genetik anomalilerin saptanması amacıyla yapılan bir tanı yöntemidir. Bu teknoloji, ilk defa 1990 yılında Handyside ve arkadaşları tarafından X’e bağlı hastalıklardan etkilenen ailelerde sağlıklı embriyoların seçimi için uygulanmıştır. Temelde, genetik hastalık taşıma riski bulunan çiftlerin sağlıklı çocuk sahibi olabilmelerini amaçlar.
PGD, klasik prenatal tanı (amniyosentez, CVS vb.) yöntemlerinden temel olarak, genetik analizin implantasyon öncesinde ve gebelik başlamadan gerçekleştirilmesiyle ayrılır. Bu sayede genetik hastalıklı embriyoların rahme transferi önlenir ve gebeliğin sonlandırılmasına gerek kalmaz.
2. PGD Süreci ve Yöntemleri
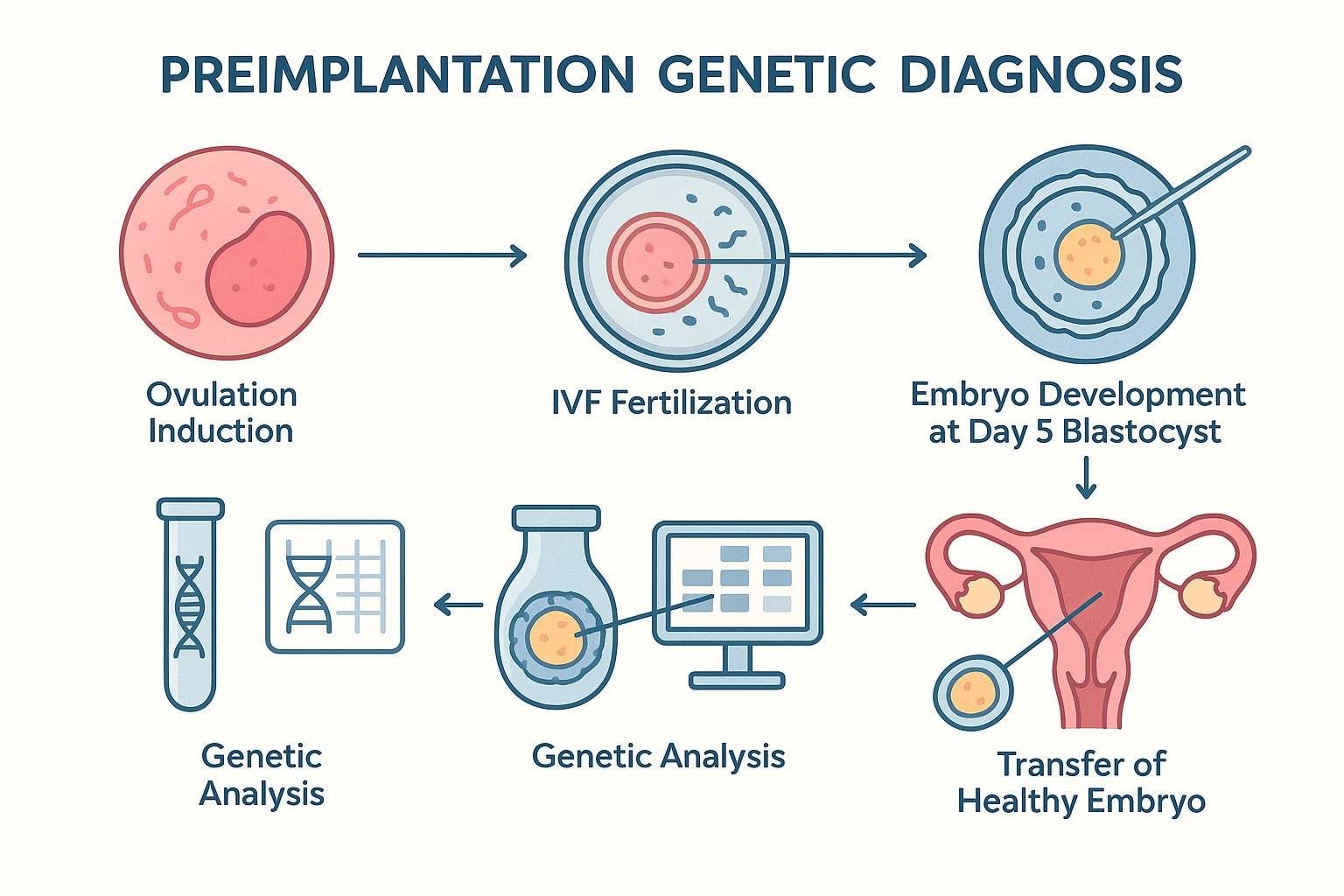
2.1. IVF ve Embriyo Oluşumu
- Ovülasyon İndüksiyonu: Anne adayında kontrollü over hiperstimülasyonu ile birden fazla oosit (yumurta) elde edilir.
- Oosit Toplama ve Fertilizasyon: Oositler, sperm ile laboratuvar ortamında döllenir (IVF/ICSI).
- Embriyo Kültürü: Embriyolar genellikle 3. (6–8 hücreli) veya 5. (blastosist) günlerine kadar kültüre edilir.
2.2. Embriyo Biyopsisi
- Kleavage Evresi Biyopsisi: 3. gün embriyosunda bir veya iki blastomerin alınması.
- Blastosist Biyopsisi: 5. gün blastosist evresinde trofoektoderm hücrelerinin alınması (günümüzde altın standarttır; embriyoya minimal zarar verir ve daha fazla DNA materyali elde edilir).
2.3. Genetik Analiz Teknikleri
- FISH (Floresan In Situ Hibridizasyon): Başlangıçta özellikle anöploidi ve cinsiyet tayini için kullanılmıştır, ancak kromozom sayısı sınırlı analiz edilir.
- PCR (Polimeraz Zincir Reaksiyonu): Tek gen hastalıkları (ör. beta-talasemi, kistik fibrozis) için kullanılır.
- Array-CGH (Komparatif Genomik Hibridizasyon): Tüm genom çapında kopya sayısı değişiklikleri (aneuploidi, delesyon/duplikasyon) tespit edilir.
- SNP Array ve NGS (Yeni Nesil Dizileme): Kromozomal ve monogenik hastalıklar, mozaizm ve daha geniş spektrumlu genomik değişiklikler tespit edilebilir.
3. Klinik Endikasyonlar
PGD uygulamasının başlıca klinik endikasyonları şunlardır:
- Monogenik (Tek Gen) Hastalıklar: Talasemi, kistik fibrozis, spinal müsküler atrofi, Duchenne müsküler distrofi, Huntington hastalığı vb.
- Kromozomal Anomaliler: Translokasyon taşıyıcıları, inversiyonlar, robertsonyen translokasyonlar.
- Anöploidi Taraması: Özellikle ileri anne yaşı, tekrarlayan gebelik kayıpları, başarısız IVF öyküsü olanlarda.
- Cinsiyet Tayini: Cinsiyete bağlı geçiş gösteren genetik hastalıklardan korunmak amacıyla.
- HLA Tiplenmesi: Özellikle hematolojik hastalıklarda, doğacak kardeşin doku uyumu için.
4. Klinik Etkinlik ve Sonuçlar
PGD, genetik hastalıklı gebeliklerin ve tekrarlayan düşüklerin önlenmesinde yüksek başarı oranlarına sahiptir. Ancak, tanı doğruluğu %98-99 civarında olsa da biyopsi ve analiz süreçlerinde teknik sınırlılıklar, mozaizm, DNA amplifikasyon hataları gibi nedenlerle yanlış negatif veya pozitif sonuçlar oluşabilir. Günümüzde, blastosist biyopsisi ve yeni nesil dizileme teknikleriyle tanı güvenilirliği artmıştır.
5. Etik, Yasal ve Psikososyal Boyutlar
5.1. Etik Sorunlar
- Embriyo Seçimi ve İmha: Sadece genetik olarak “sağlıklı” embriyoların transfer edilmesi, “istenmeyen” embriyoların imha edilmesi etik tartışmalara yol açmaktadır.
- Cinsiyet Seçimi ve Tasarım Bebekler: Sadece tıbbi gerekçeler dışında cinsiyet seçimi veya belirli özellikler için embriyo seçimi, “tasarım bebekler” (designer babies) endişesini gündeme getirmektedir.
- Erişim ve Adalet: Teknolojinin maliyetli olması ve herkese erişiminin eşit olmaması toplumsal adaletle ilgili tartışmalara yol açar.
5.2. Yasal Düzenlemeler
Ülkeler arasında PGD uygulamaları ve kapsamı açısından ciddi farklılıklar bulunmaktadır. Avrupa’da ve Türkiye’de tıbbi endikasyonlara dayalı PGD genellikle yasal ve denetimli iken, sosyal veya kozmetik amaçlı uygulamalar çoğunlukla yasaktır.
5.3. Psikososyal Etkiler
PGD uygulaması çiftlerde psikolojik baskı, karar verme zorluğu, etik ikilemler ve suçluluk duygusu gibi psikososyal yükler oluşturabilir. Kapsamlı danışmanlık ve destek bu süreçte kritik öneme sahiptir.
6. Gelecekte PGD ve Yeni Ufuklar
- Non-invaziv PGD: Kültür medyumunda embriyo tarafından salınan DNA’nın analiziyle, biyopsi gerektirmeden genetik tarama yapılması çalışmaları devam etmektedir.
- CRISPR ve Gen Düzenleme: Henüz etik ve yasal olarak kabul görmemekle birlikte, PGD sonrası embriyoda genetik hastalıkların tedavisine yönelik genom düzenleme tartışılmaktadır.
- Yapay Zekâ ve Otomasyon: Büyük veri ve yapay zekâ ile embriyo seçimi ve genetik analiz süreçlerinde daha objektif ve hızlı sonuçlar beklenmektedir.
Keşif
I. Kavramsal Uyanış (1960–1978): “İmkânsızın Hayali”
1950’lerin sonu ile 1960’ların başında, genetik biliminin yükselişiyle birlikte bilim insanları, insan embriyosunun genetik yapısını henüz doğmadan anlamanın teorik olanaklarını tartışmaya başladılar. Ancak bu dönemde “genetik hastalıklar doğmadan önce engellenebilir mi?” sorusu hâlâ bilimkurguya yakındı.
1968 yılında Robert G. Edwards, laboratuvar ortamında insan yumurtasını döllendirme fikrini ilk kez bilimsel bir platformda dillendirdiğinde büyük bir dirençle karşılaştı. Hem teknik hem etik sınırlar net değildi. Ancak Edwards’ın vizyonu, tüp bebek teknolojisinin doğmasına giden yolu açtı.
II. Tüp Bebeğin Doğuşu ve PGD’nin Tohumları (1978–1989)
1978 yılında İngiltere’de Louise Brown adlı bebek, dünyada tüp bebek teknolojisiyle (IVF) doğan ilk insan olarak tarihe geçti. Bu sadece doğurganlık tedavisinde değil, genetik tanı açısından da bir dönüm noktasıydı. Zira embriyonun laboratuvar ortamında oluşabiliyor olması, onun genetik olarak analiz edilmesi fikrini artık teknik olarak mümkün kılıyordu.
Bu başarıdan kısa süre sonra, IVF yöntemine dayalı embriyo biyopsisi fikri ortaya atıldı. 1980’lerin ortalarında, bazı araştırmacılar erken embriyo evresinde blastomer hücrelerinin çıkarılabileceğini ve bu hücrelerin genetik materyalinin analiz edilebileceğini deneysel olarak göstermeye başladılar.
III. Klinik Gerçeklik: İlk Başarılı Uygulama (1990)
Ve nihayet, 1990 yılında, İngiltere’de Alan Handyside, Robert Winston ve ekibi, X’e bağlı resesif bir hastalık taşıyan bir çiftin embriyolarına genetik analiz uygulayarak sadece sağlıklı (X kromozomu taşımayan erkek) embriyoyu transfer etti. Bu, tarihte ilk başarılı Preimplantation Genetic Diagnosis (PGD) uygulamasıydı.
Bu uygulamada, embriyodan tek bir hücre alınarak Y kromozomuna özgü DNA dizisi tespit edildi. Bu şekilde cinsiyet belirlenerek, X’e bağlı kalıtsal hastalığı taşıma riski ortadan kaldırıldı. Gebelik başarılıydı. Sağlıklı bir erkek çocuk dünyaya geldi. PGD artık hayaldiği değil, tıbbın bir parçasıydı.
IV. Teknolojik Patlama ve Yöntemlerin Evrimi (1991–2009)
1990’lar boyunca PGD yöntemleri hızla gelişti. Başlangıçta sadece cinsiyet seçimi ve tek gen hastalıkları (kistik fibrozis, talasemi, Duchenne distrofi) için kullanılabilen PGD, moleküler biyolojideki ilerlemelerle birlikte çok daha kapsamlı hale geldi.
- FISH (Fluorescence In Situ Hybridization) yöntemi ile belirli kromozomlara ait anöploidiler analiz edilmeye başlandı.
- PCR (Polimeraz Zincir Reaksiyonu) ile monogenik hastalıkların embriyo düzeyinde tanısı mümkün hale geldi.
- 2000’lerin başında array-CGH teknolojisinin gelişmesi, tüm genom taramasına olanak tanıdı.
PGD, artık sadece taşıyıcılarda değil, ileri yaş gebelikleri, tekrarlayan düşük öyküsü, başarısız IVF denemeleri gibi durumlarda da kullanılmaya başlandı. Başarılı doğum oranları arttıkça, yöntem daha geniş kabul gördü.
V. Yeni Nesil Dizileme ve Kapsayıcı Tanı Çağı (2010–2020)
2010’lu yıllarda genom dizileme teknolojisindeki büyük sıçrama PGD’ye de yansıdı. Artık tek hücreden alınan DNA parçacıkları, next-generation sequencing (NGS) yöntemleriyle yüksek doğrulukla analiz edilebiliyordu. Bu, sadece sayısal kromozom anomalileri değil, aynı zamanda küçük delesyon/duplikasyonlar ve hatta mozaizmin bile saptanmasını mümkün kıldı.
Aynı dönemde, HLA tiplemesi ile doğacak bebeğin hasta kardeşine kemik iliği donörü olabilmesi sağlandı (örn. Fanconi anemisi olgularında). Bu durum “saviour siblings” (kurtarıcı kardeşler) kavramını literatüre kazandırdı.
VI. Etik Dönüm Noktası ve Yeni Tartışmalar (2020–günümüz)
Genetik tarama teknolojilerinin gücü arttıkça, etik tartışmalar da yoğunlaştı:
- Sadece hastalıkları değil, zekâ, görünüm gibi özellikleri belirlemeye dönük “tasarım bebek” kaygıları yükseldi.
- CRISPR gibi gen düzenleme teknikleriyle embriyoda müdahale fikri gündeme geldi (Çin’de 2018’de yasa dışı uygulanan ilk CRISPR embriyo olayı büyük infial yarattı).
- Embriyo kültür sıvısından non-invaziv PGD yapılabilirliği üzerine çalışmalar başladı.
Tüm bu gelişmelerle birlikte PGD artık yalnızca bir genetik tanı aracı değil; tıbbın, etik biliminin ve biyoteknolojinin kesişim noktasında yer alan, insan hayatına yön verme potansiyeline sahip bir teknoloji haline geldi.
İleri Okuma
- Edwards, R. G., Bavister, B. D., & Steptoe, P. C. (1969). Early stages of fertilization in vitro of human oocytes matured in vitro. Nature, 221(5181), 632-635.
- Steptoe, P. C., & Edwards, R. G. (1978). Birth after the reimplantation of a human embryo. The Lancet, 312(8085), 366.
- Handyside, A. H., Kontogianni, E. H., Hardy, K., & Winston, R. M. (1990). Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature, 344(6268), 768-770.
- Harper, J. C., et al. (1994). Diagnosis of single gene defects in preimplantation human embryos. Human Reproduction, 9(5), 833-841.
- Verlinsky, Y., Kuliev, A., et al. (1996). Preimplantation diagnosis of common aneuploidies in IVF embryos. Human Reproduction, 11(5), 1006-1011.
- Harper, J. C., et al. (1998). Fluorescence in situ hybridization (FISH) for preimplantation genetic diagnosis. Human Reproduction Update, 4(5), 560-569.
- Scriven, P. N., Handyside, A. H., & Ogilvie, C. M. (2001). Chromosome translocations: segregation modes and strategies for preimplantation genetic diagnosis. Prenatal Diagnosis, 21(9), 771-778.
- Munné, S., et al. (2004). Preimplantation genetic diagnosis for aneuploidy screening in advanced maternal age patients. Fertility and Sterility, 81(5), 1174-1182.
- Munné, S., et al. (2005). Comprehensive chromosome screening by array comparative genomic hybridization. Fertility and Sterility, 84(6), 1506-1511.
- Treff, N. R., et al. (2013). Next-generation sequencing for preimplantation genetic diagnosis. Fertility and Sterility, 99(4), 1044-1050.
- Geraedts, J., & Sermon, K. (2016). Preimplantation genetic diagnosis: from testing to genome editing. Human Reproduction, 31(2), 276-282.
- He, W., et al. (2019). Noninvasive preimplantation genetic testing for aneuploidy. Trends in Molecular Medicine, 25(6), 509-520.
- Ethics Committee of the American Society for Reproductive Medicine (2023). Ethical considerations of preimplantation genetic testing. Fertility and Sterility, 119(4), 599-607.