İçindekiler
Endikasyonlar ve terapötik faydalar
Helipak, duodenum ülseri (aktif veya bir yıldır ülser öyküsü olan) olan hastalarda Helicobacter pylori_‘nin eradikasyonuna yönelik bir kombinasyon tedavisidir. H. pylori ülserin tekrarlama riskini azaltır ve başarılı bir şekilde ortadan kaldırır.
Dirençli bakterilerin gelişmesini önlemek ve diğer antibakteriyel ilaçların etkinliğini korumak için Helipak yalnızca duyarlı bakteriler tarafından meydana getirildiği bilinen veya bu bakterilerin neden olma olasılığı yüksek olan enfeksiyonların tedavisinde kullanılmalıdır. Mümkünse mikrobiyolojik kültürler ve duyarlılık testleri dikkate alınmalıdır. Bunlar eksikse lokal direnç durumu ampirik tedavi seçimi için bir temel oluşturabilir.
Dozaj
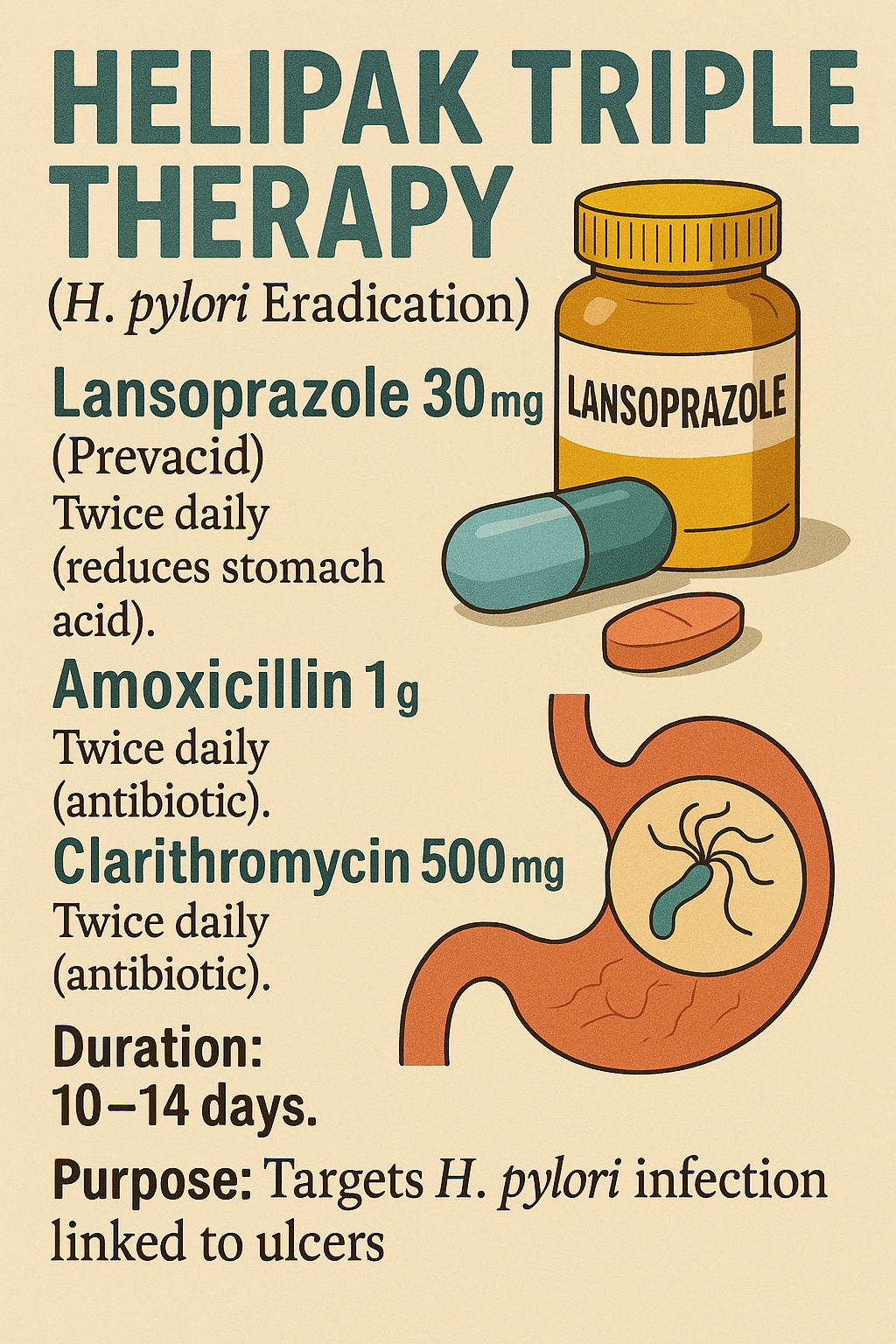
Yetişkinler için önerilen doz:
- 30 mg lansoprazol (PREVACID)
- 1 gr Amoksisilin
- 500 mg Klaritromisin
Uygulama: Günde iki kez (sabah ve akşam) 10 ila 14 gün boyunca.
Kreatinin klirensi 30 mL/dak’nın altında olan hastalarda önerilmez.
Kontrendikasyonlar
Helipak aşağıdaki durumlarda kontrendikedir:
- PREVACID formülasyonunun herhangi bir etkin maddesine veya bileşenine karşı şiddetli aşırı duyarlılık
- Bunlara şunlar dahildir: Anafilaksi, anafilaktik şok, anjiyoödem, bronkospazm, akut interstisyel nefrit ve ürtiker.
- Lansoprazol gibi proton pompası inhibitörleri (PPİ’ler) bu etkin maddelerin etkinliğini etkileyebileceğinden, Rilpivirin içeren ilaçlarla birlikte kullanımı.
Özel uyarılar ve önlemler
1. Akut aşırı duyarlılık reaksiyonları
- Penisilin tedavisi (amoksisilin) sırasında ciddi, bazen ölümcül olabilen aşırı duyarlılık reaksiyonlarının (örn. anafilaksi) ortaya çıktığı bilinmektedir.
- Penisilin veya sefalosporin alerjisi olduğu bilinen kişilerde şiddetli reaksiyon riski daha yüksektir.
- Stevens-Johnson sendromu, toksik epidermal nekroliz (TEN), DRESS sendromu veya Henoch-Schönlein purpurası gibi şiddetli aşırı duyarlılık belirtileri ortaya çıkarsa, tedavi derhal kesilmeli ve acil tedaviye başlanmalıdır. .
2. Hamilelikte kullanımı
- Klaritromisin gebelikte kontrendikedir, ancak alternatif tedavi seçeneği varsa kontrendikedir.
- Potansiyel teratojenik etkiler nedeniyle, yalnızca faydası riskinden fazlaysa kullanılmalıdır.
3. Hepatotoksisite
- Klaritromisin hepatik disfonksiyona, sarılıklı veya sarılıksız hepatoselüler veya kolestatik hepatit dahil olmak üzere, neden olabilir.
- Özellikle altta yatan ciddi hastalıkları olan hastalarda veya eş zamanlı ilaç kullananlarda hayatı tehdit eden karaciğer yetmezliği vakaları bildirilmiştir.
- Uyarı işaretleri: İştahsızlık, sarılık, koyu renkli idrar, kaşıntı, midede hassasiyet.
- Hepatit belirtileri ortaya çıkarsa klaritromisin derhal kesilmelidir.
4. QT uzaması ve kardiyak aritmiler
- Klaritromisin QT uzamasına neden olabilir ve torsades de pointes (yaşamı tehdit eden aritmiler) riski vardır.
- Pazarlama sonrası gözetimde ani kardiyak ölüm vakaları bildirilmiştir.
- Özellikle risk altında olanlar:
- Yetersiz şekilde düzeltilmiş hipokalemi veya hipomagnezemi olan hastalar
- Önemli bradikardi olan hastalar
- Yaşlı hastalar bu yan etkilere daha yatkındır.
5. Mide kanserinin olası varlığı
- Lansoprazol tedavisi sırasında semptomatik iyileşme görülmesi mide kanseri varlığını dışlamaz.
- Tedaviye yetersiz yanıt veren veya tedaviden sonra erken nüks gösteren hastalar daha ileri tanısal değerlendirmeye (örn. endoskopi) tabi tutulmalıdır.
6. Akut interstisyel nefrit (AIN)
- Lansoprazol dahil PPI’lar akut interstisyel nefrit ile ilişkilendirilmiştir.
- AIN tedavinin herhangi bir döneminde ortaya çıkabilir ve idiyosenkrazik bir bağışıklık reaksiyonu olarak kabul edilir.
- AIN şüphesi varsa lansoprazol derhal kesilmelidir.
7. Lupus eritematozus (CLE/SLE)
- Proton pompası inhibitörleri kutanöz (CLE) ve sistemik lupus eritematozus (SLE) ile ilişkilendirilmiştir.
- Vakalar hem yeni vakalar hem de mevcut otoimmün hastalıkların alevlenmesi şeklinde ortaya çıkmıştır.
- Daha yaygın görülen bulgu: CLE.
Keşif
1982 – Helicobacter pylori‘nin keşfi
- Barry J. Marshall ve J. Robin Warren, kronik gastrit ve peptik ülser hastalığının başlıca nedeninin Helicobacter pylori bakterisi olduğunu tespit etti. Bu keşif, daha önceleri çoğunlukla stres ve yaşam tarzı faktörleriyle ilişkilendirilen mide ülserine ilişkin anlayışı kökten değiştirdi.
1994 – H.’nin tanınması. pylori kanserojen olarak
- Dünya Sağlık Örgütü (WHO) H. H. pylori Grup 1 kanserojen olarak sınıflandırılmıştır çünkü mide kanseri riskinin artmasıyla ilişkilidir. Bu durum eradikasyon tedavisinin sadece ülser tedavisinde değil aynı zamanda kanser önlenmesinde de ne kadar önemli olduğunu ortaya koymaktadır.
1990’lar – Üçlü terapinin geliştirilmesi
- Proton pompası inhibitörü (PPI), amoksisilin ve klaritromisin kombinasyonundan oluşan kombinasyon tedavisi, H. pylori eradikasyonunda standart olarak belirlenmiştir. Üçlü tedavi olarak adlandırılan bu tedavi yöntemi yüksek eradikasyon oranları göstermiş ve kılavuzlarda ilk seçenek olarak yer almıştır.
1995 – Lansoprazolün (PREVACID) onayı
- Lansoprazol, asitle ilişkili gastrointestinal hastalıkların tedavisinde proton pompası inhibitörü olarak onaylanmıştır. Asit inhibisyonundaki yüksek etkinliği ülser iyileşme oranlarını iyileştirmiş ve H. pylori enfeksiyonunda antibiyotiklerin etkinliğini desteklemiştir. H. pylori eradikasyonu.
2000 – Helipak’ın piyasaya sürülmesi
- Tedaviyi basitleştirmek ve hasta uyumunu artırmak amacıyla lansoprazol, amoksisilin ve klaritromisin kombinasyonu kombinasyon paketi (Helipak) şeklinde kullanıma sunuldu. Helipak’ın standart dozajı, doğru kullanımı kolaylaştırıyor.
2017 – Maastricht V/Floransa Mutabakat Raporu
- Maastricht V/Floransa Mutabakat Raporu, H. influenzae’ya ilişkin uluslararası yönergeleri güncelledi. H. pylori tedavisi. Üçlü tedavi, önerilen birinci basamak tedavi olmaya devam etti; ancak yüksek klaritromisin direnci olan bölgelerde diğer tedavi rejimleriyle desteklendi.
Güncel gelişmeler – antibiyotik direncinde artış
- Son yıllarda klaritromisine karşı artan direnç oranları bazı bölgelerde üçlü tedavinin etkinliğini azaltmıştır. Bu durum, bizmut içeren dörtlü tedavilerin veya diğer antibiyotik kombinasyonlarının kullanımı da dahil olmak üzere tedavi kılavuzlarında ayarlamalara yol açtı.
İleri Okuma
- Marshall, B. J., & Warren, J. R. (1984). Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. The Lancet, 323(8390), 1311-1315.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. (1994). Schistosomes, liver flukes and Helicobacter pylori. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 61, 1-241.
- Chey, W. D., & Wong, B. C. (2007). American College of Gastroenterology guideline on the management of Helicobacter pylori infection. American Journal of Gastroenterology, 102(8), 1808-1825.
- Suzuki, H., Nishizawa, T., & Hibi, T. (2009). Helicobacter pylori eradication therapy. Gastroenterology Clinics of North America, 38(2), 383-399.
- Malfertheiner, P., Megraud, F., O’Morain, C. A., et al. (2017). Management of Helicobacter pylori infection—the Maastricht V/Florence consensus report. Gut, 66(1), 6-30.