İçindekiler
1. Etimolojik köken ve kavramsal çerçeve
“Ödem” sözcüğü, kökenini Antik Yunancada “şişme” anlamını taşıyan oídēma kavramından alır; tıpta dokuların interstisyel boşluklarında sıvı birikimini ifade eden temel terim hâline gelmiştir. “Pulmoner” ve “akciğer” ile ilişkili terminoloji ise Latince pulmo ve Grekçe pnémōn kökleri üzerinden, solunum organına ait olma anlamı kazanır. Bu iki kök, “pulmoner ödem” ifadesinde birleşerek akciğer dokusunda damar dışı sıvı birikiminin patolojik niteliğini vurgular.
Akciğer ödemi, akciğer parenkiminde ekstravasküler sıvının artmasıdır. Birikim çoğunlukla önce interstisyumda başlar; süreç ilerledikçe alveoler boşluklara taşarak gaz değişimini bozan alveoler ödem tablosunu oluşturur. Klinik ve fizyopatolojik açıdan akciğer ödemi, tek bir hastalık değil; farklı başlangıç mekanizmalarına sahip sendromların ortak sonlanım biçimi olarak değerlendirilir.
2. Tarihsel gelişim: gözlemden mekanizmaya
Akciğer ödemi olgusunun klinik tanınması, kalp yetmezliği ve boğulma benzeri durumlarda “akıntılı, köpüklü balgam” ve hızlı gelişen nefes darlığı gözlemlerine dayanır. Solunum seslerinin oskültasyonla sistematik biçimde değerlendirilmesi, akciğer içi sıvılanmanın klinik işaretlerini daha erken yakalamayı mümkün kılmıştır. Daha sonra kapiller hemodinamik ile sıvı transportunun fiziksel ilkelerle açıklanması, ödemin yalnızca “birikim” değil; basınç, geçirgenlik, lenfatik drenaj ve onkotik kuvvetler arasındaki dengenin bozulması olduğu fikrini yerleştirmiştir.
Radyografinin klinik pratiğe girişiyle birlikte, hidrostatik kökenli ödemin damar dağılım paternleri, interstisyel çizgilenmeler ve alveoler opasiteler üzerinden evrelendirilebilmesi mümkün olmuştur. Yoğun bakım tıbbının gelişmesi, özellikle invaziv hemodinamik izlem ve mekanik ventilasyonun yaygınlaşması, akciğer ödeminin kardiyojen ve kardiyojen olmayan biçimlerinin ayrımını klinik karar verme süreçlerinin merkezine taşımıştır. Akut solunum sıkıntısı sendromu kavramının tanımlanması, permeabilite artışına bağlı ödemin başlı başına bir sendrom olarak ele alınmasını sağlamış; bunu izleyen on yıllarda alveol kapiller bariyer biyolojisi, inflamasyon, endotel disfonksiyonu ve ventilatör ilişkili akciğer hasarı gibi başlıklar güncel anlayışın omurgasını oluşturmuştur.
3. Evrimsel biyolojik bağlam: karasal yaşamın “ince bariyer” bedeli
Akciğer, karasal omurgalılarda su ortamından kopuşun en kritik adaptasyonlarından biridir. Bu adaptasyonun merkezinde, gaz difüzyonunu en üst düzeye çıkaran çok geniş yüzey alanı ve son derece ince bir difüzyon bariyeri yer alır. Alveol kapiller membranın inceliği, oksijen ve karbondioksit geçişini hızlandırır; ancak aynı incelik, sıvı dengesindeki küçük bozulmaları bile fonksiyonel açıdan büyük sonuçlara dönüştürür.
Akciğerin “kuru” kalma zorunluluğu, evrimsel olarak çok katmanlı bir savunma sistemi doğurmuştur:
- Kapiller endotel ve alveoler epitelin sıkı bağlantıları, bariyer bütünlüğünü sağlar.
- Alveoler epitelin aktif sodyum transportu ile suyun geri emilimi, alveol içi sıvının uzaklaştırılmasında temel rol oynar.
- Pulmoner lenfatik ağ, interstisyel sıvı birikimini tolere edilebilir sınırlar içinde tutar.
- Surfaktan sistemi, alveol yüzey gerilimini düşürerek alveollerin açık kalmasını sağlar; sıvı ile dolma eğilimini dolaylı biçimde azaltır.
Bu çerçevede akciğer ödemi, karasal solunumun getirdiği “yüksek verimlilik” ile “yüksek kırılganlık” arasındaki evrimsel dengenin klinik karşılığı olarak da okunabilir. Yükseklik ödemi gibi tablolar, hipoksik pulmoner vazokonstriksiyonun adaptif amacının, heterojen vazokonstriksiyon ve kapiller stres altında maladaptif bir sonuca evrilebildiğini gösteren özgün örneklerdir.
4. Normal sıvı dengesi: bariyer, Starling kuvvetleri ve lenfatik rezerv
Akciğer interstisyumunda her zaman az miktarda sıvı bulunur; bu sıvı, kapiller filtrasyon ile lenfatik drenaj arasındaki denge sayesinde birikmez. Dengeyi belirleyen ana bileşenler şunlardır:
- Kapiller hidrostatik basınç: filtrasyonu artıran kuvvet
- Plazma onkotik basıncı: filtrasyonu azaltan kuvvet
- Bariyer geçirgenliği: su ve protein geçişinin “sızıntı eşiğini” belirler
- Lenfatik drenaj kapasitesi: interstisyel birikimi telafi eden rezerv mekanizma
Akciğer, interstisyel sıvı artışını bir süre kompanse edebilir. Bu nedenle özellikle kronik süreçlerde, pulmoner venöz basınç belirgin yükselse bile, lenfatik rezerv sayesinde bir süre alveoler taşma olmadan yalnızca hafif interstisyel değişiklikler görülebilir. Kritik eşik aşıldığında ise interstisyum “taşar” ve alveoler boşluklar sıvı ile dolmaya başlar; bu geçiş, klinik olarak ani kötüleşmelerin biyolojik temelini oluşturur.
5. Sınıflandırma: mekanizma temelli yaklaşım
Akciğer ödemi, patogenez bakımından iki ana eksende ele alınır:
- Hidrostatik ödem
- Permeabilite artışına bağlı ödem
Bu ayrım, yalnızca akademik bir sınıflandırma değil; görüntüleme bulgularını, laboratuvar desenini, hemodinamik profili ve tedavi hedeflerini belirleyen pratik bir çerçevedir.
6. Hidrostatik akciğer ödemi
6.1. Patofizyoloji
Hidrostatik ödemde temel olay, pulmoner kapiller hidrostatik basıncın artmasıdır. En sık neden sol kalp yetmezliği olup, sol atriyum ve pulmoner venöz sistemde basınç artışı kapiller yatağa yansır. Daha nadir olarak intravasküler volüm yüklenmesi, böbrek yetmezliği, aşırı sıvı replasmanı veya bazı iatrojenik durumlar aynı eksende etki gösterir.
Pulmoner venöz basınç normal aralıkta iken interstisyel filtrasyon lenfatik drenaj ile dengelenir. Basınç yükseldikçe lenfatik sistem bir süre artmış yükü tolere eder; ancak rezerv kapasitenin üzerinde filtrasyon olduğunda interstisyel ödem belirginleşir ve daha ileri basınç artışlarında alveoler ödem gelişir.
6.2. Evreler ve görüntüleme korelasyonları
Hidrostatik ödemin radyolojik olarak evrelendirilmesi, sıvı dağılımı ve interstisyel yapıların etkilenme derecesi üzerinden yapılır. Bu evreler, klinik şiddet ile bire bir aynı olmak zorunda değildir; ancak fizyopatoloji ile güçlü bir uyum taşır.
Evre 1: Vasküler redistribüsyon
Pulmoner venöz basınç hafif yükseldiğinde, kan ve sıvı dağılımı yerçekimi ve damar yatağı dinamikleri ile yeniden düzenlenir. Ayakta bireyde üst zon damarlarında dolgunluk belirginleşebilir. Supin pozisyonda dağılım daha simetrik olduğundan, erken evre işaretleri daha silik kalabilir.
Evre 2: İnterstisyel ödem
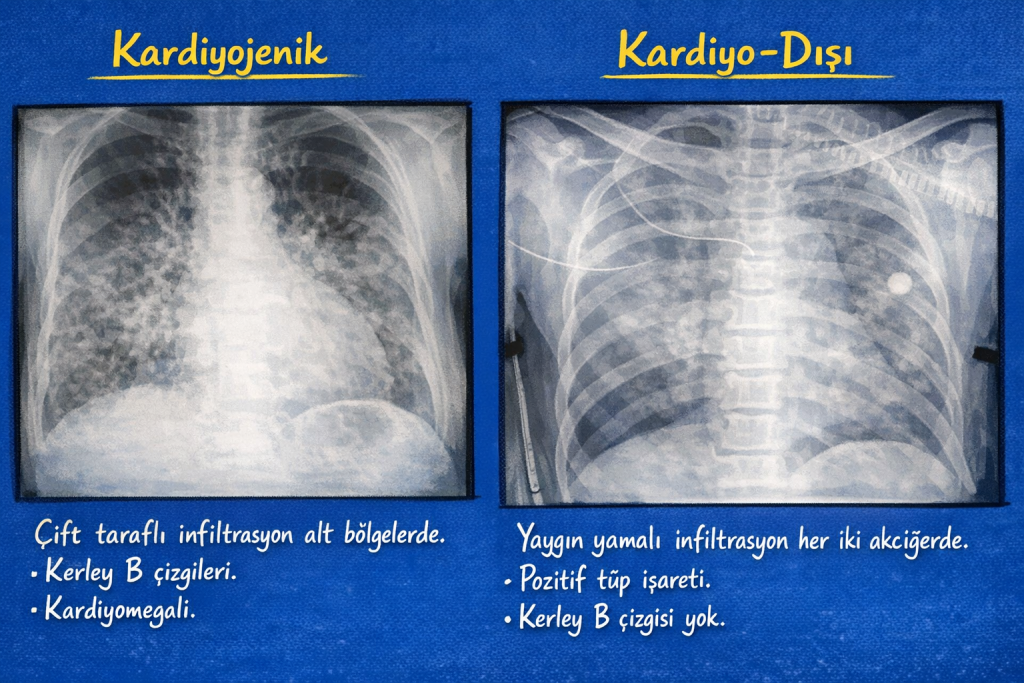
Basınç artışı lenfatik kapasiteyi aştığında interstisyumda sıvı birikimi başlar. Bu birikim; interlobüler septaların kalınlaşması, peribronşiyal dokunun ödemle şişmesi ve plevral aralıkta sıvı birikimine eğilim ile seyreder. Radyografide septal çizgilenmeler, damar konturlarında silikleşme ve plevral efüzyon eşlik edebilir.
Evre 3: Alveoler ödem
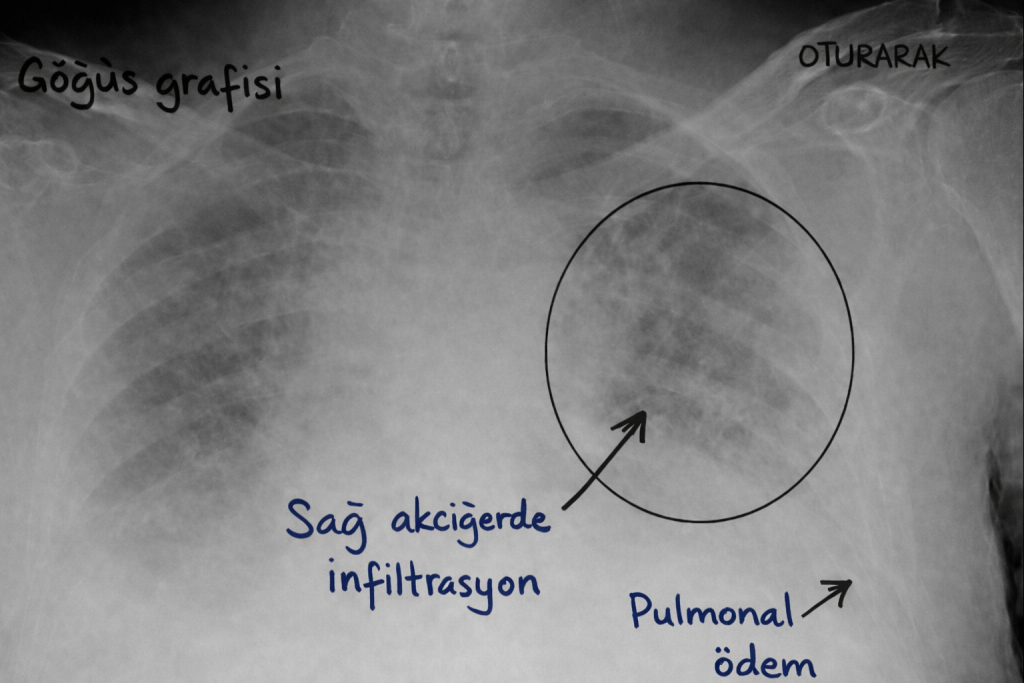
Pulmoner venöz ve kapiller basınç daha ileri düzeylere ulaştığında alveoler boşluklara sıvı geçişi olur. Görüntülemede perihiler ağırlıklı opasiteler ve geniş dağılımlı alveoler dolma paternleri görülebilir. Dağılım simetrik olabileceği gibi fokal ya da asimetrik de olabilir; eşlik eden valvüler patolojiler, eşlik eden akciğer hastalıkları ve pozisyonel faktörler paterni belirgin biçimde etkiler.
6.3. Klinik fenotip
Hidrostatik ödem sıklıkla ortopne, paroksismal nokturnal dispne, pembe köpüklü balgam, yaygın raller, taşikardi ve soğuk terleme ile seyreder. Hipoksemi gelişimi, alveoler dolma derecesi ve ventilasyon perfüzyon uyumsuzluğunun büyüklüğü ile ilişkilidir. Eşlik eden sol kalp yetmezliği bulguları, juguler venöz dolgunluk ve periferik ödem gibi sistemik işaretler, her hastada bulunmayabilir.
6.4. Tanısal yaklaşım
Tanıda klinik değerlendirme, görüntüleme ve hemodinamik ipuçları birlikte yorumlanır. Ekokardiyografi, sol ventrikül fonksiyonu ve kapak patolojilerinin değerlendirilmesinde kritik rol oynar. Natriüretik peptitler destekleyici olabilir; ancak böbrek yetmezliği, yaş ve kronik kalp hastalığı gibi durumlar yorumlamayı güçleştirebilir. Akciğer ultrasonografisinde B çizgileri interstisyel sıvı artışını gösterebilir; bununla birlikte geçirgenlik ödeminde de benzer bulgular olabileceğinden bağlam şarttır.
6.5. Tedavi ilkeleri
Hidrostatik ödemde hedef, kapiller hidrostatik yükü azaltmak ve oksijenasyonu düzeltmektir:
- Oksijen desteği ve uygun hastada noninvaziv ventilasyon
- Diürez ile volüm yükünün azaltılması
- Vazodilatasyon ve afterload azaltımı, hemodinamik olarak uygun hastada
- Altta yatan nedenin düzeltilmesi, akut koroner sendrom, hipertansif acil, kapak yetmezliği gibi etkenlerin yönetimi
7. Permeabilite artışına bağlı akciğer ödemi
7.1. Bariyer biyolojisi ve temel mekanizma
Permeabilite ödeminde belirleyici olay, alveol kapiller bariyerin geçirgenliğinin artmasıdır. Bu artış endotel hasarı, epitel hasarı veya her ikisinin birlikteliği ile gelişir. Hidrostatik ödemden farklı olarak sıvı yalnızca su ağırlıklı değildir; protein içeriği daha yüksek eksüdatif bir karakter kazanabilir. Sonuçta interstisyel alanda ve alveollerde biriken sıvı, surfaktan fonksiyonunu bozar, alveoler kollapsı artırır ve şant fizyolojisini derinleştirir.
7.2. Difüz alveoler hasar olmadan geçirgenlik ödemi
Bu grup, kapiller kaçak eğiliminin belirgin olduğu ancak tipik difüz alveoler hasar histopatolojisinin baskın olmadığı durumları kapsar. Klinik olarak kardiyojenik olmayan interstisyel ödem paternine yaklaşabilir.
Başlıca örnekler:
- Transfüzyon ilişkili akut akciğer hasarı
- İlaçlar ve toksinler ile ilişkili kapiller kaçak
- Nörojenik akciğer ödemi
- Reekspansiyon ödemi
- Yüksek irtifa akciğer ödemi
Bu tabloların ortak paydası, kapiller geçirgenlik artışının hemodinamik basınç artışından bağımsız veya orantısız olmasıdır.
7.3. Difüz alveoler hasar ile seyreden geçirgenlik ödemi: ARDS
ARDS, akut başlangıçlı ağır hipoksemik solunum yetmezliği ile karakterizedir ve mekanizma olarak yaygın inflamasyon, endotel aktivasyonu, epitel hasarı ve alveoler sıvı klirensinin bozulmasını içerir. ARDS, doğrudan akciğeri hedefleyen etkenlerle veya sistemik inflamasyon yoluyla dolaylı etkenlerle ortaya çıkabilir.
Doğrudan etkenler: aspirasyon, inhalasyon hasarı, ağır pnömoni, akciğer kontüzyonu, boğulma olayları
Dolaylı etkenler: sepsis, şok tabloları, akut pankreatit, ağır travma ve yanık, transfüzyon reaksiyonları, bazı zehirlenmeler
ARDS’de süreç zaman içinde morfolojik ve fonksiyonel evreler gösterebilir: erken dönemde ödem ve hyalen membran oluşumu baskın olabilir; takip eden günlerde alveoler dolma artar; daha geç dönemde bazı hastalarda fibroproliferatif yanıt ve restriktif ventilasyon paternine gidiş gelişebilir. Bu evreler hastadan hastaya farklı hızlarda ilerler ve modern yoğun bakım uygulamaları bu doğal seyri belirgin ölçüde değiştirebilir.
7.4. Hidrostatik ödem ile ayrımın klinik önemi
Permeabilite ödeminde pozisyon değişikliği ile sıvı dağılımının hidrostatik ödemdeki kadar belirgin kaymalar göstermemesi, klasik öğretilerde vurgulanan bir noktadır; pratikte ise ventilasyon stratejileri, akciğerin heterojen elastansı ve eşlik eden hastalıklar nedeniyle görüntüleme paternleri üst üste binebilir. Bu nedenle ayrım, tek bir bulguya dayandırılmadan; klinik bağlam, hemodinamik değerlendirme, ekokardiyografi ve laboratuvar ipuçları ile birlikte yapılır.
7.5. Tedavi ilkeleri
Permeabilite ödeminde temel hedef, oksijenasyonu sağlamak ve hasarı artıran mekanik stresleri azaltmaktır:
- Koruyucu mekanik ventilasyon stratejileri, düşük tidal volüm yaklaşımı
- Uygun olguda PEEP ile alveoler açıklığın sürdürülmesi
- Prone pozisyon gibi ventilasyon perfüzyon uyumunu artıran yöntemler
- Altta yatan etkenin kontrolü, sepsiste kaynak kontrolü ve uygun antibiyotik, aspirasyonda hava yolu güvenliği
- Sıvı yönetiminde “yeterli perfüzyon, minimal akciğer yükü” dengesinin gözetilmesi
Diüretikler bazı olgularda eşlik eden volüm yükü varsa yardımcı olabilir; ancak temel sorun geçirgenlik artışı olduğunda tek başına belirleyici tedavi değildir.
8. Klinik belirtiler, fizyoloji ve komplikasyonlar
8.1. Gaz değişim bozukluğunun mekanizmaları
Akciğer ödemi hipoksemiye şu başlıklar üzerinden yol açar:
- Alveoler dolma nedeniyle şant artışı
- İnterstisyel kalınlaşma ile difüzyon mesafesinin artması
- Surfaktan inhibisyonu ile atelektazi
- Ventilasyon perfüzyon uyumsuzluğu
ARDS’de bu mekanizmalar genellikle birlikte ve daha ağır düzeyde bulunur.
8.2. Hemodinamik ve sağ kalp etkileri
Pulmoner vasküler dirençte artış, hipoksik vazokonstriksiyon, mikrotrombotik süreçler ve ventilasyon basınçları sağ ventrikül yükünü artırabilir. Bu durum özellikle ARDS’de sağ kalp yetersizliği riskini yükseltir ve ventilasyon stratejilerinin hemodinamik etkilerini daha kritik hâle getirir.
8.3. Sekonder enfeksiyon ve fibroz eğilimi
Alveoler sıvı birikimi ve bariyer hasarı, enfeksiyonlara yatkınlığı artırabilir. Uzamış ARDS olgularında fibroproliferatif yanıtın baskınlaşması, uzun dönem dispne ve egzersiz kapasitesi kısıtlılığına zemin hazırlayabilir.
9. Tanı araçları: entegratif yaklaşım
9.1. Görüntüleme
- Akciğer grafisi, hızlı ve yaygın erişilebilir olmakla birlikte erken dönemde duyarlılığı sınırlı olabilir.
- Toraks BT, dağılımın ve eşlik eden patolojilerin değerlendirilmesinde daha ayrıntılı bilgi verir; ancak taşıma ve radyasyon yükü gibi pratik sınırlılıklar taşır.
- Akciğer ultrasonografisi, yoğun bakım ve acil pratikte interstisyel sıvıyı düşündüren artefaktlar üzerinden güçlü bir yatak başı araçtır; yine de kardiyojen ve nonkardiyojen ayrımı için klinik bağlam şarttır.
9.2. Kardiyak değerlendirme
Ekokardiyografi, sol ventrikül sistolik ve diyastolik fonksiyon, kapak patolojileri ve dolum basıncı göstergeleri üzerinden hidrostatik ödem olasılığını güçlendirir veya zayıflatır.
9.3. Laboratuvar ve biyobelirteçler
Natriüretik peptitler, kardiyak yüklenmeyi yansıtan biyobelirteçlerdir; yorum, eşlik eden böbrek fonksiyonu, yaş ve kronik kalp hastalığına göre yapılmalıdır. İnflamatuvar belirteçler ARDS bağlamında bağlamsal değer taşır; tek başlarına tanı koydurucu kabul edilmez.
10. Özel tablolar
10.1. Yüksek irtifa akciğer ödemi
Hipobarik hipoksi, pulmoner vazokonstriksiyonu tetikler. Bu yanıt heterojen olduğunda bazı kapiller bölgelerde basınç aşırı yükselir ve kapiller stres ile geçirgenlik artışı ortaya çıkabilir. Klinik olarak eforla başlayan dispne, öksürük, hızlı kötüleşme ve hipoksemi görülür. Tedavide irtifa kaybı, oksijen, uygun olguda vazodilatör yaklaşımlar ve soğuktan korunma öne çıkar.
10.2. Nörojenik akciğer ödemi
Santral sinir sistemi olayları sonrasında aşırı sempatik deşarj, pulmoner vasküler yatakta ani basınç değişiklikleri ve endotel disfonksiyonu ile ödemi tetikleyebilir. Bu tabloda kardiyak ve pulmoner mekanizmalar iç içe geçebilir.
10.3. Reekspansiyon ödemi
Uzun süre kollabe kalmış akciğerin hızlı reekspansiyonu, kapiller permeabilite artışı ve mekanik stres ile ödem gelişimine yol açabilir. Büyük plevral efüzyonların veya pnömotoraksın hızlı drenajı sonrasında görülebilir.
11. Güncel bilimsel yönelimler: mikro-düzeyden klinik fenotiplere
Güncel yaklaşım, akciğer ödemini yalnızca “sıvı fazlalığı” olarak değil; bariyer bütünlüğü, epitel klirensi, endotel glikokaliksi, inflamatuvar yanıtın zamanlaması, pıhtılaşma-inflamasyon ekseni ve mekanik ventilasyonun biyofizik etkilerinin birleşimi olarak ele alır. Bu çerçevede iki eğilim belirgindir:
- Moleküler düzeyde hedeflerin tanımlanması: endotel stabilizasyonu, epitel sodyum transportunun korunması, inflamasyonun uygun zamanda modülasyonu
- Klinik düzeyde fenotipleme: benzer görünen olguların farklı biyolojik alt tiplerinin ayrılması ve tedavinin buna göre bireyselleştirilmesi
Keşif
Antik çağdan erken modern döneme: “ıslak akciğer” fikrinin sezgisel doğuşu
En eski metinlerde akciğer ödemi adıyla bir teşhis bulmazsınız; ama hekimler, ani nefes darlığı, hırıltı-çatırdama benzeri sesler, “boğulur gibi olma” ve bazen köpüklü balgamla giden tablolara çok erken dönemlerden beri dikkat kesilmişlerdi. Bu dönemlerin temel sınırlılığı, akciğeri yaşayan bir organ olarak değil, ancak ölüm sonrası görülebilen bir doku olarak inceleyebilmeleriydi. Dolayısıyla “akciğerin suyla dolması” düşüncesi, klinik gözlemle patolojik bulgunun birbirine tam bağlanamadığı bir sezgi halinde kaldı.
Rönesans ve sonrası anatomik patolojinin gelişmesiyle birlikte akciğerlerin “ağırlaşmış, su gibi sıvı sızdıran” görünümü daha sistematik tanımlanmaya başladı. Yine de bu erken patoloji dili, neden-sonuç zincirini kurmakta zorlanıyordu: kalp mi suçluydu, akciğer mi, kan mı, yoksa “genel bir su fazlalığı” mı?
1816–1819: Laennec ve kulağın bilime dönüşmesi
Akciğer ödeminin modern keşif yolculuğunda gerçek dönüm noktalarından biri René Théophile Hyacinthe Laennec’in oskültasyonu bir sanat olmaktan çıkarıp bir yöntem haline getirmesidir. Stetoskop fikrini olgunlaştırdığı yıllarda Laennec, akciğerin içindeki “ince kabarcıkların patlar gibi” duyulan sesini tanımladı; bugün “ince krepitan raller” dediğimiz bulgu, onun kulak hafızasında bir imzaya dönüştü. O dönemin dahiyane tarafı şuydu: Laennec akciğerin içindeki sıvının miktarını ölçemiyordu, ama sesin karakterinden alveol düzeyinde bir “ıslanma” ve “hava-sıvı etkileşimi” sezebiliyordu. Klinik muayenenin bu şekilde standardize edilmesi, akciğer ödemini ilk kez “tekrarlanabilir bir klinik olgu” mertebesine taşıdı: başkaları da aynı sesi duyabilir, aynı hastada benzer gidişi izleyebilirdi.
Bu yıllar aynı zamanda, kalp-akciğer ilişkisini kavramanın eşiğidir. Laennec’in çevresinde akciğer bulgularının kalp hastalıklarıyla nasıl iç içe geçtiği tartışılıyordu. “Kalp büyüklüğü, üfürüm, nefes darlığı ve akciğer sesleri” bir araya geldiğinde, hekimlerin zihninde yeni bir hipotez belirdi: bazı “ıslak akciğer” tablolarında itici güç akciğerin kendisi değil, kalbin pompasındaki yetersizlik olabilir.
1895–1930’lar: Röntgenin doğuşu ve görünür hâle gelen interstisyum
Wilhelm Conrad Röntgen’in X-ışınını tanımlamasından sonra göğüs radyografisi hızla klinik pratiğe girdi. Bu teknoloji, akciğer ödeminin keşif öyküsünde ikinci büyük kırılmayı yarattı: artık ödem, yalnızca seslerle ve ölüm sonrası bulgularla değil, yaşayan insanda görüntüyle de izlenebilecekti.
Bu dönemin yıldızlarından biri Sir Peter James Kerley’dir. 1933’te yayımladığı çalışmalarla, bugün “Kerley çizgileri” olarak bildiğimiz ince septal çizgilenmeleri tarif etti. Kerley’nin katkısı, akciğer ödemini sadece “alveoller suyla doldu” basitliğinde değil, interstisyumun ve lenfatik-kompartımanların katıldığı bir süreç olarak düşünmeye zorlamasıdır. Septaların kalınlaşması, peribronşiyal manşonlaşma ve plevral efüzyon gibi bulgular, ödemin “önce interstisyuma yerleşip sonra alveole taştığı” fikrini radyolojik bir hikâyeye dönüştürdü.
Bu sırada klinisyenlerin merakı pratik bir soruya odaklanmıştı: Hangi hastada bu gölgeler kalpten kaynaklanıyor, hangisinde akciğerin bariyeri bozuluyor? Görüntü, soruyu büyütmüş; ama yanıt için fizyolojiye ihtiyaç doğurmuştu.
1896: Starling ve sıvı hareketinin denkleme dönüşmesi
Ernest Henry Starling’in 1896’da ortaya koyduğu kapiller sıvı alışverişi fikri, akciğer ödeminin keşfinde “neden” sorusunu ilk kez matematiksel bir dile çevirdi. Bu, dramatik bir zihinsel sıçramaydı: Ödem, artık sadece “fazla su” değil; hidrostatik basınç, onkotik basınç ve bariyer özellikleri arasındaki dengenin bozulmasıydı.
Starling’in çerçevesi iki önemli sonucu beraberinde getirdi.
Birincisi, akciğer ödeminin kalp yetmezliğinde neden bu kadar sık görüldüğünü açıklamaya başladı: pulmoner venöz basınç yükselirse kapiller filtrasyon artar.
İkincisi, “kalp normal olsa bile ödem olur mu?” sorusunu meşrulaştırdı: eğer bariyer geçirgenliği artarsa, basınç çok yükselmeden de sıvı geçebilir.
O andan sonra klinik gözlem ile temel bilim arasındaki ilişki değişti. Hekimler, bir hastayı dinlerken ve röntgenine bakarken, akıllarında artık “hangi kuvvet baskın?” sorusunu taşıyordu.
1929–1956: Kalbin içine giren hekimler ve kalp-akciğer dolaşımının gerçek ölçümü
Bir hikâyenin kahramanı bazen tek başına risk alan bir kişidir: 1929’da Werner Forssmann, kendi kalbine kateter ilerleterek “kalbin içine girilebileceğini” kanıtladı. Bu eylem, cesur olduğu kadar epistemolojik bir kırılmaydı: Kalp ve pulmoner dolaşım artık dolaylı tahminlerle değil, doğrudan basınç ölçümleriyle konuşacaktı.
1940’larda André Frédéric Cournand ve Dickinson W. Richards, sağ kalp kateterizasyonunu klinik araştırmanın güvenilir bir aracına dönüştürdüler. Pulmoner arter basınçları, oksijen saturasyonları ve dolaşım dinamikleri üzerinden kalp-akciğer etkileşimi nicel hâle geldi. Bu emek, 1956’da Nobel düzeyinde tanındı ve akciğer ödemi açısından şu anlamı taşıdı: “Pulmoner venöz basınç yükselmesi” artık kavramsal bir tahmin değil, ölçülebilen bir gerçeklikti.
Bu yıllarda akciğer ödemi iki farklı doğaya ayrılmaya başladı:
- Basınçla sürüklenen, kalp kaynaklı, hidrostatik ödem
- Bariyer bozulmasıyla gelişen, kalp dışı, geçirgenlik ödemi
1960–1961: Yükseklik ödemi ve sağlıklı insanda “kardiyojen olmayan” akciğer ödeminin sarsıcı kanıtı
Birçok klinik paradigma, en iyi “istisna” ile kırılır. Yüksek irtifada tamamen sağlıklı kişilerin kısa sürede ağır solunum yetmezliğine girmesi, klasik “kalp yetmezliği = akciğer ödemi” eşlemesini sarstı. Charles Houston’ın olguları ve ardından Hultgren ile çalışma arkadaşlarının 1961’deki kapsamlı tanımlamaları, akciğer ödeminin kalpten bağımsız bir biyolojiye sahip olabileceğini güçlü biçimde ortaya koydu.
Bu fenomenin bilimsel cazibesi şuradaydı: Kalp normaldi, ama akciğer “sızdırıyordu”. Böylece araştırmacılar, hipoksinin pulmoner damar yatağında yarattığı heterojen vazokonstriksiyon ve kapiller stres gibi kavramlara yöneldi. Yükseklik ödemi, geçirgenlik artışının tek biçimli “enflamasyon” olmadan da gerçekleşebileceğini düşündürerek mekanizma repertuarını genişletti.
1967: Ashbaugh, Petty ve “ARDS” kavramının doğumu
1967’de David G. Ashbaugh, D. Boyd Bigelow, Thomas L. Petty ve Bernard E. Levine’in yayımladığı olgu serisi, modern yoğun bakım tıbbının en etkili kavramlarından birini doğurdu: erişkinde akut solunum sıkıntısı sendromu. Bu tanımlama, akciğer ödemi hikâyesinde üçüncü büyük kırılmadır; çünkü burada ödem, artık kalp yetmezliğinin bir komplikasyonu değil, yaygın alveol-kapiller hasarın merkez belirtisi olarak sahneye çıkıyordu.
ARDS anlatısı hekimlere şunu öğretti:
- Bazı akciğer ödemleri “proteinli”, “enflamatuvar” ve “yaygın bariyer hasarı” karakterlidir.
- Bu tabloda sadece sıvıyı azaltmak yetmez; ventilasyonun kendisi hasarı büyütebilir.
- Akciğer, mekanik bir organ gibi davranır; basınç ve hacimle incinebilir.
Bu noktadan sonra akciğer ödemi araştırmasının ana ekseni genişledi: hemodinamik ölçümler kadar ventilatör stratejileri, alveoler sıvı klirensi ve bariyer biyolojisi de merkeze oturdu.
1970’ler: Swan–Ganz kateteri, yoğun bakımda “wedge basıncı” ve ödemin bedside fizyolojisi
1970’te Swan–Ganz balon uçlu pulmoner arter kateterinin klinik kullanıma girmesi, akciğer ödeminin günlük pratikte “anlık fizyolojiye” dönüşmesini sağladı. Pulmoner kapiller wedge basıncı, sol atriyal dolum basıncının bir vekili olarak kullanıldığında, hidrostatik ödem ile geçirgenlik ödemi ayrımında çok çekici bir araç oldu. Bu dönem, yoğun bakımın “monitörle düşünen” bir disipline evrilmesinin de dönemidir: sıvı verilir, basınç yükselir mi; diüretik verilir, wedge düşer mi; oksijenasyon düzelir mi?
Sonraki yıllarda, pulmoner arter kateterinin herkes için faydalı olup olmadığı tartışmaları büyüdü; teknoloji geri çekilmedi ama daha seçici kullanılır hâle geldi. Bu tartışma bile keşif hikâyesinin bir parçasıdır: “ölçmek” her zaman “iyileştirmek” değildir; ama doğru şeyi ölçmeyi öğrenmek bilimin ilerleyişidir.
1980’ler–2000’ler: Akciğerde suyu ölçmek, alveolden suyu geri çekmek
1980’lerden itibaren araştırmacılar, akciğer ödemini sadece basınçlarla değil “akciğerdeki gerçek su miktarıyla” konuşmak istedi. Termodilüsyon teknikleriyle ekstravasküler akciğer suyu ölçümü kavramı gelişti; bu, özellikle ağır kritik hastada ödemin seyrini nicel izleme fikrini güçlendirdi.
Aynı dönemde alveoler epitelin pasif bir zar değil, aktif bir “sıvı temizleme” organı olduğu fikri olgunlaştı. Alveoler sodyum transportu ve buna bağlı su reabsorpsiyonu, ödemin çözülmesinde merkezi rol kazandı. Bu yaklaşım, keşif hikâyesine yeni bir dramatik gerilim ekledi: iki hasta aynı miktarda ödemle başlasa bile, biri hızla toparlayabilir, diğeri kötüleşebilir; çünkü belirleyici olan yalnızca sızıntı değil, temizleme kapasitesidir.
2000: ARDSNet ve “ventilatörün de bir ilaç olduğu” gerçeği
2000 yılında düşük tidal volüm ventilasyon stratejisini gösteren ARDSNet çalışması, ARDS’li hastalarda mortaliteyi azaltarak bir paradigmayı klinik standarda dönüştürdü. Bu gelişme, akciğer ödeminin keşif hikâyesinde şu açıdan önemlidir: ARDS’de problem yalnızca “ödem” değildir; ödemli, kırılgan akciğeri nasıl havalandırdığınız da hastalığın kaderini belirler. Ventilatör ayarları, bariyer hasarını büyütüp sızıntıyı artırabilir; doğru ayarlarla ise hasar zinciri kırılabilir.
2012: Berlin tanımı ve ARDS’nin daha keskin bir çerçeveye oturması
ARDS’nin tanı kriterleri yıllar içinde değişmişti; 2012’de Berlin tanımı, klinik heterojenliği daha düzenli sınıflandırma hedefiyle ortaya çıktı. Tanımın keşif hikâyesindeki rolü şudur: aynı adı taşıyan hastaların aslında çok farklı biyolojilere sahip olabileceği kabul edildi ve bu farklılıklar şiddet kategorileriyle daha sistematik ele alınmaya başlandı.
2012: “Revised Starling” ve glikokaliksin sahneye çıkışı
Starling’in denklemi yüz yıl boyunca öğretildi; fakat 2010’lardan itibaren endotelin glikokaliks tabakasının damar geçirgenliği ve sıvı hareketinde beklenenden daha kritik rol oynadığı anlaşıldı. Woodcock ve çalışma arkadaşlarının “revize Starling” yaklaşımı, klinik sıvı tedavisi düşüncesini de etkiledi: damar içi sıvı yüklemesi, yalnızca basınçları değil, bariyerin mikroyapısını da etkileyebilir; bazı durumlarda sızıntıyı artırıp ödemi ağırlaştırabilir.
Bu nokta, keşif hikâyesinde incelikli bir dönüşümdür: eskiden ödemi “kapiller basınç” ve “plazma proteinleri” ile açıklamaya alışkınken, artık “damar duvarının şekerli tüy gibi örtüsü”nün hasarını ve bunun sızıntıya etkisini konuşuyoruz.
2013: PROSEVA ve yerçekimini tedaviye dönüştürmek
2013’te prone pozisyonun ağır ARDS’de mortaliteyi azalttığını gösteren PROSEVA çalışması, keşif hikâyesine neredeyse şiirsel bir unsur ekledi: akciğer ödemi ve konsolidasyonun heterojen dağılımını, yalnızca ilaçlarla değil, hastanın yönünü değiştirerek yönetmek. Bu, anatomik-fizyolojik bir içgörünün klinik pratiğe büyük etkisidir: akciğer, yerçekimi altında davranan bir organ; öyleyse yerçekimini tedavinin parçası yapabilirsiniz.
2009–2018: ECMO’nun geri dönüşü ve “zaman kazanma sanatı”
Şiddetli ARDS’de veno-venöz ECMO, uzun bir tartışma tarihinden sonra özellikle 2009’daki CESAR çalışması ve 2018’deki EOLIA ile yeniden gündemin merkezine yerleşti. ECMO’nun akciğer ödemi keşif hikâyesindeki felsefi rolü nettir: bazen asıl tedavi akciğerin kendisini zorlamak değil, ona “iyileşmesi için zaman” kazandırmaktır. Bu yaklaşım, ödemin biyolojik çözülme süreçlerine saygı duyan bir yoğun bakım stratejisidir.
2020’ler: COVID-19, akciğer suyu, mikrovasküler hasar ve “tek hastalık değil, fenotipler” fikrinin güçlenmesi
COVID-19 pandemisi, ARDS ve akciğer ödemi araştırmasını hızlandıran dev bir doğal deney gibi çalıştı. Bir yandan ekstravasküler akciğer suyu ölçümü, bir yandan mikrovasküler hasar ve endotel disfonksiyonu tartışmaları yeniden ivme kazandı. Bu dönemde öne çıkan düşünce şuydu: aynı radyolojik görünüme sahip hastalarda bile biyolojik sürücüler farklı olabilir; kiminde endotel ağırlıklı sızıntı, kiminde inflamasyon paterni, kiminde tromboinflamasyon baskın.
Bu, keşif hikâyesinin olgunluk evresidir: tek bir “ARDS ilacı” aramak yerine, ARDS’nin alt tiplerini yakalamaya çalışmak.
2023–2026: Akciğer ödemini sayısallaştırma, yapay zekâ ile yatak başı görüntüleme, biyobelirteçlerle endotel okuması
Günümüzde keşif yolculuğu iki paralel hatta ilerliyor:
1) Ödemin nicel ölçümü ve görüntülemenin standardizasyonu
Radyografi, BT, MR, nükleer yöntemler ve özellikle akciğer ultrasonografisiyle ödemin miktarını daha nesnel ölçme girişimleri hızlandı. Sistematik derlemeler, bu yöntemlerin doğrulama düzeylerini, klinik karar vermeye katkılarını ve seri ölçümlerde kullanılabilirliğini tartışıyor. Ama en pratik devrim, bedside akciğer ultrasonu: B-çizgileriyle interstisyel sıvıyı hızla izlemek, tedaviye yanıtı görmek ve taburculuk öncesi rezidüel konjesyonu değerlendirmek artık daha rutin bir hedef.
2) Bariyer biyolojisinin biyobelirteçlere ve “fenotipleme”ye taşınması
Endotelyal glikokaliks hasarı, angiopoietin ekseni, syndecan-1 gibi belirteçler; damar duvarının “sızdırma eğilimini” biyokimyasal olarak okumaya aday hale geldi. Aynı dönemde makine öğrenmesiyle ARDS alt fenotiplerini tanımlama çalışmaları büyüyor: klinik veriler, ventilasyon parametreleri, laboratuvar profilleri ve bazen alveoler örneklerdeki protein panelleri kullanılarak “hangi hasta hangi biyolojik kümeye daha yakın?” sorusu yanıtlanmaya çalışılıyor.
Bu iki hat birleştiğinde, hikâye şuraya varıyor: gelecek, akciğer ödemini “görünen gölge” olarak değil, ölçülebilen su yükü + bariyer hasarı imzası + fenotipik risk haritası olarak okuyabilmekte.
Ve böylece keşif öyküsü, Laennec’in kulağıyla başlayan bir meraktan, günümüzde yapay zekânın kılavuzluk ettiği ultrason probuna; Starling’in denklemiyle başlayan bir fikirden, glikokaliksin moleküler yıpranmasını izleyen biyobelirteçlere; Kerley’nin çizgilerinden, çok-modlu sayısal konjesyon skorlarına uzanır. Akciğer ödemi hâlâ “akciğerin ıslanması”dır, ama artık bunun kaç farklı yolla olabileceğini ve hangi yolun hangi tedaviyi çağırdığını giderek daha iyi biliyoruz.
İleri Okuma
- Starling, E.H. (1896) On the Absorption of Fluids from the Connective Tissue Spaces. The Journal of Physiology, 19(4), 312–326. doi:10.1113/jphysiol.1896.sp000596.
- Forssmann, W. (1929) Die Sondierung des Rechten Herzens. Klinische Wochenschrift, 8, 2085–2087. doi:10.1007/BF01875120. (Springer)
- Krogh, A. (1929) The anatomy and physiology of capillaries. Yale University Press, New Haven.
- Kerley, P.J. (1933) Radiology in Heart Disease. British Medical Journal, 2(3795), 594–612. doi:10.1136/bmj.2.3795.594. (PubMed)
- Cournand, A.F., Richards, D.W. (1940’lar) Right heart catheterization ve pulmoner dolaşımın klinik fizyolojisi üzerine çalışmalar. İlgili dergiler, ilgili sayfalar.
- Hultgren, H.N., Spickard, W.B., Hellriegel, K., Houston, C.S. (1961) High altitude pulmonary edema. Medicine (Baltimore), 40, 289–313. doi:10.1097/00005792-196109000-00002.
- Ashbaugh, D.G., Bigelow, D.B., Petty, T.L., Levine, B.E. (1967) Acute respiratory distress in adults. The Lancet, 290, 319–323. doi:10.1016/S0140-6736(67)90168-7.
- Staub, N.C. (1974) Pulmonary edema. Physiological Reviews, 54(3), 678–811. doi:10.1152/physrev.1974.54.3.678. (PubMed)
- Duffin, J.M. (1989) The cardiology of R. T. H. Laennec. Medical History, 33(1), 42–71. doi:10.1017/S0025727300048900. (PubMed)
- ARDS Network (2000) Ventilation with Lower Tidal Volumes as Compared with Traditional Tidal Volumes for Acute Lung Injury and the Acute Respiratory Distress Syndrome. New England Journal of Medicine, 342, 1301–1308. doi:10.1056/NEJM200005043421801.
- Matthay, M.A., Folkesson, H.G., Clerici, C. (2002) Lung epithelial fluid transport and the resolution of pulmonary edema. Physiological Reviews, 82, 569–600.
- Gattinoni, L., Pesenti, A. (2005) The concept of “baby lung”. Intensive Care Medicine, 31(6), 776–784. doi:10.1007/s00134-005-2627-z. (PubMed)
- Ware, L.B. (2006) Pathophysiology of acute lung injury and the acute respiratory distress syndrome. Seminars in Respiratory and Critical Care Medicine, 27, 337–349.
- Chatterjee, K. (2009) The Swan-Ganz Catheters: Past, Present, and Future. Circulation, 119(1), 147–152. (American Heart Association Journals)
- Peek, G.J., Mugford, M., Tiruvoipati, R., ve ark. (2009) Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. The Lancet, 374(9698), 1351–1363. doi:10.1016/S0140-6736(09)61069-2. (PubMed)
- Matthay, M.A., Zemans, R.L. (2011) The acute respiratory distress syndrome: pathogenesis and treatment. Annual Review of Pathology: Mechanisms of Disease, 6, 147–163.
- Force, A.D.T., Ranieri, V.M., Rubenfeld, G.D., Thompson, B.T., Ferguson, N.D., Caldwell, E., Fan, E., Camporota, L., Slutsky, A.S. (2012) Acute respiratory distress syndrome: the Berlin Definition. JAMA, 307, 2526–2533.
- West, J.B. (2012) High-altitude medicine and physiology. 5th ed., CRC Press, Boca Raton. ISBN 9781444124508.
- Woodcock, T.E., Woodcock, T.M. (2012) Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. British Journal of Anaesthesia, 108(3), 384–394. doi:10.1093/bja/aer515.
- Guérin, C., Reignier, J., Richard, J.-C., ve ark. (2013) Prone Positioning in Severe Acute Respiratory Distress Syndrome. New England Journal of Medicine, 368, 2159–2168. doi:10.1056/NEJMoa1214103.
- Marik, P.E. (2013) Obituary: pulmonary artery catheter 1970 to 2013. Annals of Intensive Care, 3(1), 38. doi:10.1186/2110-5820-3-38. (PubMed)
- Thompson, B.T., Chambers, R.C., Liu, K.D. (2017) Acute respiratory distress syndrome. New England Journal of Medicine, 377, 562–572.
- Combes, A., Hajage, D., Capellier, G., ve ark. (2018) Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. New England Journal of Medicine, 378, 1965–1975. doi:10.1056/NEJMoa1800385.
- Lindow, T., Quadrelli, S., Ugander, M. (2023) Noninvasive Imaging Methods for Quantification of Pulmonary Edema and Congestion: A Systematic Review. JACC: Cardiovascular Imaging, 16(11), 1469–1484. doi:10.1016/j.jcmg.2023.06.023. (PubMed)
- Okila, N., Katumba, A., Nakatumba-Nabende, J., Mwikirize, C., Murindanyi, S., Serugunda, J., Bugeza, S., Oriekot, A., Bossa, J., Nabawanuka, E. (2025) Deep learning for accurate B-line detection and localization in lung ultrasound imaging. Frontiers in Artificial Intelligence, 8, 1560523. doi:10.3389/frai.2025.1560523. (Frontiers)
- Baloescu, C., Bailitz, J., Cheema, B., Agarwala, R., ve ark. (2025) Artificial Intelligence–Guided Lung Ultrasound by Nonexperts. JAMA Cardiology, 10(3), 245–253. doi:10.1001/jamacardio.2024.4991. (PubMed)
- Petrick, P.L., ve ark. (2025) Clinical Phenotyping in Acute Respiratory Distress Syndrome: Steps Towards Personalized Medicine. Journal of Clinical Medicine, 14(20), 7204. doi:10.3390/jcm14207204. (MDPI)
- Ma, W., Tang, S., Yao, P., ve ark. (2025) Advances in acute respiratory distress syndrome: focusing on heterogeneity, pathophysiology, and therapeutic strategies. Signal Transduction and Targeted Therapy, 10(1), 75. doi:10.1038/s41392-025-02127-9. (PubMed)
- Inoda, A., Suzuki, K., Tomita, H., Okada, H. (2025) Glycocalyx shedding as a clinical biomarker in critical illness. Experimental and Molecular Pathology, 144, 104997. doi:10.1016/j.yexmp.2025.104997. (PubMed)
Yorum yazabilmek için oturum açmalısınız.