İçindekiler
Etimoloji ve tarihçe
“Pulmoner” Latince pulmo (akciğer) kökünden gelir; “vasküler” Latince vasculum (küçük damar); “direnç” ise Latince resistentia (karşı koyma) köküne dayanır. Kardiyopulmoner hemodinaminin “direnç” kavramı, Poiseuille (19. yy) ve Ohm benzeri hemodinamik analojilerle biçimlenmiştir: basınç farkı = akım × direnç. 20. yüzyılın ortasında sağ kalp kateterizasyonunun rutine girmesi, pulmoner arter basınçlarının ve dolaylı sol atriyal basıncın (pulmoner kılcal kama basıncı, PCWP) ölçümünü olanaklı kılmış; PVR, klinik karar süreçlerinin merkezine yerleşmiştir.
Tanım
Pulmoner vasküler direnç, pulmoner dolaşım boyunca kanın karşılaştığı hemodinamik karşı koymayı ifade eder. Operasyonel tanım, sağ ventrikülün (SV) ürettiği basınç ile sol atriyuma dönen kan arasındaki basınç farkının, birim zamanda geçen kan akımına (kardiyak debi, CO) oranıdır.
PVR = (mPAP-PCWP) / CO
- mPAP: Ortalama pulmoner arter basıncı
- PCWP: Pulmoner kılcal kama basıncı (sol atriyal basıncın dolaylı göstergesi)
- CO: Kardiyak debi
Birimler: “Wood unit (WU)” sıklıkla kullanılır. Dönüşüm: (1\ \text{WU} = 80\ \text{dyn·s·cm}^{-5}). Klinik raporlamada WU tercih edilir (ör. 2–3 WU fizyolojik; ≥3 WU artmış olarak yorumlanır; bağlam ve yaşa göre değişir).
Makro ve mikro-anatomi: damar ağının mimarisi
Pulmoner arter, pulmoner trunkustan ayrılarak lobar, segmental ve subsegmental arterlere; distalde arteriollere ve alveol çevresi kılcallara bağlanır; oksijenlenmiş kan, venüller ve pulmoner venler yoluyla sol atriyuma döner. Akciğer damar ağının eşsiz özelliği, alveollerle “mekanik” bir eş-bağlılık içinde olmasıdır: alveol hacmi ve interstisyel basınç, kılcal ve ekstra-alveoler damar çaplarını belirgin biçimde etkiler.
Hemodinamik çerçeve: Ohm yasası, Poiseuille akımı ve nabızlılık
PVR, yalnızca statik bir direnç değildir; nabızlı akım altında “empedans” kavramı (rezistans + inertans + kapasitans) önem kazanır. Pulmoner arteriyel uyum (compliance, C) ve elastans (E) ile sağ ventrikül–pulmoner arter (SV–PA) eşleşmesi, sağ kalp yüklenmesini belirler. “RC zamanı” (rezistans × komplians) pulmoner yatakta görece sabit kalma eğilimindedir; PVR yükselirken komplians düşer ve nabız basıncı artar.
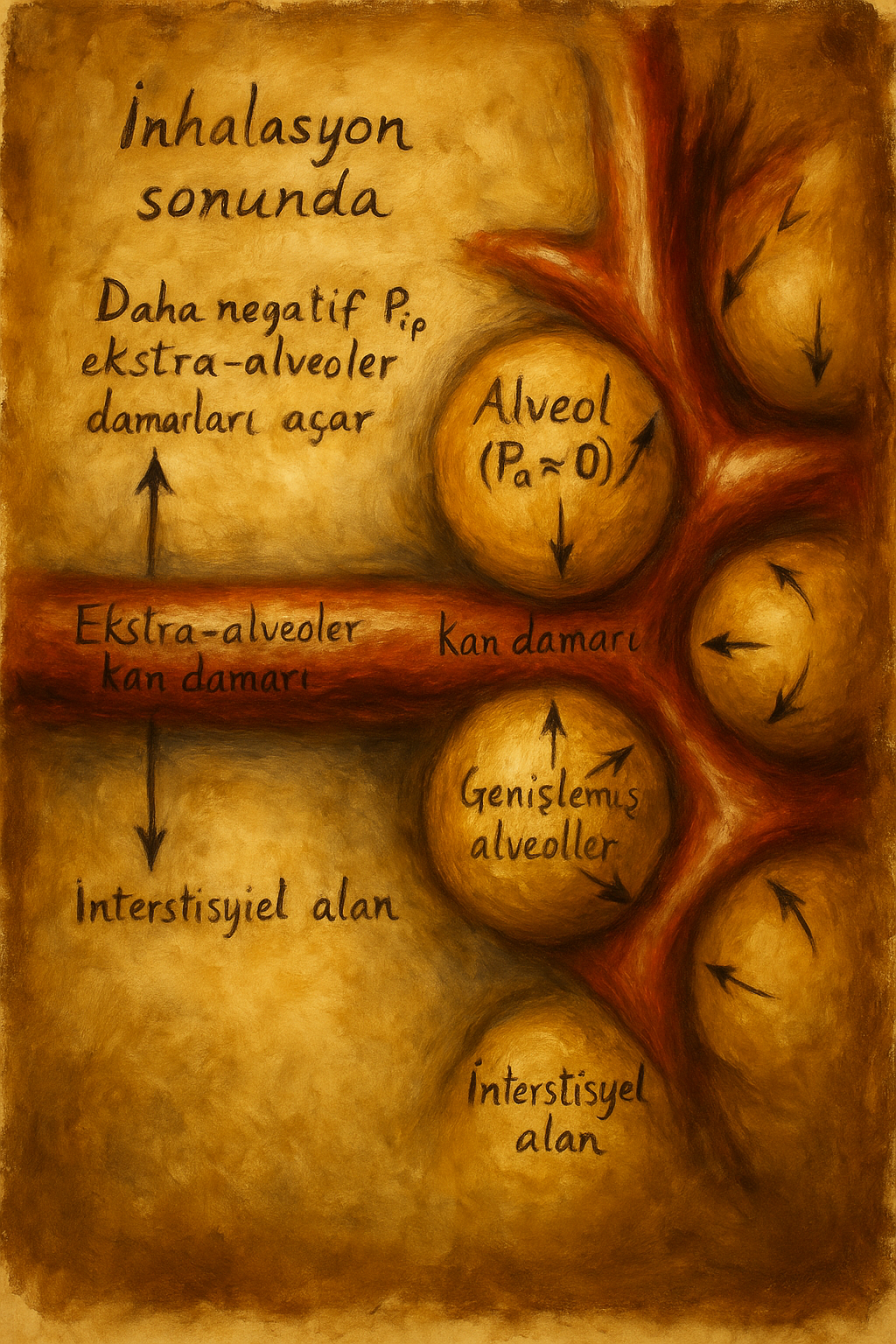
PVR’nin çift kaynaklı oluşumu: alveoler ve ekstra-alveoler damarlar
Lung volume–PVR ilişkisi U-şeklindedir:
- Düşük akciğer hacmi (atelectazi, ekspiryum sonu altı): Ekstra-alveoler damarlar çevresel çekişin azalmasıyla daralır → PVR artar.
- Yüksek akciğer hacmi (hiperinflasyon, aşırı PEEP): Alveol içi basınç kılcal damarları sıkıştırır → PVR artar.
- Fonksiyonel rezidüel kapasite (FRC) çevresi: Rekrutman ve distansiyon en verimli, PVR en düşük.
Dinamik modülatörler
1) Vazokonstriksiyon–vazodilatasyon dengesi
- Hipoksik pulmoner vazokonstriksiyon (HPV): Alveoler PO₂ düşüşüne yanıt olarak bölgesel arteriyoller daralır; perfüzyon iyi havalanan bölgelere yönlenir. Moleküler arka planında düz kas hücrelerinde O₂-duyarlı K⁺ kanalları, kalsiyum giriş artışı, endotelin artışı; karşıt yönde NO ve prostasiklin bulunur.
- Endotel aracılı mediyatörler:
- Vazodilatör: Nitrik oksit (eNOS kaynaklı), prostasiklin (PGI₂).
- Vazokonstriktör: Endotelin-1, tromboksan A₂, serotonin.
- İlaçlar ve inhalasyon gazları: NO inhalasyonu, PDE5 inhibitörleri, sGC uyarıcıları, kalsiyum kanal blokerleri; halojenli anestetikler ve hiperkapni/alkaloz–asidoz dengesi gibi faktörler.
2) Yapısal yeniden şekillenme
Kronik basınç/yük stresine yanıt olarak medial hipertrofi, intimada fibromüsküler kalınlaşma, adventisyel fibrozis ve kılcal kaybı ortaya çıkar. Uzamış HPV, kronik hipoksemik hastalıklarda (KOAH, interstisyel akciğer hastalıkları, uyku apnesi, yüksek irtifa) dirençte kalıcı artışa zemin hazırlar. Tromboembolik hastalıkta organize pıhtı ve distal mikrovasküler remodeling, PVR’yi belirgin yükseltir.
3) Hemorheoloji: viskozite ve hematokrit
Poiseuille yasasına göre viskozite arttıkça direnç artar. Polisitemi (yüksek hematokrit), soğuk ortam, hiperviskozite sendromları PVR’yi yükseltebilir; hemodilüsyon ise düşürebilir. Kan hacmi artışı (hipervolemi) akıma bağlı transmural gerilim ve kapanma-eşiği dinamiklerini değiştirir.
4) Gravite ve bölgesel perfüzyon
Düşey konumda bazallerde transmurallik daha yüksek, dorso-kaudal alanlarda perfüzyon fazladır. West bölgeleri (Zone 1–3) kavramsallaştırması, alveol ve damar basınçlarının göreli büyüklüklerine dayalı akım desenlerini açıklar; ventilasyon-perfüzyon (V/Q) eşleşmesi ve PVR bu dağılımdan etkilenir.
Egzersiz ve PVR
Sağlıklı bireyde egzersizle CO yükselirken PVR düşer: kapalı kılcalların “rekütmanı” (yeni kanalların açılması) ve distansiyon (mevcut kanalların genişlemesi) devreye girer; bu sayede mPAP sınırlı artar ve sağ ventrikül yükü kontrol altında tutulur. Patolojide (pulmoner hipertansiyon) bu adaptasyon yetersizdir; mPAP aşırı yükselir, dispne ve egzersiz kapasitesi kısıtlanır.
Ölçüm ve hesaplama ayrıntıları
Sağ kalp kateterizasyonu
- Basınçlar: RAP, RV, PAP (sistolik/diastolik/ortalama), PCWP (nazal/venöz yol ile wedge).
- Akım (CO): Termodilüsyon veya Fick yöntemi.
- Hesaplamalar:
- Transpulmoner gradyan (TPG) = mPAP − PCWP
- PVR (WU) = TPG / CO
- Diyastolik basınç gradyanı (DPG) = dPAP − PCWP (özellikle sol kalp hastalığı zemininde pre/post-kapiller ayrımı için yardımcı)
- Birim dönüşümü: {PVR}({dyn·s·cm}^{-5}) = 80 x PVR {WU}.
İnvazif olmayan tahminler
- Ekokardiyografi: TR jetinden sPAP tahmini, RVOT-VTI ile strok volüm/CO; ancak dolaylı ve operatöre bağımlıdır.
- Kardiyak MR: Pulmoner akım ölçümü, sağ ventrikül hacim-fonksiyon analizi; vasküler komplians ve akım dalga biçimleri.
- BT anjiyografi: Proksimal obstrüksiyon, damar çapları, sağ kalp yüklenmesi; fakat doğrudan direnç ölçmez.
Ölçümde hataya açık noktalar
- PCWP ölçüm tekniği/hacmi aşırı “over-wedging”, mitral kapak hastalığı, pulmoner venöz tıkanıklık yanlış yüksek PCWP’ye ve PVR’nin olduğundan düşük hesaplanmasına yol açabilir.
- CO ölçümü: Triküspit yetersizliği, şantlar, ağır trikuspid regürjitasyonunda termodilüsyon hataları; Fick yönteminde VO₂ varsayımı.
- Mekanik ventilasyon ve PEEP, transmural basınçları değiştirerek mPAP/PCWP yorumunu etkiler.
PVR’yi yükselten başlıca durumlar (seçilmiş örnekler)
- Pulmoner hipertansiyon (WHO Grup 1–5):
- Grup 1: Pulmoner arteriyel hipertansiyon (idiopatik, herediter, ilaç/ toksin, bağ dokusu hastalıkları vb.)
- Grup 2: Sol kalp hastalıkları (yüksek PCWP; sıklıkla DPG düşük/normal)
- Grup 3: Akciğer hastalığı ve/veya hipoksemi (KOAH, İAH, OSA, yüksek irtifa)
- Grup 4: Kronik tromboembolik pulmoner hipertansiyon (CTEPH) ve diğer pulmoner arter obstrüksiyonları
- Grup 5: Multifaktöriyel/Belirsiz mekanizmalar (hematolojik, sistemik vb.)
- Akut pulmoner emboli: Ani PVR artışı → akut RV yüklenmesi.
- ARDS ve mekanik ventilasyon: Yüksek akciğer hacmi ve PEEP ile alveoler damar sıkışması; hipoksinin HPV’yi tetiklemesi.
- Neonatal dönemde persistan pulmoner hipertansiyon (PPHN): Doğum sonrası normal düşmesi gereken PVR’nin persistansı.
- Gebelik ve doğum: Volüm yükü, hiperventilasyon, pulmoner vazodilatör-dengelerin değişimi; altta yatan PH’de belirgin risk.
PVR ve sağ ventrikül: yük, eşleşme ve yetmezlik
Sağ ventrikül ince-duvarlı, düşük basınçlı bir pompadır; PVR yükseldiğinde afterload artar, SV–PA eşleşmesi bozulur, stroke hacim azalır, RV dilatasyonu ve trikuspid yetmezliği gelişebilir. Uzamış yüklenme ile RV hipertrofisi ve sistolik/diastolik disfonksiyon ortaya çıkar; karaciğer konjesyonu ve periferik ödem gibi sistemik etkiler izlenir. Klinik izlemi, RV ejeksiyon fraksiyonu, TAPSE, RV-arteriyel bağlanım (Ees/Ea) ve natriüretik peptidler gibi göstergelerle yapılır.
Gaz değişimi üzerine etkiler
PVR artışı ve buna eşlik eden damar yeniden şekillenmesi, perfüzyon dağılımını bozar; V/Q uyumsuzluğu, şant ve difüzyon sınırlamaları hipoksemi ve hiperkapniyi derinleştirebilir. HPV kısa vadede V/Q optimizasyonu sağlar; ancak yaygın hipokside global PVR artışı zararlıdır.
Tedavi ve yönetim stratejileri
Genel ilkeler
- Altta yatan nedenin saptanması (PH gruplaması; sol kalp, akciğer hastalığı, tromboemboli).
- Oksijenizasyonun optimizasyonu; hipoksinin giderilmesi HPV’yi azaltır.
- Hacim yönetimi: Diyürez ile RV duvar geriliminin ve sağ atriyal basıncın azaltılması; hipovolemiden kaçınılması (RV doluşu gerek).
- Asit-baz ve ventilasyon hedefleri: Hiperkapni/asidoz vazokonstriksiyonu artırır; mekanik ventilasyonda düşük sürücü basınç ve PEEP optimizasyonu, akciğer hacmi-PVR U-eğrisi gözetilerek yapılır.
Vazodilatör/özel tedaviler (endikasyona göre)
- Kalsiyum kanal blokerleri: Yalnızca vazoreaktivite testi pozitif azınlıkta.
- Endotelin reseptör antagonistleri: Bosentan, ambrisentan, macitentan.
- PDE-5 inhibitörleri / sGC uyarıcıları: Sildenafil, tadalafil; riociguat (özellikle CTEPH ve PAH’da).
- Prostasiklin ekseni: Epoprostenol (IV), treprostinil (IV/SC/İnhalasyon), iloprost (inh); IP-reseptör agonisti selexipag.
- İnhale NO: Akut vazoreaktivite testi, perioperatif veya ağır hipoksemide köprü.
- Antikoagülasyon: CTEPH ve seçilmiş PAH alt gruplarında.
- Destekleyici: Demir replasmanı (eksiklikte), aşılama, egzersiz rehabilitasyonu, obstrüktif uyku apnesinde CPAP.
Girişimsel/cerrahi seçenekler
- Pulmoner tromboendarterektomi (PTE): Proksimal/segmental düzeyde organize pıhtıların çıkarılması; CTEPH’de küratif olabilir, PVR’yi belirgin azaltır.
- Balon pulmoner anjiyoplasti (BPA): Distal/ince dallı CTEPH olgularında aşamalı seanslarla damar genişletme; hemodinami ve fonksiyonu iyileştirir.
- Atrial septostomi (seçilmiş PAH): Sağdan sola geçişle RV dekompresyonu ve kardiyak output artırımı; hipoksemi pahasına.
- Akciğer veya kalp-akciğer transplantasyonu: İleri refrakter hastalıkta.
Anestezi ve yoğun bakımda PVR yönetimi
- İndüksiyon ve idame: Hipoksi, hiperkapni, asidoz ve hipotermiden kaçınma; adekvat analjezi/sedasyon ile sempatik aşırı aktivasyonun sınırlanması.
- Ventilatör ayarları: Aşırı tidal hacim ve PEEP’ten kaçınma; plato basınçlarını düşük tutma; asidozu düzeltme.
- Hemodinamik destek: Noradrenalin (sistemik basıncı korurken pulmoner etkisi görece nötr), inotroplar (dobutamin/milrinon) ve seçici pulmoner vazodilatör kombinasyonları; sıvı titrasyonu.
Özel durumlar
- Yüksek irtifa: Alveoler hipoksiye bağlı global HPV → PVR artışı; predispozan bireylerde yüksek irtifa pulmoner ödemi (HAPE).
- Gebelik: Hemodinamik yük artışı ve farmakoterapi sınırlılıkları; teratojenite ve maternal-fetal riskler dikkate alınarak multidisipliner izlem.
- Çocukluk çağı/yenidoğan: PPHN’de fetal dolaşımdan postnatal geçişin başarısızlığı; inhale NO, ventilasyon stratejileri, prostasiklinler, ekmo köprüleri.
- Kronik akciğer hastalığı (KOAH/İAH): Uzun süreli oksijen tedavisi hipoksemiye bağlı PVR artışını sınırlayabilir; egzersiz ve rehabilitasyonla periferik koşullanmaya destek.
- Akut PE: Sistemik tromboliz, kateter-yönlendirmeli tedaviler veya cerrahi embolektomi; hemodinamik stabilite öncelikli.
Ölçümsel nüanslar ve raporlama
- PVR tek başına değil, mPAP, PCWP, CO, SVR, komplians ve RV fonksiyon veri seti ile birlikte yorumlanmalıdır.
- Pre- vs post-kapiller ayrımı: PCWP yüksekliği, DPG ve TPG ile birlikte değerlendirilir; sol kalp hastalığı zemininde “kombine pre/post-kapiller PH” olasılığı özellikle DPG ≥7 mmHg ve/veya PVR ≥3 WU ile desteklenir.
- Egzersiz veya sıvı yükü testleri, sınırda olgularda rezerv ve hemodinamik fenotipi açığa çıkarabilir.
Pratik örnek hesap
- mPAP = 35 mmHg, PCWP = 15 mmHg, CO = 5 L/dk ise:
- TPG = 35 − 15 = 20 mmHg
- PVR = 20 / 5 = 4 WU (≈ 320 dyn·s·cm⁻⁵) → artmış.
Evrimsel ve işlevsel perspektif
Pulmoner yatak, memelilerde düşük basınç/düşük direnç ilkesi üzerine evrimleşmiştir; ince duvarlı sağ ventrikül, geniş komplianslı pulmoner arterler ve geniş kapiller ağ, yüksek yüzey alanı ile gaz değişimini en düşük enerji maliyetiyle sağlar. HPV gibi yerelleşmiş refleksler, heterojen akciğer ventilasyonuna rağmen oksijen alımını maksimize eden “akıllı” bir yönlendirme mekanizmasıdır; ancak kronik ve yaygın tetiklendiğinde sistemik uyumun sınırlarını aşar.
Klinik uygulamaya çeviri: karar noktaları (özet başlıklar olmadan, uygulama rehberi niteliğinde)
- PVR yükselmişse daima “neden?” sorusuyla başlanır: sol kalp, akciğer parankimi/hipoksemi, tromboemboli, primer vaskülopati.
- PVR normal, mPAP yüksek ve PCWP yüksekse öncelik sol kalp/diyastolik disfonksiyon yönündedir.
- PVR yükselmiş ve PCWP normal ise prekapiller süreçler (PAH, hipoksik/akciğer, CTEPH) öne çıkar.
- Tedavi, patofizyolojik fenotipe göre hedeflenir: oksijenizasyon, hacim yönetimi, seçici vazodilatör eksenleri, antitrombotik stratejiler, gerekirse PTE/BPA veya transplantasyon.
- İzlem, yalnız basınçlarla değil fonksiyonel kapasite (6DYT, kardiopulmoner egzersiz testi), RV fonksiyon göstergeleri ve biyobelirteçlerle entegre yapılır.
Keşif
Pulmoner vasküler direncin hikâyesi, kanın kalpteki döngüsel hareketinin kavranmasıyla başlar, mikroskobun kılcal ağı görünür kılmasıyla derinleşir, ölçüm aletlerinin damarlara uzanmasıyla sayıya dönüşür ve nihayet hücre içi yolların çözümlenmesiyle moleküler bir haritaya bürünür. Bugün “PVR” diye kısalttığımız kavramın ardında, asırlar boyunca birbirine eklemlenen gözlemler, aletler, matematik benzetmeler ve cesur klinik girişimler vardır.
1) Dolaşımın resmedilişi: kalbin pompa olarak keşfi ve kılcal köprü
1628’de William Harvey, “Motu Cordis” ile kalbin vücuda kan pompaladığını ve kanın kapalı bir devre içinde dolaştığını savunurken, pulmoner geçidin akış direnci hakkında henüz konuşmaz; ama temel soruyu açar: Akımın olduğu yerde bir zorlanma, bir karşı koyma da vardır. Harvey’in kavramsal çerçevesini, 1660’larda Marcello Malpighi mikroskobun gözüyle tamamlar: Arterlerle venleri birbirine bağlayan kılcalları görür. Böylece kalbin sağından çıkan kanın akciğerlerde kılcal bir elek içinden süzülerek sol kalbe döndüğü fikri, somut bir anatomiye kavuşur. Malpighi’nin cam merceği, ileride “direncin nerede üretildiği” sorusunu soracak kuşaklara yol gösterir: En dar boru neredeyse, akış orada zorlanır.
2) Basıncın ölçülmesi: cam tüpler, kimograflar ve hemodinami
1733’te Stephen Hales, atardamar basıncını ilk kez doğrudan ölçtüğünde, fizyolojiye bir koordinat sistemi armağan eder: Basınç somut bir büyüklüktür. 19. yüzyıl ortasında Jean Léonard Marie Poiseuille, dar tüplerden akışın yasalarını betimler; viskozite, uzunluk ve yarıçapın dördüncü kuvveti denkleme girer. Aynı yüzyılda Carl Ludwig, kimografı geliştirerek basınç dalgalarını zamanın üzerine yazar; hemodinamik, sayısal bir dil kazanır. Bu dönemde Ohm yasasına yapılan benzetme—basınç farkı = akım × direnç—klinik fizyolojinin zihin haritasına kazınır. Pulmoner yatağın “düşük basınç–düşük direnç” doğası, sistemik dolaşımla kıyas içinde düşünülmeye başlar.
3) Kateterin yolculuğu: sağ kalbe giren tel ve PVR’nin formüle edilişi
1929’da Werner Forssmann, kendi sağ kalbine kateter ilerleterek denenemez sanılanı dener. Bunu klinik bilime dönüştüren André Cournand ve Dickinson Richards, sağ kalp kateterizasyonunu sistematikleştirir; 20. yüzyıl ortasında pulmoner arter basınçlarını, sağ ventrikül ve sağ atriyum basınçlarını güvenle ölçer hâle geliriz. Adolf Fick’in 19. yüzyılda tarif ettiği ilke (O₂ tüketimi ve arteriyovenöz O₂ farkından kardiyak debinin hesaplanması), 1940’ların klinik laboratuvarında kan-gaz analizörleri ve metabolik ölçümlerle yeniden doğar. Böylece bir denklem pratikleşir:
PVR = {Ortalama Pulmoner Arter Basıncı (mPAP)} – {Pulmoner Kılcal Kama Basıncı (PCWP)}}{\{Kardiyak Debi (CO)}}
Basınçların doğrudan, akımın ise Fick veya termodilüsyonla ölçülebildiği bir çağda, “direnç” artık soyut bir sezgi değil, raporlanabilir bir değerdir. Klinikçiler Wood biriminden söz etmeye başlar; araştırmacılar, aynı basınçta neden birinde akım düşerken diğerinde arttığını damar çapı ve komplians üzerinden tartışır.
4) Akciğerin mekanik coğrafyası: bölgeler, hacim ve U-şekilli ilişki
20. yüzyılın ortalarından itibaren John B. West ve çağdaşları, akciğer içi basınç ilişkilerini katmanlandırır: “Bölgeler” kavramı (Zone 1–3), alveol basıncı ile arter-ven basınçlarının göreli büyüklüklerine göre akımın bölgesel dağıldığını anlatır. Pulmoner damarların bir kısmı alveol duvarlarının içinde (alveoler damarlar), bir kısmı ise interstisyel çekişle açılan ekstra-alveoler yatakta bulunur. Akciğer hacmi arttıkça alveoler damarlar sıkışır; hacim düştükçe ekstra-alveoler damarlar kapanmaya meyleder. PVR’nin akciğer hacmine göre U-şeklinde değiştiği kavrayışı, mekanik ventilasyon stratejilerine ve egzersiz fizyolojisine yeni bir akıl sunar. Egzersizde kardiyak debi yükselirken PVR’nin paradoksal biçimde düşmesi—rekütman ve distansiyon—sağlıklı yatağın adaptasyon kabiliyetini görünür kılar.
5) Refleksler ve mediyatörler: hipoksik vazokonstriksiyon ve endotelin–NO ekseni
Akciğer damarları çevrenin gaz karışımına kulak kesilir. Alveoler hipoksi geliştiğinde, düz kas hücresinin membran kanalları ve kalsiyum dinamiği değişir; hipoksik pulmoner vazokonstriksiyon devreye girer, perfüzyon iyi havalanan yerlere kaydırılır. 1980’lerin sonuna gelindiğinde endotelin-1’in güçlü bir vazokonstriktör olduğu gösterilir; buna karşı nitrik oksit endotel kaynaklı gevşetici faktör olarak tanımlanır, guanilat siklaz–cGMP yoluyla düz kası gevşetir. Aynı eksenin klinik yansıması çok geçmeden damar tonusunun hedefli farmakolojisine dönüşür: endotelin reseptör antagonistleri, fosfodiesteraz-5 inhibitörleri ve çözünür guanilat siklaz uyarıcıları, PVR’yi ilaçla “ayar”lamanın yollarını açar. Prostasiklin ekseninin (PGI₂) damar gevşetici ve antiproliferatif etkileri, önce intravenöz epoprostenol ile, ardından inhaler ve subkutan/IV analoglarla yatağa girer.
6) Görüntülemenin genişleyen penceresi: yapı, akım ve doku eşlemesi
1960’lardan itibaren kateter laboratuvarı altın standart kalmayı sürdürürken, 20. yüzyılın sonu ve 21. yüzyılın başında görüntüleme, PVR’nin gölgelerini daha ince hatlarla çizer. Yüksek çözünürlüklü BT, proksimal obstrüksiyonları ve sağ kalbin yüklenme izlerini yakalar; çift enerjili BT perfüzyon haritaları akımın nereye gittiğini boyar; kardiyak MR faz kontrast ve 4D akım teknikleriyle pulmoner arter uyumunu, dalga yansımasını ve nabızlı akımı değerlendirir. Ekokardiyografi, triküspit yetersizliği jetinden sistolik pulmoner basıncı ve çıkış yolu hız-zaman integraliyle debiyi tahmin eder; doğrudan “direnç” ölçmez ama yatağın davranışı hakkında işaretler verir. Klinik yaklaşımda ölçüm; anatomi, akım ve doku bilgisinin birlikte yorumlandığı bir bütün hâline gelir.
7) Tromboembolik çağrışımlar: pıhtının gölgesi ve cerrahi çözümler
Pulmoner yatağın direncini bir anda yükselten akut emboli, sağ ventrikülün kırılganlığını açığa çıkarır. Pıhtının kronikleşip damar duvarına organize olduğu tabloda—kronik tromboembolik pulmoner hipertansiyon—hemodinamik bozulma kalıcılaşır. 20. yüzyılın son çeyreğinden itibaren Jamieson ve ekollerinin geliştirdiği pulmoner tromboendarterektomi, seçilmiş anatomide küratif bir kapı aralar; distal ve inatçı olgularda, 2010’lar boyunca rafine edilen balon pulmoner anjiyoplasti, segmental ve subsegmental dar segmentleri seanslar hâlinde genişletir. Bu girişimler, PVR’nin yalnızca “ton” değil, “yapı” tarafından da belirlendiği gerçeğini somutlaştırır.
8) Genetik ve hücresel yeniden şekillenme: BMPR2’den SOX17’ye uzanan hat
2000’lere gelindiğinde pulmoner arteriyel hipertansiyonun ailesel yüzünde BMPR2 mutasyonları dikkat çeker; TGF-β süperailesi sinyallemesi, düz kas ve endotelin proliferasyon/ölüm dengelerini saptırır. Bunu CAV1, KCNK3, TBX4, SOX17 ve PVOD/PCH spektrumunda EIF2AK4 gibi genetik ipuçları izler. Endotelden adventisyeye uzanan çok hücreli bir koreografi—mitojenik sürücüler, iyon kanalları, metabolik yeniden programlama, iltihabi mikroçevre—mikroskobik ölçekte “direncin” makroskopik yükselişine tercüme olur. Hastalığın fenotipleri yalnız basınçla değil; damar duvarının kalınlığı, lümen daralması, kılcal kaybı ve elastikiyet kaybı ile de tanımlanır.
9) Kişiselleştirme ve ölçekte yönetim: yatak başından popülasyona
Klinikte PVR değerinin tek başına yorumlanmadığı bir olgunluk dönemine girilir: mPAP, PCWP, kardiyak debi, nabızlı akım parametreleri ve sağ ventrikül–pulmoner arter eşleşmesi aynı sahnededir. Biyobelirteçler (örneğin natriüretik peptidler), kardiyopulmoner egzersiz testleri ve yürüme performansı, hemodinamik fotoğrafı işlevsel bir filmle tamamlar. Risk katmanlama yaklaşımları, hastanın başlangıç fenotipini ve tedaviye yanıtını nüanslarıyla ayırmaya çalışır. Bir yandan uzun dönem oksijen tedavisi hipoksemiye bağlı HPV yükünü gevşetir; öte yandan ilaç sınıfları—endotelin blokajı, PDE-5 inhibisyonu/sGC uyarımı, prostasiklin yolu ve IP-reseptör agonistleri—tek başına veya kombine, hedefleri damar tonusu ve duvar biyolojisi olan bir orkestraya dönüşür. Refrakter olguda septostomi, ECMO köprüleri ve transplantasyon, uç basamaktaki seçenekler olarak yerini korur.
10) Yoğun bakım ve anestezide PVR’nin kırılgan dengesi
Pulmoner damar yatağı asit-baz ve gaz değişimiyle dakikalar içinde şekil değiştirebilir. Hipoksi, hiperkapni ve asidoz, direnci yükseltir; mekanik ventilasyonda aşırı PEEP ve yüksek akciğer hacmi, alveoler damarları sıkıştırarak afterload’ı artırır. İnhale nitrik oksit, hedefe yönelik ve hızla ayarlanabilen bir vazodilatör olarak seçilmiş durumlarda sağ ventrikülün önündeki eşiği düşürür. Sıvı yönetimi, sağ doluşu korurken duvar gerilimini azaltma sanatı hâline gelir; vazopresör ve inotroplar, sistemik perfüzyonu koruyup pulmoner yatağı gereksiz yere sıkıştırmayan bir denge arar.
11) Güncel araştırma ufku: çok-ölçekli ölçümler, omik çağ ve akıllı modeller
Günümüzde PVR’yi anlamak, tek bir rakamı kaydetmekten ziyade çok-ölçekli bir ölçüm problemidir. 4D akım MR ile dalga yayılımı ve yansıma analizleri; BT perfüzyon eşlemeleriyle bölgesel akım haritaları; invazif kateterle basınç–akım döngülerinden türetilen direnç, komplians ve empedans bileşenleri aynı masada toplanır. Omik yaklaşımlar, endotelin–NO–prostasiklin üçgenini aşan yeni düğümler (örneğin metabolik aksonlar, mikrobiyota–konak etkileşimi, epigenetik düzenekler) arar. Genetik alt tiplerin (BMPR2, SOX17, TBX4, KCNK3, EIF2AK4 vb.) klinik seyri ve tedavi yanıtı üzerindeki etkileri, “fenotip–genotip–terapi” üçlemesinde kişiselleştirme olanağı sunar. Makine öğrenimi temelli risk skorları ve dijital fenotipleme, hemodinamik ve görüntüleme verilerini uzunlamasına izlerle birleştirerek “hangi hastada hangi eşik değer önemlidir?” sorusuna bireysel yanıtlar arar. CTEPH’de BPA tekniklerindeki rafinmanlar komplikasyonları azaltırken, PTE endikasyon seçimini daha isabetli kılacak anatomi–fizyoloji eşleştirmeleri geliştirilmektedir. Yenidoğan döneminde persistan pulmoner hipertansiyon için hedefli vazodilatör kombinasyonları ve ventilasyon stratejileri, gelişen akciğerin biyolojisiyle uyumlu basınç–hacim reçeteleri arar.
12) Anlatının ekseni: akışa direncin dört yüzü
Bugün PVR’yi, dört yüzlü bir prizma gibi okuruz. Birinci yüz, geometridir: damar çapları, uzunluklar ve dallanma mimarisi. İkincisi, doku mekaniğidir: akciğer hacmi, interstisyel çekiş ve komplians. Üçüncüsü, biyoaktif tondur: endotelin, NO, prostasiklin ve iyon kanalları üzerinden ayarlanabilir bir kasılma–gevşeme dengesi. Dördüncüsü, zamandır: mikrodamarın proliferatif yeniden şekillenmesi ve kılcal kaybı gibi yavaş değişimler ile hipoksik yanıt gibi dakikalar içinde gelişen hızlı modülasyon yan yana var olur. Keşif yolculuğu Harvey’in kalbi döngüsel kılmasıyla başlamıştı; bugün aynı döngünün, basınç ve akım kadar dirençle de yazıldığını, direncin ise yalnız bir sayı değil, damar yatağının yaşayan biyografisi olduğunu biliyoruz.
İleri Okuma
- Harvey, W. (1628). Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus. Frankfurt: William Fitzer.
- Hales, S. (1733). Statical Essays: Containing Haemastaticks. London: W. Innys and R. Manby.
- Ohm, G. S. (1827). Die galvanische Kette, mathematisch bearbeitet. Berlin: Riemann.
- Poiseuille, J. L. M. (1846). Recherches expérimentales sur le mouvement des liquides dans les tubes de très-petits diamètres. Paris: Imprimerie Nationale.
- Forssmann, W. (1929). Die Sondierung des rechten Herzens. Klinische Wochenschrift, 8(45), 2085–2087.
- Cournand, A., & Richards, D. W. (1941). Catheterization of the right auricle in man. Proceedings of the Society for Experimental Biology and Medicine, 46, 462–466.
- Dickinson, C. J. (1953). The development of the concept of pulmonary vascular resistance. British Heart Journal, 15(1), 1–12.
- Wood, P. (1958). Pulmonary hypertension with special reference to the vasoconstrictive factor. British Heart Journal, 20, 557–570.
- West, J. B., Dollery, C. T., & Naimark, A. (1964). Distribution of blood flow in isolated lung: relation to vascular and alveolar pressures. Journal of Applied Physiology, 19, 713–724.
- Rubin, L. J. (1985). Primary pulmonary hypertension. The New England Journal of Medicine, 312(3), 159–165.
- Palmer, R. M. J., Ferrige, A. G., & Moncada, S. (1987). Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature, 327, 524–526.
- Yanagisawa, M., Kurihara, H., Kimura, S., et al. (1988). A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 332, 411–415.
- Barst, R. J., Rubin, L. J., Long, W. A., et al. (1996). A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy in primary pulmonary hypertension. The New England Journal of Medicine, 334, 296–302.
- Deng, Z., Haghighi, F., Chin, K., et al. (2000). Familial primary pulmonary hypertension (gene for BMPR2) maps to chromosome 2q31–32. Nature Genetics, 26, 81–84.
- Lane, K. B., Machado, R. D., Pauciulo, M. W., et al. (2000). Heterozygous germline mutations in BMPR2, encoding a TGF-β receptor, cause familial primary pulmonary hypertension. Nature Genetics, 26, 81–84.
- Jamieson, S. W., Kapelanski, D. P., Sakakibara, N., et al. (2003). Pulmonary endarterectomy: experience and results in 1500 cases. Annals of Thoracic Surgery, 76, 1457–1462.
- Pengo, V., Lensing, A. W. A., Prins, M. H., et al. (2004). Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. The New England Journal of Medicine, 350, 2257–2264.
- Vonk-Noordegraaf, A., Marcus, J. T., Holverda, S., et al. (2005). Early changes of right ventricular geometry and function in pulmonary hypertension. American Journal of Respiratory and Critical Care Medicine, 171, 1131–1135.
- Lankhaar, J.-W., Westerhof, N., Faes, T. J. C., et al. (2006). Quantification of right ventricular afterload in pulmonary hypertension: the pulmonary vascular resistance and compliance relationship. Journal of the American College of Cardiology, 47, 2049–2056.
- Sanz, J., Kariisa, M., Dellegrottaglie, S., et al. (2007). Evaluation of pulmonary artery stiffness in pulmonary hypertension with cardiac magnetic resonance. Journal of the American College of Cardiology, 49, 851–858.
- Hoette, S., Jardim, C., & Souza, R. (2010). Diagnosis and treatment of pulmonary hypertension: an update. Jornal Brasileiro de Pneumologia, 36, 795–811.
- Kataoka, M., Inami, T., Hayashida, K., et al. (2012). Percutaneous transluminal pulmonary angioplasty for chronic thromboembolic pulmonary hypertension. Circulation, 125, 2381–2389.
- Vonk-Noordegraaf, A., Haddad, F., Chin, K. M., et al. (2013). Right heart adaptation to pulmonary arterial hypertension: Physiology and pathobiology. Journal of the American College of Cardiology, 62(25 Suppl), D22–D33.
- Naeije, R., & Vachiéry, J.-L. (2013). Pre- versus postcapillary pulmonary hypertension: a pragmatic diagnostic approach. European Respiratory Journal, 41, 217–223.
- Pulido, T., Adzerikho, I., Channick, R. N., et al. (2013). Macitentan and morbidity and mortality in pulmonary arterial hypertension (SERAPHIN). The New England Journal of Medicine, 369, 809–818.
- Ghofrani, H.-A., D’Armini, A. M., Grimminger, F., et al. (2013). Riociguat for the treatment of chronic thromboembolic pulmonary hypertension (CHEST-1). The New England Journal of Medicine, 369, 319–329.
- West, J. B. (2013). Respiratory Physiology: The Essentials (10th ed.). Philadelphia: Lippincott Williams & Wilkins.
- Naeije, R., & Manes, A. (2014). The right ventricle in pulmonary arterial hypertension. European Respiratory Review, 23(134), 476–487.
- Eyries, M., Montani, D., Girerd, B., et al. (2014). EIF2AK4 mutations cause pulmonary veno-occlusive disease and pulmonary capillary hemangiomatosis. Nature Genetics, 46, 65–69.
- Galiè, N., Humbert, M., Vachiery, J.-L., et al. (2015). 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European Heart Journal, 37(1), 67–119.
- Galiè, N., Barberà, J. A., Frost, A. E., et al. (2015). Initial use of ambrisentan plus tadalafil in pulmonary arterial hypertension (AMBITION). The New England Journal of Medicine, 373, 834–844.
- Sitbon, O., Channick, R., Chin, K. M., et al. (2015). Selexipag for the treatment of pulmonary arterial hypertension (GRIPHON). The New England Journal of Medicine, 373, 2522–2533.
- Simonneau, G., Torbicki, A., Dorfmüller, P., et al. (2017). Endothelial pathobiology in pulmonary arterial hypertension. European Respiratory Review, 26, 170009.
- Zaiman, A. L., & Fessel, J. P. (2018). Metabolic and redox signaling in pulmonary hypertension. Antioxidants & Redox Signaling, 28, 682–709.
- Tello, K., Dalmer, A., Axmann, J., et al. (2019). Right ventricular stroke work index in pulmonary arterial hypertension. Journal of Heart and Lung Transplantation, 38, 1380–1389.
- Simonneau, G., Montani, D., Celermajer, D. S., et al. (2019). Haemodynamic definitions and updated clinical classification of pulmonary hypertension. European Respiratory Journal, 53(1), 1801913.
- Humbert, M., Kovacs, G., Hoeper, M. M., et al. (2022). 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European Heart Journal, 43, 3618–3731.