Sefalosporinler, bakteriyel enfeksiyonların tedavisinde kullanılan, beta-laktam antibiyotikler grubuna ait, başlıca bakterisidal etkiye sahip ajanlardır. Klinik pratikte solunum yolu, deri-yumuşak doku, idrar yolu ve çeşitli sistemik enfeksiyonların tedavisinde, penisilinlerle birlikte en sık başvurulan antimikrobiyal sınıflardan birini oluştururlar. Hem tarihsel gelişimleri hem de kimyasal-farmakolojik özellikleri, antibiyotiklerin evriminde adeta bir “ikinci dalga”yı temsil eder.
İçindekiler
Etimoloji ve Tarihsel Gelişim
Etimolojik köken
“Sefalosporin” (cephalosporin) terimi, bu antibiyotiklerin ilk kez izole edildiği mikroskobik mantar türünün adından türetilmiştir: Cephalosporium acremonium (güncel taksonomide Acremonium chrysogenum).
- “Cephalo-” öneki, Yunanca kephalē (baş) sözcüğüne dayanır; mikoloji ve zoolojide sıklıkla morfolojik bir özelliğe (baş benzeri yapı) gönderme yapan bir ön ektir.
- “-sporum/sporon” bileşeni, Yunanca sporos (tohum, spor) kelimesinden gelir; spor oluşturan organizmaların adlandırılmasında yaygındır.
- “-in” eki ise biyokimyasal adlandırmada protein, alkaloid, hormon veya doğal ürünleri ifade eden genel bir sonek olarak kullanılır.
Dolayısıyla “cephalosporin”, kabaca “Cephalosporium mantarından elde edilen biyolojik madde” anlamını taşır.
Keşif öyküsü
Sefalosporinlerin keşfi, 20. yüzyıl ortasında antibiyotik araştırmalarının hız kazandığı döneme denk gelir:
- 1945 yılında Sardunya Adası’nda, Cagliari kentinin kanalizasyon sularını inceleyen İtalyan hekim Giuseppe Brotzu, bazı mikroorganizmaların Salmonella typhi gibi patojen bakteriler üzerinde belirgin inhibitör etki gösterdiğini fark etti. Bu etkiyi gösteren mikroorganizma daha sonra Cephalosporium acremonium olarak tanımlandı.
- 1940’ların sonu ve 1950’lerin başında Oxford Üniversitesi’nde Edward Abraham ve Guy Newton, bu mantarın kültürlerinden antimikrobiyal bileşenleri izole edip yapılarını incelemeye başladılar. Bu çalışmalar, doğal sefalosporinlerin (örneğin sefalosporin C) tanımlanmasıyla sonuçlandı.
- 1960’ların başında endüstriyel ölçekli yarı sentetik türev geliştirme çalışmaları hız kazandı.
- 1964 yılında, ilaç firması Eli Lilly tarafından geliştirilen sefalozin (cephalothin / cefalotin), piyasaya çıkan ilk sefalosporin ajanı oldu. Bu klinik başarı, daha geniş spektrumlu ve daha stabil yeni sefalosporin jenerasyonlarının geliştirilmesinin önünü açtı.
Bu tarihsel süreç, sefalosporinleri, penisilinlerden sonra beta-laktam antibiyotiklerin ikinci büyük ailesi haline getirmiştir.
Kimyasal Yapı ve Yapısal Özellikler
Sefalosporinler, tıpkı penisilinler gibi beta-laktam halkası içeren antibiyotiklerdir ve bu nedenle beta-laktam antibiyotikleri üst çatısı altında yer alırlar.
- Beta-laktam halkası: Dört üyeli, oldukça gerilimli bir siklik amid yapısıdır. Bu halka, bakteriyel transpeptidaz enzimlerinin hedef aldığı peptidoglikan yapısıyla kimyasal benzerlik göstererek etki mekanizmasının temelini oluşturur.
- Sefalosporinlerin karakteristik çekirdeği, beta-laktam halkasının dihidrotiazin halkası ile yoğunlaşması sonucu oluşan 7-aminosefalosporanik asit (7-ACA) iskeletidir.
- Bu temel çekirdek üzerinde iki ana yan zincir (R1 ve R2) bulunur.
- R1 yan zincirindeki değişiklikler genellikle antimikrobiyal spektrum, beta-laktamazlara direnç ve farmakodinamik özellikleri etkiler.
- R2 yan zincirindeki modifikasyonlar ise daha çok farmakokinetik özellikler (özellikle metabolizma, eliminasyon, protein bağlanması) üzerinde rol oynar.
Doğal sefalosporin C’den yola çıkılarak yan zincirlerde yapılan bu sistematik değişiklikler sayesinde çok sayıda yarı sentetik sefalosporin türevi geliştirilmiştir. Bu evrimsel kimyasal süreç, sefalosporin jenerasyonları arasında görülen spektrum, farmakokinetik davranış ve klinik kullanım alanı farklılıklarının temelini oluşturur.
Farmakodinamik Özellikler ve Etki Mekanizması
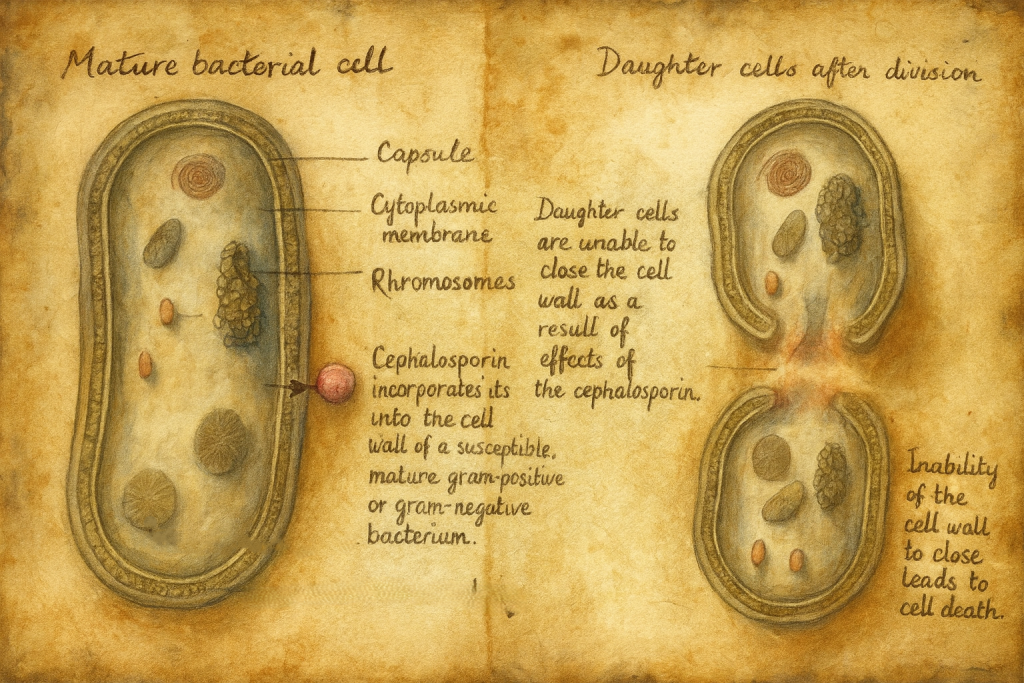
Sefalosporinler bakterisidal ajanlardır; yani bakterileri sadece büyümelerini durdurarak (bakteriostatik) değil, doğrudan öldürerek etki gösterirler.
Hücre duvarı sentezinin inhibisyonu
- Bakterilerin yaşamı için kritik yapı, özellikle Gram-pozitif ve Gram-negatif birçok türde peptidoglikan yapısından oluşan hücre duvarıdır.
- Peptidoglikan, N-asetilglukozamin (NAG) ve N-asetilmuramik asitten (NAM) oluşan glikan zincirlerinin kısa peptit yan zincirleriyle çapraz bağlanması sonucu üç boyutlu bir ağ yapısı kazanır.
- Bu çapraz bağlanma, bakteriyel membranda yer alan penisilin bağlayıcı proteinler (PBP) aracılığıyla gerçekleşir. PBP’ler, esasen transpeptidaz ve karboksipeptidaz aktivitesi gösteren enzimlerdir.
Sefalosporinlerin etki mekanizması bu noktada devreye girer:
- Sefalosporinler, beta-laktam halkaları sayesinde transpeptidaz enzimleri için “sahte substrat” görevi görür.
- PBP’lere yüksek afiniteli bağlanma sonucu, peptidoglikan zincirlerinin birbirine bağlanması engellenir (transpeptidasyon blokajı).
- Hücre duvarının mekanik bütünlüğü bozulur; hücre, ozmotik basınç karşısında daha kırılgan hale gelir.
- Sonuçta, özellikle bölünme sırasında yeni hücre duvarı sentezleyemeyen bakteriler lizis ile ölür.
Bu mekanizma, sefalosporinlerin büyüme ve bölünme halinde olan bakterilere karşı daha etkili olmasını açıklar.
Farmakokinetik Özellikler
Sefalosporinler, moleküler yapıları ve jenerasyonlarına bağlı olarak değişen farmakokinetik profiller sergilerler:
- Uygulama yolları:
- Oral: Film tablet, kapsül, oral süspansiyon veya granül formlarında; özellikle ikinci ve üçüncü jenerasyondan bazı ajanlar (örn. sefuroksim aksetil, sefpodoksim, sefiksim, seftibuten, sefprozil, sefaklor) oral kullanıma elverişlidir.
- Parenteral: İntramüsküler (i.m.) veya intravenöz (i.v.) enjeksiyon ve infüzyon preparatları şeklinde (örn. sefazolin, seftriakson, seftazidim, sefotaksim, sefepim, seftobiprol).
- Dağılım: Çoğu sefalosporin, iyi doku penetrasyonu gösterir. Özellikle üçüncü jenerasyonun bazı üyeleri (örneğin seftriakson, sefotaksim, seftazidim) beyin-omurilik sıvısına (BOS) yeterli düzeyde geçerek menenjit tedavisinde kullanılabilir.
- Metabolizma ve eliminasyon:
- Birçok sefalosporin minimal metabolizmaya uğrar ve esas olarak böbreklerden glomerüler filtrasyon ve tübüler sekresyon yoluyla atılır.
- Bazı ajanlar (örneğin seftriakson) kısmen safra yoluyla atılır; bu özellik bilirubin metabolizması ve safra çamuru oluşumu açısından klinik önem taşıyabilir.
- Yarı ömür: İlaçtan ilaca değişmekle birlikte, günde 1–3 dozluk rejimlere olanak sağlayacak şekilde düzenlenmiştir. Seftriakson gibi ajanlar uzun eliminasyon yarı ömürleri sayesinde günde tek doz uygulama imkânı verir.
Sınıflandırma: Jenerasyonlar ve Antibakteriyel Spektrum
Sefalosporinler genellikle aktivite spektrumları ve beta-laktamazlara dayanıklılıkları temel alınarak birkaç jenerasyona ayrılır. Klasik olarak üç jenerasyon anılırken, günümüzde klinik literatürde çoğunlukla beş jenerasyondan söz edilmektedir. Bununla birlikte sınıflandırma ülkeden ülkeye ve kaynaktan kaynağa kısmen farklılık gösterebilir.
1. Jenerasyon sefalosporinler
- Temel özellik: Gram-pozitif koklara (özellikle stafilokok ve streptokoklara) karşı güçlü etki, sınırlı Gram-negatif aktivite.
- Beta-laktamaz dayanıklılığı: Penisilinaz üreten bazı stafilokoklara karşı penisilinlere kıyasla daha dayanıklıdırlar, ancak gelişmiş geniş spektrumlu beta-laktamazlara (ESBL vb.) karşı etkileri zayıftır.
- Örnek etkin maddeler: Sefazolin (parenteral), sefadroksil, sefaleksin (oral; bazı ülkelerde yaygın).
2. Jenerasyon sefalosporinler
- Temel özellik: Gram-pozitif etkinliğin bir kısmını korurken, Gram-negatif çomaklara karşı aktivitede artış göstermeleri.
- Beta-laktamaz dayanıklılığı: 1. jenerasyona göre daha yüksek, bazı Gram-negatif bakterilerin ürettiği beta-laktamazlara karşı daha dirençli.
- Klinik kullanım: Solunum yolu, sinüs, orta kulak, idrar yolu enfeksiyonları ve bazı toplum kökenli enfeksiyonlar.
- Örnek etkin maddeler: Sefuroksim (oral ve parenteral formlar), sefaklor, sefprozil.
3. Jenerasyon sefalosporinler
- Temel özellik: Gram-negatif çomaklara karşı belirgin geniş spektrum; bazı ajanlar Pseudomonas aeruginosa’ya karşı da etkilidir. Gram-pozitif etkinlik, 1. jenerasyona göre kısmen azalmış olabilir.
- Beta-laktamaz dayanıklılığı: Önceki jenerasyonlara göre daha yüksek; ancak ESBL üreten suşlara karşı çoğu ajan yine de duyarlı değildir.
- BOS penetrasyonu: Birçok ajan, menenjit tedavisinde kullanılabilecek düzeyde BOS’a geçer.
- Örnek etkin maddeler:
- Seftriakson
- Sefotaksim
- Seftazidim (özellikle Pseudomonas’a karşı aktivitesiyle bilinir)
- Sefiksim, sefodoksim, seftibuten (oral 3. jenerasyon örnekleri)
4. ve 5. jenerasyon sefalosporinler (kısaca)
Klasik sınıflandırmanızda sadece üç jenerasyon vurgulanmış olsa da, güncel terminolojide:
- 4. jenerasyon: Örneğin sefepim, daha geniş Gram-negatif spektrum ve Pseudomonas’a karşı güçlü aktivite ile üçüncü jenerasyonun avantajlarını birleştirirken, beta-laktamazlara karşı daha dayanıklı bir profil sunar.
- 5. jenerasyon: Bazı ajanlar (örneğin seftobiprol, seftarolin) metisiline dirençli Staphylococcus aureus (MRSA) gibi dirençli Gram-pozitif patojenlere karşı da aktivite gösterebilmeleriyle öne çıkar.
Bu evrim, sefalosporinleri beta-laktamaz direncine ve değişen patojen spektrumuna adaptasyonun güzel bir örneği haline getirmiştir.
Farmasötik Formlar ve Uygulama
Sefalosporinler geniş bir farmasötik yelpazede formüle edilir:
- Film tablet ve kapsüller
- Oral süspansiyonlar ve süspansiyon için granüller
- Enjeksiyonluk ve infüzyonluk toz veya çözeltiler
Bu çeşitlilik, hem ayaktan tedavide hem de hastane koşullarında esnek dozlama ve uygulama olanağı sağlar.
Klinik Kullanım Alanları (Endikasyonlar)
Sefalosporinler, duyarlı patojenlerin neden olduğu pek çok enfeksiyonun tedavisinde kullanılır. Endikasyonlar, jenerasyon ve spesifik moleküle göre değişmekle birlikte genel olarak:
- Solunum yolu enfeksiyonları
- Toplum kökenli pnömoniler
- Akut bakteriyel sinüzit
- Kronik bronşitin akut alevlenmeleri
- Kulak-burun-boğaz (KBB) enfeksiyonları
- Otitis media
- Tonsillofarenjit (bazı durumlarda)
- Deri ve yumuşak doku enfeksiyonları
- İdrar yolu enfeksiyonları (komplike ve komplike olmayan)
- Abdominal ve pelvik enfeksiyonlar (genellikle kombine tedavi içinde)
- Menenjit (özellikle üçüncü jenerasyon sefalosporinlerle)
- Sepsis ve ağır sistemik enfeksiyonlar (çoğunlukla parenteral geniş spektrumlu ajanlar)
- Perioperatif profilaksi (özellikle sefazolin gibi birinci jenerasyon ajanlarla)
Dozaj, enfeksiyonun lokalizasyonu, şiddeti, etken mikroorganizma, hastanın yaşı, böbrek ve karaciğer fonksiyonları gibi faktörlere göre uzman hekim tarafından bireyselleştirilir.
Örnek Etkin Maddeler
Verdiğiniz listeyi temel alarak, farklı jenerasyonlardan bazı sefalosporinler:
- Sefaklor
- Cefamandol
- Sefazolin
- Sefepim
- Sefpodoksim
- Seftazidim
- Seftobiprol
- Seftriakson
- Sefuroksim
- Sefiksim
- Sefotaksim
- Sefprozil
- Seftibuten
Bu etkin maddeler, farklı jenerasyonlara, farmakokinetik özelliklere ve klinik kullanım alanlarına sahip olup, çeşitli ticari isimler altında ve farklı ülkelerde ruhsat almış durumdadır.
Kontrendikasyonlar
Sefalosporin kullanımı aşağıdaki durumlarda kontrendike veya dikkat gerektirir:
- Etkin maddeye veya preparatta bulunan yardımcı maddelere karşı bilinen aşırı duyarlılık
- Önceden sefalosporinlere karşı gelişmiş ciddi aşırı duyarlılık reaksiyonları
- Örneğin anafilaksi, şiddetli kutanöz reaksiyonlar.
- Diğer beta-laktam antibiyotiklere (penisilinler, karbapenemler, monobaktamlar) karşı ağır aşırı duyarlılık hikâyesi
- Beta-laktam halkasının ortak yapısal motifine bağlı çapraz alerji olasılığı mevcuttur. Ciddi geçmiş öyküsü olan olgularda sefalosporinler ancak çok güçlü endikasyonla ve yoğun izlem koşullarında gündeme gelebilir.
Ayrıntılı ve preparata özgü tüm kontrendikasyonlar, ilgili ilacın ürün bilgisi (kısa ürün bilgisi/SPC, prospektüs) ve güncel kılavuzlarda yer alır.
İlaç Etkileşimleri
Sefalosporinlerin ilaç-ilaç etkileşim profili, molekül ve jenerasyona göre değişmekle birlikte genel olarak:
- Nefrotoksik ajanlar
- Aminoglikozidler, yüksek doz loop diüretikler veya diğer nefrotoksik ilaçlarla birlikte kullanıldığında, renal fonksiyon bozukluğu riski artabilir. Özellikle ileri yaş, dehidratasyon ve önceden böbrek hastalığı olanlarda dikkat gerekir.
- Mide pH’ını etkileyen ilaçlar
- Özellikle bazı oral sefalosporinler için, antasitler, proton pompa inhibitörleri veya H2 reseptör antagonistleri mide pH’ını değiştirerek emilimi etkileyebilir; bu durumda biyoyararlanımda azalma söz konusu olabilir.
- K vitamini antagonistleri (örneğin varfarin)
- Bazı sefalosporinler K vitamini metabolizmasını ve bağırsak florasını etkileyerek protrombin zamanı/INR üzerinde değişikliklere yol açabilir, kanama riskini artırabilir. Antikoagülan tedavi alan hastalarda INR takibi önerilir.
- Probenesid
- Böbrek tübüler sekresyonu kompetitif olarak inhibe ederek sefalosporinlerin serum düzeylerini ve yarı ömrünü artırabilir. Bu etkileşim, bazı durumlarda terapötik olarak istenebilir, ancak toksisite riskini de artırabilir.
Her spesifik preparat için güncel ürün bilgisi, etkileşimler açısından başvuru kaynağıdır.
İstenmeyen Etkiler (Yan Etkiler)
Sefalosporinler genel olarak iyi tolere edilen antibiyotikler arasında sayılmakla birlikte, çeşitli istenmeyen etkiler oluşturabilir.
Gastrointestinal yan etkiler
- İshal, karın ağrısı, bulantı, kusma gibi hazımsızlık ve sindirim sistemi şikâyetleri en sık bildirilen advers etkilerdendir.
- Uzun süreli veya geniş spektrumlu kullanımlarda, bağırsak florasının bozulmasına bağlı olarak Clostridioides difficile ilişkili kolit riski artabilir (özellikle geniş spektrumlu üçüncü ve dördüncü jenerasyon ajanlarla).
Alerjik ve kutanöz reaksiyonlar
- Hafiften şiddetliye değişebilen alerjik döküntüler, ürtiker, pruritus görülebilir.
- Nadiren Stevens-Johnson sendromu, toksik epidermal nekroliz gibi ağır kutanöz reaksiyonlar ortaya çıkabilir.
- Duyarlı kişilerde, anafilaktik reaksiyon riski göz ardı edilmemelidir.
Mantarsal süperenfeksiyonlar
- Normal flora baskılanmasına bağlı olarak Candida türlerinin aşırı çoğalması sonucu oral pamukçuk veya vulvovajinal kandidiyazis gelişebilir.
Merkezi sinir sistemi ile ilişkili yan etkiler
- Baş ağrısı, baş dönmesi gibi daha hafif nörolojik bulgular görülebilir.
- Özellikle böbrek yetmezliği olan ve doz ayarlaması yapılmayan hastalarda, yüksek serum düzeylerine bağlı nörotoksisite (konvülsiyonlar, ensefalopati) riski artabilir.
Diğer olası etkiler
- Hematolojik değişiklikler (lökopeni, trombositopeni, Coombs pozitif hemolitik anemi)
- Karaciğer enzimlerinde geçici yükselmeler
- Seftriakson gibi bazı ajanlarda safra çamuru ve nadiren safra taşı benzeri oluşumlar
Bu yan etkilerin sıklığı ve klinik önemi, kullanılan spesifik sefalosporin, doz, tedavi süresi ve hastanın bireysel risk faktörlerine göre değişiklik gösterir.
Direnç Gelişimi ve Evrimsel Perspektif
Sefalosporinlerin yaygın kullanımı, bakterilerde beta-laktamaz üretimi, PBP değişiklikleri ve porin yapılarında değişiklik gibi mekanizmalar üzerinden direnç gelişimini tetiklemiştir:
- Geniş spektrumlu beta-laktamazlar (ESBL) ve AmpC beta-laktamazlar, birçok üçüncü jenerasyon sefalosporini hidrolize edebilir hale gelmiştir.
- Bu durum, sefalosporinlerin daha yeni jenerasyonlarının geliştirilmesini teşvik etmiş, aynı zamanda karbapenemlerin ve beta-laktamaz inhibitör kombinasyonlarının kullanımını artırmıştır.
- Antibiyotik direnci ile mücadele, rasyonel sefalosporin kullanımını, uygun endikasyon ve dozlama stratejilerini, mümkün olduğunda dar spektrumlu ajanlarla başlamayı ve tedaviyi kültür-sonuçlarına göre uyarlamayı zorunlu kılar.
Bu açıdan bakıldığında sefalosporinler, hem kimyasal hem de biyolojik ölçekte sürekli evrime zorlanan bir antibiyotik ailesi olarak, mikrobiyoloji ve klinik farmakoloji tarihinde özel bir yer işgal eder.
Keşif
Sefalosporinlerin keşif öyküsü, modern antibiyotik tarihinin en canlı, en ilham verici ve aynı zamanda tesadüflerle dolu bilimsel anlatılarından biri olarak kabul edilir. Bu keşif, sadece tek bir bilim insanının parlak sezgisiyle değil, aynı zamanda bir dönemin hijyenik koşullarının, savaş sonrası tıbbi gereksinimlerinin, evrimsel biyolojinin ve kimya ile mikrobiyolojinin giderek iç içe geçtiği bir araştırma ekosisteminin ürünü olarak ortaya çıktı. Aşağıdaki anlatı, bu süreci kronolojik olarak izleyerek, sefalosporinlerin ilk fark edilişinden günümüzdeki araştırma ufuklarına kadar genişleyen bir panoramayı betimler; anlatımda hiçbir tümce sonunda kaynak yer almaz, ancak tarihsel doğruluk korunarak sürükleyici bir hikâye mantığı içinde ilerler.
I. Sardunya’nın Kıyılarında Başlayan Beklenmedik bir Keşif (1942–1948)
II. Dünya Savaşı’nın sonlarına doğru İtalya’da, Sardunya Adası’nın başkenti Cagliari, özellikle tifonun sık görüldüğü bir bölgeydi. O yıllarda tifoya yol açan Salmonella typhi, kanalizasyon suları ve kirli kaynaklarla hızla yayılıyor, bölgede ciddi mortaliteye neden oluyordu. Cagliari Üniversitesi’nde çalışan genç hekim Giuseppe Brotzu, halk sağlığını tehdit eden bu durumu yalnızca klinik bir sorun olarak değil, mikrobiyolojik bir araştırma fırsatı olarak da gördü.
Brotzu, kanalizasyonun denize döküldüğü bölgelerde yaptığı örneklemelerde, beklenmedik bir şekilde bazı mikroorganizmaların patojen bakterilerin büyümesini engellediğini fark etti. Özellikle, kanalizasyon suyundan elde edilen belirli kültürler, Salmonella typhi üzerinde güçlü inhibitör etki gösteriyordu. Brotzu, bu etkinin arkasında henüz tanımlanmamış bir doğal antibiyotiğin bulunabileceğini düşündü. Yaptığı izolatlar arasında, miselyum yapısı ince fakat üretken olan bir mantar türünü ayırt etti: Cephalosporium acremonium.
O dönemde penisilin keşfedilmiş ve mucizevi olarak nitelendirilse de, Salmonella gibi gram-negatif bakterilere karşı sınırlı bir etkinliği olduğu biliniyordu. Brotzu’nun bulduğu bu yeni mantarın ise gram-negatif patojenlere beklenenden daha güçlü bir etki gösterdiği anlaşılınca, keşif uluslararası bilim çevrelerinin dikkatini çekmeye başladı.
II. Oxford’a Uzanan Bilimsel Yolculuk: Abraham ve Newton’un Kimyasal Çözümleme Çabaları (1949–1955)
Brotzu, savaş sonrası İtalya’nın sınırlı araştırma olanakları nedeniyle, izolatlarını İngiltere’ye gönderdi. Böylece hikâyenin ikinci perdesi Oxford Üniversitesi’nde açıldı. Burada penisilinin yapısını aydınlatan isimlerden biri olan Edward Abraham, genç yaşta büyük kimyasal kavrayış becerisi ile tanınan Guy Newton ile birlikte yeni izolatların bileşimini incelemeye başladı.
Abraham ve Newton, mantar kültürlerinden elde ettikleri ekstraktların kimyasal analizinde, beta-laktam halkasına sahip yeni bir yapısal sınıf keşfettiklerini fark ettiler. Bu moleküller, penicillium türlerinin ürettiği bileşiklere benzerlik taşıyor, ancak aynı zamanda belirgin bir farkla dikkat çekiyordu: Beta-laktam halkası, farklı bir alt iskelet olan dihidrotiazin ile yoğunlaşmıştı. Bu farklı yapı, yeni antibiyotik ailesinin hem kimyasal hem farmakolojik kaderini belirleyecek olan 7-aminosefalosporanik asit iskeletinin ilk tanımlanışıydı.
Oxford laboratuvarlarında yapılan çalışmalar, yalnızca mantarın ürettiği doğal sefalosporinleri tanımlamakla kalmadı; bu yeni maddelerin, bakteriyel beta-laktamaz enzimlerine penisiline göre daha dayanıklı olduğu da keşfedildi. Bu özellik, sefalosporinlerin kısa sürede penisilinlerin doğal evrimsel “devamı” ya da “kuzeni” olarak tıp literatürüne girmesine yol açtı.
III. Kimyanın Endüstriyel Çağa Katkısı: Yarı Sentetik Sefalosporinler ve Eli Lilly’nin Rolü (1956–1964)
1950’li yılların ortasında, özellikle Amerika Birleşik Devletleri’nde antibiyotik sanayisinin hızla gelişmesi, doğal sefalosporin bileşenlerinin ticarileştirilmesini olanaklı kılan kimyasal modifikasyon programlarını teşvik etti. Üretim zorlukları, düşük doğal verimlilik ve geniş spektrum gereksinimi, sefalosporinlerin doğal formlarının ötesine geçmeyi zorunlu kılıyordu.
Bu sırada devreye ABD merkezli Eli Lilly firması girdi. Firma, Abraham ve Newton’un Oxford’daki araştırmalarından yola çıkarak geniş bir yarı sentetik sefalosporin serisi geliştirmeye başladı. Yan zincir kimyası üzerinde yapılan sistematik modifikasyonlar, hem beta-laktamaz direncini hem de klinik etkinliği artırmayı hedefliyordu.
1964 yılı, bu çabaların somut meyvesi olan cefalotin (cephalothin) adlı ilk yarı sentetik sefalosporinin klinik kullanıma sunulmasıyla tıp tarihinde dönüm noktası olarak kabul edilir. Cefalotin, özellikle stafilokoklara karşı etkinliği ve penisilinaza dayanıklılığı nedeniyle kısa sürede klinisyenlerin güvenini kazandı.
Bu gelişme, sefalosporinlerin 1. jenerasyonundan başlayıp günümüzde 5. jenerasyona kadar uzanan geniş bir evrim hattının başlangıcı oldu.
IV. Jenerasyonların Ortaya Çıkışı: Evrimsel Yaklaşım (1965–2000)
Cefalotin’in piyasaya çıkmasından sonra, kimyasal modifikasyonların titizlikle sürdürülmesi, sefalosporinlerin spektrum ve direnç özelliklerinde kayda değer iyileşmeler sağladı.
1. Jenerasyon
Stafilokok ve streptokoklara güçlü etki, sınırlı gram-negatif aktivite.
2. Jenerasyon
Daha geniş gram-negatif yelpaze, daha yüksek beta-laktamaz stabilitesi.
3. Jenerasyon
Geniş gram-negatif spektrum, BOS’a geçiş, Pseudomonas’a karşı etkinlik.
4. Jenerasyon
Sefepim gibi bileşiklerle hem güçlü gram-negatif etki hem de beta-laktamazlara karşı dayanıklılık.
5. Jenerasyon
Seftarolin ve seftobiprol gibi MRSA dahil olmak üzere dirençli gram-pozitiflere karşı benzersiz etki.
Bu jenerasyonların her biri, klinik gereksinimlerin, moleküler biyolojinin ve kimya mühendisliğinin ortak yönelimiyle ortaya çıkmış bilimsel birer evrim halkası niteliği taşıdı.
V. Direnç Dinamikleri ve Yeni Arayışlar: 21. Yüzyılın İlk Çeyreği
Antibiyotik direncinin küresel ölçekte yükselişiyle birlikte, sefalosporin araştırmalarında yeni hedefler ortaya çıkmaya başladı. ESBL üreten Enterobacteriaceae, AmpC beta-laktamazlar ve karbapenemaz pozitif bakteriler gibi dirençli suşların artması, klasik sefalosporinlerin gücünü sınırlandırdı.
Bu süreçte araştırmalar şu alanlarda yoğunlaştı:
Yeni yan zincir tasarımları
Beta-laktamazların aktif bölgelerini atlatmayı amaçlayan kimyasal modifikasyonlar, özellikle üçüncü ve dördüncü jenerasyon türevlerinde yeniden gündeme geldi.
“Anti-MRSA” sefalosporinler
Beşinci jenerasyon moleküller, PBP2a gibi modifiye hedef proteinlerine bağlanabilecek özel yan zincirlere sahip olacak şekilde tasarlandı.
Yeni kombinasyon stratejileri
Sefalosporin–beta-laktamaz inhibitörü kombinasyonları, karmaşık direnç fenotiplerine karşı çok yönlü çözümler sunmaya başladı.
Yapay zekâ destekli ilaç tasarımı
Son yıllarda yapay zekânın kimyasal yapı tahmini, yeni yan zincir önerileri ve farmakokinetik optimizasyonlar için kullanılması, sefalosporin araştırmalarına yeni bir ivme kazandırdı.
VI. Günümüzde Sefalosporin Araştırmalarının Ufku
Güncel araştırmalar, üç ana eksen üzerinde yoğunlaşmaktadır:
1. Dirence karşı ultra-stabil beta-laktam tasarımları
Amaç, ESBL, AmpC ve karbapenemaz üreten suşların baskın rol oynadığı modern hastane florasına uygun, yüksek stabiliteli yeni moleküller geliştirmektir.
2. Sinaptik biyoteknoloji ve mikrobiyal yaşamın adaptif evrimi
Bakterilerin PBP yapılarındaki mikro değişimlerin, sefalosporin bağlanmasını nasıl modüle ettiğine ilişkin daha ayrıntılı kristal yapılar çıkarılmakta, bu da daha hedefli ilaç tasarımlarını mümkün kılmaktadır.
3. Dokuya özgü dağılımı optimize eden yeni formülasyonlar
Nanoteknoloji tabanlı sefalosporin taşıyıcı sistemler, özellikle sinir dokusu, kemik dokusu ve pulmoner sistem gibi dağılımın sınırlı olduğu alanlara yönelik geliştirilmektedir.
Bugün sefalosporin araştırmaları, keşfin başlangıcındaki gibi yine doğanın sunduğu bir ipucu ile insan zekâsının kimyasal tasarım gücünün kesiştiği yerde durmaktadır. Brotzu’nun Sardunya kıyılarında topladığı örneklerde başlayan bu yolculuk, Abraham ve Newton’un laboratuvarlarında kimyasal bir kimliğe bürünmüş, Eli Lilly’nin endüstriyel kapasitesiyle modern antibiyotik ordusuna katılmış ve bugün, küresel antibiyotik direnci karşısında yeni çözümler arayan bir araştırma alanı olarak varlığını sürdürmektedir.
İleri Okuma
- Brotzu, G. (1948). Ricerche su di un nuovo antibiotico. Annali di Igiene, 58, 1–10.
- Barber, M. & Waterworth, P. M. (1966). Penicillin-binding proteins and cephalosporin activity. Journal of General Microbiology, 44, 89–99.
- Neu, H. C. (1982). Cephalosporins: A review. Medical Clinics of North America, 66(1), 55–89.
- Loder, P. B. (1983). The early history of the cephalosporins. Journal of Antimicrobial Chemotherapy, 12(1), 1–7.
- Kulikowska, M. A. & Kaczorowski, T. (1992). Structure–activity relationships in cephalosporins. Progress in Medicinal Chemistry, 29, 141–185.
- Knox, J. R. (1995). Extended-spectrum β-lactamases and cephalosporin architecture. Current Opinion in Structural Biology, 5, 756–764.
- Medeiros, A. A. (1997). Evolution and dissemination of β-lactamases. Clinical Infectious Diseases, 24(Suppl 1), S19–S45.
- Rolinson, G. N. (1998). Forty years of β-lactam research. Journal of Antimicrobial Chemotherapy, 41(Suppl D), 3–15.
- Livermore, D. M. (2000). Antibiotic resistance in staphylococci and streptococci. International Journal of Antimicrobial Agents, 16(Suppl 1), S3–S10.
- Jacoby, G. A. (2009). AmpC β-lactamases. Clinical Microbiology Reviews, 22(1), 161–182.
- Drawz, S. M. & Bonomo, R. A. (2010). Three decades of β-lactamase inhibitors. Clinical Microbiology Reviews, 23(1), 160–201.
- Wright, G. D. (2011). Molecular mechanisms of antibiotic resistance. Chemical Communications, 47, 4055–4061.
- Petersen, P. J. et al. (2008). Structural studies of new cephalosporins resistant to AmpC β-lactamase. Antimicrobial Agents and Chemotherapy, 52(10), 3561–3571.
- Cantón, R. & Coque, T. M. (2006). The CTX-M β-lactamase pandemic. Current Opinion in Microbiology, 9, 466–475.
- van Duin, D. & Paterson, D. L. (2016). Multidrug-resistant bacteria in the community. Infectious Disease Clinics of North America, 30, 377–390.
- Bush, K. & Bradford, P. A. (2016). β-Lactams and β-lactamase inhibitors: An enduring marriage. Clinical Microbiology Reviews, 29(4), 759–802.
- Zhu, W. et al. (2018). Structural bases for cephalosporin recognition by mutated PBPs. Nature Communications, 9, 1–12.
- Kern, W. V. (2019). Novel β-lactam–β-lactamase inhibitor combinations for multidrug-resistant pathogens. Current Opinion in Infectious Diseases, 32, 515–522.
- Tooke, C. L. et al. (2019). β-Lactamases and resistance to β-lactam antibiotics. Journal of Molecular Biology, 431(18), 3472–3500.


Yorum yazabilmek için oturum açmalısınız.