Tanım ve Terminoloji
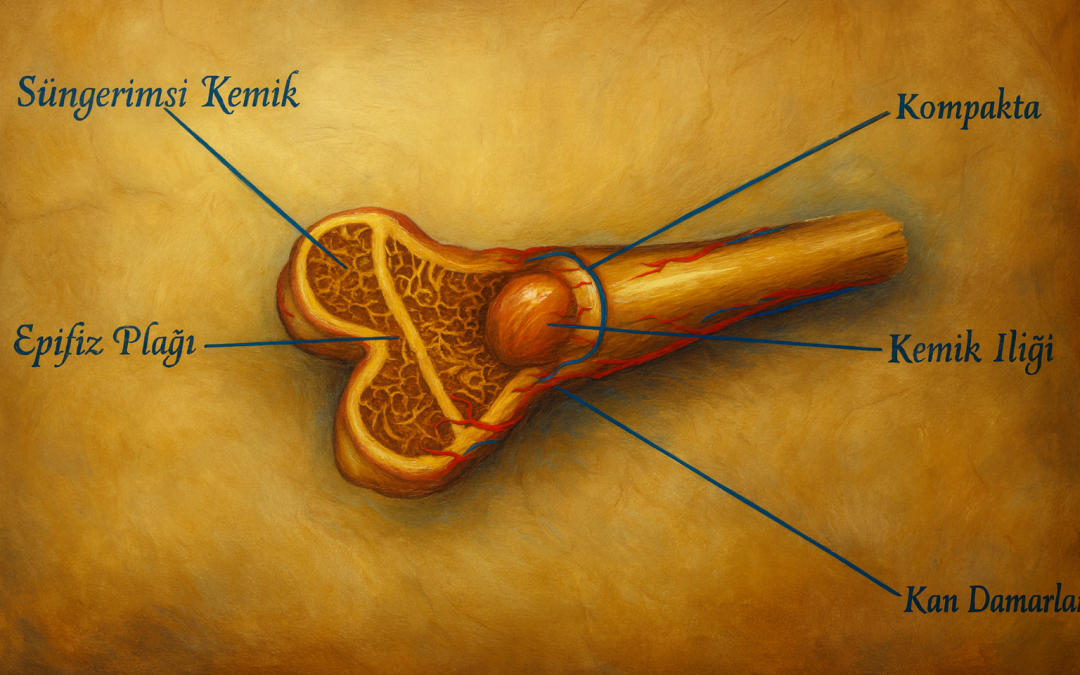
Süngerimsi kemik (Lat. substantia spongiosa; İng. trabecular ya da cancellous bone), insan iskeletinde kompakt (kortikal) kemikle birlikte bulunan iki temel kemik dokusundan biridir. Makroskopik olarak gözenekli ve “süngerimsi” görünümü, ince çubukçuklar ve plaklardan oluşan üç boyutlu bir kafes—trabeküler ağ—sayesindedir. Bu ağın boşluklarını çoğunlukla kemik iliği doldurur. Kortikal kemik dıştan bir kılıf gibi kemiği sararken, süngerimsi kemik özellikle epifiz ve metafiz bölgelerinde, ayrıca yassı kemiklerin iç kısımlarında baskındır.
Makroanatomik Yerleşim
- Uzun kemikler: Femur, tibia, humerus gibi uzun kemiklerin epifizlerinde ve metafizlerinde yoğun süngerimsi kemik bulunur; diafiz ise esasen kortikaldir.
- Aksiyel iskelet ve yassı kemikler: Vertebra cisimleri, pelvis, sternum, kaburgalar ve kafatası kemiklerinin diploë tabakası süngerimsi kemiğin en zengin olduğu alanlardır.
- Fonksiyonel sonuç: Bu dağılım, eklemlere yakın yük aktarım bölgelerinde şok emilimi ve enerji dağılımını optimize ederken, gövde kemiklerinde yük taşıma ve hematopoetik işlevlerin birlikte yürütülmesini sağlar.
Mikroyapı: Trabeküler Ağ ve Yüzeyler
Süngerimsi kemik, trabekül adı verilen çubuksu (rod) ve plak benzeri (plate) elementlerin iç içe geçtiği, yönlenmiş bir kafesten oluşur.
- Anizotropi: Trabeküller, yük aktarma çizgilerini izleyerek düzenlenir (Wolff yasası). Bu, belirli yönlerde yüksek dayanım ve rijitlik sağlar.
- Yüksek yüzey/hacim oranı: Trabeküler yüzey, kortikale kıyasla çok daha fazladır; bu, yeniden şekillenme (remodelling) hızını artırır ve metabolik değişimlere duyarlılığı güçlendirir.
- Trabeküler morfometri (kavramsal): Klinik ve araştırma sahasında trabeküler kalınlık, ayrıklık, sayı, bağlantısallık yoğunluğu ve yapısal model indeksi gibi ölçütler, mikro-mimari kalitenin nicel betimlenmesini sağlar.
Hücresel Bileşenler ve Doku Organizasyonu
- Osteoblastlar: Mezenkimal kökenli hücreler olup kolajen tip I ağırlıklı organik matrisi (osteoid) sentezler, mineralizasyonu başlatır.
- Osteositler: Lakün-kanaliküler ağ içinde gömülü “duyusal” hücreler; mekanik uyarıyı algılar, sklerostin gibi mediyatörlerle kemik oluşumunu modüle eder.
- Osteoklastlar: Hematopoetik kökenli, çok çekirdekli rezorptif hücreler; RANK–RANKL–OPG ekseniyle sıkı biçimde düzenlenir.
- Endosteal yüzey: Trabeküler yüzleri döşeyen endosteal hücreler, remodelling ünitesinin (BMU) etkinliğinde kilit role sahiptir.
Organik ve İnorganik Matris
- Organik faz: Başlıca kolajen tip I; ayrıca osteokalsin, osteopontin, kemik sialoproteini gibi yapısal/adezif proteinler.
- İnorganik faz: Hidroksiapatit kristalleri; kalsiyum-fosfat homeostazının ana deposu.
- Gözeneklilik: Mikroporozite ve kanaliküler ağ, besin ve sinyal iletimini kolaylaştırır; aynı zamanda mekanik davranışa katkı yapar.
Gelişim ve Yeniden Şekillenme
- Ossifikasyon yolları: Uzun kemiklerin çoğu endokondral, yassı kemiklerin büyük bölümü intramembranöz ossifikasyonla oluşur. Primer dokudan sekonder, daha düzenli trabeküler mimariye geçiş, büyüme ve yüklenme ile şekillenir.
- Remodelling döngüsü: Rezorpsiyon (osteoklast), terslenme ve formasyon (osteoblast) fazlarıyla ilerler. Süngerimsi kemikte yüzey zenginliği nedeniyle döngü sıktır; bu, hem adaptasyonu hem de osteoporoz gibi durumlarda hızlı kütle kaybını açıklar.
- Mekano-biyoloji: Mikro-gerinim eşikleri aşıldığında kemik yapımı uyarılır; yetersiz yükte rezorpsiyon öne çıkar (mekanostat kavramı).
Kemik İliği ve Nişler
Trabeküler boşluklar, kırmızı (hematopoetik) ve sarı (yağ) iliğin değişen oranlarını içerir. Erişkinde aksiyel iskelet ve proksimal metafizlerde kırmızı ilik baskın kalır.
- Hematopoetik niş: Stromal hücreler, endotel ve osteoblast/osteoklast hattı, kök hücrelerin öz-düzenlenmesi ve farklılaşmasında mikroçevre sağlar.
- Metabolik etkileşim: İlik yağ dokusu, enerji ve sinyalizasyon (ör. adipokinler) üzerinden kemik hücre aktivitesini etkileyebilir.
Biyomekanik Özellikler
- Hafiflik ve dayanımın bileşimi: Düşük yoğunluk, yüksek spesifik dayanımla dengelenir; yük yönlerine göre optimize edilmiş bir kafes, darbe ve tekrarlayan yükleri dağıtır.
- Hücre-örgü ölçekleri arası köprü: Elastisite ve akma davranışı, trabeküler yoğunluk ve bağlantısallıkla güçlü biçimde ilişkilidir; gözenekli “hücresel katı” prensipleri geçerlidir.
- Kırık mekaniği: Trabeküler perforasyon ve bağlantı kaybı, ani rijitlik düşüşüne ve çökme tarzı kırıklara (ör. vertebra kompresyonu) zemin hazırlar.
Fizyolojik İşlevler
- Mekanik destek ve şok emilimi: Ekleme yakın bölgelerde yük çizgilerini izleyen trabeküler mimari, mikrohasarları dağıtır.
- Mineral deposu: Kalsiyum ve fosfatın dinamik tamponu; paratiroid hormon (PTH), D vitamini ve kalsitonin gibi eksenlerle düzenlenir.
- Hematopoez: Kırmızı ilik aracılığıyla eritrosit, lökosit ve trombosit üretimi sürdürülür.
- Endokrin etkileşimler: Osteosit/osteoblast kökenli sinyaller (ör. sclerostin, FGF23) sistemik mineral ve enerji metabolizmasına bağlanır.
Hormonlar, İlaçlar ve Beslenme
- Östrojen eksikliği: RANKL artışı ve OPG düşüşüyle rezorpsiyon hızlanır; trabeküler plak→çubuk dönüşümü ve perforasyon belirgindir.
- Glukokortikoidler: Osteoblast/osteosit apoptozu ve rezorptif eğilimde artış; trabeküler kayıp hızlıdır.
- Anabolik ve antiresorptif tedaviler:
- Anabolikler: Aralıklı PTH analoğu ve sclerostin inhibitörü, trabeküler mikro-mimariyi güçlendirme potansiyeli taşır.
- Antiresorptifler: Bifosfonatlar ve RANKL inhibitörleri rezorpsiyonu baskılar; kırık riskini azaltır.
- Mikrobesinler: D vitamini ve kalsiyum yeterliliği mineralizasyon ve remodelling dengesi için kritiktir; protein ve enerji yetersizliği kemik yapımını sınırlar.
Yaşlanma, Cinsiyet ve Sistemik Etkenler
- Yaşlanma: Bağlantısallık kaybı, trabeküler incelme ve perforasyon öne çıkar; vertebra ve kalça kırık riski artar.
- Cinsiyet farklılıkları: Östrojenin koruyucu etkisi postmenopozda azalır; erkeklerde kayıp daha geç ve farklı paternlerde seyredebilir.
- Sistemik hastalıklar: Endokrinopatiler (hiperparatiroidi, hipertiroidi), inflamatuvar hastalıklar ve malabsorpsiyon sendromları trabeküler bütünlüğü zedeler.
Görüntüleme ve Nicel Değerlendirme
- Radyografi: Trabeküler paternde seyrelme ve mimari bozulma dolaylı ipuçları verir.
- DXA: Areal kemik mineral yoğunluğunu ölçer; trabeküler bone score (TBS) gibi türetilmiş metrikler mikro-mimari hakkında dolaylı bilgi sağlar.
- BT/mikro-BT: Üstün morfometrik çözünürlük; ex vivo altın standart. Klinik pratikte yüksek çözünürlüklü periferik BT (HR-pQCT) ile in vivo mikro-mimari analizi mümkündür.
- MR: Yağ/hematopoetik ilik dağılımı ve trabeküler patern hakkında radyasyon içermeyen bilgi sunar (özellikle araştırma ve belirli klinik endikasyonlarda).
Klinik Önemi ve Örnek Durumlar
- Osteoporoz: Vertebral kompresyon, kalça ve distal radius kırıkları; mikro-mimari kayıp kırık riskini yoğunluk düşüşünden bağımsız artırabilir.
- Osteomalazi: Yetersiz mineralizasyon; trabeküler yapı yumuşar, psödofraktür eğilimi artar.
- Neoplastik süreçler: Multipl miyelomda lizis odakları; metastatik hastalıkta lizitik (ör. meme, akciğer) ya da blastik (ör. prostat) paternler.
- Paget hastalığı: Anormal remodelling; mozaik patern, deformiteler ve kırık riski.
- Enfeksiyon: Osteomiyelit trabeküler ağda destrüksiyon ve ilik tutulumu yapabilir.
- Cerrahi/ortopedik uygulamalar:
- Kansellöz greftler: Hızlı damar-sızma ve birleşme eğilimi nedeniyle sıklıkla tercih edilir.
- Vida tutuşu: Süngerimsi kemikte vida tasarımı ve sıkma torku, çekme-kopma direnci için kritiktir.
- Vertebroplasti/ kifoplasti: Kompresyon kırıklarında ağrı kontrolü ve segmental stabilite amacıyla uygulanır.
- Dental implantoloji: Alveoler kemikte trabeküler yoğunluk ve kalite, implant stabilitesinin önemli belirleyicisidir.
Karşılaştırmalı ve Evrimsel Notlar
Kara omurgalılarında yükse maruziyetli segmentlerde süngerimsi ağ, enerji verimliliği ve mukavemetin optimal bileşimini sağlar. Kuşlarda pnömatizasyon ve özgül uçuş yüklerine adaptasyon; primatlarda dikey yüklenmeye uyumlu vertebral ve kalça mimarisi, trabeküler ağın çevresel zorlara yanıt verebilen evrimsel esnekliğini yansıtır.
Keşif
Antik kavrayıştan modern mikromimarîye uzanan bir keşif serüveni
İnsan iskeletinin “hafif ama güçlü” tarafı olan substantia spongiosa—bugün daha sık kullandığımız adıyla süngerimsi/trabeküler kemik—tıp tarihinin neredeyse her döneminde farklı bir merakın odak noktası oldu. Kavramın kendisi, güncel standartlarda Terminologia Anatomica’da “Substantia spongiosa; substantia trabecularis” biçiminde kayıtlıdır ve kompakta (kortikal) kemikten farklı bir doku sınıfını işaret eder: boşluklu, kirişsi-trabeküler bir kafes, içinde hematopoetik (ve yağ) iliği barındıran canlı bir iskele. Bu yalın tanımın ardında, yüzyıllara yayılan deneyler, araç devrimleri ve fikir kavgaları vardır.
I. Antik tasvirler: “Diploë”nin gölgesinde
Süngerimsi maddenin ilk “adı”, aslında kafatası kemiklerine özgü bir fenomene, iki kompakt tabaka arasındaki gözenekli ara tabakaya verilen diploë terimidir. Hipokratik metinlerde kafa yaralanmaları anlatılırken diploē’ye inen kırıklar tarif edilir; Galen de bu alanın damarlarını ve cerrahi önemini vurgular. Bu antik çerçeve, spongiosayı bağımsız bir doku kategorisi olarak değil, kemik içinde “iki tabaka arasında süngerimsi bir zemin” olarak resmeder.
II. Rönesans’ta iskeletin yeniden yazımı: Vesalius’un mirası
1543’te Vesalius, De humani corporis fabrica’da kemiklerin dokusal çeşitliliğini, ağırlık/sağlamlık dengesini ve “süngersi” görünümü ayrıntılı gravürlerle işledi. Rönesans, insan kadavrası üzerinde sistematik gözlemi ve çizimi meşrulaştırdığı için, spongiosanın kemik bütünlüğüne katkısı ilk kez geniş okur kitlesine görsel ve didaktik bir dille anlatılabildi. Vesalius, kompakta ile spongiozun ayrımını standardize etmese de, modern terminolojinin önünü açan iskelet-merkezli bir öğretinin temelini attı.
III. Erken mikroskopinin eşiği: liflerden kanalcıklara
- yüzyılın optik devrimi, kemik dokusunu gözle görülemeyen ölçekte tartışmaya açtı. Robert Hooke’un mikroskobik gözlem kültürünü popülerleştiren çalışmaları, kemikteki “hücresi” (gözenekli) örüntülere dikkat çekti; kısa süre sonra Clopton Havers’ın Osteologia nova’sı (1691), lameller ve kanallar ağını tanımlayarak bugün “Havers kanal sistemi” dediğimiz organizasyonu literatüre soktu. Aynı yüzyılın sonlarında Antonie van Leeuwenhoek, kemikteki kanalikülleri tarif eden mektuplarıyla (1690’lar) osteosit ağının ilk izlerini çizdi. Bu dönem, spongiosanın “boşluk” değil “ağ (network)” olduğuna dair sezgiyi besledi.
IV. 18. yüzyıl: büyüme, periost ve dinamik kemik
Spongiosa anlayışındaki bir sonraki sıçrama, kemik büyümesi ve yenilenmesi fikrinin deneylerle sınandığı 18. yüzyılda geldi. Henri-Louis Duhamel du Monceau, periost altına yerleştirdiği gümüş teller ve madder-boyası deneyleriyle periostun osteogenik (kemik oluşturucu) rolünü savundu (1739–1743). Bu hipotez tartışılsa da, kemik yüzeyinde yıllık “eklemeli büyüme” fikrini yerleştirdi. Yüzyılın sonunda John Hunter, kemik yeniden yapılanmasının canlı dokulara özgü bir süreç olduğunu deneysel ve karşılaştırmalı anatomi üzerinden işledi. Böylece spongiosa, pasif bir “dolgu” değil, dönüşen bir biyomühendislik harcı olarak tahayyül edildi.
V. 19. yüzyıl: çizgiler, vinçler ve “yasa”
Von Meyer–Culmann buluşması ve Wolff’un dönüşüm yasası
1860’larda Zürih’te anatomist Georg Hermann von Meyer ile inşaat mühendisi Karl Culmann’ın yolları kesişti. Culmann’ın grafik statik’i ve “kriko/vinç” (Fairbairn) şemaları, femurun proksimalindeki trabeküler demetlerin çekme ve basınç izo-yörüngeleri ile şaşırtıcı paralelliğini gösterdi. Von Meyer’in 1867 tarihli “Die Architektur der Spongiosa” makalesi, spongiosayı yük izlerini takip eden bir kafes olarak resmeden ilk programatik metin oldu. Bu kavrayış, 1892’de cerrah Julius Wolff’un “Kemik Dönüşümü Yasası” ile genelleştirildi: kemik (ve iç mimarisi) uygulanan mekanik uyarana göre yeniden şekillenir. Spongiosa, işte bu geri-bildirim ilkesinin en görünür sahnesidir.
VI. 20. yüzyılın ikinci yarısı: üç boyutlu çağın doğuşu
Histolojik kesit morfometrisinin sınırlamalarını aşan kritik kırılma, mikro-BT (micro-CT) ile geldi: Feldkamp ve ark. (1989), trabeküler mimarinin yıkımsız, hacimsel incelenmesini mümkün kıldı. Ardından mikro-sonlu eleman (µFE) teknikleri, voxel-tabanlı ağlarla spongiosa’nın rijitlik ve dayanımını hesaplamaya başladı; yapı (Tb.Th, Tb.N, Tb.Sp, Conn.D) ile işlev (modüller, akma) arasında dijital bir köprü kuruldu. Klinik tarafta ise HR-pQCT (XtremeCT, sonra XtremeCT II) ile in vivo 61 µm voksel boyutuna inildi; böylece distal radius/tibia trabekülleri yerinde, yinelemeli olarak izlenebilir oldu.
VII. Ölçmek, kıyaslamak, kestirmek: metriklerin yükselişi
Üç boyutlu verilerle birlikte morfometrik indeksler de rafine edildi. Hildebrand & Rüegsegger’in SMI’ı (1997), yapıların “çubuk-mu, plaka-mı” doğasını nicelleştirmeye girişti; ardından SMI’nin varsayımlarını ve duyarlılığını tartışan eleştirel metodoloji makaleleri geldi. Öte yandan sadece BT’ye dayanmayan, klinik yoğunluğu yüksek bir başka çizgi, bel DXA görüntülerinin doku dokusallığını kullanan Trabecular Bone Score (TBS) idi: BMD’den bağımsız kırık öngörüsü ek bilgisi sunarak risk sınıflamasını keskinleştirdi ve FRAX ayarlamasına entegre oldu. Spongiosayı “görmeden” okumaya yarayan bu yaklaşım, tarama programlarına düşük maliyetli bir mikro-mimarî penceresi ekledi.
VIII. Moleküler paradigmanın gelişi: RANKL/OPG ekseninden sclerostin’e
Mikromimarîyi kuran ve söken hücresel orkestranın dili 1990’larda daha iyi çözüldü. Osteoprotegerin (OPG)’in keşfi (1997), RANKL–RANK–OPG ekseninin osteoklastogenez ve rezorpsiyondaki merkezi rolünü aydınlattı. 2000’lerde SOST/sclerostin’in osteosit kaynaklı bir Wnt inhibitörü olduğunun anlaşılması ve sclerosteosis/van Buchem fenotiplerinden gelen insan genetik verisi, trabeküler yapı-işlev dengesinin osteosit sinyalizasyonuyla ayarlandığını gösterdi. Bu çizgi, 2019’da romosozumab’ın (anti-sclerostin) klinik onayıyla doğrudan spongiosa mimarisine müdahale eden anabolik/antirezorptif ikili etkili bir tedaviye dönüştü.
IX. Günümüz (2020’ler): çözünürlük, “omik”, yapay zekâ
Bugün spongiosa araştırması üç güçlü akımı birleştiriyor:
- Görüntüleme: İkinci nesil HR-pQCT’nin daha yüksek çözünürlüğü ve hareket/artefakt düzeltmeleri, takip çalışmalarında trabeküler ağ kaybının hızı ve deseni gibi uç noktalara kapı açtı; klinik BT’de süper-çözünürlük ve yeni segmentasyon yöntemleri spongiosayı “rutin”e yaklaştırıyor.
- Tek-hücre ve uzamsal omikler: Kemik ve iliğin tek-hücreli transkriptom ve uzamsal atlasları, osteoblast-osteosit hatları ile stromal/immün çevrenin konuşmasını hücresel koordinatlar üzerinde çözümlüyor; spongiosa artık sadece bir mekanik ağ değil, sinyal trafiğinin coğrafyası olarak resmediliyor.
- Yapay zekâ: Derin öğrenme tabanlı segmentasyon ve harmonizasyon algoritmaları, mikro-BT/HR-pQCT verilerini hızla ve tutarlı şekilde işleyerek yapısal metriklerin çok merkezli karşılaştırılabilirliğini artırıyor. Bu sayede zamana bağlı yeniden yapılanma haritaları ve hasta-özgül mikro-FE modelleri daha güvenilir hale geliyor.
X. Bir “doku”dan fazlası: mimarlık, ekoloji ve tasarım
Spongiosa, bugün, salt bir histoloji başlığı değil, üç katmanlı bir bilim ve mühendislik kesişimidir:
- Mimarlık: Von Meyer’den bu yana trabeküler “kafesin” yük izlerine göre trajektörel örgütlenmesi, hafif-dayanıklı strüktür tasarımlarına ve additif imalatta porozite/mimari optimizasyonuna ilham veriyor.
- Ekoloji: İlik adipoz dokusunun ve bağışıklık hücrelerinin (osteommunoloji) spongiosadaki yerleşim ve metabolik etkileri, kırılganlığın yalnızca yoğunluk veya kalınlığa indirgenemeyeceğini gösteriyor.
- Tasarım: Klinik kararlarda TBS/HR-pQCT gibi mikromimarî duyarlı parametrelerin ilaç seçimine ve tedavi yanıtı izlemlerine entegre edilmesi, “kemik kalitesi”ni hacimsel yoğunluğun ötesine taşıyor. (Kaynaklar ve güncel çalışmalar için aşağıdaki seçki.)
İleri Okuma
- Vesalius A. (1543). De humani corporis fabrica. Basel: Oporinus.
- Havers C. (1691). Osteologia nova. London: Smith & Walford.
- Leeuwenhoek A. (1690’lar). Letters on the structure of bones. Royal Society Correspondence.
- Duhamel du Monceau H.-L. (1739–1743). Expériences sur la croissance des os et le rôle du périoste. Paris.
- Hunter J. (1792). Observations on Certain Parts of the Animal Oeconomy. London: G. Nicol.
- Culmann K. (1866). Die graphische Statik. Zürich: Meyer & Zeller.
- von Meyer G.H. (1867). Die Architektur der Spongiosa. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin, 34, 615–628.
- Wolff J. (1892). Das Gesetz der Transformation der Knochen. Berlin: Hirschwald.
- Feldkamp L.A., Goldstein S.A., Parfitt A.M., et al. (1989). The direct examination of three-dimensional bone architecture in vitro by computed tomography. Journal of Bone and Mineral Research, 4(1), 3–11.
- van Rietbergen B., Weinans H., Huiskes R., et al. (1995). A new method to determine trabecular bone elastic properties and loading using micro-finite element models. Journal of Biomechanics, 28(1), 69–81.
- Hildebrand T., Rüegsegger P. (1997). Quantification of bone microarchitecture with the Structure Model Index. Computer Methods in Biomechanics and Biomedical Engineering, 1(1), 15–23.
- Simonet W.S., et al. (1997). Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell, 89(2), 309–319.
- Brunkow M.E., et al. (2001). Bone dysplasia sclerosteosis results from loss of the SOST gene product, a novel cystine knot–containing protein. American Journal of Human Genetics, 68(3), 577–589.
- Manske S.L., Boyd S.K. (2015). High-resolution peripheral quantitative computed tomography: measuring bone quality in vivo. Clinical Reviews in Bone and Mineral Metabolism, 13, 187–199.
- FDA (2019). Romosozumab (Evenity) label and approval information. U.S. Food and Drug Administration.
- Shevroja E., Hans D., et al. (2021). Trabecular bone score: A review of clinical use in fracture risk assessment. Bone, 143, 115–118.
- Neeteson N.J., et al. (2023). Automated deep learning segmentation of trabecular bone in HR-pQCT imaging. Bone Reports, 18, 101–109.
- Frazer L.L., et al. (2024). Super-resolution methods improve clinical CT assessment of trabecular microarchitecture. Bone, 178, 116–123.
- Bandyopadhyay S., et al. (2024). A single-cell and spatial atlas of the human bone marrow microenvironment. Nature, 628, 345–354.