Nazofaringeal Sürüntü: Anatomi, Fizyoloji ve Klinik Uygulama
Etimolojik Köken ve Terminolojik Çerçeve
Nazofaringeal sürüntü terimi, Latince “nasus” kökünden türeyen burun ve Yunanca “pharynx” kelimesinden gelen boğaz kavramlarının birleşiminden oluşur. Nazofarenks, üst solunum yolunun anatomik olarak burun boşluğunun posterior kısmı ile orofarenksin superior sınırı arasında uzanan kritik bir geçiş bölgesini ifade eder. Sürüntü sözcüğü ise, mukozal yüzeylerden örnekleme amacıyla gerçekleştirilen mekanik bir eylemi tanımlar. Bu terminoloji, modern tıbbi uygulamalarda özellikle mikrobiyal patojen tespiti ve viral tanı metodolojisi bağlamında merkezi bir konum işgal etmektedir.
Evrimsel Perspektif ve Anatomik Organizasyon
Üst solunum yolunun evrimsel gelişimi, omurgalıların karasal yaşama adaptasyonu sürecinde şekillenmiş kompleks bir anatomik ve fizyolojik sistemin ortaya çıkışını temsil eder. Nazofarenks, bu sistemin en yoğun mukozal yüzeylerinden birini barındırır ve adaptif immün sistemin gelişiminde kritik rol oynayan organize lenfoid yapıları içerir. Farengeal tonsil olarak da bilinen adenoid doku, bu bölgede konumlanarak özellikle çocukluk çağında immün hafızanın oluşumuna katkıda bulunur ve çevresel antijenlere karşı birincil savunma hattını oluşturur.
Nazofaringeal mukozanın histolojik yapısı, çok katlı silyalı solunum epiteli ile karakterizedir. Bu epitel tabakasının altında zengin vasküler ağlar, seromukozal bezler ve mukus salgılayan goblet hücreleri yer alır. Mukus tabakası, inhale edilen partiküllerin ve patojenlerin fiziksel bir bariyer aracılığıyla tutulmasını sağlarken, silyalı hücreler mukosilier klerensin sürdürülmesinde görev alır. Bu anatomik ve fizyolojik özellikler, nazofarenksin hem patojenlerin birincil kolonizasyon yeri hem de immün gözetim merkezi olarak işlev görmesini sağlar.
Nazofarenks, anterior olarak posterior nazal aperturalarla, inferior olarak yumuşak damakla, superior olarak sfenoid sinüs ve kafatabanının bir kısmıyla sınırlanır. Bu bölgenin lateral duvarlarında Eustachian tüp orifisleri bulunur ve bu anatomik özellik, orta kulak ile nazofarenks arasındaki fizyolojik bağlantıyı temsil eder. Zengin lenfatik drenaj ağı, retrofaringeal ve derin servikal lenf nodlarına uzanır ve bu durum, bu bölgeden köken alan enfeksiyonların potansiyel yayılım yollarını belirler.
Patofizyolojik Önem ve Mikrobiyal Ekoloji
Nazofarenks, insan vücudunun dış ortamla sürekli temas halinde olan ve dolayısıyla mikrobiyal kolonizasyona en açık anatomik bölgelerinden biridir. Bu alan, hem kommensal mikroorganizmaların hem de potansiyel patojenlerin kolonizasyonu için ideal bir niş oluşturur. Normal florada Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis ve çeşitli viridans streptokok türleri bulunur. Bu mikrobiyal topluluk, ekosistem dengesi içinde immün sistem gelişimine katkıda bulunur ve kolonizasyon direnci olarak bilinen fenomen aracılığıyla patojenik organizmaların invazyon kapasitesini sınırlar.
Viral solunum yolu enfeksiyonlarının büyük çoğunluğu, nazofaringeal bölgede başlar ve bu anatomik lokalizasyon, tanısal örnekleme stratejileri açısından kritik öneme sahiptir. SARS-CoV-2 virüsünün neden olduğu COVID-19 pandemisi, nazofaringeal bölgenin viral patojenez açısından merkeziyetini dramatik biçimde ortaya koymuştur. Virüs, hücre yüzeyinde eksprese edilen anjiyotensin dönüştürücü enzim 2 reseptörüne yüksek afinite ile bağlanarak hücre içine girer ve nazofaringeal epitelde erken enfeksiyon döneminde yüksek viral yük oluşturur. Bu durum, semptom başlangıcından önce bile bulaşıcılığın mümkün olmasını açıklar ve asemptomatik taşıyıcıların epidemiyolojik önemini vurgular.
İnfluenza virüsleri, rinovirüsler, respiratory syncytial virus, adenovirüsler, metapnömovirüs ve diğer solunum yolu patojenlerinin de benzer şekilde nazofaringeal mukozada preferansiyel olarak replike olması, bu bölgenin tanısal örnekleme için ideal bir hedef olmasını sağlar. Viral replikasyon dinamiği, enfeksiyonun erken fazlarında nazofarenks bölgesinde maksimum viral yüke ulaşır ve bu kinetik patern, zamanlamanın tanısal duyarlılık üzerindeki etkisini belirler.
Tanısal Metodoloji ve Klinik Rasyonel
Nazofaringeal sürüntü, solunum yolu enfeksiyonlarının mikrobiyal tanısında altın standart örnekleme yöntemlerinden biri olarak kabul edilir. Bu yöntemin tercih edilmesinin temel nedeni, enfeksiyonun aktif olduğu anatomik bölgeden doğrudan örnekleme yapılması ve dolayısıyla yüksek duyarlılık ve özgüllük elde edilmesidir. Anterior nazal sürüntü, orofaringeal sürüntü ve tükürük gibi alternatif örnekleme yöntemleriyle karşılaştırıldığında, nazofaringeal sürüntü genellikle daha yüksek viral yük tespit eder ve yalancı negatif sonuç oranını minimize eder.
COVID-19 pandemisi sırasında gerçekleştirilen kapsamlı karşılaştırmalı çalışmalar, nazofaringeal sürüntünün anterior nazal sürüntüye göre özellikle enfeksiyonun erken dönemlerinde ve düşük viral yük senaryolarında superior performans gösterdiğini ortaya koymuştur. Bu fark, nazofaringeal bölgenin viral replikasyon açısından birincil hedef doku olmasından kaynaklanır. Bununla birlikte, hasta konforu ve örnekleme kolaylığı açısından anterior nazal sürüntü avantajlar sunabilir ve belirli klinik senaryolarda kabul edilebilir bir alternatif oluşturabilir.
Örnekleme zamanlaması, tanısal doğruluk açısından kritik bir parametredir. Viral enfeksiyonlarda, semptom başlangıcından sonraki ilk beş gün içinde viral yük genellikle en yüksek seviyededir ve bu dönemde gerçekleştirilen örneklemeler maksimum duyarlılık sağlar. Enfeksiyonun ilerleyen dönemlerinde viral yük progressif olarak azalır ve alt solunum yolu örneklerinin tanısal değeri artabilir.
Örnekleme Araçları ve Teknik Spesifikasyonlar
Nazofaringeal sürüntü işleminde kullanılan araçların özellikleri, örnekleme başarısında belirleyici rol oynar. İdeal nazofaringeal sürüntü çubuğu, esnek sentetik polimerlerden üretilir ve uç kısmında mikrofiber bazlı sentetik elyaflardan oluşan absorban bir baş bulunur. Bu başın dokusuna gömülü mikroskobik lifler, mukozal yüzeyden hücresel materyali, mukusu ve viral partikülleri etkili biçimde tutar ve sonrasında transport medyumuna optimal salınım sağlar.
Çubuğun şaft kısmı, nazofaringeal anatominin doğal kıvrımlarına uyum sağlayacak esneklikte olmalı ancak aynı zamanda kontrollü ilerleme için yeterli rijitliği korumalıdır. Modern sürüntü sistemleri genellikle poliüretan, polietilen veya poliester gibi materyallerden üretilir. Bazı gelişmiş tasarımlar, optimal örnekleme derinliğini gösteren işaretleme çizgileri ve güvenli transport için önceden belirlenmiş kırılma noktaları içerir. Bu kırılma noktası, çubuğun transport tüpünün içinde kalmasını sağlar ve örnekleme sonrası kontaminasyon riskini azaltır.
Geleneksel ahşap saplı pamuklu çubuklar, nazofaringeal sürüntü için uygun değildir ve bu durum birkaç kritik nedene dayanır. Pamuk lifleri, bazı viral nukleik asitleri absorbe edebilir ve polimeraz zincir reaksiyonu gibi moleküler tanı testlerini inhibe eden rezidüel kimyasal maddeler içerebilir. Ahşap sap, esneklik açısından yetersizdir ve nazofaringeal anatomiye uygun navigasyonu zorlaştırır. Modern sentetik materyaller, bu sorunları ortadan kaldırmış ve örnekleme verimliliğini önemli ölçüde artırmıştır.
Anatomik Yönelim ve Güvenli Uygulama Prensipleri
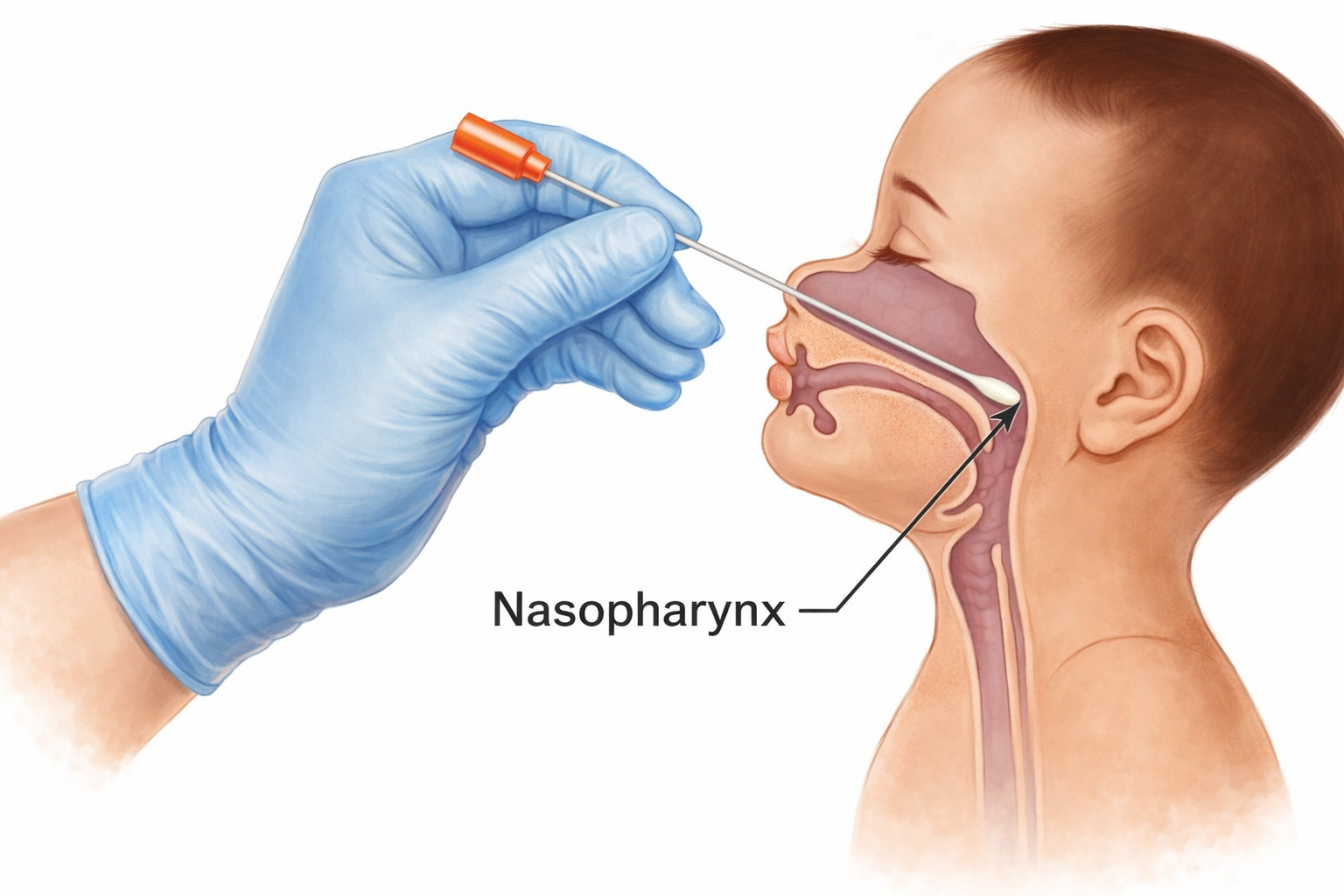
Nazofaringeal sürüntünün güvenli ve etkili biçimde uygulanması, üst solunum yolu anatomisinin tridimensiyonel bilgisini gerektirir. Burun boşluğu, median septum tarafından iki kompartmana ayrılır ve her bir kompartman konkalar olarak adlandırılan kemik çıkıntılarla kompleks bir yapı kazanır. İnferior, orta ve superior konkalar, nazal kavitenin lateral duvarından protrüde olur ve burun boşluğunu dar kanallar halinde böler. Bu anatomik organizasyon, inhale edilen havanın ısıtılması, nemlendirilmesi ve filtrelenmesi için yüzey alanını maksimize eder.
Nazofarenkse güvenli ulaşım için, sürüntü çubuğunun burun tabanı boyunca, yani nazal kavite zemininde ve septuma paralel neredeyse yatay bir yönelimde ilerletilmesi esastır. Bu yönelim, inferior konkanın medial yüzeyi ile septum arasındaki doğal geçişi takip eder. Yaygın bir uygulama hatası, çubuğun superior doğru, orbita tabanına veya kafatabanına doğru yönlendirilmesidir. Bu hatalı yönelim, orta konka ile temas ve dirence neden olur ve ender durumlarda etmoid labirent veya cribriform plate yaralanması gibi ciddi komplikasyonlara yol açabilir.
Optimal örnekleme derinliği, nazofaringeal duvarın posterosuperior kısmına ulaşmayı hedefler ve bu mesafe yetişkinlerde genellikle burun deliğinden altı ila sekiz santimetre arasında değişir. Çubuk, yumuşak bir direnç hissedilinceye kadar ilerletilir ve bu nokta nazofaringeal mukozaya temasın göstergesidir. Aşırı güç uygulanması, mukozal yaralanmaya ve epistaksis gibi yan etkilere neden olabilir. Eğer anatomik varyasyonlar veya obstrüksiyonlar nedeniyle çubuk kolayca ilerletilemiyorsa, işlem durdurulmalı ve kontralateral burun deliği tercih edilmelidir.
Prosedürel Protokol ve Standardizasyon
Nazofaringeal sürüntü işlemi, standardize edilmiş bir protokol çerçevesinde gerçekleştirilmelidir. İşlem öncesi hazırlık, gerekli malzemelerin organizasyonunu, kişisel koruyucu ekipmanın giyilmesini ve el hijyeninin sağlanmasını içerir. Hastanın bilgilendirilmesi ve informasyonlu onamın alınması, etik ve hukuki açıdan zorunludur. Bu bilgilendirme sürecinde, işlemin amacı, beklenen duyusal deneyim ve potansiyel yan etkiler açıklanmalıdır.
Kontrendikasyonların değerlendirilmesi kritik öneme sahiptir. Aktif epistaksis, yakın tarihli nazal veya kafatabanı cerrahisi, ciddi koagülopati veya antikoagülan tedavi, ciddi nazal deformiteler ve anatomik obstrüksiyonlar göreceli kontrendikasyonlar arasında yer alır. Bu durumlarda, risk-fayda analizi yapılmalı ve gerekirse alternatif örnekleme yöntemleri düşünülmelidir.
Hastanın burun boşluğunun inspeksiyonu, hangi burun deliğinin daha uygun olduğunun belirlenmesine yardımcı olur. Septal deviasyon, polip, hipertrofik konka veya diğer anatomik varyasyonlar, bir tarafın diğerine tercih edilmesini gerektirebilir. Hasta, işlem öncesinde burnunu bir mendille nazikçe temizlemelidir ve bu uygulama hem mukus ve sekreyonları uzaklaştırır hem de hasta konforunu artırır.
Steril sürüntü çubuğu, aseptik teknik kullanılarak ambalajından çıkarılır ve sağlayıcı tarafından bir kalem tutar gibi kavranır. Hasta başını hafifçe ekstansiyonda tutabilir veya başın arkası desteklenebilir. Bu pozisyon, nazofaringeal geçişi kolaylaştırır ve anatomik açıyı optimize eder. Alternatif olarak, baş nötral pozisyonda tutulabilir ve burun ucu hafifçe kaldırılarak benzer bir etki sağlanabilir.
Çubuk, kontrollü ve yavaş bir hareketle burun deliğine sokulur. Hareket yumuşak ve düzgün olmalı, ani itme veya torsiyon hareketlerinden kaçınılmalıdır. Çubuk burun tabanı boyunca ilerletilirken, kulak kepçesi veya başın arkası yönünde bir yönelim hedeflenir. Nazofaringeal duvara ulaşıldığında, çubuk yerinde üç ila beş saniye tutulur ve bu süre mukozal yüzeyden yeterli hücresel materyal ve viral partikül emilimini sağlar.
Bazı protokoller, çubuğun nazik bir rotasyonunu önermektedir ancak güncel bilimsel kanıtlar, rotasyonun tanısal verim açısından ek fayda sağlamadığını ve hasta konforu açısından dezavantajlı olabileceğini göstermektedir. Çubuğun geri çekilmesi, sokulması kadar kontrollü ve yavaş olmalıdır. Geri çekilme sırasında konka veya septuma temasın minimize edilmesi, sekonder kontaminasyonu önler.
Elde edilen örnek, derhal uygun viral transport medyumuna aktarılmalıdır. Bu medyum, viral partiküllerin stabilitesini korurken bakteriyel ve fungal büyümeyi inhibe eder. Transport medyumu genellikle protein bazlı besin maddeleri, tampon sistemler, antibiyotikler ve antifungal ajanlar içerir. Örnekler, soğuk zincir korunarak laboratuvara ulaştırılmalıdır ve ideal olarak dört saat içinde işleme alınmalıdır.
Hasta Deneyimi ve Nörofizyolojik Yanıtlar
Nazofaringeal sürüntü, minimal invaziv bir prosedür olmasına rağmen, hastaların çoğu tarafından rahatsız edici olarak deneyimlenir. Bu duyu deneyimi, trigeminal sinirin nazal dallarının mekanik ve kimyasal uyarılmasından kaynaklanır. Trigeminal sinir, nazofaringeal bölgeye yoğun duyusal innervasyon sağlar ve mukozal yüzeydeki mekanoreseptörler ve nosiseptörler, çubukun teması ile aktive olur.
Bu aktivasyon, çeşitli refleks yanıtları tetikler. Lakrimal refleks, gözyaşı salgılanmasına neden olur ve bu durum işlem sırasında sıklıkla gözlemlenir. Hapşırma refleksi, nazal mukozanın irritasyonuna karşı koruyucu bir yanıt olarak ortaya çıkabilir. Öğürme refleksi, çubuğun posterior farengeal duvara teması durumunda aktive olabilir ve bu durum vagal sinir uyarımını yansıtır. Bazı hastalarda, vazovagal yanıt gelişebilir ve bu durum bradikardi, hipotansiyon ve nadiren presenkop ile karakterizedir.
Rahatsızlık hissi, yanma, baskı ve yabancı cisim hissi gibi duyusal modaliteleri içerir. Bu semptomlar genellikle işlem sırasında ve hemen sonrasında en belirgindir ve birkaç dakika içinde progressif olarak azalır. Nazal sekreyonlarda geçici artış, mukozal irritasyona yanıt olarak gelişir ve sekretuar bezlerin parasempatik stimülasyonunu yansıtır.
Komplikasyonlar ve Güvenlik Profili
Nazofaringeal sürüntünün komplikasyon profili, doğru teknik uygulandığında oldukça güvenlidir. En sık görülen yan etki epistaksistir ve bu genellikle minimal ve kendi kendini sınırlayan karakterdedir. Anterior nazal kavitenin Kiesselbach plexusu olarak bilinen bölgesi, zengin vasküler anastomozlar içerir ve mekanik travmaya duyarlıdır. Posterior epistaksis daha nadirdir ancak daha ciddi olabilir ve sfenopalalin arterden köken alan kanamayı içerebilir.
Mukozal laserasyon ve abrazyon, aşırı güç uygulanması veya yanlış anatomik yönelim durumunda gelişebilir. Ciddi komplikasyonlar arasında, kafatabanı yaralanması ve beyin omurilik sıvısı sızıntısı yer alır ancak bunlar son derece nadirdir ve genellikle altta yatan anatomik anormallikler veya yakın tarihli cerrahi ile ilişkilidir. Literatürde bildirilen vakalar, cribriform plate defektleri, ensefaloseller veya invaziv paranazal sinüs patolojileri olan hastalarda gerçekleşmiştir.
İnfeksiyon bulaşı riski, uygun kişisel koruyucu ekipman kullanımı ve standart enfeksiyon kontrol önlemleri ile minimize edilir. Örnekleme sırasında aerosol oluşumu, özellikle hasta hapşırdığında veya öksürdüğünde mümkündür ve bu durum sağlık çalışanları için bulaşma riski oluşturur. N95 veya FFP2 tipi respiratörler, göz koruması, eldiven ve önlük kullanımı, bu riski önemli ölçüde azaltır.
Moleküler Tanı ve Laboratuvar İşleme
Nazofaringeal sürüntü ile elde edilen örneklerin laboratuvar işleme süreci, moleküler tanı platformlarının gelişimi ile önemli ölçüde evrilmiştir. Modern tanısal yaklaşım, viral nukleik asitlerin amplifikasyonuna ve tespitine dayanır. Gerçek zamanlı revers transkripsiyon polimeraz zincir reaksiyonu teknolojisi, viral genomun spesifik bölgelerini hedefleyerek yüksek hassasiyet ve özgüllükle patojenleri tespit eder.
Moleküler tanı sürecinin ilk adımı, mukozal hücrelerden ve viral partikülerden nukleik asit ekstraksiyonudur. Bu işlem, hücre lizisi, protein denatürasyonu ve nukleik asit saflaştırmasını içerir. Ekstraksiyon verimliliği, tanısal duyarlılığı doğrudan etkiler ve otomatize sistemler, standardizasyon ve yüksek verim sağlar.
SARS-CoV-2 tespiti için kullanılan assayler, genellikle viral genomun birden fazla bölgesini hedefler. Nükleokapsid geni, spike protein geni ve RNA-bağımlı RNA polimeraz geni, yaygın hedefler arasında yer alır. Multiplex PCR platformları, aynı örnekten birden fazla solunum yolu patojeninin eşzamanlı tespitini sağlar ve bu yaklaşım, klinik karar verme sürecini hızlandırır ve koenfeksiyonların tanınmasını mümkün kılar.
Döngü eşik değeri, örnekteki viral yükün göreceli miktarını yansıtan bir parametredir. Düşük döngü eşik değerleri yüksek viral yükü, yüksek değerler ise düşük viral yükü gösterir. Bu değer, enfeksiyonun evresini tahmin etmede ve bulaşıcılık potansiyelini değerlendirmede yardımcı olabilir ancak tek başına klinik karar verme için kullanılmamalıdır.
Hızlı antijen testleri, alternatif bir tanısal yaklaşım sunar ve sonuç süresi on beş ila otuz dakika arasında değişir. Bu testler, viral proteinlerin immünokromatografik tespitine dayanır ve yüksek viral yük senaryolarında iyi performans gösterir. Ancak duyarlılıkları, moleküler testlere göre düşüktür ve düşük viral yük durumlarında yalancı negatif sonuçlar verebilir.
Klinik Bağlam ve Uygulama Alanları
Nazofaringeal sürüntü, çeşitli klinik senaryolarda uygulama alanı bulur. COVID-19 pandemisi sırasında, bu yöntem semptomatik hastaların tanısında, asemptomatik bireylerin taramasında, temas takibinde ve epidemiyolojik sürveyans programlarında yaygın olarak kullanılmıştır. Yüksek riskli ortamlarda, düzenli tarama programları, asemptomatik bulaşmanın önlenmesinde kritik rol oynamıştır.
İnfluenza sezonu boyunca, nazofaringeal sürüntü influenza virüslerinin tespiti ve antiviral tedavi kararlarının yönlendirilmesinde kullanılır. Erken tanı, özellikle yüksek riskli popülasyonlarda, zamanında tedavi başlanmasını ve komplikasyon oranlarının azaltılmasını sağlar. Respiratory syncytial virus enfeksiyonlarının tanısı, özellikle infantlarda ve immünsüprese hastalarda, klinik yönetimi etkiler.
Bazı bakteriyel patojenlerin, özellikle Bordetella pertussis, Neisseria meningitidis ve Corynebacterium diphtheriae gibi organizmaların, nazofaringeal taşıyıcılığının tespiti, halk sağlığı açısından önem taşır. Taşıyıcılık taraması, salgın kontrol önlemlerinin uygulanmasında ve hedeflenmiş antimikrobiyal profilaksinin yönlendirilmesinde kritik bilgi sağlar.
Keşif
Erken Gözlemler ve Mikrobiyal Teorinin Doğuşu
Nazofaringeal sürüntü yönteminin tarihi, on dokuzuncu yüzyılın ikinci yarısında mikroorganizmaların hastalık etkeni olarak tanınmasıyla başlar. Louis Pasteur’ün 1860’larda mikrobiyal teorinin temellerini atması ve Robert Koch’un 1880’lerde bakteriyolojik postülatlarını formüle etmesi, enfeksiyon hastalıklarının bilimsel olarak anlaşılmasında devrim yarattı. Bu dönemde, enfeksiyon kaynaklarının belirlenmesi için insan vücudunun çeşitli bölgelerinden örnekleme yöntemleri geliştirilmeye başlandı.
Difteri üzerine yapılan çalışmalar, nazofaringeal örneklemenin ilk sistematik uygulamalarına zemin hazırladı. Edwin Klebs, 1883’te difteri hastalarının farengeal membranlarından bakteri kültürlerini izole etti ve bu çalışma, üst solunum yolundan mikrobiyal örneklemenin tanısal değerini ortaya koydu. Friedrich Loeffler, bir yıl sonra Klebs’in gözlemlerini doğruladı ve bu bakteriyi saf kültür olarak izole etti. Loeffler’in çalışmaları, örnekleme tekniklerinin standardizasyonunda önemli adımları içeriyordu ve farengeal sürüntü yöntemini sistematik hale getirdi.
Yirminci yüzyılın başlarında, bakteriyoloji laboratuvarları dünya çapında kurulmaya başladı ve klinik örnekleme yöntemleri giderek daha sofistike hale geldi. Boğaz ve burun kültürlerinin rutin olarak alınması, difteri, boğmaca ve meningokok enfeksiyonları gibi ciddi hastalıkların tanısında standart uygulama haline geldi. Bu dönemde, farklı anatomik bölgelerden alınan örneklerin tanısal değeri karşılaştırılmaya başlandı ve nazofarenksin özel önemi giderek netleşti.
Viral Etijenler ve Metodolojik Evrim
Virüslerin keşfi ve karakterizasyonu, yirminci yüzyılın ilk yarısında örnekleme metodolojisinde yeni bir paradigma yarattı. Wendell Stanley’in 1935’te tütün mozaik virüsünü kristalize etmesi, virüslerin fiziksel varlıklarının anlaşılmasında çığır açtı. Elektron mikroskobunun 1940’larda biyolojik araştırmalara uygulanması, viral partiküllerin görselleştirilmesini mümkün kıldı ve viral enfeksiyonların tanısında yeni perspektifler açtı.
İnfluenza virüsünün izolasyonu ve karakterizasyonu, nazofaringeal örneklemenin viral tanıdaki önemini vurguladı. 1933’te Christopher Andrewes, Wilson Smith ve Patrick Laidlaw, insan influenza virüsünü ilk kez izole ettiler ve bu çalışma için hastaların üst solunum yolu sekreyonlarını kullandılar. Bu araştırmacılar, virüsün nazal ve farengeal bölgelerde yoğun olarak replike olduğunu gösterdiler ve bu gözlem, nazofaringeal örneklemenin viral tanıdaki mantığını oluşturdu.
1940’lar ve 1950’ler boyunca, hücre kültürü tekniklerinin gelişimi viral izolasyon ve tanıda devrim yarattı. John Enders, Thomas Weller ve Frederick Robbins, 1949’da polio virüsünü hücre kültüründe üretmeyi başardılar ve bu çalışma onlara Nobel Ödülü kazandırdı. Bu teknik, diğer virüslerin izolasyonuna da uygulandı ve nazofaringeal örneklerden elde edilen materyalin hücre kültürlerinde inokülasyonu, viral tanının standart yöntemi haline geldi.
Respiratory syncytial virus, 1956’da Robert Chanock tarafından şempanze soğuk algınlığı ajanı olarak tanımlandı ve daha sonra infantlarda ciddi alt solunum yolu enfeksiyonlarının başlıca nedeni olarak tanındı. Rinovirüsler, 1960’larda David Tyrrell ve meslektaşları tarafından soğuk algınlığının en sık etkeni olarak karakterize edildi. Bu keşiflerin her biri, nazofaringeal bölgeden alınan örneklerin analizine dayanıyordu.
Moleküler Devrim ve PCR Çağının Başlangıcı
Moleküler biyolojideki ilerlemeler, 1980’lerden itibaren tanısal tıpta paradigma değişimine yol açtı. Kary Mullis’in 1983’te polimeraz zincir reaksiyonunu icat etmesi, tıbbi tanının en önemli teknolojik atılımlarından birini temsil etti. PCR teknolojisi, son derece küçük miktarlardaki nukleik asitleri milyonlarca kez çoğaltma kapasitesi sundu ve bu özellik, viral enfeksiyonların tanısında çığır açtı.
PCR’nin klinik tanıya uyarlanması, 1990’lar boyunca hızla ilerledi. Gerçek zamanlı PCR teknolojisinin gelişimi, kantitatif nukleik asit tespitini mümkün kıldı ve tanısal hassasiyeti dramatik şekilde artırdı. Bu teknoloji, nazofaringeal sürüntü örneklerinden viral yükün ölçülmesine olanak sağladı ve enfeksiyonun şiddetini ve bulaşıcılık potansiyelini değerlendirmede yeni olanaklar yarattı.
Thomas Chien ve meslektaşlarının 1990’ların ortalarında gerçek zamanlı PCR için floresan prob sistemlerini geliştirmesi, bu tekniğin klinik laboratuvarlarda rutin kullanımını pratik hale getirdi. Multiplex PCR platformlarının ortaya çıkışı, tek bir örnekten birden fazla patojenin eşzamanlı tespitini mümkün kıldı ve bu kapasite, karmaşık solunum yolu enfeksiyonlarının tanısında özellikle değerli oldu.
Örnekleme Araçlarının Teknolojik Evrimi
Nazofaringeal sürüntü araçlarının tasarımı, yirminci yüzyıl boyunca önemli evrim geçirdi. Erken dönemde, ahşap saplı pamuklu çubuklar kullanılıyordu ancak bu araçların çeşitli sınırlamaları vardı. Pamuk lifleri, bazı mikroorganizmaları inhibe eden yağlar ve reçineler içerebiliyordu ve ahşap sap, nazofaringeal anatominin karmaşık yapısına uyum sağlamada yetersiz kalıyordu.
1960’lar ve 1970’lerde, sentetik materyallerin gelişimi örnekleme araçlarında yenilikçi tasarımlara yol açtı. Kalsiyum aljinat, polyester ve rayon gibi sentetik elyaflar, pamuk yerine kullanılmaya başlandı. Bu materyaller, mikroorganizmaları daha etkili bir şekilde tutuyor ve transport medyumuna daha iyi salınım sağlıyordu. Esnek plastik saplar, anatomik navigasyonu kolaylaştırdı ve hasta konforunu artırdı.
1980’lerde, flok sürüntü teknolojisi geliştirildi. Bu yenilikçi tasarım, sentetik elyafların dikey olarak tutturulduğu bir yapı içeriyordu ve bu konfigürasyon, mikrobiyal materyalin tutulması ve salınımı için optimal yüzey alanı sağlıyordu. Copan Diagnostics ve diğer şirketler, flok sürüntü sistemlerini ticari olarak geliştirdiler ve bu ürünler, özellikle moleküler tanı uygulamaları için tercih edilen araçlar haline geldi.
SARS Salgını ve Örnekleme Protokollerinin Standardizasyonu
2002-2003 SARS salgını, nazofaringeal örnekleme metodolojisinde kritik bir dönüm noktasını temsil etti. SARS koronavirüsü, yeni bir viral patojendi ve hızlı yayılımı, güvenilir tanısal testlerin acil olarak geliştirilmesini gerektirdi. Hong Kong, Singapur, Kanada ve diğer etkilenen bölgelerdeki araştırmacılar, optimal örnekleme stratejilerini belirlemek için yoğun çaba gösterdiler.
Joseph Sung ve meslektaşları Hong Kong’da, farklı anatomik bölgelerden alınan örneklerin tanısal değerini karşılaştırdılar. Nazofaringeal aspirat ve sürüntü örneklerinin, orofaringeal sürüntü ve tükürük örneklerine göre daha yüksek viral yük içerdiğini gösterdiler. Bu bulgular, nazofaringeal örneklemenin SARS tanısı için tercih edilen yöntem olarak benimsenmesine yol açtı.
SARS salgını ayrıca, sağlık çalışanlarının korunması için kişisel koruyucu ekipman protokollerinin önemini vurguladı. Singapur’daki araştırmacılar, örnekleme sırasında aerosol oluşumunun riskini araştırdılar ve güvenlik önlemlerini optimize ettiler. Dünya Sağlık Örgütü, SARS ve diğer solunum yolu patojenlerinin örneklenmesi için standardize edilmiş kılavuzlar yayınladı ve bu dokümanlar, küresel düzeyde protokol harmonizasyonunu sağladı.
H1N1 Pandemisi ve Hızlı Tanının Önemi
2009 H1N1 influenza pandemisi, nazofaringeal örnekleme ve hızlı tanı kapasitesinin pandemi yönetimindeki kritik rolünü gösterdi. Meksika’da ortaya çıkan ve hızla dünya çapında yayılan bu yeni influenza suşu, halk sağlığı sistemleri için büyük bir zorluk oluşturdu. Hızlı tanı testlerinin geliştirilmesi ve yaygınlaştırılması, antiviral tedavi kararlarının yönlendirilmesinde ve epidemiyolojik sürveyansın sürdürülmesinde hayati önem taşıdı.
Amerika Birleşik Devletleri Hastalık Kontrol ve Önleme Merkezleri, hızlı PCR bazlı tanı protokolleri geliştirdi ve bu testleri dünya çapındaki laboratuvarlara dağıttı. Nazofaringeal ve orofaringeal sürüntü kombinasyonlarının kullanımı, bazı protokollerde optimal tanısal hassasiyet için önerildi. Bu dönemde, nokta-bakım testlerinin geliştirilmesi de hız kazandı ve hızlı antijen testleri, klinik ortamlarda giderek daha yaygın hale geldi.
Pandemik influenza A/H1N1’in karakterizasyonu, nazofaringeal örneklerden elde edilen viral genom dizilerinin analizine dayanıyordu. Filogenetik çalışmalar, virüsün kökenini ve evrimsel geçmişini aydınlattı ve küresel viral genomik sürveyans ağlarının kurulmasına yol açtı. Bu ağlar, günümüzde influenza ve diğer solunum yolu virüslerinin izlenmesinde temel araçlar olarak işlev görüyor.
COVID-19 Pandemisi ve Tanısal Kapasitenin Sınırlarının Zorlanması
2019’un sonlarında Çin’in Wuhan kentinde ortaya çıkan ve SARS-CoV-2 virüsünün neden olduğu COVID-19 pandemisi, nazofaringeal sürüntü yöntemini küresel bilincin merkezine taşıdı. Pandeminin ilk aylarında, Çinli bilim insanları hızla virüsü izole ettiler, genomunu dizillediler ve tanısal testler geliştirdiler. Christian Drosten ve Berlin’deki meslektaşları, Ocak 2020’de ilk validated RT-PCR protokolünü yayınladılar ve bu protokol, dünya çapında yaygın olarak benimsendi.
Nazofaringeal sürüntü, COVID-19 tanısında altın standart örnekleme yöntemi olarak hızla yerleşti. Pandeminin ölçeği, milyarlarca testin gerçekleştirilmesini gerektirdi ve bu talep, örnekleme araçları üretiminde benzeri görülmemiş bir genişlemeye yol açtı. Küresel tedarik zinciri baskıları, alternatif örnekleme yöntemlerinin araştırılmasını hızlandırdı ve anterior nazal sürüntü, tükürük ve gargaralama örnekleri sistematik olarak değerlendirildi.
Yale Üniversitesi’nden Anne Wyllie ve meslektaşları, tükürük örneklerinin tanısal performansını araştırdılar ve belirli senaryolarda nazofaringeal sürüntüye eşdeğer hassasiyet gösterdiğini rapor ettiler. Johns Hopkins Üniversitesi’nden araştırmacılar, nazofaringeal ve orofaringeal sürüntü kombinasyonlarının performansını analiz ettiler. Bu çalışmalar, örnekleme stratejilerinin optimizasyonunda ve kaynakların verimli kullanımında önemli bilgiler sağladı.
Pandeminin ilerleyen aşamalarında, kendi kendine örnekleme yöntemlerinin araştırılması hız kazandı. Birleşik Krallık’ta gerçekleştirilen geniş ölçekli çalışmalar, eğitimli bireylerin kendi nazofaringeal veya anterior nazal sürüntülerini alabileceğini ve kabul edilebilir tanısal doğruluk elde edilebildiğini gösterdi. Bu bulgular, toplum bazlı tarama programlarının tasarımında yeni olanaklar yarattı.
Viral Yük Dinamikleri ve Bulaşıcılık Araştırmaları
COVID-19 pandemisi, nazofaringeal örneklerden ölçülen viral yükün klinik ve epidemiyolojik önemi üzerine kapsamlı araştırmalara yol açtı. Almanya’daki Roman Wölfel ve meslektaşları, SARS-CoV-2 enfeksiyonunun erken dönemindeki viral yük kinetiklerini karakterize ettiler. Nazofaringeal örneklerde viral yükün, semptom başlangıcından hemen sonra pik yaptığını ve ardından progressif olarak azaldığını gösterdiler.
Harvard Üniversitesi’nden Michael Mina ve meslektaşları, viral yükün bulaşıcılıkla korelasyonunu araştırdılar ve belirli viral yük eşiklerinin bulaşma riski ile ilişkisini karakterize ettiler. Bu çalışmalar, izolasyon protokollerinin optimizasyonunda ve halk sağlığı stratejilerinin geliştirilmesinde önemli bilgiler sağladı. Döngü eşik değerlerinin yorumlanması, klinik ve epidemiyolojik karar verme süreçlerinde merkezi bir konu haline geldi.
Asemptomatik ve presemptomatik bulaşmanın önemi, nazofaringeal örnekleme ve tarama stratejileri açısından kritik bir boyut ekledi. İtalya’daki Vo kasabasında gerçekleştirilen kapsamlı tarama programı, tüm nüfusun nazofaringeal sürüntü ile test edilmesini içerdi ve asemptomatik enfeksiyonların prevalansını ortaya koydu. Bu bulgular, geniş ölçekli test stratejilerinin tasarımında ve pandemi kontrolünde etkili yaklaşımların belirlenmesinde önemli rol oynadı.
Hızlı Tanı Teknolojilerinin Gelişimi
COVID-19 pandemisi, nokta-bakım tanı teknolojilerinin gelişimini dramatik şekilde hızlandırdı. Geleneksel laboratuvar bazlı PCR testleri, yüksek hassasiyet sunmasına rağmen, merkezi laboratuvar altyapısı gerektirir ve sonuç süreleri saatler ila günler arasında değişebilir. Hızlı moleküler testler ve lateral akış antijen testlerinin geliştirilmesi, on beş dakika ila bir saat içinde sonuç alma kapasitesi sağladı.
Cepheid, Abbott ve diğer şirketler, tamamen otomatize edilmiş nokta-bakım PCR sistemleri geliştirdiler. Bu platformlar, nazofaringeal sürüntü örneklerinden otomatik nukleik asit ekstraksiyonu, amplifikasyonu ve tespiti gerçekleştirir. Binax-NOW, BD Veritor ve diğer lateral akış testleri, viral antijenlerin immünokromatografik tespitine dayalı hızlı tanı olanakları sağladı.
Hızlı antijen testlerinin performansı, viral yük ile yakından korelasyon gösterir. Yüksek viral yük senaryolarında, bu testler mükemmel duyarlılık gösterir ancak düşük viral yük durumlarında hassasiyet azalır. Cochrane meta-analizleri, hızlı antijen testlerinin semptomatik hastalarda ortalama yüzde seksenbeş duyarlılık gösterdiğini ancak asemptomatik bireylerde performansın düştüğünü ortaya koydu. Bu bulgular, hızlı testlerin uygun kullanım senaryolarının belirlenmesinde rehberlik sağladı.
Varyant Sürveyansı ve Genomik Epidemiyoloji
SARS-CoV-2’nin evrimsel dinamikleri, nazofaringeal örnekleme ve genomik sekanslamanın entegrasyonunu gerektirdi. İngiltere’de ortaya çıkan Alpha varyantı, Güney Afrika’daki Beta varyantı, Hindistan’daki Delta varyantı ve Omicron varyantının tanımlanması, sistematik genomik sürveyansa dayanıyordu. Bu sürveyans programları, nazofaringeal sürüntü örneklerinden elde edilen viral genomların yeni nesil dizileme teknolojileri ile analizini içeriyordu.
Sanger Institute ve Wellcome Trust’taki COVID-19 Genomics UK konsorsiyumu, dünya çapında en kapsamlı genomik sürveyans programlarından birini yürüttü. Haftalık yüzbinlerce örneğin dizilenmesi, varyantların erken tespitini ve epidemiyolojik karakterizasyonunu mümkün kıldı. Nazofaringeal örneklerden elde edilen yüksek kaliteli viral RNA, bu büyük ölçekli dizileme çalışmalarının temelini oluşturdu.
Varyant-spesifik PCR assaylerinin geliştirilmesi, belirli mutasyonların hızlı tespitini sağladı. S-gen target failure fenomeni, Omicron varyantının erken dönemde indirekt olarak tanınmasında kullanıldı. Bu yaklaşımlar, genomik dizileme kapaситesi sınırlı olan ortamlarda varyant sürveyansının sürdürülmesine olanak tanıdı.
Mikrobiyal Ekoloji ve Mikrobiom Araştırmaları
Nazofaringeal mikrobiomun karakterizasyonu, yirmi birinci yüzyılın ilk yirmi yılında önemli ilerleme kaydetti. Yeni nesil dizileme teknolojilerinin kültür-bağımsız mikrobiyal topluluk analizine uygulanması, nazofaringeal floranın karmaşıklığını ortaya çıkardı. 16S ribozomal RNA gen dizileme çalışmaları, yüzlerce bakteriyel türün bu anatomik nişte var olduğunu gösterdi.
National Institutes of Health’in İnsan Mikrobiom Projesi, çeşitli vücut bölgelerinden mikrobiyal toplulukları karakterize etti ve nazofarenks, önemli örnekleme bölgelerinden biriydi. Bu çalışmalar, sağlıklı bireylerde mikrobiom kompozisyonunun önemli bireyler arası varyabilite gösterdiğini ancak belirli dominant taksonların tutarlı olarak bulunduğunu ortaya koydu.
Mikrobiom-patojen etkileşimlerinin araştırılması, enfeksiyon duyarlılığının anlaşılmasında yeni perspektifler açtı. Streptococcus pneumoniae kolonizasyonunun, nazal mikrobiom kompozisyonu ile korelasyon gösterdiği ve belirli kommensal bakterilerin kolonizasyon direncine katkıda bulunduğu gösterildi. Bu bulgular, probiyotik yaklaşımların ve mikrobiom modülasyonunun potansiyelini vurguladı.
Çağdaş Yaklaşımlar ve Gelecek Yönelimleri
Günümüzde, nazofaringeal örnekleme teknolojisi ve uygulamaları gelişmeye devam ediyor. Mikrofluidik sistemler, minimal örnek hacimlerinden hızlı ve hassas tanı sağlama potansiyeli sunuyor. CRISPR bazlı tanı platformları, SHERLOCK ve DETECTR gibi sistemler, izothermal amplifikasyon ve CRISPR-Cas enzimatik aktivitesini birleştirerek hızlı ve yüksek özgüllükte tanı olanakları yaratıyor.
Yapay zeka ve makine öğrenmesi algoritmalarının tanısal yorumlamaya entegrasyonu, kompleks veri setlerinin analizinde yeni olanaklar sağlıyor. Viral yük kinetiklerinin, klinik semptomların ve diğer biyobelirteçlerin entegre analizine dayalı prediktif modeller, hastalık seyrinin tahmininde ve kişiselleştirilmiş tedavi stratejilerinin geliştirilmesinde umut vaat ediyor.
Evde kullanım için tasarlanan tanı cihazlarının gelişimi, nazofaringeal örneklemenin daha geniş kitlelere ulaşmasını sağlıyor. Akıllı telefon bazlı okuma sistemleri, lateral akış testlerinin sonuçlarının objektif olarak yorumlanmasına olanak tanıyor ve dijital sağlık kayıtları ile entegrasyonu kolaylaştırıyor. Bu teknolojiler, halk sağlığı sürveyansında ve bireysel sağlık yönetiminde devrim yaratma potansiyeline sahip.
Nazofaringeal sürüntü yönteminin yüz elli yıllık tarihi, bilimsel merakın, teknolojik yeniliğin ve klinik ihtiyacın kesişiminde ilerleyen büyüleyici bir hikâyedir. Basit bakteriyolojik kültür çalışmalarından sofistike moleküler tanı platformlarına, bu yöntem sürekli evrilmiş ve her yeni pandemi ile yeniden şekillenmiştir. Gelecekte, daha az invaziv, daha hızlı ve daha erişilebilir tanı yöntemlerinin ortaya çıkması beklenmektedir ancak nazofaringeal bölgenin solunum yolu enfeksiyonlarının tanısındaki merkezi rolü, bilimsel kanıtlarla sağlam bir şekilde kurulmuştur ve önümüzdeki yıllarda da korunacaktır.
İleri Okuma
- Pasteur, L. (1861). Mémoire sur les corpuscules organisés qui existent dans l’atmosphère. Annales des Sciences Naturelles, 16, 5-98.
- Koch, R. (1876). Die Ätiologie der Milzbrand-Krankheit, begründet auf die Entwicklungsgeschichte des Bacillus anthracis. Beiträge zur Biologie der Pflanzen, 2, 277-310.
- Koch, R. (1882). Die Ätiologie der Tuberkulose. Berliner Klinische Wochenschrift, 19, 221-230.
- Klebs, E. (1883). Über Diphtherie. Verhandlungen des Kongresses für Innere Medizin, 2, 139-154.
- Loeffler, F. (1884). Untersuchungen über die Bedeutung der Mikroorganismen für die Entstehung der Diphtherie. Mittheilungen aus dem Kaiserlichen Gesundheitsamte, 2, 421-499.
- Ivanovsky, D. (1892). Über die Mosaikkrankheit der Tabakspflanze. St. Petersburg Academy of Sciences Bulletin, 35, 67-70.
- Bordet, J., & Gengou, O. (1906). Le microbe de la coqueluche. Annales de l’Institut Pasteur, 20, 731-741.
- Smith, W., Andrewes, C.H., & Laidlaw, P.P. (1933). A virus obtained from influenza patients. Lancet, 222(5732), 66-68.
- Stanley, W.M. (1935). Isolation of a crystalline protein possessing the properties of tobacco-mosaic virus. Science, 81(2113), 644-645.
- Francis, T., & Magill, T.P. (1935). Immunological studies with the virus of influenza. Journal of Experimental Medicine, 62(4), 505-516.
- Hirst, G.K. (1941). The agglutination of red cells by allantoic fluid of chick embryos infected with influenza virus. Science, 94(2427), 22-23.
- Enders, J.F., Weller, T.H., & Robbins, F.C. (1949). Cultivation of the Lansing strain of poliomyelitis virus in cultures of various human embryonic tissues. Science, 109(2822), 85-87.
- Dulbecco, R. (1952). Production of plaques in monolayer tissue cultures by single particles of an animal virus. Proceedings of the National Academy of Sciences, 38(8), 747-752.
- Chanock, R., Roizman, B., & Myers, R. (1957). Recovery from infants with respiratory illness of a virus related to chimpanzee coryza agent (CCA). I. Isolation, properties and characterization. American Journal of Hygiene, 66(3), 281-290.
- Tyrrell, D.A., & Bynoe, M.L. (1965). Cultivation of a novel type of common-cold virus in organ cultures. British Medical Journal, 1(5448), 1467-1470.
- Hamre, D., & Procknow, J.J. (1966). A new virus isolated from the human respiratory tract. Proceedings of the Society for Experimental Biology and Medicine, 121(1), 190-193.
- McIntosh, K., Dees, J.H., Becker, W.B., Kapikian, A.Z., & Chanock, R.M. (1967). Recovery in tracheal organ cultures of novel viruses from patients with respiratory disease. Proceedings of the National Academy of Sciences, 57(4), 933-940.
- Kapikian, A.Z., James, H.D., Kelly, S.J., Dees, J.H., Turner, H.C., McIntosh, K., Kim, H.W., Parrott, R.H., Vincent, M.M., & Chanock, R.M. (1969). Isolation from man of “avian infectious bronchitis virus-like” viruses (coronaviruses) similar to 229E virus, with some epidemiological observations. Journal of Infectious Diseases, 119(3), 282-290.
- Saiki, R.K., Scharf, S., Faloona, F., Mullis, K.B., Horn, G.T., Erlich, H.A., & Arnheim, N. (1985). Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science, 230(4732), 1350-1354.
- Mullis, K., Faloona, F., Scharf, S., Saiki, R., Horn, G., & Erlich, H. (1986). Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harbor Symposia on Quantitative Biology, 51, 263-273.
- Saiki, R.K., Gelfand, D.H., Stoffel, S., Scharf, S.J., Higuchi, R., Horn, G.T., Mullis, K.B., & Erlich, H.A. (1988). Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science, 239(4839), 487-491.
- Mullis, K.B. (1990). The unusual origin of the polymerase chain reaction. Scientific American, 262(4), 56-65.
- Holland, P.M., Abramson, R.D., Watson, R., & Gelfand, D.H. (1991). Detection of specific polymerase chain reaction product by utilizing the 5′—-3′ exonuclease activity of Thermus aquaticus DNA polymerase. Proceedings of the National Academy of Sciences, 88(16), 7276-7280.
- Heid, C.A., Stevens, J., Livak, K.J., & Williams, P.M. (1996). Real time quantitative PCR. Genome Research, 6(10), 986-994.
- Peiris, J.S., Lai, S.T., Poon, L.L., Guan, Y., Yam, L.Y., Lim, W., Nicholls, J., Yee, W.K., Yan, W.W., Cheung, M.T., Cheng, V.C., Chan, K.H., Tsang, D.N., Yung, R.W., Ng, T.K., & Yuen, K.Y. (2003). Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet, 361(9366), 1319-1325.
- Drosten, C., Günther, S., Preiser, W., van der Werf, S., Brodt, H.R., Becker, S., Rabenau, H., Panning, M., Kolesnikova, L., Fouchier, R.A., Berger, A., Burguière, A.M., Cinatl, J., Eickmann, M., Escriou, N., Grywna, K., Kramme, S., Manuguerra, J.C., Müller, S., Rickerts, V., Stürmer, M., Vieth, S., Klenk, H.D., Osterhaus, A.D., Schmitz, H., & Doerr, H.W. (2003). Identification of a novel coronavirus in patients with severe acute respiratory syndrome. New England Journal of Medicine, 348(20), 1967-1976.
- Sung, J.J., Wu, A., Joynt, G.M., Yuen, K.Y., Lee, N., Chan, P.K., Cockram, C.S., Ahuja, A.T., Yu, L.M., & Wong, V.W. (2004). Severe acute respiratory syndrome: report of treatment and outcome after a major outbreak. Thorax, 59(5), 414-420.
- Chan, K.H., Poon, L.L., Cheng, V.C., Guan, Y., Hung, I.F., Kong, J., Yam, L.Y., Seto, W.H., Yuen, K.Y., & Peiris, J.S. (2004). Detection of SARS coronavirus in patients with suspected SARS. Emerging Infectious Diseases, 10(2), 294-299.
- Dawood, F.S., Jain, S., Finelli, L., Shaw, M.W., Lindstrom, S., Garten, R.J., Gubareva, L.V., Xu, X., Bridges, C.B., & Uyeki, T.M. (2009). Emergence of a novel swine-origin influenza A (H1N1) virus in humans. New England Journal of Medicine, 360(25), 2605-2615.
- CDC. (2009). Novel H1N1 influenza diagnostic and surveillance considerations for clinicians and public health officials. Morbidity and Mortality Weekly Report, 58(RR-9), 1-8.
- Garten, R.J., Davis, C.T., Russell, C.A., Shu, B., Lindstrom, S., Balish, A., Sessions, W.M., Xu, X., Skepner, E., Deyde, V., Okomo-Adhiambo, M., Gubareva, L., Barnes, J., Smith, C.B., Emery, S.L., Hillman, M.J., Rivailler, P., Smagala, J., de Graaf, M., Burke, D.F., Fouchier, R.A., Pappas, C., Alpuche-Aranda, C.M., López-Gatell, H., Olivera, H., López, I., Myers, C.A., Faix, D., Blair, P.J., Yu, C., Keene, K.M., Dotson, P.D., Boxrud, D., Sambol, A.R., Abid, S.H., St George, K., Bannerman, T., Moore, A.L., Stringer, D.J., Blevins, P., Demmler-Harrison, G.J., Ginsberg, M., Kriner, P., Waterman, S., Smole, S., Guevara, H.F., Belongia, E.A., Clark, P.A., Beatrice, S.T., Donis, R., Katz, J., Finelli, L., Bridges, C.B., Shaw, M., Jernigan, D.B., Uyeki, T.M., Smith, D.J., Klimov, A.I., & Cox, N.J. (2009). Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans. Science, 325(5937), 197-201.
- Corman, V.M., Landt, O., Kaiser, M., Molenkamp, R., Meijer, A., Chu, D.K., Bleicker, T., Brünink, S., Schneider, J., Schmidt, M.L., Mulders, D.G., Haagmans, B.L., van der Veer, B., van den Brink, S., Wijsman, L., Goderski, G., Romette, J.L., Ellis, J., Zambon, M., Peiris, M., Goossens, H., Reusken, C., Koopmans, M.P., & Drosten, C. (2020). Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Eurosurveillance, 25(3), 2000045.
- Zhu, N., Zhang, D., Wang, W., Li, X., Yang, B., Song, J., Zhao, X., Huang, B., Shi, W., Lu, R., Niu, P., Zhan, F., Ma, X., Wang, D., Xu, W., Wu, G., Gao, G.F., & Tan, W. (2020). A novel coronavirus from patients with pneumonia in China, 2019. New England Journal of Medicine, 382(8), 727-733.
- Zhou, P., Yang, X.L., Wang, X.G., Hu, B., Zhang, L., Zhang, W., Si, H.R., Zhu, Y., Li, B., Huang, C.L., Chen, H.D., Chen, J., Luo, Y., Guo, H., Jiang, R.D., Liu, M.Q., Chen, Y., Shen, X.R., Wang, X., Zheng, X.S., Zhao, K., Chen, Q.J., Deng, F., Liu, L.L., Yan, B., Zhan, F.X., Wang, Y.Y., Xiao, G.F., & Shi, Z.L. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 579(7798), 270-273.
- Wölfel, R., Corman, V.M., Guggemos, W., Seilmaier, M., Zange, S., Müller, M.A., Niemeyer, D., Jones, T.C., Vollmar, P., Rothe, C., Hoelscher, M., Bleicker, T., Brünink, S., Schneider, J., Ehmann, R., Zwirglmaier, K., Drosten, C., & Wendtner, C. (2020). Virological assessment of hospitalized patients with COVID-2019. Nature, 581(7809), 465-469.
- To, K.K., Tsang, O.T., Leung, W.S., Tam, A.R., Wu, T.C., Lung, D.C., Yip, C.C., Cai, J.P., Chan, J.M., Chik, T.S., Lau, D.P., Choi, C.Y., Chen, L.L., Chan, W.M., Chan, K.H., Ip, J.D., Ng, A.C., Poon, R.W., Luo, C.T., Cheng, V.C., Chan, J.F., Hung, I.F., Chen, Z., Chen, H., & Yuen, K.Y. (2020). Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infectious Diseases, 20(5), 565-574.
- Wyllie, A.L., Fournier, J., Casanovas-Massana, A., Campbell, M., Tokuyama, M., Vijayakumar, P., Warren, J.L., Geng, B., Muenker, M.C., Moore, A.J., Vogels, C.B., Petrone, M.E., Ott, I.M., Lu, P., Venkataraman, A., Lu-Culligan, A., Klein, J., Earnest, R., Simonov, M., Datta, R., Handoko, R., Naushad, N., Sewanan, L.R., Valdez, J., White, E.B., Lapidus, S., Kalinich, C.C., Jiang, X., Kim, D.J., Kudo, E., Linehan, M., Mao, T., Moriyama, M., Oh, J.E., Park, A., Silva, J., Song, E., Takahashi, T., Taura, M., Weizman, O.E., Wong, P., Yang, Y., Bermejo, S., Odio, C.D., Omer, S.B., Dela Cruz, C.S., Farhadian, S., Martinello, R.A., Iwasaki, A., Grubaugh, N.D., & Ko, A.I. (2020). Saliva or nasopharyngeal swab specimens for detection of SARS-CoV-2. New England Journal of Medicine, 383(13), 1283-1286.
- Vogels, C.B., Brito, A.F., Wyllie, A.L., Fauver, J.R., Ott, I.M., Kalinich, C.C., Petrone, M.E., Casanovas-Massana, A., Catherine Muenker, M., Moore, A.J., Klein, J., Lu, P., Lu-Culligan, A., Jiang, X., Kim, D.J., Kudo, E., Mao, T., Moriyama, M., Oh, J.E., Park, A., Silva, J., Song, E., Takahashi, T., Taura, M., Tokuyama, M., Venkataraman, A., Weizman, O.E., Wong, P., Yang, Y., Cheemarla, N.R., White, E.B., Lapidus, S., Earnest, R., Geng, B., Vijayakumar, P., Odio, C., Fournier, J., Bermejo, S., Farhadian, S., Dela Cruz, C.S., Iwasaki, A., Ko, A.I., Landry, M.L., Foxman, E.F., & Grubaugh, N.D. (2020). Analytical sensitivity and efficiency comparisons of SARS-CoV-2 RT-qPCR primer-probe sets. Nature Microbiology, 5(10), 1299-1305.
- Mina, M.J., Parker, R., & Larremore, D.B. (2020). Rethinking Covid-19 test sensitivity — a strategy for containment. New England Journal of Medicine, 383(22), e120.
- He, X., Lau, E.H., Wu, P., Deng, X., Wang, J., Hao, X., Lau, Y.C., Wong, J.Y., Guan, Y., Tan, X., Mo, X., Chen, Y., Liao, B., Chen, W., Hu, F., Zhang, Q., Zhong, M., Wu, Y., Zhao, L., Zhang, F., Cowling, B.J., Li, F., & Leung, G.M. (2020). Temporal dynamics in viral shedding and transmissibility of COVID-19. Nature Medicine, 26(5), 672-675.
- Lavezzo, E., Franchin, E., Ciavarella, C., Cuomo-Dannenburg, G., Barzon, L., Del Vecchio, C., Rossi, L., Manganelli, R., Loregian, A., Navarin, N., Abate, D., Sciro, M., Merigliano, S., De Canale, E., Vanuzzo, M.C., Besutti, V., Saluzzo, F., Onelia, F., Pacenti, M., Parisi, S.G., Carretta, G., Donato, D., Flor, L., Cocchio, S., Masi, G., Sperduti, A., Cattarino, L., Salvador, R., Nicoletti, M., Caldart, F., Castelli, G., Nieddu, E., Labella, B., Fava, L., Drigo, M., Gaythorpe, K.A., Brazzale, A.R., Toppo, S., Trevisan, M., Baldo, V., Donnelly, C.A., Ferguson, N.M., Dorigatti, I., & Crisanti, A. (2020). Suppression of a SARS-CoV-2 outbreak in the Italian municipality of Vo’. Nature, 584(7821), 425-429.
- Dinnes, J., Deeks, J.J., Berhane, S., Taylor, M., Adriano, A., Davenport, C., Dittrich, S., Emperador, D., Takwoingi, Y., Cunningham, J., Beese, S., Domen, J., Dretzke, J., Ferrante di Ruffano, L., Harris, I.M., Price, M.J., Taylor-Phillips, S., Hooft, L., Leeflang, M.M., McInnes, M.D., Spijker, R., Van den Bruel, A., & Cochrane COVID-19 Diagnostic Test Accuracy Group. (2021). Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection. Cochrane Database of Systematic Reviews, 3(3), CD013705.
- Rambaut, A., Holmes, E.C., O’Toole, Á., Hill, V., McCrone, J.T., Ruis, C., du Plessis, L., & Pybus, O.G. (2020). A dynamic nomenclature proposal for SARS-CoV-2 lineages to assist genomic epidemiology. Nature Microbiology, 5(11), 1403-1407.
- Davies, N.G., Abbott, S., Barnard, R.C., Jarvis, C.I., Kucharski, A.J., Munday, J.D., Pearson, C.A., Russell, T.W., Tully, D.C., Washburne, A.D., Wenseleers, T., Gimma, A., Waites, W., Wong, K.L., van Zandvoort, K., Silverman, J.D., CMMID COVID-19 Working Group, COVID-19 Genomics UK (COG-UK) Consortium, Diaz-Ordaz, K., Keogh, R., Eggo, R.M., Funk, S., Jit, M., Atkins, K.E., & Edmunds, W.J. (2021). Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. Science, 372(6538), eabg3055.
- Tegally, H., Wilkinson, E., Giovanetti, M., Iranzadeh, A., Fonseca, V., Giandhari, J., Doolabh, D., Pillay, S., San, E.J., Msomi, N., Mlisana, K., von Gottberg, A., Walaza, S., Allam, M., Ismail, A., Mohale, T., Glass, A.J., Engelbrecht, S., Van Zyl, G., Preiser, W., Petruccione, F., Sigal, A., Hardie, D., Marais, G., Hsiao, N.Y., Korsman, S., Davies, M.A., Tyers, L., Mudau, I., York, D., Maslo, C., Goedhals, D., Abrahams, S., Laguda-Akingba, O., Alisoltani-Dehkordi, A., Godzik, A., Wibmer, C.K., Sewell, B.T., Lourenço, J., Alcantara, L.C., Kosakovsky Pond, S.L., Weaver, S., Martin, D., Lessells, R.J., Bhiman, J.N., Williamson, C., & de Oliveira, T. (2021). Detection of a SARS-CoV-2 variant of concern in South Africa. Nature, 592(7854), 438-443.
- Mlcochova, P., Kemp, S.A., Dhar, M.S., Papa, G., Meng, B., Ferreira, I.A., Datir, R., Collier, D.A., Albecka, A., Singh, S., Pandey, R., Brown, J., Zhou, J., Goonawardane, N., Mishra, S., Whittaker, C., Mellan, T., Marwal, R., Datta, M., Sengupta, S., Ponnusamy, K., Radhakrishnan, V.S., Abdullahi, A., Charles, O., Chattopadhyay, P., Devi, P., Caputo, D., Peacock, T., Wattal, C., Goel, N., Satwik, A., Vaishya, R., Agarwal, M., Indian SARS-CoV-2 Genomics Consortium (INSACOG), Genotype to Phenotype Japan (G2P-Japan) Consortium, CITIID-NIHR BioResource COVID-19 Collaboration, Mavousian, A., Lee, J.H., Bassi, J., Silacci-Fegni, C., Saliba, C., Pinto, D., Irie, T., Yoshida, I., Hamilton, W.L., Sato, K., Bhatt, S., Flaxman, S., James, L.C., Corti, D., Piccoli, L., Barclay, W.S., Rakshit, P., Agrawal, A., & Gupta, R.K. (2021). SARS-CoV-2 B.1.617.2 Delta variant replication and immune evasion. Nature, 599(7883), 114-119.
- Viana, R., Moyo, S., Amoako, D.G., Tegally, H., Scheepers, C., Althaus, C.L., Anyaneji, U.J., Bester, P.A., Boni, M.F., Chand, M., Choga, W.T., Colquhoun, R., Davids, M., Deforche, K., Doolabh, D., du Plessis, L., Engelbrecht, S., Everatt, J., Giandhari, J., Giovanetti, M., Hardie, D., Hill, V., Hsiao, N.Y., Iranzadeh, A., Ismail, A., Joseph, C., Joseph, R., Koopile, L., Kosakovsky Pond, S.L., Kraemer, M.U., Kuate-Lere, L., Laguda-Akingba, O., Lesetedi-Mafoko, O., Lessells, R.J., Lockman, S., Lucaci, A.G., Maharaj, A., Mahlangu, B., Maponga, T., Mahlakwane, K., Makatini, Z., Marais, G., Maruapula, D., Masupu, K., Matshaba, M., Mayaphi, S., Mbhele, N., Mbulawa, M.B., Mendes, A., Mlisana, K., Mnguni, A., Mohale, T., Moir, M., Moruisi, K., Mosepele, M., Motsatsi, G., Motswaledi, M.S., Mphoyakgosi, T., Msomi, N., Mwangi, P.N., Naidoo, Y., Ntuli, N., Nyaga, M., Olubayo, L., Pillay, S., Radibe, B., Ramphal, Y., Ramphal, U., San, J.E., Scott, L., Shapiro, R., Singh, L., Smith-Lawrence, P., Stevens, W., Strydom, A., Subramoney, K., Tebeila, N., Tshiabuila, D., Tsui, J., van Wyk, S., Weaver, S., Wibmer, C.K., Wilkinson, E., Wolter, N., Zarebski, A.E., Zuze, B., Goedhals, D., Preiser, W., Treurnicht, F., Venter, M., Williamson, C., Pybus, O.G., Bhiman, J., Glass, A., Martin, D.P., Rambaut, A., Gaseitsiwe, S., von Gottberg, A., & de Oliveira, T. (2022). Rapid epidemic expansion of the SARS-CoV-2 Omicron variant in southern Africa. Nature, 603(7902), 679-686.
- Greaney, A.J., Loes, A.N., Crawford, K.H., Starr, T.N., Malone, K.D., Chu, H.Y., & Bloom, J.D. (2021). Comprehensive mapping of mutations in the SARS-CoV-2 receptor-binding domain that affect recognition by polyclonal human plasma antibodies. Cell Host & Microbe, 29(3), 463-476.
- Kinloch, N.N., Ritchie, G., Brumme, C.J., Dong, W., Dong, W., Lawson, T., Jones, R.B., Montaner, J.S., Leung, V., Romney, M.G., Stefanovic, A., Matic, N., Lowe, C.F., Brumme, Z.L., & COVIDSeq Consortium. (2020). Suboptimal biological sampling as a probable cause of false-negative COVID-19 diagnostic test results. Journal of Infectious Diseases, 222(6), 899-902.
- Man, W.H., de Steenhuijsen Piters, W.A., & Bogaert, D. (2017). The microbiota of the respiratory tract: gatekeeper to respiratory health. Nature Reviews Microbiology, 15(5), 259-270.
- Biesbroek, G., Tsivtsivadze, E., Sanders, E.A., Montijn, R., Veenhoven, R.H., Keijser, B.J., & Bogaert, D. (2014). Early respiratory microbiota composition determines bacterial succession patterns and respiratory health in children. American Journal of Respiratory and Critical Care Medicine, 190(11), 1283-1292.
- Petersen, E., Koopmans, M., Go, U., Hamer, D.H., Petrosillo, N., Castelli, F., Storgaard, M., Al Khalili, S., & Simonsen, L. (2020). Comparing SARS-CoV-2 with SARS-CoV and influenza pandemics. Lancet Infectious Diseases, 20(9), e238-e244.