
Alzheimer hastalığı ile ilgili en son gelişmede, EPFL’den (Ecole Polytechnique Fédérale de Lausanne) bilim insanları, hastanın bağışıklık sistemini hastalığa karşı uyarabilen implant edilebilir (yerleştirilebilir) kapsül üretmeyi başardıklarını açıkladı.
Alzheimer hastalığının gelişimi ile ilgili hipotezlerden birisine göre, hastalığın sebeplerinden birisi amiloid beta (amyloid-β) proteininin beynin farklı yerlerden aşırı birikmesidir. Bunun sonucunda da nöronlar için zehirli (toksik) etkiler gösteren protein plakların oluşmasına sebep olmaktadır.
Bu plaklarla baş etmenin en etkili yöntemi amiloid-β proteinlerini hedefleyip onlara bağlanabilecek antikorları kullanmaktır. Çünkü antikorlar bağışıklık sistemini, kendi bağlandıkları şeye saldırıp yok etmeleri için uyarabilmektedir. Bu tedavi biçiminden maksimum verimlilik sağlamak için ilk bilişsel düşüşlerin yaşanmasından daha önce uygulanması gerektiği düşünülüyor. Böylelikle Alzheimer hastalığının öncülü olabilecek bilişsel yetenek azalmaları, demansiya gibi rahatsızlıklar dahi, plak oluşumu engelleneceği için önlenebilir olacaktır. Ne var ki, bu terapi üst üste aşı enjeksiyonları uygulanmasını gerektirdiğinden belirli yan etkiler üretebiliyor.
Şimdi ise EPFL’den bilim insanları antikorları sürekli iğnelerle deri altına vermek yerine, sürekli ve güvenli biçimde hastanın beyninin içine antikorları salgılayabilecek implant geliştirmeyi başardı ve bulgularını Brain dergisinde yayımladı.
Patrick Aebischer’in EPFL’deki laboratuvarında amiloid-β’ya karşı antikorlar üretmek üzere genetik olarak modifiye edilmiş hücreleri barındıran kapsüller üretildi. Derinin altındaki dokuya yerleştirilen kapsüllerden, kan dolaşımının içine sürekli biçimde kapsülün içindeki hücreler tarafında sentezlenen antikorlar salınıyor. Bu antikorlar daha sonra kan-beyin bariyerini (blood-brain barrier) aşarak hedefleri olan amiloid-β plaklarına ulaşıyorlar.
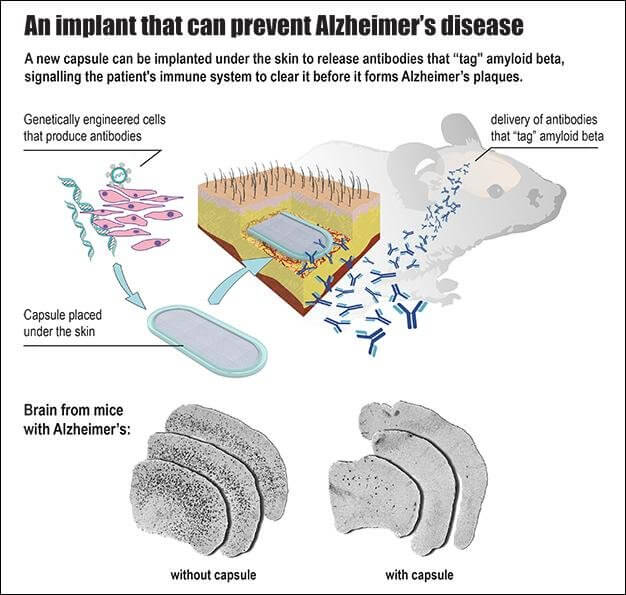
Kapsülün temeli 2014 yılında Aebischer’in laboratuvarında yayımlanan dizayna dayanıyor. Birbirine polipropilen film ile tutturulan iki geçirgen zardan oluşan kapsül makrokapsülleme cihazı (ing. macroencapsulation device) olarak anılıyor. Kapsülün toplam uzunluğu 27 milimetre, eni 12 milimetre ve kalınlığı 1.2 milimetre ve hücre büyümesini kolaylaştıran hidrojel barındırıyor.
Kapsülün içindeki hücreler ise çok büyük bir önem arz ediyor. Bu hücrelerin hem antikorları üretebilmeleri gerekiyor hem de yerleştirildikleri canlının bağışıklık sistemini kendi üzerlerine çekmemek için o bireye biyolojik olarak uyumlu olmaları gerekiyor. Bu ikinci sorun her transplant işleminde aşılması gereken bir sorundur. Tam da bu noktada kapsülün zarları devreye giriyor ve hücreler için bireyin bağışıklık sistemine karşı bir kalkan görevi görüyor. Bu koruma sayesinde bir tek donörden alınacak hücreler birden fazla hasta için kullanılabilir hale geliyor.
Kapsülün içine yerleştirilmeden önce hücreler, özel olarak amiloid-β proteinlerini tanıyarak hedefleyebilecek antikorları (savunma molekülleri) üretmek üzere genetik olarak modifiye ediliyor. Bu hücreler tercihen kas dokusundan alınıyor ve dışlarını kaplayan geçirgen zar, kapsülün çevresinden gerekli olan besinlerin ve moleküllerin kapsül içine alınmasını sağlıyor.
Fareler üzerinde test edilen mini-cihaz büyük bir başarı gösterdi. Alzheimer hastalığını simüle edecek biçimde üretilen fareler üzerinde yapılan deneylerde, beyindeki amiloid-β plaklarında ciddi bir azalma gözlemlendi. Dahası, 39 haftalık süre boyunca kapsülden yayılan antikorlar sayesinde beyinde daha fazla amiloid-β plağı oluşmadığı tespit edildi. Tedavi sayesinde ayrıca, Alzheimer’ın işaretlerinden biri olan amiloid-tau proteininin fosforilasyonunda da azalma görüldü.
Bağışıklık sistemini; güvenli, sağlıklı ve sürekli biçimde antikorlar vererek uyarmayı ve bu yolla da Alzheimer hastalığının biyoişaretlerinin miktarlarında azalmayı sağlayan bu yöntemin, diğer nörodejeneratif hastalıkların tedavisinde de kullanılabileceği öngörülüyor.
Kaynak :
- Bilimfili,
- Aurélien Lathuilière, Vanessa Laversenne, Alberto Astolfo, Erhard Kopetzki, Helmut Jacobsen, Marco Stampanoni, Bernd Bohrmann, Bernard L. Schneider, Patrick Aebischer. A subcutaneous cellular implant for passive immunization against amyloid-β reduces brain amyloid and tau pathologies. Brain, 2016; aww036 DOI:10.1093/brain/aww036




 Yeni yapılan bir araştırmaya göre; erkek ve kadın beyinleri farklı şekilde yaşlanıyor ve bu durum erkeklerin neden Parkinson’a ve kadınların da Alzheimer’a daha müsait olduğunu açıklayabilir.
Yeni yapılan bir araştırmaya göre; erkek ve kadın beyinleri farklı şekilde yaşlanıyor ve bu durum erkeklerin neden Parkinson’a ve kadınların da Alzheimer’a daha müsait olduğunu açıklayabilir.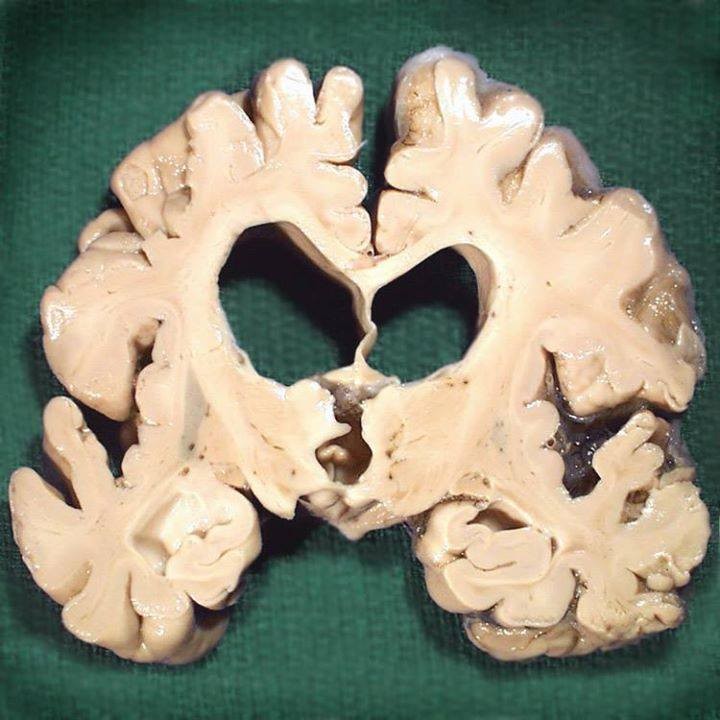




 Kalsiyumun eşik bekçisi IP3R‘nin yapısınınatomik ölçekteki yeni görüntüleri, bu gizemi çözmek için yeni bir adım olabilir ve kanal bozukluklarıyla alakalı pek çok hastalığın tedavisine olanak sağlayabilir.
Kalsiyumun eşik bekçisi IP3R‘nin yapısınınatomik ölçekteki yeni görüntüleri, bu gizemi çözmek için yeni bir adım olabilir ve kanal bozukluklarıyla alakalı pek çok hastalığın tedavisine olanak sağlayabilir.
Yorum yazabilmek için oturum açmalısınız.