Tanım ve Kavramsal Çerçeve
Amfolit (amfoterik elektrolit), sulu çözeltide hem proton verebilen (Brønsted–Lowry asidi) hem de proton alabilen (Brønsted–Lowry bazı) kimyasal türdür. “İki yönlü çözünme/tepkime” yeteneği, ortam pH’ına bağlı olarak aynı maddenin asidik ya da bazik davranış sergilemesine olanak tanır. Bu çift yönlülük, biyolojik sistemlerde tamponlama, yük dengesi, enzimatik aktivite ve taşınım gibi süreçlerin incelikle ayarlanmasının temelidir.
Amfolitler molekül seviyesinde çoğunlukla zayıf asidik ve zayıf bazik fonksiyonel gruplar birlikte içerir: α-karboksil (–COOH/–COO⁻), α-amino (–NH₃⁺/–NH₂), imidazol, fenolik hidroksil, guanidinyum, sülfhidril, fosfat vb. Bu grupların pKₐ değerleri ve birbirlerine göre konumları, maddenin farklı pH’larda ne kadar protonlanacağını ve dolayısıyla net yükünü belirler.
Amfoterik Davranışın Asit–Baz Temeli
Bir amfolitin genelleştirilmiş proton verme–alma denklikleri:
- Asit gibi davranış: HA ⇌ H⁺ + A⁻
- Baz gibi davranış: B + H₂O ⇌ BH⁺ + OH⁻
Bu iki denge aynı tür için, pH’a bağlı olarak eşzamanlı ve rekabetçi biçimde işler. Çözelti pH’ı, Henderson–Hasselbalch ilişkisiyle amfolitin protonlanma derecelerini belirler. Çok fonksiyonlu (poliprotik) türlerde ardışık pKₐ değerleri (pKₐ₁, pKₐ₂, …) üzerinden adım adım türleşme (speciation) izlenir.
Örnek Amfolit Sistemleri
Su (H₂O)
Su, hem H⁺ verebilir (zayıf asit) hem de H⁺ alabilir (zayıf baz):
- Asidik: 2 H₂O ⇌ H₃O⁺ + OH⁻
- Bazik: H₂O + HA ⇌ H₃O⁺ + A⁻
Bu nedenle su amfoterik bir çözücüdür ve biyolojik sıvılarda asit–baz dengesinin evrensel arka planını oluşturur.
Bikarbonat (HCO₃⁻)
Bikarbonat karbonik asit–karbonat sisteminin amfolitidir:
- Asit gibi: HCO₃⁻ ⇌ H⁺ + CO₃²⁻
- Baz gibi: HCO₃⁻ + H⁺ ⇌ H₂CO₃ (⇌ CO₂ + H₂O)
Bikarbonat, kan plazmasının başlıca tamponu olup solunum (CO₂ atılımı) ve böbrek (H⁺ atımı/HCO₃⁻ geri emilimi) fonksiyonlarıyla entegre çalışır.
Fosfat Türleri (H₂PO₄⁻ / HPO₄²⁻)
Fosforik asit poliprotiktir: H₃PO₄ ⇌ H₂PO₄⁻ ⇌ HPO₄²⁻ ⇌ PO₄³⁻.
Burada H₂PO₄⁻ ve HPO₄²⁻ amfolit gibi davranabilir:
- H₂PO₄⁻ (asit): H₂PO₄⁻ ⇌ H⁺ + HPO₄²⁻
- HPO₄²⁻ (baz): HPO₄²⁻ + H⁺ ⇌ H₂PO₄⁻
Fosfat tamponu intracellular pH düzenlenmesinde ve idrarın titrasyon asitliğinde önemlidir. Klinik asit–baz değerlendirmesinde, fosfat tamponunun katkısı özellikle kronik böbrek hastalığı ve tübüler asidoz tablolarında öne çıkar.
Hidrojenfosfat (HPO₄²⁻) – Örnek
İfadelerde sıkça rastlanan “H(PO₄)(–2)” yazımı, pratikte HPO₄²⁻’e karşılık gelir. HPO₄²⁻, proton alarak H₂PO₄⁻’e dönüşebilir (baz davranışı) veya daha bazik koşullarda proton vererek PO₄³⁻ oluşturabilir (asit davranışı).
Amino Asitler, Proteinler ve Zwitteriyonlar
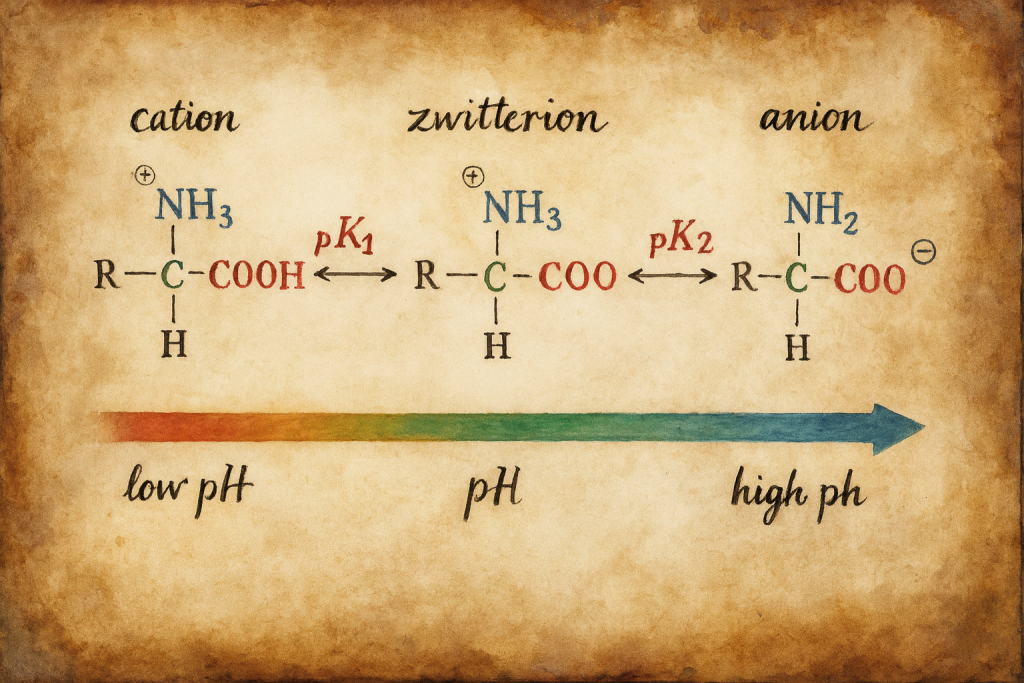
Amino asitler, fizyolojik pH yakınında amfolit özelliklerinin en belirgin örnekleridir. Tipik bir α-amino asitte:
- –COOH ⇌ –COO⁻ + H⁺ (asidik grup)
- –NH₃⁺ ⇌ –NH₂ + H⁺ (bazik grup)
pH belirli bir aralıkta –NH₃⁺ ve –COO⁻ gruplarının aynı molekülde eşzamanlı bulunmasına yol açar. Bu çift yüklü fakat net elektriksel yükü sıfır hâle zwitteriyon (dipolar iyon) denir. “Dahili tuz oluşumu” olarak da anılan bu durum, çözünürlük, iyonik etkileşimler, elektrik alan altındaki hareketlilik (elektroforez) ve enzim–substrat tanıma için belirleyicidir.
Proteinler; yan zincirlerdeki asidik (Asp, Glu), bazik (Lys, Arg, His) ve zayıf asidik/bazik (Tyr, Cys vb.) gruplar sayesinde çok merkezli amfolit gibi davranır. Bu, proteinlerin:
- İzoelektrik noktasını (pI; net yükün sıfır olduğu pH) belirler,
- Çökelme/çözünme davranışını etkiler (örn. pI civarında minimum çözünürlük),
- Yüzey yük dağılımı ve etkileşim ağları üzerinden katlanma ve kompleksleşmeyi şekillendirir,
- İzolektrik odaklama (IEF) gibi ayırma tekniklerinde keskin bantlar hâlinde odaklanmalarına imkân verir.
İzoelektrik Nokta (pI) ve Türleşme
Bir amfolitin pI’ı, ardışık pKₐ değerlerinin uygun ortalamasıyla (basit iki fonksiyonel grup için pI ≈ (pKₐ,asit + pKₐ,baz)/2) yaklaşık bulunur. pH < pI olduğunda molekül net pozitif, pH > pI olduğunda net negatif yük taşır. Bu ilke, protein–protein etkileşimleri, membranlarla ilişki ve terapötik protein formülasyonlarında stabilite analizlerinin temel araçlarındandır.
Tamponlama ve Fizyolojik Önemi
Amfolitler, zayıf asidik ve bazik formları arasında karşılıklı dönüşebilirlik sayesinde pH değişimlerine direnç gösterir (tampon etkisi). Tıpta başlıca üç amfolitik tampon sistemi ayırt edilir:
- Bikarbonat/Karbonik Asit Sistemi (HCO₃⁻/CO₂)
- Ekstraselüler sıvı ve kandaki başlıca tampon.
- Akciğerler (CO₂ atılımı) ve böbrekler (H⁺ atımı, HCO₃⁻ geri emilimi/yeniden üretimi) ile açık bir sistemdir.
- Asit-baz bozuklukları (metabolik asidoz/alkaloz, respiratuvar asidoz/alkaloz) bu eksende değerlendirilir.
- Fosfat Sistemi (H₂PO₄⁻/HPO₄²⁻)
- Hücre içi ve böbrek distal nefron segmentlerinde etkindir.
- Titrasyon asitliği bileşenlerinden biridir; idrarla H⁺ atımının biyokimyasal göstergesidir.
- Protein/Proteinatik Sistemler
- Plazma proteinleri (özellikle albumin) ve hemoglobin önemli tamponlardır.
- Hemoglobinin amfolitik grupları ve oksijenasyon durumu, eritrosit içi pH ve CO₂ taşıma kapasitesini etkiler (Haldane etkisi).
Klinik Yansımalar
- Asit–baz bozukluklarının tanısı: Amfolit tamponları, kan gazı (pH, pCO₂, HCO₃⁻), anyon açığı ve idrar anion açığı gibi parametrelerin yorumlanmasında kurucu niteliktedir.
- Böbrek fonksiyonu: Fosfat ve amonyum tamponları üzerinden net asit atılımı değerlendirilir. Renal tübüler asidoz tiplerinde fosfat tampon katkısı azalabilir veya yeniden dağıtılabilir.
- Plazma proteinleri: Hipoalbüminemi, plazmanın tampon kapasitesini azaltarak metabolik alkaloz değerlendirmesinde pH–HCO₃⁻ ilişkisini çarpıtabilir; anyon açığının albümine göre düzeltilmesi gerekebilir.
- İlaçların farmakokinetiği: Birçok amfolitik ilaç (bir arada asidik ve bazik fonksiyonel gruplar içeren moleküller) pH’a bağlı iyonizasyon profilleri nedeniyle membran geçişi, dağılım hacmi ve renal tübüler geri emilimde belirgin pH-bağımlılık sergiler (iyon tuzağı).
- Beslenme ve metabolizma: Amino asitlerin amfolitik ve zwitteriyonik doğası, intestinal taşıyıcılar üzerinden emilim ve asidik yük–baza yük dengesinde rol oynar.
Analitik ve Teknolojik Uygulamalar
- İzolektrik Odaklama (IEF): pH gradyenti boyunca proteinler pI değerlerinde odaklanır. Burada kullanılan taşıyıcı amfolit karışımları (carrier ampholytes), geniş ya da dar aralıklı pH gradyentlerinin stabil biçimde oluşmasını sağlar.
- Kapiler Elektroforez/İyonik Hareketlilik: Amfolitlerin net yükleri pH’a göre değiştiğinden, ayırma seçiciliği pH ile ince ayarlanabilir.
- Titrasyon ve pKₐ tayini: Çok protonlu amfolitlerin titrasyon eğrileri, birden çok tampon bölgesi gösterir; bu da ayrıntılı pKₐ haritalaması ve türleşme analizi için kullanılır.
- Biyofarmasötik formülasyon: Protein terapötiklerinde pH–pI ilişkisi; agregasyon, viskozite ve immünojenisite risklerinin azaltılması için kritik optimizasyon parametresidir.
Terminoloji ve “Özel Durum”: Zwitterion (Dipolar İyon)
Amfoterik bir bileşende aynı anda iki karşıt yük (ör. –NH₃⁺ ve –COO⁻) bulunuyorsa, molekül zwitterion veya dipolar iyon olarak adlandırılır. Bu durumda “dahili tuz oluşumu” net yükü sıfıra yaklaştırır; buna rağmen molekül yük dağılımı taşır ve elektrostatik etkileşimlere katılır. Zwitteriyonik hâl, özellikle orta pH aralığında amino asitlerin tipik ve baskın türleşmesidir.
Semboller ve Sık Kullanılan Türler (Seçme)
- H₂O: Amfoter çözücü; kendi-iyonizasyon dengesiyle pH ölçeğinin temelini oluşturur.
- HCO₃⁻: Bikarbonat; hem asit hem baz gibi davranabilir; kan tamponlamasında başroldedir.
- H₂PO₄⁻ / HPO₄²⁻: Fosfat tamponunun amfolit bileşenleri; hücre içi ve renal fizyolojide önemlidir.
- Amino asitler/proteinler: Çok merkezli amfolitler; pI kavramı ve elektroforetik ayırma tekniklerinin temelini oluşturur.
Keşif
Amfolitlerin tarihini izlemek, kimyanın asit–baz düşüncesinin evrimini, biyokimyanın moleküler dilini ve analitik teknolojilerin yaratıcı sıçramalarını aynı pano üzerinde okumak gibidir. Hikâye, asit ve bazların birer “karakter” olarak zihinlerde netleştiği dönemde başlar; bir maddenin aynı anda hem proton verebilmesi hem de alabilmesi fikri, önce sezgisel bir gözlem olarak doğar, ardından formel kuramlarda yerini bulur ve nihayet laboratuvar tezgâhlarında ölçülebilir, yönetilebilir bir araca dönüşür.
pH’ın icadı ve asit–baz kuramlarının iki yönlü karakteri fark etmesi
- yüzyılın başında S. P. L. Sørensen’in pH kavramını tanıtmasıyla birlikte, proton etkinliği kullanışlı bir ölçeğe kavuştu; klinik ve endüstriyel kimyada pH’ın hızla benimsenmesi, asit–baz dengesini sayılarla konuşur hâle getirdi. Henderson ve Hasselbalch’ın birbirini tamamlayan çalışmaları, tampon sistemlerinin denge denklemlerini doğrudan klinik yoruma bağladı; kan–plazma dengesinden biyokimyasal reaksiyonlara kadar geniş bir haritada pH–pK_a ilişkisi operatif bir rehbere dönüştü. Çok kısa bir süre sonra Brønsted–Lowry ve Lewis tanımları, “asit” ve “baz”ın ne olduğuna kavramsal açıklık getirdi: proton verme–alma (Brønsted–Lowry) ile elektron çifti alışverişi (Lewis) çerçeveleri, tek bir maddenin koşullara göre asidik ya da bazik davranabileceğini kuramsal bir zorunluluk hâline getirdi. Bu kuramsal zemin, “amfoterik” ya da “amfolit” karakterin yalnızca bir istisna değil, doğada son derece yaygın bir özellik olduğunu görünür kıldı.
Zwitteriyon fikrinin yerleşmesi: Amino asitlerin çift karakterli portresi
Amino asit kimyasının yükselişiyle birlikte, aynı molekül üzerinde zıt yüklü grupların eşzamanlı varlığına işaret eden “zwitteriyon/dipolar iyon” tasviri yerleşti. –COO⁻ ve –NH₃⁺ uçlarının bir arada bulunabildiği, net yükü sıfıra yakın fakat yerel yük yoğunlukları taşıyan bu hallerin, çözünürlükten elektroforetik göç davranışına, enzim–substrat tanımadan taşıyıcı aracılı geçirgenliğe kadar pek çok özelliği belirlediği anlaşıldı. Böylece amfolitlerin “fizyolojik dilde” konuştuğu yerin, hücrelerin içi ve kanın kimyası olduğu netleşti: bikarbonat/karbonat ve dihidrojenfosfat/hidrojenfosfat çiftleri gibi sistemler, canlılığın tampon mimarisini taşır sütunlar olarak karşımıza çıktı.
“Amfolit”in bir teknolojiye dönüşmesi: İzolelektrik odaklamanın doğuşu
1950’lerin sonu ve 1960’ların başında, isoelectric focusing (IEF, izoelektrik odaklama) fikri —moleküllerin net yüklerinin sıfırlandığı pH değerlerinde (pI) odaklanabileceği— analitik ayırma dünyasını kökten etkiledi. Harry Svensson’un teorik çerçeveyi kurması ve izleyen yıllarda yöntemsel ayrıntıları tarif etmesi, amfolitlerin adeta “taşıyıcı” rol oynadığı pH gradyentlerine giden kapıyı araladı. Çok kısa bir süre içinde, sentetik taşıyıcı amfolit karışımlarının (Ampholine ve ardılları) geliştirilmesi, kararlı ve öngörülebilir pH gradyentlerinin pratikte kurulmasını sağladı; böylece protein ve peptitlerin pI’larına göre yüksek çözünürlükle ayrılması, araştırma ve tanı laboratuvarlarında günlük rutine girdi.
Bu sıçramanın hemen arkasından gelen kritik bir birleşme, Patrick H. O’Farrell’in iki boyutlu elektroforezi oldu: birinci boyutta IEF ile pI’a göre, ikinci boyutta SDS-PAGE ile molekül kütlesine göre ayrım. Yalnızca birkaç yıl içinde iki boyutlu haritalar (2-DE), hücresel proteomların “topografyasını” ilk kez yüksek çözünürlükle görselleştirdi; amfolitler bu haritaların sessiz mimarlarıydı. 1970’lerin sonu ve 1980’lerde, immobilize pH gradyentinin (IPG) tasarlanması ikinci büyük devrimdi: gradyentin kimyasal olarak jel matriksine bağlanması, bantların keskinliğini ve çalışılabilirliği artırdı; dar aralıklı, milimetrik pH pencerelerinde mikrodüzey farkları seçilebilir kıldı. Analitik kimyanın gündelik diliyle söylersek, amfolit artık yalnızca bir kavram değil; “üretilebilen, formüle edilebilen ve ayarlanan” bir araç kutusuydu.
Klinik ve endüstriyel izdüşümler: Tampon mimarisinden biyofarmaya
Biyolojideki başrol, plazma ve hücre içi tamponlarda amfolitlerin üstlendiği görevlerle görünür oldu. Bikarbonat sistemi, akciğer–böbrek ekseninin açık devresinde pH dalgalanmalarını sönümleyen bir amortisör; fosfat sistemi, hücre içi ve renal tübülde titrasyon asitliğinin belirleyicisi; proteinler (özellikle hemoglobin ve albumin), iyonizasyon durumları pO₂ ve bağlanma etkileşimlerine duyarlı “akıllı” tamponlar olarak çalıştı. Klinik kimyada kan gazı yorumunun, anyon açığı hesaplarının ve metabolik/respiratuvar bozuklukların ayrımının arka planında bu amfolitik ağlar örülüdür. Farmasötik kimyada ise pek çok küçük molekül ilacın “amfolitik” doğası, çözünürlük–geçişkenlik–dağılım ekseninde pH bağımlı profiller çizer; iyon tuzaklanması ve pH mikroçevresi, farmakokinetik ve doku seçiciliğinde belirleyici olur.
Proteomik çağında amfolit: Kapiler ve mikroakışkan platformlar
1990’lardan itibaren IEF, kapiler formatlara ve mikroakışkan kanallara uyarlanınca, amfolit karışımlarının dağılımı, polidispersitesi ve odaklama dinamikleri ayrıntılı şekilde sorgulandı. Taşıyıcı amfolit markaları (Ampholine, Pharmalyte, Servalyt, Bio-Lyte) ve bunların kütle dağılımı, pH yanıt eğrileri ve fraksiyonlama profilleri karşılaştırıldı; IPG temelli reformatlar, shotgun proteomik için birinci boyut seçimlerinde yenilikçi akışlar doğurdu. Böylece pH gradyentlerinin tasarımı, kitlesel üretimle birlikte “ayar düğmeleri” çoğalan bir mühendislik problemine dönüştü.
Yüzey bilimi ve malzeme cephesi: Zwitteriyonik polimerlerin yükselişi
Aynı dönemde, amfolitik/zwitteriyonik mimari biyomalzeme tasarımında yeni bir sayfa açtı. Hücre zarlarının baş gruplarının doğasından ilham alan zwitteriyonik polimerler, su ile güçlü hidratasyon kabukları oluşturarak protein adsorpsiyonunu ve biyokirlenmeyi engelleyen “doğal antifouling” yüzeyler sundu. Bu malzemeler, kateter ve implant kaplamalarından membran teknolojisine, biyosensörlerden hücre mühendisliğine kadar geniş bir alanda düşük biyofouling ve yüksek biyouyumluluk vaat etti. Zamanla moleküler spektroskopi ve yüzey yöntemleri (ör. SFG) ile bu hidratasyon kabuklarının düzeni, dayanıklılığı ve dinamikleri moleküler ayrıntıda gözlenir hâle geldi.
Hesaplamalı cephe: Sürekli pH simülasyonlarından makine öğrenmesine
Proteinlerin ve küçük moleküllerin pK_a haritalarını güvenilir biçimde öngörmek, amfolitik türleşmenin “dinamik atlası”nı çıkarmak demektir. Bu amaçla geliştirilen sürekli/discrete “constant pH” moleküler dinamik yöntemleri, protonasyon durumlarının simülasyon sırasında değişmesine izin vererek, enzimatik mikroortamların ve protein yüzeylerinin pH-duyarlı davranışını yakalar hâle geldi. Bir yandan da makine öğrenmesi, geniş ve heterojen veri üstünde pK_a kestirimi için doğruluğu ve hız ekonomisini birlikte iyileştirdi; tek çözücüden çoklu çözücülere uzanan modeller, retrosentetik planlama ve malzeme tasarımı ile entegre edilerek pH-odaklı tasarım döngülerini hızlandırdı. Amfolitleri artık yalnızca ayrıştırmıyor; özelliklerini veriden öğreniyor, simülasyonda sınayıp tasarlıyoruz.
Bugünün gündemi: İnce ayarlı gradyentler, biyouyumlu yüzeyler, akıllı tamponlar
Bugün amfolit araştırması üç geniş hatta ilerliyor. Birincisi, proteomikte hedefe uyarlanmış, dar ve doğrusal pH pencereleri sağlayan IPG reçetelerinin optimizasyonu; elektroforetik platformların kapiler/mikroakışkan biçimlere evrilmesi ve kütle spektrometresiyle bağlanması. İkincisi, zwitteriyonik polimerlerin ve jel ağlarının biyofouling’e direnç, kanla temas biyouyumu, mekanik dayanıma eşlik eden uzun ömürlü hidratasyon davranışı için incelikli tasarımı. Üçüncüsü, hesaplamalı–deneysel döngüde pK_a ve türleşme tahminlerinin doğruluğunu artıran fizik bilgili yapay zekâ yaklaşımları ve sürekli pH simülasyonlarının gerçekçi koşullara (tuz, kalabalık ortam, birlikte iyonizasyon) genişletilmesi. Tüm bu başlıklarda, amfolit kavramı kuramsal köklerinden kopmadan, teknik ayrıntı ve pratik performans arasında gidip gelen yaratıcı bir saha olmaya devam ediyor.
İleri Okuma
- Henderson, L. J. (1908). The theory of neutrality regulation in the animal organism. American Journal of Physiology, 21, 427–448. https://doi.org/10.1152/ajplegacy.1908.21.1.427
- Sørensen, S. P. L. (1909). Über die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen. Biochemische Zeitschrift, 21, 131–304.
- Hasselbalch, K. A. (1916). Die Berechnung der Wasserstoffzahl des Blutes aus der freien und gebundenen Kohlensäure. Biochemische Zeitschrift, 78, 112–144.
- Tanford, C. (1962). Physical Chemistry of Macromolecules. Wiley, New York. ISBN 9780471847925.
- Good, N. E.; Winget, G. D.; Winter, W.; Connolly, T. N.; Izawa, S.; Singh, R. M. M. (1966). Hydrogen Ion Buffers for Biological Research. Biochemistry, 5(2), 467–477. https://doi.org/10.1021/bi00866a011
- Vesterberg, O.; Svensson, H. (1966–1969). Ampholytes and isoelectric focusing. Acta Chemica Scandinavica, 23, 2653–2666 (ve ilgili patent/uygulamalar). https://actachemscand.org/pdf/acta_vol_23_p2653-2666.pdf
- Vesterberg, O. (1971). Isoelectric focusing of proteins. Progress in Biophysics and Molecular Biology, 21, 197–270. https://doi.org/10.1016/0079-6107(71)22035-8
- Bates, R. G. (1973). Determination of pH: Theory and Practice. Wiley, New York. ISBN 9780471061673.
- O’Farrell, P. H. (1975). High Resolution Two-Dimensional Electrophoresis of Proteins. Journal of Biological Chemistry, 250(10), 4007–4021. https://pubmed.ncbi.nlm.nih.gov/236308/
- Segel, I. H. (1975). Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley, New York. ISBN 9780471774214.
- Bjellqvist, B.; Righetti, P. G.; Gorg, A.; et al. (1982). Isoelectric focusing in immobilized pH gradients: principle, methodology and some applications. Journal of Biochemical and Biophysical Methods, 6(4), 317–339. https://pubmed.ncbi.nlm.nih.gov/7142660/
- Gianazza, E.; Righetti, P. G. (1983). Isoelectric focusing in immobilized pH gradients. Journal of Neuroscience Methods, 7(3), 275–289. https://doi.org/10.1016/0165-0270(83)90039-8
- Adams, L. D.; Gallagher, S. R. (1992). Two‐Dimensional Gel Electrophoresis Using the O’Farrell System. Current Protocols in Molecular Biology, 10.4.1–10.4.24. https://doi.org/10.1002/0471142727.mb1004s18
- Righetti, P. G. (1997). Isoelectric Focusing in Immobilized pH Gradients. Journal of Chromatography B, 699(1–2), 3–19. https://doi.org/10.1016/S0378-4347(97)00200-5
- Righetti, P. G. (1998). Isoelectric focusing of proteins and peptides in gel slabs or capillaries: is there a future? Analytica Chimica Acta, 372(1–2), 1–19. https://doi.org/10.1016/S0003-2670(98)00329-8
- Righetti, P. G. (2010). Isoelectric Focusing: Theory, Methodology and Applications. Elsevier, Amsterdam. ISBN 9780444538093.
- Donnini, S.; Tegeler, F.; Groenhof, G.; Grubmüller, H. (2011). Constant pH Molecular Dynamics in Explicit Solvent with λ-Dynamics. Journal of Chemical Theory and Computation, 7(6), 1962–1978. https://doi.org/10.1021/ct200061r
- Agilent Technologies (2014). Principles and Applications of Capillary Isoelectric Focusing. Application Note 5991-1660EN.
- Chen, W.; Huang, Y.; Shen, J.; Luo, R.; Kirk, S.; Wang, P. H. (2014). Recent development and application of constant pH molecular dynamics. Molecular Simulation, 40(10–11), 830–838. https://pubmed.ncbi.nlm.nih.gov/25309035/
- He, M.; Chen, Y.; Liu, Z.; Zhao, C.; Shao, L.; Jiang, S. (2016). Zwitterionic materials for antifouling membrane surface construction. Acta Biomaterialia, 40, 142–152. https://doi.org/10.1016/j.actbio.2016.02.009
- Boron, W. F.; Boulpaep, E. L. (2017). Medical Physiology. 3rd ed., Elsevier, Philadelphia. ISBN 9781455743773.
- Cargile, B. J.; Bundy, J. L.; Stephenson, J. L. (2005). Immobilized pH Gradient Isoelectric Focusing as a First-Dimension Separation for Shotgun Proteomics. Journal of Proteome Research, 4(4), 1677–1687. https://doi.org/10.1021/pr050122m
- Righetti, P. G.; Simó, C.; Sebastiano, R.; Citterio, A. (2007). Carrier ampholytes for IEF, on their fortieth anniversary (1967–2007), brought to trial in court: the verdict. Electrophoresis, 28(21), 3799–3810. https://doi.org/10.1002/elps.200700232
- Simó, C.; Citterio, A.; Antonioli, P.; et al. (2007). Mass distribution, polydispersity and focusing properties of carrier ampholytes for isoelectric focusing. Electrophoresis, 28(18), 3313–3324. https://doi.org/10.1002/elps.200600853
- Nelson, D. L.; Cox, M. M. (2021). Lehninger Principles of Biochemistry. 8th ed., W. H. Freeman, New York. ISBN 9781319228002.
- Li, Q.; Xia, C.; Yuan, Z.; et al. (2022). Zwitterionic Biomaterials. Chemical Reviews, 122(19), 16537–16574. https://doi.org/10.1021/acs.chemrev.2c00344
- de Oliveira, V. M.; Apostolov, R.; Villa, A.; Gräter, F.; Hünenberger, P. H. (2022). Constant pH Molecular Dynamics Simulations. Living Journal of Computational Molecular Science, 3(1), 1583. https://doi.org/10.33011/livecoms.3.1.1583
- Vigh, G. (2023). The path from Svensson’s steady-state model to capillary isoelectric focusing. Electrophoresis, 44(1–2), 76–96. https://doi.org/10.1002/elps.202200120
- Kragh, H. (2025). S.P.L. Sørensen, the pH concept and its early history. Chemistry in Context, 2, 1–24. https://doi.org/10.1007/s10698-025-09532-6
- Yang, C.; Zhou, Y.; Sun, Z.; et al. (2025). Review of the latest progress of AI and Machine Learning methods for pKa prediction. Current Opinion in Green and Sustainable Chemistry, 100, 100167. https://doi.org/10.1016/j.cogsc.2025.100167

Yorum yazabilmek için oturum açmalısınız.