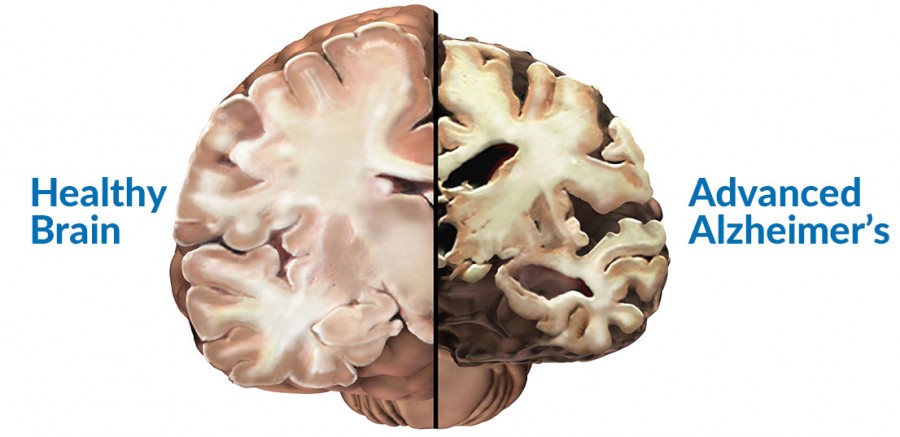
Alzheimer, dünya üzerinde yaklaşık 47 milyon insanı etkileyen yıkıcı bir beyin hastalığıdır. Fakat ne var ki; Alzheimer hastalığını tedavi etmede ya da amansız ilerlemesini önlemede henüz etkin bir tedavi yöntemine sahip değiliz.
Alzheimer, beyinde, beta-amiloid ve tau isimli iki anormal proteinin gelişmesinden kaynaklanan bir hastalıktır. Tau proteinleri, nöronları ve nöron bağlantılarını etkileyerek, nöronların ölümüne ve beyin bölgelerinin birbiriyle normal iletişiminin kesilmesine neden olması açısından önemlidir. Pek çok vakada, tau patolojisi ilk etapta beynin, entorhinal korteks ve hipokampal oluşum olarak bilinen hafıza merkezlerinde görülür. Bu durum, hastalarda, hastalığın herhangi bir belirtisinin görülmediği yıllar öncesinde ortaya konulmuştur.
Zamanla, beyin boyunca görülen tau protein miktarında artış başlar. Bu durum, Alzheimer hastalığı semptomlarında karakteristik bir ilerlemeye neden olur. Burada başlangıçtaki bellek kaybını takiben bağımsızlık kaybına yol açan düşünce ve davranışlarda daha yaygın değişiklikler görülür. Bu durumun nasıl gerçekleştiğine ilişkin ise bilim dünyasında henüz bir uzlaşıya varılmış değil.
Transnöronal Yayılım
5 Ocak’ta (2018) Brain‘de yayımlanan bir araştırmada, insanlarda tau proteinlerinin bağlantılı nöronlar arasındaki yayılımına ilişkin ilk deliller elde edildi. Bu bulgu oldukça önemli bir adımdır, çünkü geliştirilecek yeni yöntemlerle söz konusu bu yayılım durdurulabilirse, Alzheimer hastalığı erken yaşlarda engellenebilir veya semptomları durdurulabilir.
“Transnöronal yayılım”, geçmişte ortaya atılmış ve farelerde yapılan çalışmalar tarafından da desteklenmiş bir yaklaşımdır. Geçmişte yapılan çalışmalarda, sağlıklı fare beynine anormal tau proteinleri enjekte edilmiş ve bu proteinlerin hızlıca yayıldığı ve farede demans semptomlarına neden olduğu görülmüştü. Ancak ne var ki, aynı sürecin insanlarda da işlerlik gösterdiğine ilişkin geçmişte herhangi bir araştırma yapılmamıştı. Öte yandan, enjekte edilen tau miktarı nispeten yüksek olması ve –farelerdeki– hastalık ilerlemesinin insanlarda olduğundan daha hızlı gerçekleşmesinden kaynaklı fare çalışmalarından elde edilen deliller tartışmalıydı.

Bağlı nöronlar arasında tau yayılımı temsili gösterimi / Görsel: Cope, et. al. Brain, https://doi.org/10.1093/brain/awx347Brain’de yayımlanan çalışmada, araştırma ekibi, ileri iki beyin görüntüleme tekniğini birlikte kullandı. Bu tekniklerden birisi, beyinde belirli moleküllerin varlığını taramaya yarayan PET yani pozitron emisyon tomografisiyken; diğeri, beyindeki kan akışını gerçek zamanlı olarak taramaya yarayan fMRI yani fonksiyonel manyetik rezonans görüntülemeydi. Araştırmada, pozitron emisyon tomografisi (PET) ile hastalardaki anormal tau proteinleri doğrudan gözlemlenebildi ve beynin her bölgesinde ne kadar miktarda bulunduğu tam olarak görülebildi. Fonksiyonel manyetik rezonans görüntülemeyle (fMRI) ise, birbiriyle iletişimde olan beyin bölgelerinin ortaya çıkardığı aktivite gözlemlenebildi. İlk kez, aynı insanları her iki yöntemle tarayarak, beyindeki bağlantıları, Alzheimer hastalığı olan insanlardaki anormal tau dağılımı ile doğrudan ilişkilendirildi.
Beyin bağlantısını analiz etmek için “grafik analizi” isimli bir tekniğin kullanıldığı araştırmada, beyin eşit büyüklükteki 598 bölgeye ayrıldı. Ardından bölgeler arasındaki bağlantı, bir sosyal ağ gibi incelenerek beyindeki bir bölgenin temas sayısı, kaç “arkadaşlık” grubuna katıldığı ve beyin bölgelerinin kaçının aynı zamanda birbirleriyle temas kurdukları gibi faktörler değerlendirildi.
Bir influenza salgınında, geniş bir sosyal ağ içerisinde bulunan insanların enfekte olması ve başkalarına bulaştırması çok daha olasıdır. Benzer şekilde, transnöronal yayılım hipotezi de bağlantısı güçlü beyin bölgelerinin daha fazla tau biriktireceği tahmininde bulunuyor. Araştırmada da bu durum gözlemlendi. Bu ilişki her bir beyin ağında tekil olarak ve aynı zamanda da tüm beyinde bulunuyordu.
Öte yandan, geçmişte yapılan araştırmalarda, yüksek metabolik ihtiyaç gerektiren ya da komşu bölgelerinden yeterli destek görmeyen beyin bölgelerinde tau görünümünün daha muhtemel olduğu sonucuna ulaşılmıştı. Her ne kadar bu faktörlerin nöronal ölüm açısından önemi mümkünse de, Brain‘de yayımlanan araştırmada anormal tau brikiminin başlıca nedenleri arasında yer almadı.
Ayrıca, araştırmada, hafif bilişsel bozukluktan ciddi Alzheimer hastalığına kadar farklı hastalık şiddeti bulunan hastalara bakarak, tau birikiminin nedenleri sonuçlarından ayrılabildi. Araştırma ekibi, Alzheimer hastalığındaki artan tau miktarının, beynin bir bütün olarak daha az bağlantısal hale gelmesine neden olduğu ve kalan bağlantıların da giderek rastgele bir hal aldığı sonucuna ulaştı.
Uzun-menzilli Bağlantılar
Son olarak, araştırma ekibi, Alzheimer hastalığındaki bulguları, her 100.000 kişiden yaklaşık üçünü etkileyen progresif supranükleer felç (PSP) adı verilen nadir bir vakayla karşılaştırdı. Bu hastalık da tau proteinlerinin neden olduğu bir hastalıktır, fakat beyin altı ile sınırlı kalır. Araştırmacılar, PSP’de delillerin transnöronal yayılımı desteklemediğini ortaya koydu. Bunun sebebi anormal tau patolojisinin iki hastalıktaki farklı yapısından kaynaklanıyor olabilir. Alzheimer hastalığında, tau, “çift sarmal iplikler” halindeyken, PSP’de bu yapı “düz iplikler” şeklindedir.
Araştırma ekibi, PSP ilerledikçe, direkt uzun menzilli bağlantıların öncelikli olarak zarar gördüğünü ortaya koydu. Bu da bilginin beyinde daha dolaylı bir yol izlemesi gerektiği anlamına geliyor. Bu durum PSP hastalarına bir soru sorulduğunda neden genellikle yavaş ancak doğru cevap verdiklerini açıklamamıza yardımcı olabilir.
Sonuç olarak, Alzheimer hastası insanlarda transnöronal yayılıma dair deliller, tau patolojisinin beyinde önemli bir hasar oluşturmadan önce kilitlenmesine yönelik yeni tedavi stratejilerinin geliştirilebilmesine olanak sağlayabilir.
Kaynaklar ve İleri Okuma:
- Tau burden and the functional connectome in Alzheimer’s disease and progressive supranuclear palsy. Brain, (January, 2018). https://academic.oup.com/brain/advance-article/doi/10.1093/brain/awx347/4775021
- Selective Neuronal Vulnerability in Neurodegenerative Diseases: from Stressor Thresholds to Degeneration. Neuron, (July, 2011). http://www.sciencedirect.com/science/article/pii/S0896627311005617
- Prevalence, characteristics, and survival of frontotemporal lobar degeneration syndromes. Neurology, (April, 2016). http://n.neurology.org/content/86/18/1736.short
- How Alzheimer’s Spreads Through the Brain. NeuroscienceNews. http://neurosciencenews.com/neurology-alzheimers-spread-8277/ (accessed January 8, 2018).
Bu yazının kaynağı: https://bilimfili.com/alzheimer-beyinde-nasil-yayiliyor/