Etimoloji
Aponeurosis** kelimesi, “kasın tendona dönüştüğü uç” anlamına gelen Eski Yunanca ἀπονεύρωσις (aponeúrōsis) teriminden gelmektedir. Bu bir bileşiktir:
- ἀπονευρόομαι (aponeuróomai): “Tendon olmak.”
- Son ek -σῐς (-sis): Nominal bir formu belirtir.
Terim, aponevrozların tendonların uzantısı olarak kabul edildiği erken dönem anatomik anlayışı yansıtmaktadır; bu ayrım 17. yüzyılda Thomas Willis’in çalışmalarıyla netleşmiştir.
Yapı
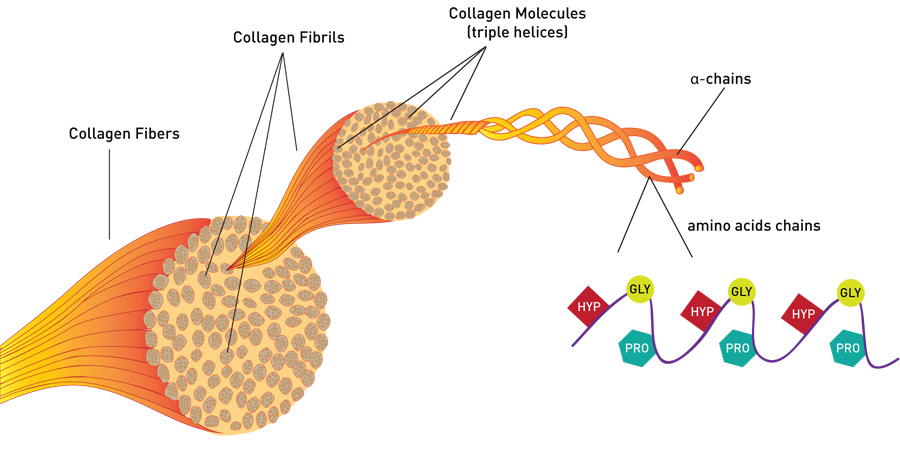
- Aponevrozlar, düzenli, paralel demetler halinde düzenlenmiş kolajen liflerden oluşan yoğun fibröz bağ dokusu tabakalarıdır.
- Kompakt ve silindirik olan tendonların aksine, aponevrozlar geniş, düz ve esnektir ve büyük kas bölgelerinin kemiklere veya diğer yapılara bağlanmasını sağlar.
Fonksiyonlar
- Kas Bağlantısı:
Kasları kemiklere, kıkırdağa veya diğer kaslara bağlayarak hareket oluşturmak için kas kasılmalarını iletir. - Kuvvet Dağılımı:
Kaslar tarafından üretilen kuvveti tendonlara kıyasla daha geniş bir alana yayar. - Yapısal Bütünlük:
Kas-iskelet iskeletine güç, stabilite ve destek sağlar. - Enerji Emilimi:
Dinamik kas hareketleri sırasında enerjiyi emer ve dağıtır.
Tendonlar ve Fasyalar ile Karşılaştırma
- Tendonlar**:
- Kompakt, lifli ve yüksek gerilme kuvvetlerine dayanacak şekilde tasarlanmıştır.
- Kas ve kemik arasında ip benzeri bir bağlantı görevi görür.
- Aponörozlar**:
- Geniş, ince ve esnektir, kasın daha geniş bir alana bağlanmasını sağlar.
- Fascia**:
- Kasları çevreleyen ve ayıran daha ince ve daha esnek bağ dokusu katmanları.
- Aponörozlar tendonlara dönüşebilir veya kasları bağlamak için fasya ile birleşebilir.
Anahtar Konumlar
Aponörozlar, kasları tutturdukları ve yapısal takviye sağladıkları vücut boyunca dağılmıştır. Örnekler şunları içerir:
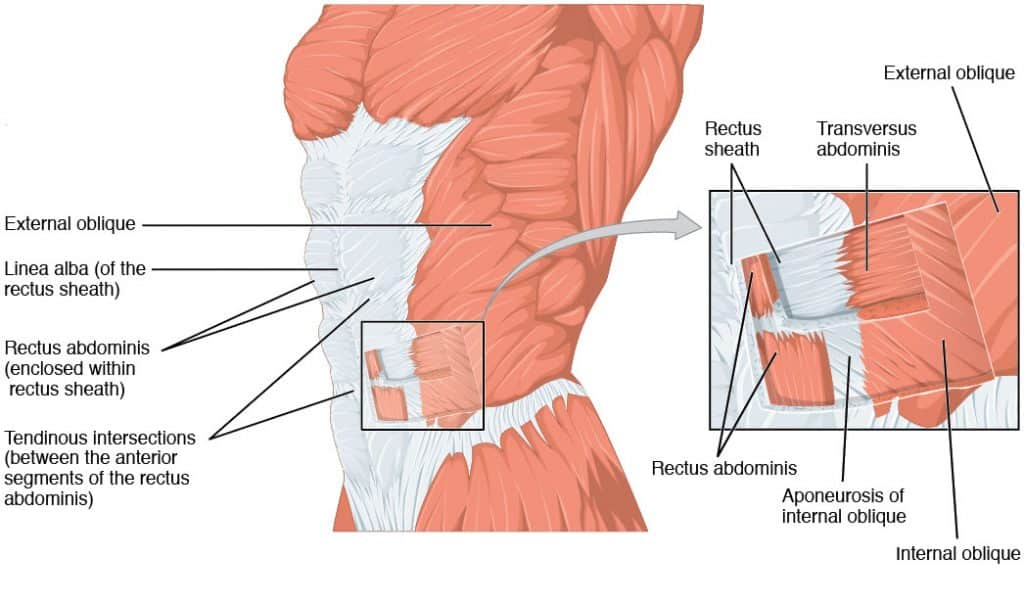
- Rektus kılıfı**: Karın kaslarını kaplar.
- Torakolomber fasya: Sırt kaslarını destekler.
- Palmar aponevroz: Avuç içi kaslarını sabitler.
- Plantar fasya: Ayak kemerini destekler.
- Lingual aponevroz: Dilde bulunur.
- Palatin aponevroz: Yumuşak damakta bulunur.
Klinik Önem
Aponevrozlar, aşağıdakiler de dahil olmak üzere çeşitli tıbbi durumlarla ilgilidir:
- Fıtıklar: Aponevrotik katmanlardaki zayıflıklar organ veya doku çıkıntılarına yol açabilir.
- Kas Yırtılmaları: Aponevrozlar aşırı stres altında yırtılabilir ve yaralanmaya yol açabilir.
- Tendinit: Tendonların yakınındaki aponörotik bölgeler iltihaplanabilir.
Keşif
Tendonlar ve Bağ Dokusuna İlk Referanslar (Antik Dönem – Orta Çağ)
1. Antik Yunan Kökenleri (MÖ 5. yüzyıl civarı)
- Antik Yunan (MÖ 4. Yüzyıl): Hipokrat ve Galen de dahil olmak üzere erken anatomistler, kas bağlantılarındaki bağ dokularının önemini belirtmiş ancak tendonlar, bağlar ve aponevrozlar arasında ayrım yapmamışlardır.
- Orta Çağ (5.-15. Yüzyıl): Tıbbi el yazmaları, tendonları tanımlayan ancak aponevrozları ayrı bir yapı olarak ayırt etmeyen Galen’in öğretilerini esas olarak takip etmiştir.
2. Terimin Tanıtımı ve Anatomik Tanımlama (17. Yüzyıl)
- Thomas Willis (1621-1675):
- Yunanca apo (“uzak”) ve nöron (“sinir”) kelimelerinden türetilen ve “sinirden uzak” anlamına gelen aponevroz terimini ortaya atmıştır.
- Aponevrozları tendonlardan ve fasyadan farklı, belirgin lifli yapılar olarak tanımladı ve kasları kemiklere veya diğer dokulara bağlamadaki rollerini vurguladı.
- Çalışmaları kas bağlantılarının anatomik anlayışını ve işlevsel önemlerini ilerletti.
3. 18. ve 19. Yüzyıl Gelişmeleri
- 18. Yüzyıl: Aponevrozlar, kas-iskelet sistemi dinamiklerinde kritik bir rol oynayan özel bağ dokuları olarak giderek daha fazla kabul görüyordu, ancak yine de sıklıkla tendonlarla karıştırılıyordu. – 19. Yüzyıl: Aponevrozlar ve tendonlar arasındaki ayrım daha da belirginleşti. Aponevrozlar, daha kompakt ve silindirik olan tendonlara kıyasla daha geniş alanları kaplamalarına olanak tanıyan geniş, düz yapıları nedeniyle tanındı.
- Bilimsel Tartışma: Araştırmacılar, aponevrozlar ve tendonlar arasındaki yapısal ve işlevsel farklılıkları keşfetmeye devam etti.
4. 20. Yüzyıl: Ayrıntılı Çalışma ve Klinik Tanıma
- 20. Yüzyılın Başları: Mikroskopi alanındaki gelişmeler, bilim insanlarının aponevroz yapılarının daha ince ayrıntılarını incelemesine olanak sağladı. Aponevrozlardaki kolajen liflerinin rolü daha iyi anlaşıldı ve kuvveti geniş alanlara dağıtma yetenekleri vurgulandı.
- Klinik Çalışmalar: Aponevrozlar, fıtık, kas yırtığı ve tendinit gibi klinik durumlarla ilişkilendirilmeye başlandı. Eklem sabitleme ve kas kuvvetlerini dağıtmadaki rolleri açıklığa kavuşturuldu. – Fasyanın Anlaşılması: Aponevrozlar ve fasya arasındaki ilişki daha net bir şekilde tanımlandı ve aponevrozların kas-kemik bağlantılarında önemli roller oynayan uzmanlaşmış, yoğun fasyalar olduğu belirtildi.
5. Modern Araştırma ve Teknolojik Gelişmeler (20. Yüzyıl Sonları – Günümüz)
- Mikroskopi ve Görüntüleme: MRI ve ultrason gibi gelişmiş görüntüleme teknikleri, aponevrozların ve kaslara, kemiklere ve fasyalara olan bağlantılarının daha net bir şekilde görüntülenmesini sağladı.
- Genetik ve Moleküler Araştırma: 20. yüzyılın sonlarında ve 21. yüzyılın başlarında, özellikle kolajen lifleri olmak üzere aponevrozların moleküler bileşimine yönelik araştırmalar, bunların biyomekanik verimlilik ve yaralanma önlemedeki rolünü daha da tanımladı. – Klinik Uygulama: Aponevrozlar artık plantar fasiit, karın fıtığı ve kas zorlanmaları dahil olmak üzere çeşitli durumlardaki katılımları açısından inceleniyor ve klinik tıptaki önemleri vurgulanıyor.
İleri Okuma
Yoo, W. C., & Rho, M. H. (2017). The structural properties of the aponeurosis and its relationship with tendon. International Journal of Medical Research.