
Grip virüsü, gösterilerinde bir anda kılık değiştirme numarası yapan sihirbazlar gibidir. Genomu 20-30 yıl içinde, hayvan genomlarının milyonlarca yılda geçireceği değişimleri geçirebilir. Dolayısıyla bedenlerimizi enfeksiyona karşı uyaranlar da dahil olmak üzere, viral proteinler kendilerini sürekli yeniler. Bağışıklık sistemimizi tehdit ederken, aşı üreticilerinin de işini zorlaştırırlar.
Evrimin proteinler üzerindeki etkisini inceleyen biyolog Jesse Bloom, aralıksız değişimin bir fırsat olduğunu düşünüyor. Geçmiş grip mevsimlerinde toplanan verilerden, Bloom bugünkü grip virüslerinin atalarından bazılarının genetik yapısını bütünüyle biliyor. Seattle’da bulunan Fred Hutchinson Kanser Araştırma Merkezi’ndeki laboratuvarında bu bilgiyi kullanarak, virüslerin bağışıklık sistemini atlatacak dönüşümleri nasıl geçirdiklerini anlamaya çalışıyor.
Bloom ve ekibi, “evrimsel biyokimya” alanında çalışan ve giderek büyüyen bir grubun parçası. Yaşamın muazzam çeşitliliğini açıklamak ve bu çeşitliliğin tam olarak nasıl belirdiğini belirlemek istiyorlar. Bitkilerin ve hayvanların farklı ortamlara nasıl uyum sağladığına odaklanmak yerine, bu araştırmacılar çeşitliliği çok daha küçük ölçekte ele alıyor: Yaptıkları çalışma, ilkel yaşam biçimlerine olanak tanıyan az sayıdaki proteinin, nasıl olup da şu anki biyolojik süreçleri yöneten milyonlarca özelleşmiş proteine evrildiğini açıklamayı amaçlıyor.
Bloom genetik kayıtlardan yararlanarak, geçmiş zamanlarda varolmuş virüs proteinlerini düzenleyebiliyor ve ardından her seferinde bir amino asit olacak şekilde nasıl evrim geçirdiklerini yeniden gözlemliyor. Diğer araştırmacılar, biyolojik moleküllerin milyonlarca yıl içinde evrilen atalardan kalma biçimlerini diriltmek için modern türleri çözümlüyor.
Ellerinde geçmişe ait bir protein olan araştırmacılar, tek bir amino asiti değiştirmenin (muhtemelen evrim sürecinde böyle olmuştur) proteinin esneyişini, katlanışını ve diğer moleküllerle bağlanışını (ya da bağlanmayışını) nasıl değiştirdiğini sınayabiliyorlar. Adım adım amino asit değişiklikleri yaparak proteinin alternatif tarih versiyonlarını deneyen bilimciler, bir proteinin fiziksel biçiminin nasıl hem evrilmesini sağladığını, hem de evrimini sınırladığını öğrenebiliyor.
Bu çalışma uzun zamandır yanıtlanmayı bekleyen bazı soruları nihayet yanıtlayabilir: Evrim ne dereceye kadar şans eseri olaylara bağlı? Evrim farklı yollar izleyerek aynı noktaya varabilir mi? Biyolojik karmaşıklık nasıl evrilir? Bu tür deneyler, bir yandan da modern proteinler üzerinde çalışan ve amino asit sıralamasının biyolojik işlevlerle nasıl bağlantılı olduğunu inceleyen araştırmacılara da yardımcı oluyor.
Biçim Eşittir İşlev
Amino asitlerin bu sıralı dizisi, bir proteine karşılık gelen gen haritasını tutan gen tarafından okunur. Uygun asitler bir kez dizildikten sonra, origami kağıtlarına benzer şekilde, proteinin hücre içinde ne yapacağını belirleyen köşeli ve çıkıntılı minik yapılar biçimine katlanır. Bir proteinin katlanış şekli, onun belli DNA parçalarını yakalamasını veya bazı kimyasal tepkimeleri hızlandırmasını sağlar. Bir gendeki mutasyonlar, ortaya çıkan proteinin biçimini değiştirebilir ya da davranışında farkedilmesi güç değişiklikler yaratabilir. Böylece zaman içinde bir proteinin işlevi değişebilir. Fakat olasılıklar sonsuz değildir. Parçalanan, katlanmakta başarısız olan veya gereken performansı göstermeyen yeni proteinler, doğal seçilimin sınavlarından sağ çıkamaz.
“Katlanmanın, durağanlığın (stabilliğin), çözünürlüğün, işlevin ve özgünlüğün (spesifikliğin) fiziksel belirleyicileri, evrimsel sürecin özünde yer alan etkenlerdir,” diyor Şikago Üniversitesi’nden biyolog Joe Thornton. “Yakın zamana kadar bu durum pek kabul görmüyor ve açıkça belirtilmiyordu.” Şimdi ise moleküler evrimi anlamak için proteinlerin işlevleri olan, fiziksel nesneler olarak incelenmelerinin öneminin anlaşıldığını ekliyor Thornton.
Araştırmacılar proteinlerin geçmişlerini yeniden yapılandırırken, bazen genetik mutasyonların bir molekülü, daha önce başarılı olamayacak başka mutasyonlara bir şans verecek denli değiştirdiğini fark etti. Bu da yeni özelliklerin ve işlevlerin evrilmesi için fırsat yaratıyor. Bu biyologların onlarca yıldır aklından geçen bir düşünce olmasına karşın, laboratuvarda araştırılmaya yeni başlanıyor.
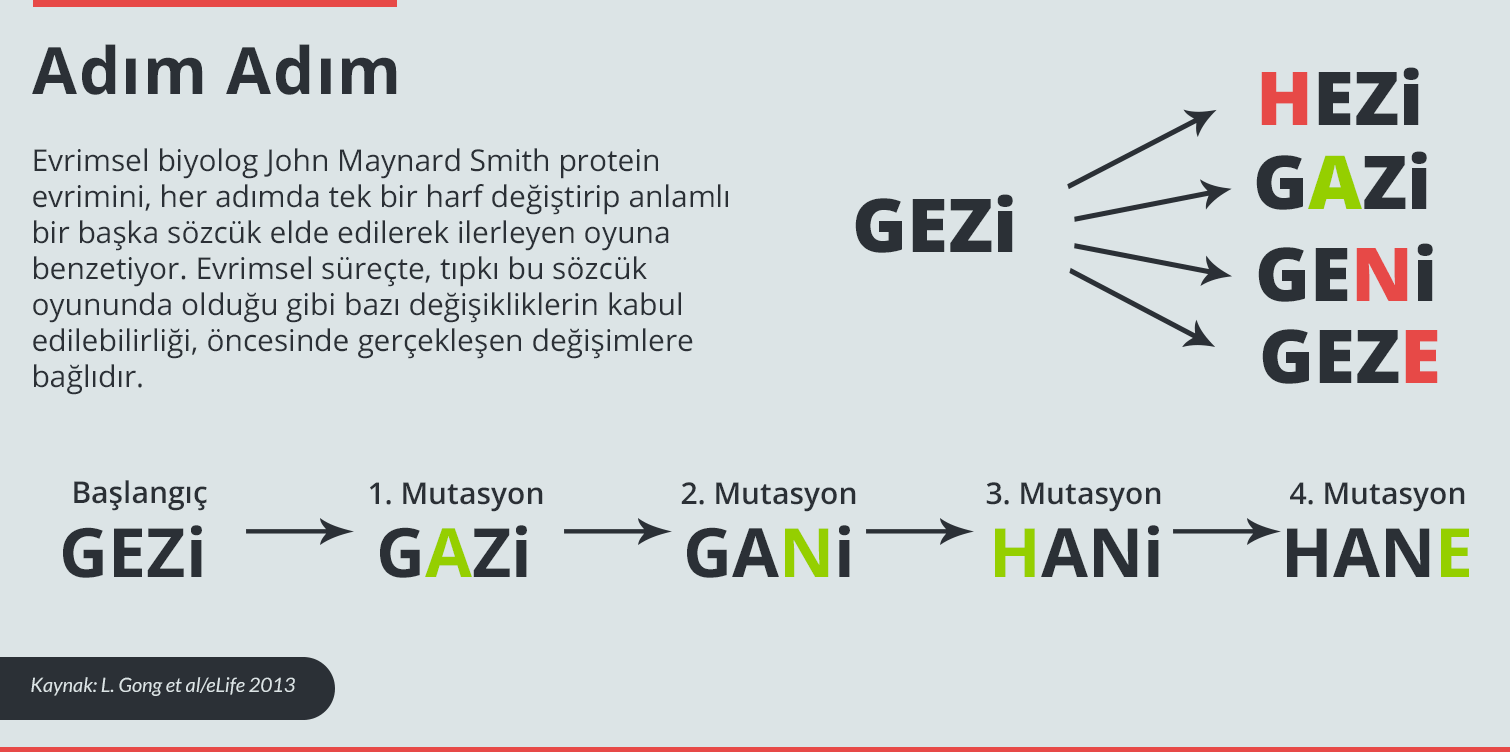
Yüksek boyutta görmek için görselin üzerine tıklayın.
Örneğin Bloom ve meslektaşları, grip virüsünün evriminin mutasyonlar arası etkileşimden nasıl etkilendiğini araştırmak içinnükleoprotein denilen bir grip virüsü proteini kullandı. Çeşitli mutasyonların toplamda yarattığı etkiyi anlamak, araştırmacıların yeni genetik varyasyonların kısa vadeli etkilerini öngörmelerini sağlayabilir. Bu bilgi, önümüzdeki grip mevsimlerinde hangi viral dizilerin etrafta olabileceğinin tahmin edilmesine ve etkili aşıların geliştirilmesine yardımcı olabilir.
Nükleoprotein genlerini, 1968 ve 2007’de yalıtılan virüs dizileri ile karşılaştıran ekip, 1968 proteinin yeni biçimine dönüşmesini sağlayan olası adımları haritaladı. Nükleoprotein 1968’de oynadığı rolün aynısını (viral RNA’nın düzenlenmesine yardımcı olmayı) sürdürse de, bu kırk yıllık süreç içinde 498 amino asitinden 33 tanesi değişmiş. Amino asitlerinin küçük bir kısmı da birden fazla kez değişim geçirmiş. Ekip bu bulguları 2013 yılında eLife dergisinde yayımlanan makalelerinde açıklamıştı1.
Bloom ve çalışma arkadaşları, 1968 nükleoproteinini yapılandırdı ve ardından son kırk yılda gerçekleşmiş mutasyonların her birinin gerçekleşmesinin yarattığı etkileri sınadı. Mutasyonlardan bazıları, bir işgalci olduğunda kişinin bağışıklık hücrelerini uyaran protein kısımlarını etkiledi. Bu da muhtemelen grip virüsünün yakalanmaktan kaçabilmesine yardım ediyor. Fakat gerçekleşen değişimlerin bir bölümü de kendi başlarına, virüs için kötü sonuçlar doğurdu: Nükleoprotein, göevini yapmasına yetecek süre boyunca uygun şekilde katlanmış kalamadı.
Nükleoproteinin evrimi sırasında, mutasyonların bazıları proteinin durağanlığını yükseltti. Daha sonraki mutasyonlar gerçekleştiğinde, muhtemelen daha önce gerçekleşmiş bu tür değişimler sayesinde proteinin yapısı bozulmadan kalabildi ve işlevlerini sürdürmeye devam edebildi.
Bir mutasyonun yarattığı etki öteki mutasyonlara bağlı olduğunda, bu karşılıklı etkileşime “epistasis” (iki değişkenin birbirini etkilemesi durumu) denir. Oregon Üniversitesi’nden biyofizikçi Michael Harms, tekil moleküller arasındaki bu etkileşimlerin, evrimin izleyeceği yolu belirlemede büyük önem taşıdığını söylüyor. Kendisi, s100 olarak adlandırılan bir grup proteindeki işlev çeşitliliğinin nasıl evrildiğini inceliyor. Harms, epistasisin evrimin tümünde görülen yaygın bir özellik olduğunu ekliyor.
Birbirine bağlı etkileşimler sadece mutasyon çiftleri arasında olmakla kalmıyor. Bundan çok daha karmaşık olabiliyorlar. Diğer laboratuvarlardan gelen verileri inceleyen Harms, epistatik etkileşimlerin 6 farklı mutasyona birden bağlı bile olabildiğini buldu. Böylesi bir karşılıklı etkileşimin varlığı, genler kendilerini azıcık dönüştürdüğü takdirde, evrimin çoğu zaman rotayı çok farklı yönlere çevireceği anlamına geliyor.
İzin Veren Mutasyonlar
Araştırmacılar, ileride gerçekleşecek değişimler için zemin hazırlayan mutasyonlara “izin veren” mutasyonlar adını veriyor. Bazı protein işlevlerinin ortaya çıkışı, ancak bu tür izin veren mutasyonların, evrilen bir molekülü pek de olası olmayan biçimde değiştirmelerinden sonra gerçekleşebiliyor.
Thornton, omurgalılarda stres tepkilerini, büyümeyi ve cinsel gelişimi yöneten steroid hormonlarının, kendi reseptörleri ile nasıl ortaklık geliştirdiklerini incelemek için atadan kalma proteinlerin yeniden yapılandırılmasından yararlanıyor. Reseptörler, hücre içi yanıtı tetiklemek için belirli partnerlere bağlanan proteinlerdir. Farklı türlerdeki steroid reseptörlerini karşılaştıran Thornton, moleküller arasındaki evrimsel ilişkilerin haritasını ve ortak atalarının olası amino asit dizilimini çıkarabilmiş. Ardından laboratuvar ortamında yetiştirilen hücrelere, uzun zamandır soyu tükenmiş durumda olan proteini kodlayan bir DNA molekülü eklemiş. Böylece bu hücreler, ellerine geçen genetik yönergeleri kullanarak, maziden kalma bir küçük parça üretmiş.
Thornton’un çalışmalarının çoğu, ekibi ile birlikte 2006 yılında yeniden yapılandırmış oldukları 450 milyon yıllık bir reseptör protein ile başlıyor. Bu protein, farklı hormonlar tarafından etkinleştirilen modern reseptör molekülleri ortaya çıkarıyor. Reseptörlerden biri olan glukokortisoid reseptörü, stres hormonu olan kortizole yanıt veriyor. Bir başka reseptör olanmineralokortisoid reseptörü, aldosteron hormonuna cevaben tuzun ve diğer elektrolitlerin düzeyini kontrol ediyor. Thornton’un ekibi, bu reseptörlerin yeniden yapılandırılan atasının, hem kortizol ile hem de aldosteron ile etkinleştirilebildiğini keşfetti.
Thornton, sadece kortizole yanıt veren bir reseptörün, seçici olmayan reseptörden 40 milyon yıl sonra belirdiğini gösterdi. Genel ata reseptörü, kortizole özel bir reseptöre dönüştüren amino asit değişiklikleri dizisi, ekip tarafından ortaya kondu. Ancak deneylerden anlaşıldığı üzere, antik reseptörün tercihlerini değiştiren mutasyonlar kendi başlarına işlevsel bir reseptör üretemiyorlar. “İşlev değiştiren mutasyonlar kendi başlarına tolere edilemiyorlar,” diyor Thornton. Reseptörün çeşitli bölgelerinin durağanlığını bozuyorlar. Tıpkı grip virüsünün evrilen nükleoproteinide olduğu gibi, öncelikle ata reseptörün yapısının sıradaki mutasyona dayanabilecek duruma gelmesi gerekiyor.
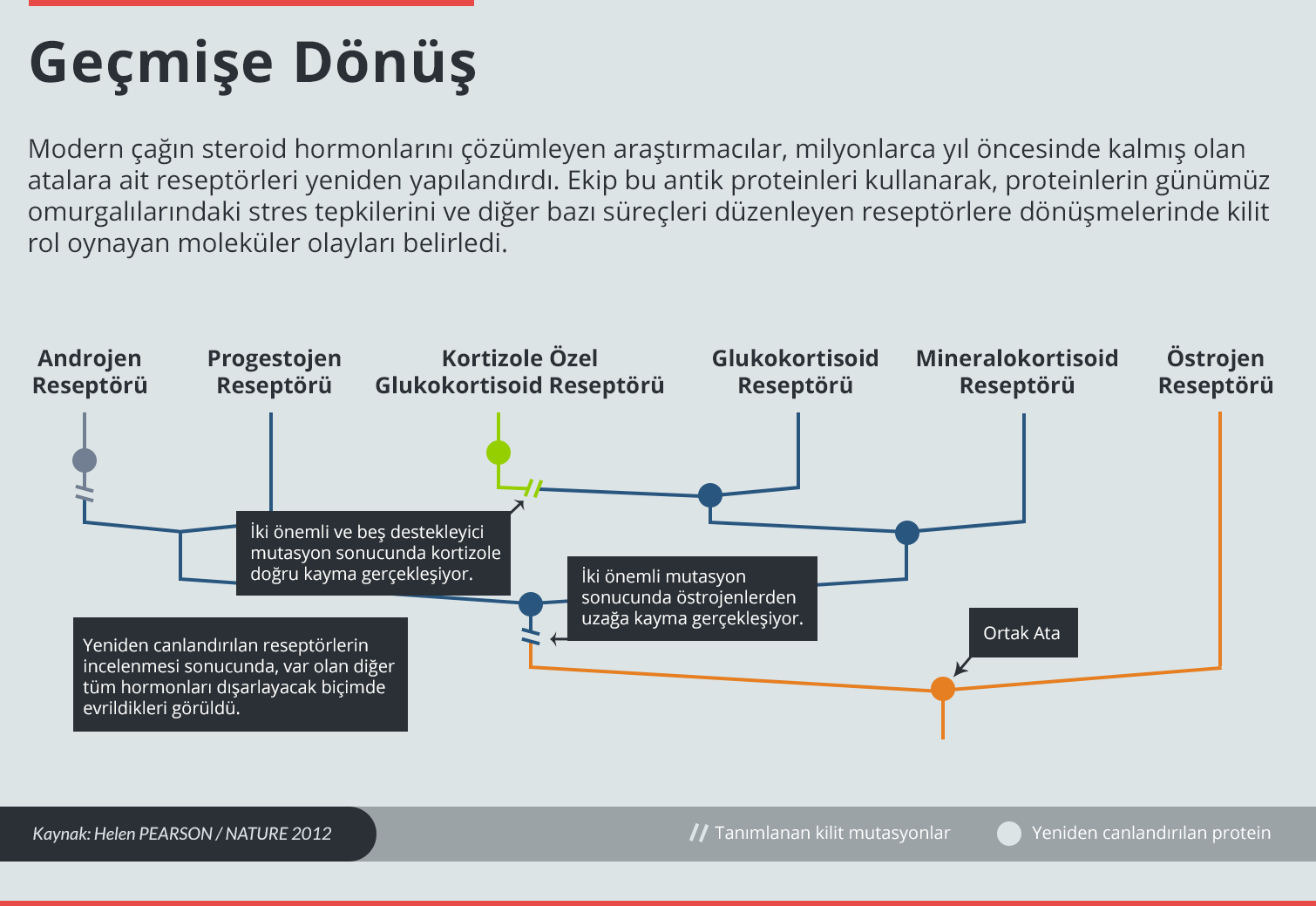
Yüksek boyutta görmek için görselin üzerine tıklayın.
Thornton ve çalışma arkadaşları 2009 yılında Nature dergisinde yayımladıkları bir makalede, iki amino asit değişiminin, antik reseptörü dönüşüm için usulca hazır duruma getirdiğini açıkladı2. Bunlar olmadan, işlev değişimi sağlayan mutasyona ulaşma olasılığı olamazdı. “Zamanı geri sarabilsek ve tarihin yeniden akmasını sağlayabilsek, bu izin verici mutasyonların yinelenme olasılığı pek az olurdu. Muhtemelen çok farklı bir glukokortisoid reseptörü ve çok farklı bir endokrin sistemi elde ederdik,” diyor Thornton.
Thornton ve o sıralarda Thornton’un Oregon Üniversitesi’ndeki laboratuvarında doktora sonrası araştırmacısı olan Harms, evrimin başka bir yol izleyerek aynı sonuca ulaşıp ulaşamayacağını araştırıyordu3. Harms, antik proteinin binlerce değişik çeşidini yaratıp inceleyerek, onun aynı işlev değişimine uğramasıyla sonuçlanacak alternatif mutasyon zincirlerini tarıyordu. Nature dergisinde 2014 yılında yayımladıkları makalede, başka alternatif bulamadıklarını açıkladılar. Görünüşe göre evrim, nadir rastlanan bir fırsattan yararlanabilmişti.
Reseptör proteinin değişik çeşitlerinin biyofiziksel analizi, kortizole özgü bağlanmanın evrilmesine neden bu kadar az mutasyonun olanak tanıdığının anlaşılmasını sağladı. Bazı bölgelerin fazladan desteğe gereksinimi olmakla birlikte, reseptörün de ayrıca iki biçim arasında geçiş yapabiliyor olması gerekiyordu: Kortizol yokken inaktif bir yapı ve hormon bağlandığında gen aktifleştirici bir yapı. Mutasyonların bazıları reseptörün aktif biçimini fazlasıyla durağanlaştırıyordu ve “daima açık” konfigürasyonuna sabitliyordu. Mutasyonların ayrıca, işlev değiştirici mutasyonlar işe karışmadan önce, kendi başlarına ata proteine uyumlu olması gerekiyordu. “Bir mutasyonun tüm bu koşulları sağlaması gerekir ve bu da pek kolay bir şey değil. Izin veren mutasyonların (bu işlevsel değişim için) neden bu denli nadir olduklarının açıklaması böyle olsa gerek,” diyor Thornton.
Fakat her yeni işlevin, karmaşık epistatik etkileşimlerin sonucu olduğu da söylenemez. Geçtğimiz Ocak ayında eLife dergisinde yayımladıkları makalede Thornton ve Oregon Üniversitesi’nden Ken Prehoda, tek bir amino asit değişimi sonucunda yepyeni bir işlev kazanan antik bir protein tanımladı4. Ekip, hücrelerin bölünmeden önce uzayda yönelimlerini ayarlamalarına yardım eden bir hayvan proteinin kökenini araştırdı. Gelişen bir bedende yeni hücrelerin doğru yerlerde konumlamları açısından bu çok önemlidir. Çok hücreli organizmaların ortaya çıkmasından önce tek hücreli yaşam formlarının bunu doğru yapıyor olmaları gerekiyordu.
Thornton, Prehoda ve ekip arkadaşları, proteinin GKPID (PID: protein etkileşim alanı. [İng. protein-interaction domain]) adı verilen ve bölünme sırasında iskele görevi görerek hücrelerin yönelimlerini düzenleyen bir parçasına odaklandı. GKPID‘nin milyar yıllık atası buna benzer hiçbir şey yapmıyordu. Modern guanilat kinaz enziminin atası olan bir enzim öncülüydü ve hücrelerin DNA’nın yapıtaşlarından bazılarını yaparken kullandığı bir kimyasal tepkimeyi katalizliyordu. Şaşırtıcı ama tek bir mutasyon, bu atalardan kalma proteini enzimden iskeleye dönüştürmeye yetmişti.
Evrimi şekillendiren fiziksel ilkeler hakkında genel kuramlar geliştirmek için neden daha fazla proteinin evrimsel tarihlerinin anlaşılması gerektiğini, bu örnekten anlayabiliriz. İnsanlar ne zaman bir proteini ayırsalar, yeni bir özellik görüyorlar. Neyse ki hızlanan bilgisayarlar, gelişen yazılımlar ve referans genomların artan sayısı sayesinde, atalardan kalma proteinlerin yeniden yapılandırılmasına ilişkin araştırmalar ilerliyor.
Farklı Adımlarla Aynı Noktaya Varılabilir
Şansa bağlı olaylar evrimin önüne serilecek olasılıkları değiştirebilirken, evrilen proteinlerin keşfe çıkabilecekleri bir özgürlük alanları da mevcut. Bazı işlevlere ulaşmak için seçebilecekleri birden fazla yol olabiliyor. Brandeis Üniversitesi’nden biyokimyacı Douglas Theobald, pek çok hücrenin oksijensiz enerji üretmek için kullandığı bir enzim üzerinde yaptığı araştırmada bunu görmüş. Laktat dehidrojenaz enzimi, yapısal olarak benzer enzimlerden sadece bir kez evrilmemiş; farklı organizma gruplarında en az dört kez evrilmiş5.
Benzer bir enzim olan malat dehidrojenaz enzimini, laktat dehidrojenaz enzimine dönüştüren evrimsel olayları yeniden yapılandırarak, Theobald ve ekibi şunu buldu: İki adet tek hücreli parazit grubu, aynı enzim tarafından farklı yollarla ortaya çıkmıştı. Bu bulgular eLife dergisinin 2014 sayısında ve Protein Science dergisinin geçen Şubat sayısında yayımlandı. Yapılan çalışma, farklı genetik alt yapıların evrimin rotasını farklı organizmalarda farklı yollara kırabildiğini, fakat yine de benzer sonuçlara ulaşılabildiğini gösteriyor. “Çok miktarda epistasis olsa bile, aynı işleve götürebilecek yine de bir çok yol olabilir,” diyor Theobald.
California Üniversitesi Berkeley Kampüsü’nden Susan Marqusee, bir proteinin yeni bir şeyler yapmaya başlaması için birden fazla yol olduğunu gören bir başka araştırmacı. Marqusee, Thornton’un ekibiyle ortak çalışma yaparak, iki farklı bakterinin (Escherichia coli ve sıcağı seven Thermus thermophilus) çok farklı sıcaklıklarda aynı işi yapacak enzimleri nasıl geliştirdiklerini incelemiş.
T. thermophilus çoğu proteinin parçalanmasına neden olacak yüksek sıcaklıktaki su kaynaklarına bayılıyor. Biyokimyacılar, doğanın bu bakteride uyguladığı stratejilerden yararlanarak ısıya dayanıklı proteinlerin mühendisliğini yapmaya karar verdi. Dolayısıyla bu özellikten sorumlu olan genel ilkeleri bulmaları gerekiyordu. E. coli ve T. thermophilus’taki H1 enzimlerinin ortak atasını yeniden yapılandırarak, Marqusee’nin ekibi bakteriyel proteinin ısıyla nasıl başa çıktığını anlamayı başardı.
Ekibin 2014 yılında PLOS Biology’de yayımladığı makaleye göre, 3 milyar yıl öncesinden kalma ortak ata, T. thermophilus’un bugün kullandığı enzimden daha az durağandı6. Isıya dayanaklı protein evrilirken, durağanlığı giderek artmıştı; tek bir yenilikten ötürü değil, farklı zamanlarda ayrı biyofiziksel stratejilerden dolayı. “Fiziksel kimya, sonuçta doğru fenotipe götürdüğü sürece pek sorun değildir,” diyor Marqusee. Evrim, durağanlığı desteklemek için farklı amino asitlerden farklı yollarla yararlanabildiği için enzimin artmakta olan ısıya dayanıklılığı, belli mutasyon dizilerinin şans eseri varolmasına bağlı değildi.
Evrimin İzleyeceği Yol Tahmin Edilebilir mi?
Proteinlerin geçmişte nasıl evrildiklerinin incelenmesi sayesinde, evrimin gelecekte nasıl ilerleyeceğine ilişkin bir fikir edinmek pek mümkün değil. “Ortaya çıkan tabloya bakılırsa, şansın rolü o denli büyük ki, gelecekte evrimin nasıl ilerleyeceğine ilişkin uzun vadeli öngörü yapmak riskli olur,” diyor Thornton. Yapılan çalışmalar, bugünkü proteinlerin neden yapmakta oldukları şeyi yaptıklarına ilişkin yanıtlar sunmaları açısından yine de çok önemli.
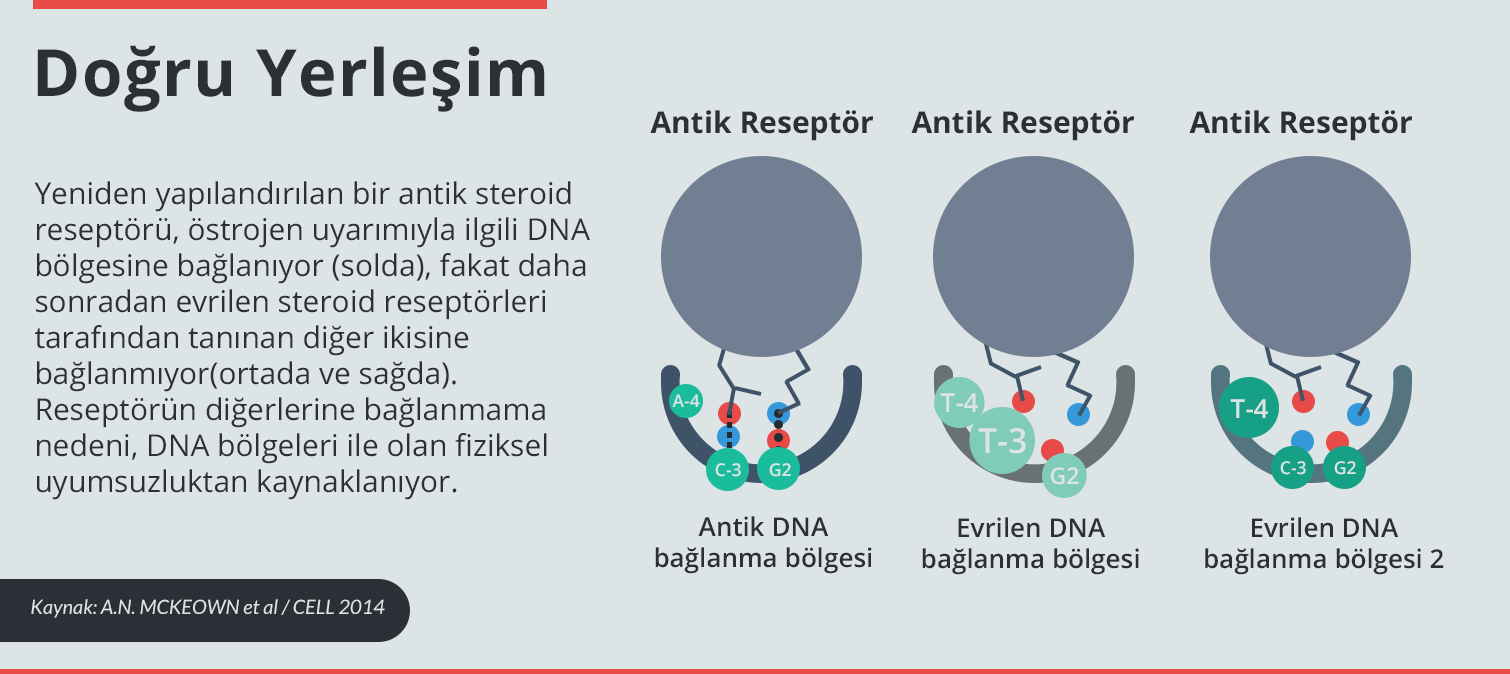
Yüksek boyutta görmek için görselin üzerine tıklayın.
Thornton’un çalışmasından bir örnek vermek gerekirse, steroid reseptörlerindeki DNA bağlanma bölgelerinin, DNA hedefleri ile birlikte nasıl evrildiğinden söz edebiliriz. Hormon aktiveli reseptörler, belli genleri açmak için DNA’nın özel kısımlarına bağlanan transkripsiyon faktörü görevi görüyor. 2014 yılında Thornton’un ekibi Cell dergisinde yayımladıkları yazıda, atalardan kalma proteinlerden birindeki büyükçe bir amino asitin, bugünkü steroid reseptörlerinin çoğu tarafından beğenilen DNA bölümüne proteinin bağlanmasını engellediği açıklandı7. Antik protein tuhaf bir şekilde DNA’dan geri sıçrıyordu ve tutunmasına yetecek teması sağlayamıyordu. Reseptörün yeni özelliğini kazanması, mutasyonların bu engellere son vermesi ile oldu.
Araştırmacılar çoğu zaman birbirleri ile ilişkili iki protein arasındaki hangi farkların onları farklı davranmaya ittiğini söyleyemez. Ama evrimsel yollarını yeniden yapılandırmak, onları doğru yöne sevk edebilir. Theobald ile Brandeis Üniversitesi’nden meslektaşı Dorothee Kern, kronik miyeloid lösemi ile ilgili büyümeyi sağlayan bir protein olan Abl’nin, ilişkili olduğu Src proteininden nasıl farklılaştığını inceledi. Araştırmacılar, kansere karşı geliştirilen Gleevec ilacının neden Abl’ye bağlanıp kapatırken, benzer yapıdaki Src’yi engellemediğini bilmek istiyordu. Theobald, Kern ve çalışma arkadaşları, Abl’de Gleevec’in bağlanması konusunda önem taşıyan 15 amino asit belirledi. Bu amino asiter, iki farklı konfigürasyon arasında protein geçişlerinin nasıl olacağını etkiliyordu. Elde edilen bulgular geçtiğimiz yıl Science dergisinde yayımlanan bir makale ile paylaşıldı8.
Bazı proteinler veya protein kısımları, içsel olarak evrime diğerlerinden daha açık olabilir. Çok hızlı evrilen bir viral protein olanhemagglutinin’in belli kısımları değişime karşı alışılmadık derecede dayanıklıdır. Konu üzerinde çalışan Bloom ve Bargavi Thyagarajan’ın 2014’te eLife dergisinde yayımladıkları makaleye göre, hemagglutinine karşı geliştirilen antibiyotikler bağışıklık sisteminin gribe karşı en iyi savunması olmakla birlikte, protein de yakalanmadan sızmakta ustaydı9.
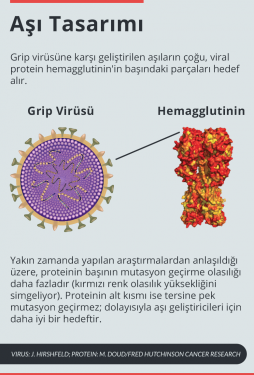
Yüksek boyutta görmek için görselin üzerine tıklayın.
Araştırmacılar nispeten yeni bir yöntem kullandı: Derin Mutasyonel Tarama. Bu sayede laboratuvarda yetiştirilen virüslerdeki hemagglutinin proteinlerini, mümkün olan neredeyse tüm amino asit değişiklikleri ile yapılandırıp sınadılar. Bir ev sahibinde, hemagglutinini bağışıklık sisteminden saklayacak değişimler avantajlı oluyordu. Laboratuvar ortamında saklancak bir bağışıklık sistemi olmasa da, virüsler yine de proteinin başka yerlerindeki değişikliklerden çok, hemagglutinin parçalarındaki değişikliklerde hayatta kalabildi. Bloom ve lisansüstü öğrencisi Michael Doud, proteinin daha detaylı bir görüntüsünü ve mutasyona dayanabilen bölgelerini, Nisan ayındabioRxiv.org sitesinde yayımladıkları makale ile paylaştı.
Bu virüs için iyi ama insanlar için kötü. Görünüşe bakılırsa hemagglutinin, tam da aşı üreticilerinin aynı kalmasını isteyecekleri bölgelerinde fazlasıyla değişiklik yapabiliyor. Araştırmacılar aşı hazırlayanların hemagglutinin’in mutasyona daha dayanıksız olan bölgelerini hedef almalarını öneriyor. Bu stratejiyi uygulamaya koyan laboratuvarlar oldu bile. Henüz neden hemagglutinin belli parçalarının değişimleri daha iyi karşıladığı açık değil. Bloom ileride bunu da anlamayı umuyor.
“Evrimi hiçbir zaman tam olarak öngöremeyeceğiz, çünkü son derece stokastik bir süreç,” diyor Bloom. “Ama sanıyorum bizi etkileyen evrimsel süreçlerin çoğu hakkında daha iyi tahminler yapabiliriz. Bunlar gerçekten zorlayıcı problemler, ama galiba deneylerden yararlanabileceğimiz bir noktaya varıyoruz ve moleküler düzeyde olanları anlamak, süreç hakkında düşünmemize yardımcı oluyor.”
Kaynak:
- Bilimfili,
- Science News, “Scientists dig up proteins from the past”
< https://www.sciencenews.org/article/scientists-dig-proteins-past >
Notlar:
[1] Lizhi Ian Gong Marc A Suchard Jesse D Bloom Stability-mediated epistasis constrains the evolution of an influenza proteine eLİFE DOI: http://dx.doi.org/10.7554/eLife.00631 Published May 14, 2013 Cite as eLife 2013;2:e00631
[2] Jamie T. Bridgham, Eric A. Ortlund & Joseph W. Thornton An epistatic ratchet constrains the direction of glucocorticoid receptor evolution Nature 461, 515-519 (24 September 2009) | doi:10.1038/nature08249; Received 12 May 2009; Accepted 30 June 2009
[3] Michael J. Harms & Joseph W. Thornton Historical contingency and its biophysical basis in glucocorticoid receptor evolution Nature 512, 203–207 (14 August 2014) doi:10.1038/nature13410 Received 24 January 2014 Accepted 28 April 2014 Published online 15 June 2014
[4] Douglas P Anderson Dustin S Whitney Victor Hanson-Smith Arielle Woznica William Campodonico-Burnett Brian F Volkman Nicole King Joseph W Thornton Kenneth E Prehoda Evolution of an ancient protein function involved in organized multicellularity in animals DOI: http://dx.doi.org/10.7554/eLife.10147 Published January 7, 2016 Cite as eLife 2016;5:e10147
[5] Jeffrey I Boucher Joseph R Jacobowitz Brian C Beckett Scott Classen Douglas L Theobald An atomic-resolution view of neofunctionalization in the evolution of apicomplexan lactate dehydrogenases DOI: http://dx.doi.org/10.7554/eLife.02304 Published June 25, 2014 Cite as eLife 2014;3:e02304
[6] Kathryn M. Hart, Michael J. Harms, Bryan H. Schmidt, Carolyn Elya, Joseph W. Thornton, Susan Marqusee Thermodynamic System Drift in Protein Evolution PLOS Biology Published: November 11, 2014http://dx.doi.org/10.1371/journal.pbio.1001994
[7] Alesia N. McKeown4, Jamie T. Bridgham, Dave W. Anderson, Michael N. Murphy, Eric A. Ortlund, Joseph W. Thornton Evolution of DNA Specificity in a Transcription Factor Family Produced a New Gene Regulatory Module Cell DOI: http://dx.doi.org/10.1016/j.cell.2014.09.003
[8] C. Wilson, R. V. Agafonov, M. Hoemberger, S. Kutter, A. Zorba, J. Halpin, V. Buosi, R. Otten1, D. Waterman, D. L. Theobald, D. Kern Using ancient protein kinases to unravel a modern cancer drug’s mechanism Science 20 Feb 2015: Vol. 347, Issue 6224, pp. 882-886 DOI: 10.1126/science.aaa1823
[9] Thyagarajan B, Bloom JD The inherent mutational tolerance and antigenic evolvability of influenza hemagglutinin. Elife. 2014 Jul 8;3. doi: 10.7554/eLife.03300.




















Yorum yazabilmek için oturum açmalısınız.