- Gadolinyum, Gd sembolü ve atom numarası 64 olan kimyasal bir elementtir. Manyetik rezonans görüntüleme (MRI) dahil olmak üzere çeşitli tıbbi uygulamalarda kullanılan nadir toprak elementidir.
- Butrol, bir dizi farmasötik ilaçta bulunan bir kimyasal gruptur. Gadolinyumun vücuttaki çözünürlüğünü artırmaya yardımcı olduğu düşünülmektedir.
- “Gadobutrol” kelimesi, “gadolinium” ve “butrol” kelimelerinin birleşimidir.
- Gadolinyum, MRI da dahil olmak üzere çeşitli tıbbi uygulamalarda kullanılan nadir bir toprak elementidir.
- Butrol, bir dizi farmasötik ilaçta bulunan bir kimyasal gruptur.
- Gadobutrol ilk olarak 1990’ların başında kullanıldı.
- Gadobutrol, MRI taramalarında kullanılan gadolinyum bazlı bir kontrast maddedir.
- Gadobutrol, Gadavist ticari adı altında pazarlanmaktadır.
Gadovist (gadobutrol), manyetik rezonans görüntüleme (MRI) taramalarında kontrast maddesi olarak kullanılan bir marka reçeteli ilaçtır. Vücudun belirli bölgelerinin taramada daha net görünmesine yardımcı olur. Bu ilaç, gadolinyum bazlı kontrast maddeler (GBCA’lar) olarak bilinen bir ilaç sınıfına aittir.
Gadovist, manyetik rezonans görüntüleme (MRI) için makrosiklik, iyonik olmayan bir kontrast maddesi olan gadobutrol içerir. Tanısal görüntülemede anormal vaskülaritenin (kan temini) veya kan-beyin bariyerinin bozulmasının görselleştirilmesini geliştirir.
Farmakodinamik olarak Gadovist (gadobutrol), manyetik rezonans görüntüsünü bozan güçlü bir manyetik sinyal oluşturur. Gadolinyum iyonunun paramanyetik özellikleri bu bozulmanın nedenidir.
Farmakokinetik olarak, Gadovist (gadobutrol) metabolizmaya uğramaz ve değişmeden idrarla atılır. İntravenöz enjeksiyondan sonra hücre dışı boşlukta hızla dağılır ve böbreklerde glomerüler filtrasyon yoluyla elimine edilir. Eliminasyon yarı ömrü yaklaşık iki saattir.
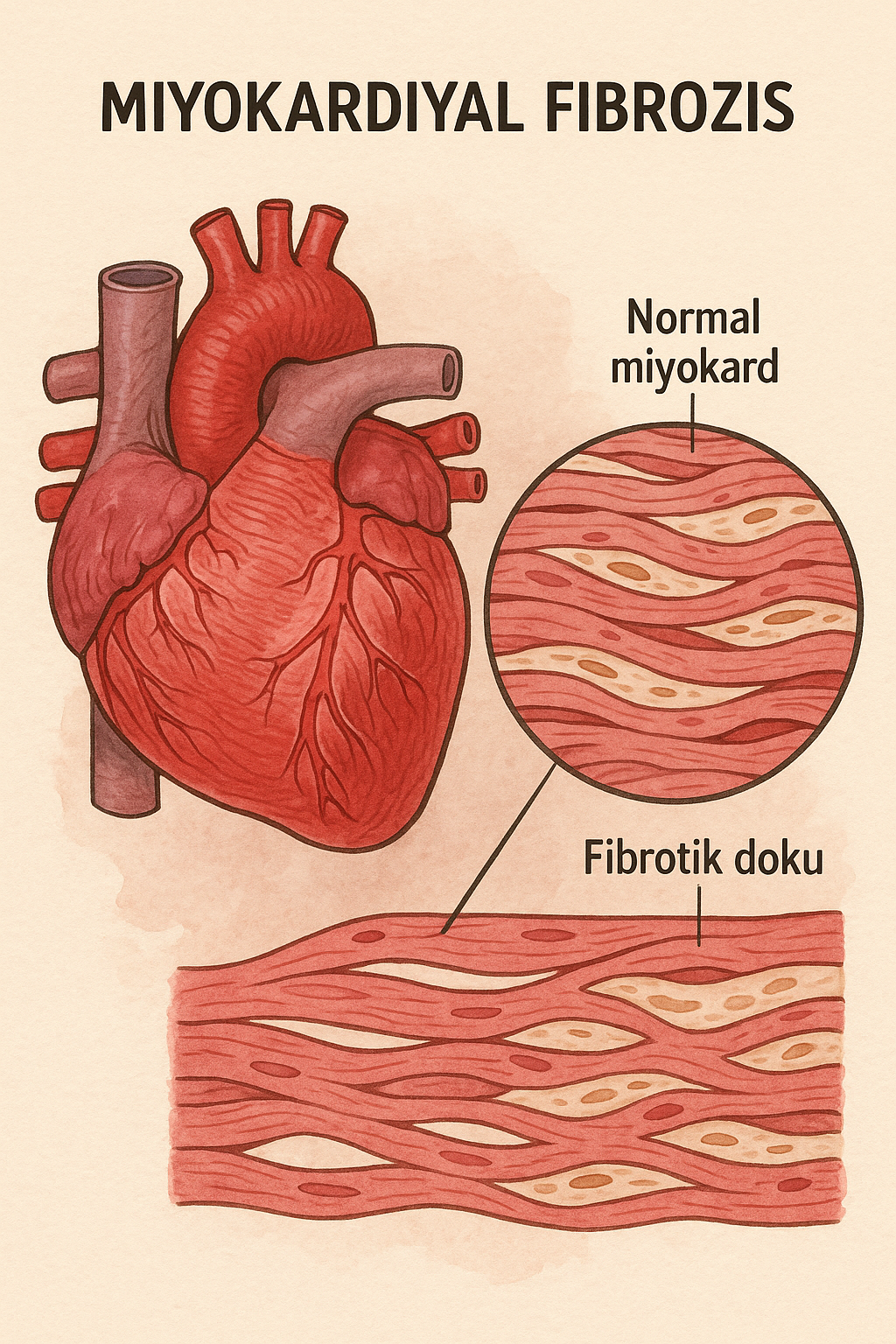
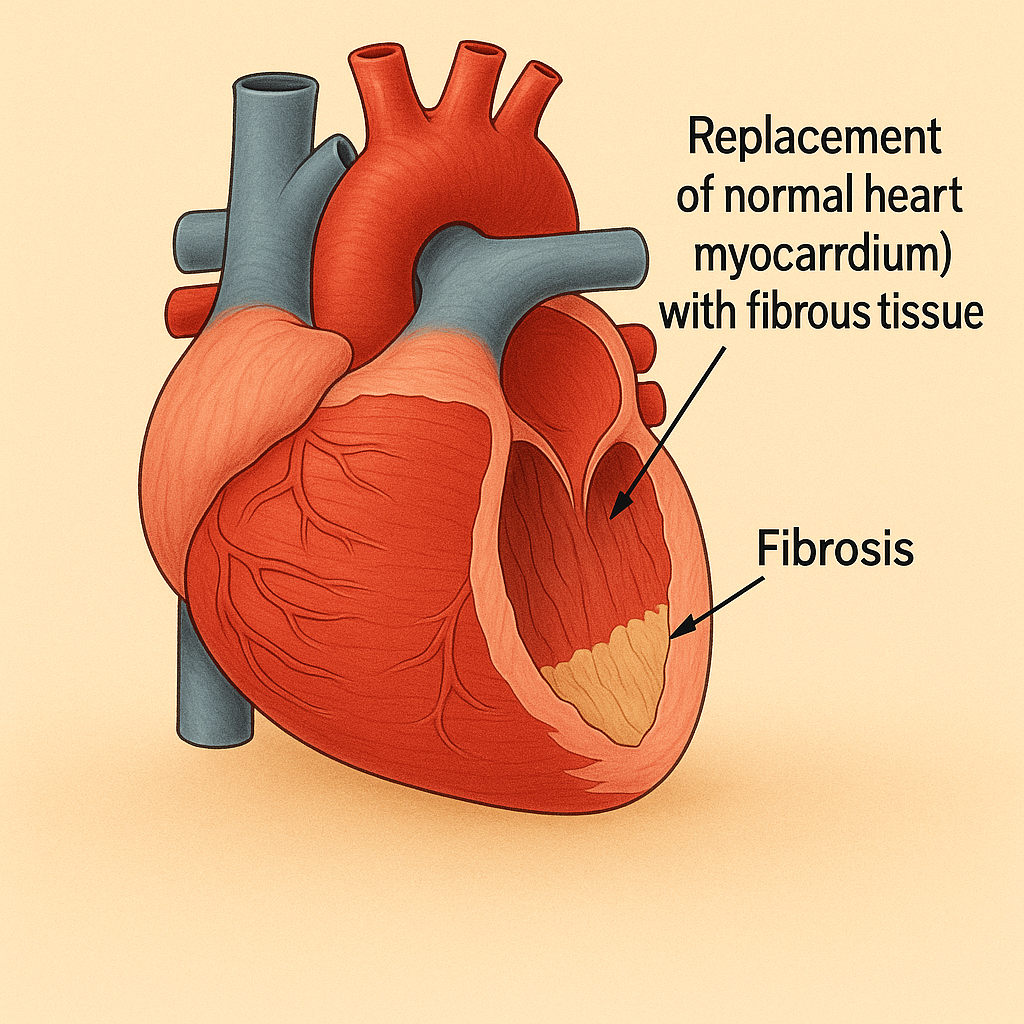
Gadovist’i kullanmadan önce, gadolinyum bazlı kontrast maddeler, şiddetli böbrek yetmezliği olan hastalarda cilt, eklemler, gözler ve iç organların fibrozunu içeren nadir ve ciddi bir sendrom olan nefrojenik sistemik fibroz (NSF) riskini artırdığından, hastanın böbrek fonksiyonu değerlendirilmelidir.
Dozaj:
Bir hastaya verilen Gadovist (gadobutrol) dozu, hastanın vücut ağırlığı, yapılan tarama türü ve görüntüleme merkezinin özel protokolleri dahil olmak üzere birkaç faktöre bağlı olarak değişebilir.
Bununla birlikte, ürünün reçete bilgisine göre, çoğu yetişkin ve 2 yaş ve üzeri çocuklar için önerilen doz 0,1 mmol/kg vücut ağırlığıdır (0,1 mL/kg vücut ağırlığına eşdeğer). Örneğin, 70 kg’lık bir kişi 7 mL Gadovist dozu alacaktır.
Uygulanacak dozun nihai olarak belirlenmesinin her zaman MRG’de kontrast madde kullanımı konusunda deneyimli ve hastanın tıbbi durumu ile görüntüleme prosedürünün özelliklerini bilen bir sağlık uzmanı tarafından yapılması gerektiğine dikkat edilmelidir.
Tüm ilaçlarda olduğu gibi, GADOVİST’in dozu, hasta özelliklerine ve yapılan MRG tipine göre bireyselleştirilmelidir. Yeterli görüntüleme elde etmek için gereken en düşük doz her zaman kullanılmalıdır.
Yaygın yan etkiler arasında baş ağrısı, mide bulantısı ve baş dönmesi yer alır, ancak kardiyovasküler, solunum veya kutanöz belirtilerle seyreden anafilaktoid veya anafilaktik reaksiyonlar da dahil olmak üzere şiddetli reaksiyonlara (şok dahil) kadar değişen ciddi reaksiyonlar da mümkündür ve acil tıbbi müdahale gerektirir.
Gadovist’in yalnızca hastayı doğrudan denetleme ve anafilaktik veya anafilaktoid reaksiyonlar durumunda tıbbi olarak yeterli tedavinin mevcut olmasını sağlama yetkisine sahip bir hekimin gözetimi altında uygulanması gerektiğini lütfen unutmayın.
Tarih
Gadobutrol adı ilk olarak 1990’ların başında ilaç şirketi Bayer AG tarafından geliştirildiğinde kullanıldı. Gadobutrol, MRI taramalarında kullanılan gadolinyum bazlı bir kontrast maddedir. Gadavist ticari adı altında pazarlanmaktadır.
Kaynak:
- Gadovist Prescribing Information. Bayer Healthcare Pharmaceuticals Inc. (https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/201277s000lbl.pdf)
- Radiologyinfo.org. Gadolinium-based Contrast Materials. (https://www.radiologyinfo.org/en/info.cfm?pg=safety-contrast-gadolinium)
- Drugs.com. Gadovist. (https://www.drugs.com/monograph/gadovist.html)

Yorum yazabilmek için oturum açmalısınız.