- Terim Kökeni: Latince lympha (“su”) + Yunanca -oma (“tümör”) kelimelerinden türetilmiştir.
- Açıklama: Lenfatik sistemde (bağışıklık sisteminin bir parçası) kaynaklanan ve lenfositlerin (beyaz kan hücreleri) anormal büyümesini içeren bir kanser.
- 1832’den beri Hodgkin lenfoma (HL) ve Hodgkin olmayan lenfoma (NHL) olarak ikiye ayrılır. Her yaş grubunu etkiler ve B hücreli veya T hücreli soyları içerir.
Sınıflandırma
- Hodgkin Lenfoma (HL): Reed-Sternberg hücreleriyle karakterizedir; modern tedavilerle mükemmel prognoz gösterir.
- Alt tipler: Klasik HL (nodüler skleroz, karışık hücrelilik) ve nodüler lenfosit baskın HL.
- Hodgkin Olmayan Lenfoma (NHL):
- B hücreli NHL (%85-90 vaka) : Diffüz büyük B hücreli lenfoma (DLBCL, agresif) ve yavaş ilerleyen formlar (örn. foliküler lenfoma) gibi alt tipleri içerir.
- T hücreli NHL (örn. kutanöz T hücreli lenfoma): Genellikle agresiftir (örn. periferik T hücreli lenfoma); kutanöz T hücreli lenfomalar (örn. mikozis fungoides) öncelikle cildi etkiler.
- HL’den daha yaygındır; 25’ten fazla alt tip içerir (örn. diffüz büyük B hücreli lenfoma, foliküler lenfoma).
Epidemiyoloji
Hodgkin Olmayan Lenfoma (NHL)
- İnsidans (2022 ABD):
- Yeni vakalar: ~80.470 (44.120 erkek; 36.350 kadın).
- Ölümler: ~20.250 (11.700 erkek; 8.550 kadın).
- Küresel Yük: Gelişmiş ülkelerde daha yüksek (örn. ABD, Avrupa).
- Yıllık ABD Oranı: 100.000 kişide ~19 vaka.
Hodgkin Lenfoma (HL)
- Küresel Görülme Sıklığı: Yılda ~80.000 vaka.
- Yaşam Oranları:
- Erken evre: Modern tedaviyle (örn. ABVD kemoterapi + radyasyon) 5 yıllık sağ kalım oranı >%90.
Risk Faktörleri ve Nedenleri
- Bilinmeyen Neden: Çoğu vakada belirgin bir tetikleyici yoktur.
- İlişkili Riskler:
- İmmün Yetmezlik (HIV/AIDS, organ nakli alıcıları).
- Otoimmün hastalıklar (örn. romatoid artrit).
- Enfeksiyonlar (EBV, H. pylori, HTLV-1).
- Genetik yatkınlık.
Coğrafi Dağılım
- NHL: Gelişmiş ülkelerde daha yaygındır (yaşam tarzı/çevresel faktörler).
- HL: Bimodal yaş dağılımı (erken yetişkinlikte ve 55 yaşından sonra zirve yapar).
- Enfeksiyon Bağlantılı Lenfomalar:
- Burkitt lenfoması (EBV; Afrika).
- Gastrik MALT lenfoması (H. pylori; küresel).
Temel İstatistik Özeti
| Kategori | Ayrıntılar |
|---|---|
| En Yaygın Lenfoma | Hodgkin Olmayan Lenfoma (2022’de 80.470 ABD vakası, ~8.500 HL vakasına kıyasla). |
| Küresel Yaygınlık | NHL oranları Kuzey Amerika/Avrupa’da en yüksektir; HL dünya çapında benzerdir. |
| Yaşam Süresi | HL: >%90 5 yıllık sağ kalım (erken evre); agresif NHL: tedaviyle %60-70. |
| Ölüm Oranı | NHL, ABD’deki kanser ölümlerinin yaklaşık %4’ünü oluşturmaktadır. |
Önemli Çıkarımlar
- Lenfomalar, iki ana türü olan bağışıklık sistemi kanserleridir: HL ve NHL.
- NHL çok daha yaygındır (vakaların yaklaşık %90’ı) ancak HL’nin mükemmel sağ kalım oranları vardır.
- Risk faktörleri arasında bağışıklık disfonksiyonu ve enfeksiyonlar bulunur.
- Tedavi gelişmeleri (örn. CAR T hücre tedavisi) agresif alt tipler için sonuçları iyileştirmektedir.
Klinik Özellikler
- Birincil: Ağrısız, şişmiş lenf düğümleri (boyun, koltuk altı, kasık).
- Nodal: Ağrısız lenfadenopati (>1 cm, kalıcı ≥4 hafta).
- Ekstranodal Tutulum: Gastrointestinal sistem, cilt veya diğer organlar.
- Sistemik Semptomlar: Ateş, Yorgunluk, kaşıntı, kilo kaybı, gece terlemeleri (“B belirtileri“)
- Komplikasyonlar: Bağışıklık sistemi işlev bozukluğu (örn. otoimmün vaskülit), von Willebrand hastalığı (edinilmiş) gibi ikincil durumlar.
Tanı
1. Klinik Değerlendirme ve Başlangıç Bulguları
- Malign lenfomalar, lenfatik sistemin klonal olarak çoğalan lenfositlerinden kaynaklanan, lenf nodu mimarisinin bozulduğu heterojen bir kötü huylu hastalık grubudur.
- Benign (reaktif) lenf nodu büyümeleri ise genellikle enfeksiyon veya immün yanıtlarla ilişkili olup, poliklonal lenfosit artışı ve korunmuş nodal mimari ile karakterizedir.
- Klinik semptomlar; lenfadenopati, B semptomları (ateş, gece terlemesi, kilo kaybı), splenomegali/hepatomegali gibi bulguları içerebilir.
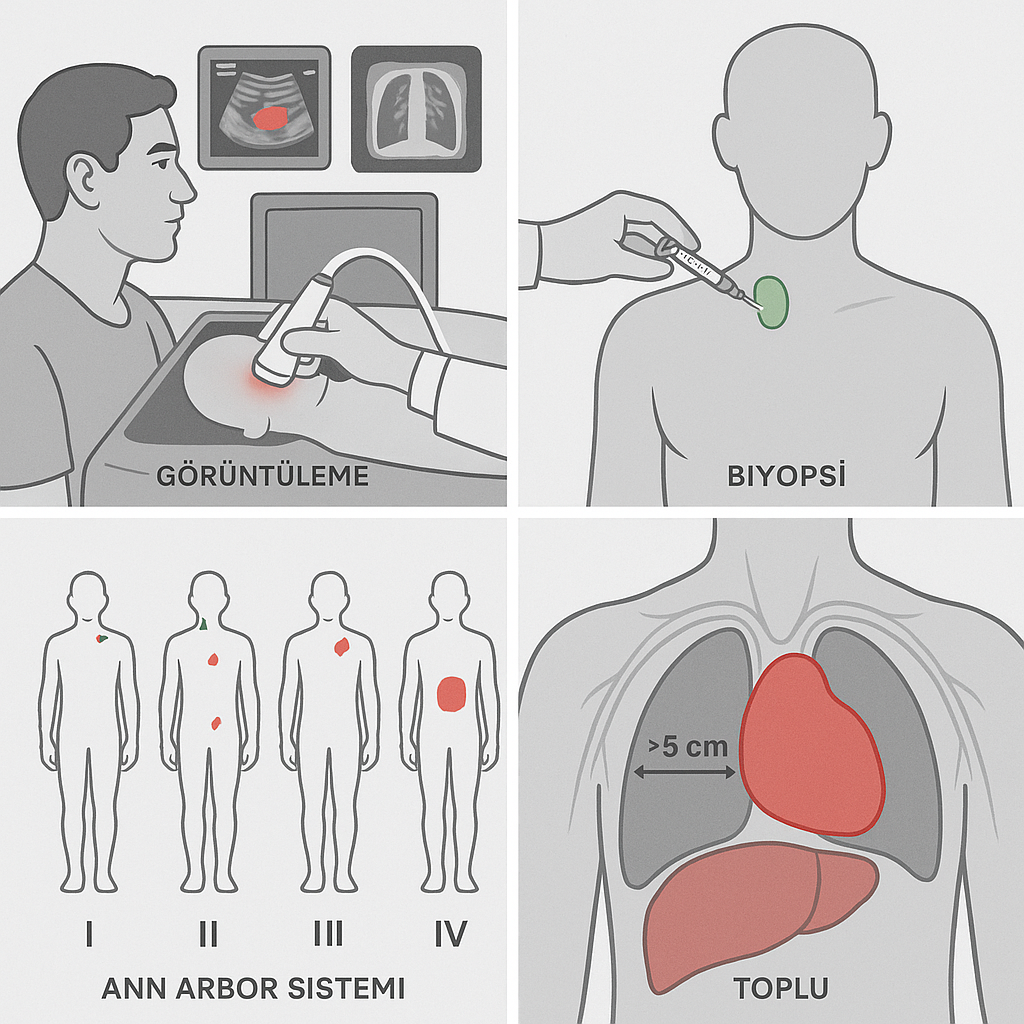
2. Görüntüleme Yöntemleri
- Nodal ve ekstranodal hastalığın yaygınlığının saptanması için temel görüntüleme teknikleri kullanılır:
- Ultrasonografi: Yüzeyel lenf nodlarının değerlendirilmesi.
- X-ışını: Toraks ve mediastinal kitlelerin ön değerlendirmesi.
- Bilgisayarlı Tomografi (BT) / Pozitron Emisyon Tomografisi-BT (PET-BT): Tüm vücut taraması ile hastalığın dağılımının ve evresinin belirlenmesi, özellikle tedavi öncesi ve sonrası takipte kullanılır.
3. Histopatolojik Doğrulama ve Biyopsi
- Altın standart tanı yöntemi: Eksizyonel lenf nodu biyopsisi.
- İnsizyonel ya da iğne biyopsileri çoğu zaman yeterli değildir.
- Alınan dokuda histolojik alt tipin belirlenmesi, immunfenotipleme ve klonalite analizleri yapılır.
- İmmunofenotipik Analiz:
- Yüzey belirteçleri (ör. CD30, CD15) özellikle Hodgkin lenfoma için ayırt edicidir.
- FACS (Fluoresan Aktive Hücre Sıralama) ile klonalitenin ve alt tipin tanımlanması sağlanır.
4. Laboratuvar Testleri
- Tam Kan Sayımı: Anemi, lökopeni, trombositopeni gibi sistemik bulguların değerlendirilmesi.
- Laktat Dehidrogenaz (LDH): Yüksekliği, tümör yükü ve prognoz ile ilişkili olabilir.
- Diğer: Karaciğer ve böbrek fonksiyon testleri, viral serolojiler (örn. EBV, HIV).
5. Ek Değerlendirmeler
- Kemik İliği Biyopsisi: Özellikle ileri evre hastalık şüphesi varsa, infiltrasyonun saptanması için gereklidir.
- Organomegali Araştırılması: Splenomegali ve hepatomegali fizik muayene ve görüntüleme ile değerlendirilir.
6. Evreleme
- Ann Arbor Evreleme Sistemi:
- Evre I: Tek bir lenf nodu bölgesi veya tek ekstranodal tutulum.
- Evre II: Diyaframın aynı tarafında iki veya daha fazla lenf nodu bölgesi.
- Evre III: Diyaframın her iki tarafında lenf nodu bölgeleri.
- Evre IV: Yaygın, dissemine ekstranodal tutulum (örn. kemik iliği, karaciğer).
- Toplu (Bulky) Hastalık:
- Lezyonların >5 cm (50 mm) olması veya mediastinal kitlenin toraks çapının >1/3’ünü kaplaması toplu hastalığı gösterir.
7. Ayırıcı Tanı
- Malign ve benign lenfadenopatilerin ayırıcı tanısında:
- Monoklonal çoğalma (malign) ve poliklonal proliferasyon (benign/enfeksiyöz mononükleoz) temel ayrım noktalarıdır.
- Örneğin, enfeksiyöz mononükleozda poliklonal lenfosit artışı izlenir.
8. Klinik Seyre Göre Alt Tipler
- İndolent Lenfomalar: Yavaş gelişen, genellikle uzun süreli seyirli (ör. folliküler lenfoma).
- Agresif ve Yüksek Dereceli Agresif Lenfomalar: Hızlı progresyon, yüksek proliferasyon oranı.
- Özel Alt Tipler:
- MALT lenfoması (özellikle Helicobacter pylori ile ilişkili).
- Hairy cell lösemi (kladribin ile tedavi edilebilen, uzun remisyon süresi sağlayan nadir alt tip).
Prognoz
- Olumlu: Hodgkin lenfoma (yüksek kür oranları).
- NHL’de değişken:
- Agresif T hücreli NHL: Kötü prognoz.
- Agresif B hücreli NHL (örn. DLBCL): Kemoimmünoterapi ile potansiyel olarak tedavi edilebilir (örn. R-CHOP).
- Yavaş ilerleyen B hücreli NHL: Kronik, yönetilebilir ancak tedavi edilemez.
Tedavi
Tedavi Seçenekleri
- Kemoterapi: Agresif lenfomalar için temel tedavi (örn. NHL için R-CHOP).
- Radyasyon Tedavisi: Lokalize hastalık için kullanılır.
- Kök Hücre Nakli: Nükseden/dirençli vakalar için.
- Hedefli Tedaviler: Monoklonal antikorlar (örn. rituksimab), CAR T hücre tedavisi.
İleri Tedaviler:
- CAR T hücreli Tedavi: Nükseden/dirençli B hücreli NHL için (örn. aksikabtagene siloleucel).
- Kemoterapisiz Rejimler: Polatuzumab-Rituximab-Glofitamab (hedefli CD20/CD79b) gibi kombinasyonlar.
Konvansiyonel Tedaviler: Radyasyon, kemoterapi (örn. HL için ABVD), immünoterapi.
Tedavi Komplikasyonları
- Sitokin Salınım Sendromu (CRS): CAR T hücre tedavisiyle ilişkilidir.
- Nörolojik Toksisite: ICE Puanı (Bağışıklık Etki Hücreleriyle İlişkili Ensefalopati) ile değerlendirilir ve kafa karışıklığı, nöbetler veya konuşma sorunları derecelendirilir.
- Enfeksiyonlar, sekonder maligniteler ve organ toksisitesi.
Keşif
Tarihsel Bağlam ve İlk Gözlemler
Lenfoma ile ilgili olabilecek en eski kayıtlı gözlem, İtalyan hekim Marcello Malpighi’nin “De viscerum structura exercitatio anatomica” (İki Lenfomanın Tarihsel Hikayesi: Bölüm I: Hodgkin lenfoması) adlı yayınında 18 yaşında bir kadının otopsisi sırasında bir vakayı tanımladığı 1666 yılına dayanır. O zamanlar açıkça HL olarak tanımlanmamış olsa da, bu gözlem erken bir açıklama olarak kabul edilir, ancak kesin doğası 17. yüzyıl patolojisinin sınırlamaları nedeniyle hala tartışılmaktadır.
Daha kesin bir dönüm noktası, 1832’de İngiliz hekim Thomas Hodgkin’in Londra’daki Tıbbi ve Cerrahi Derneği’ne, şu anda HL (Lenfoma – Wikipedia) olarak bildiğimiz lenfatik sistemdeki anormallikleri tanımlayan bir makale sunduğunda meydana geldi. Onun adına okunan bu çalışma, HL’nin tanınmasını resmileştirdi, hastalığa onun adını verdi ve gelecekteki araştırmalar için ortamı hazırladı.
NHL için tanınma daha kademeliydi. 1864’te Alman patolog Rudolf Virchow, lenf nodu büyümesini “lenfosarkom” olarak tanımladı; bu terim daha sonra NHL sınıflandırmasına katkıda bulundu (İki Lenfomanın Tarihsel Hikayesi: Bölüm II: Hodgkin Olmayan Lenfoma). Bunu 1865’te Julius Cohnheim’ın “psödoleukemi”yi tanıması izledi ve 1871’de Theodor Bilroth “malign lenfoma” terimini kullanarak lenfoid neoplazmların anlaşılmasını daha da genişletti.
Önemli Bilimsel Atılımlar
HL’yi anlamada önemli bir ilerleme, Reed-Sternberg hücrelerinin keşfiyle 1898 ile 1902 yılları arasında gerçekleşti. Avusturyalı patolog Carl Sternberg ve Amerikalı patolog Dorothy Reed Mendenhall, HL hastalarının lenf düğümlerindeki büyük, anormal hücreleri bağımsız olarak tanımladılar ve daha sonra Reed-Sternberg hücreleri olarak adlandırıldılar (Hodgkin Lenfomasının Tarihi – Hodgkin’s International). İlgili çalışmalarında ayrıntılı olarak açıklanan bu bulgu, HL’nin ayrı bir varlık olarak belirlenmesine yardımcı oldu ve biyolojisi ve genetiği üzerine daha fazla araştırma yapılmasını kolaylaştırdı.
NHL alt tiplerinin sınıflandırılması da 20. yüzyılın başlarında ilerledi. 1925’te Amerikalı doktorlar Nathan Brill ve Douglas Symmers, günümüzde foliküler lenfoma olarak bilinen ve yaygın bir NHL türü olan “dev foliküler lenfoma”yı tanımladılar (İki Lenfomanın Tarihsel Hikayesi: Bölüm II: Hodgkin Olmayan Lenfoma). Bu, NHL’nin heterojen bir hastalık grubu olarak giderek daha fazla tanınmasına katkıda bulundu.
Genetik ve viral bağlantılar anlayışı daha da geliştirdi. 1964’te araştırmacılar Anthony Epstein ve Yvonne Barr, epidemiyolojik ve laboratuvar çalışmaları yoluyla Epstein-Barr virüsünü (EBV) bir NHL türü olan Burkitt lenfomasına bağladılar (Hodgkin Lenfoma Tarihi – news-medical.net). Bu bağlantı, lenfoma gelişiminde bulaşıcı ajanların rolünü vurguladı. Sonraki genetik keşifler arasında, 1972’de Manolov ve Manolova tarafından tanımlanan Burkitt lenfomasındaki t(8;14) translokasyonu ve 1984’te foliküler lenfomadaki t(14;18) translokasyonu yer aldı; her ikisi de bu hastalıkların moleküler temellerinin anlaşılması için kritik öneme sahipti.
Sınıflandırma Sistemlerinin Gelişimi
20. yüzyılın ortalarında lenfomaları sistematik olarak sınıflandırma çabaları görüldü. 1956’da Henry Rappaport, 1966’da Silahlı Kuvvetler Patoloji Enstitüsü fasikülü tarafından değiştirilen ve lenfomaları morfolojiye göre kategorize eden organize bir sınıflandırma önerdi (İki Lenfomanın Tarihsel Hikayesi: Bölüm II: Hodgkin Olmayan Lenfoma). 1974’te Lukes ve Collins’in sistemi, Lennert ve Luke’un Kiel sınıflandırması ve Bennett ve ark.’nın İngiliz Ulusal Lenfoma Araştırması (BNLI) sınıflandırması dahil olmak üzere daha fazla sınıflandırma ortaya çıktı. 1.000 NHL vakasını inceleyen altı uzman ve altı uzman olmayan kişi tarafından geliştirilen Ulusal Kanser Enstitüsü’nün 1978 Çalışma Formülasyonu, lenfomaları düşük, orta ve yüksek dereceli kategorilere ayırdı. Daha sonra, 1994’teki Gözden Geçirilmiş Avrupa-Amerikan Lenfoma (REAL) sınıflandırması ve 2001 ve 2008’deki WHO sınıflandırmaları, hücre soyuna ve farklılaşmaya göre gruplandırarak bu kategorileri iyileştirdi.
Tedavi Önemli Noktaları
Tedavi ilerlemeleri 20. yüzyılın başlarında başladı. 1902’de Alman hekim P. Askanazy, X-ışınlarının keşfinden kısa bir süre sonra HL için X-ışını tedavisinin ilk başarılı kullanımını bildirdi ve bu, kanser tedavisinde beklenmedik bir erken uygulamayı işaret etti (Hodgkin Lenfoma Tarihi – Hodgkin’s International). Radyasyon tedavisi 1940’larda ve 1950’lerde daha da rafine hale gelerek HL için bir standart haline geldi.
Kemoterapi, 20. yüzyılın ortalarında önemli bir tedavi olarak ortaya çıktı. 1967’de Vincent DeVita ve meslektaşları HL için MOPP rejimini (mekloretamin, vinkristin, prokarbazin, prednizon) tanıttı ve tedavi sonuçlarını devrim niteliğinde değiştirdi (Hodgkin Lenfoma Tarihi – news-medical.net). NHL için CHOP rejimi (siklofosfamid, doksorubisin, vinkristin, prednizon) ilk olarak 1972’de McKelvey ve arkadaşları tarafından bildirildi ve tedavinin temel taşı haline geldi.
Lenfoma evrelemesi de ilerledi ve 1971’de HL için önerilen Ann Arbor evreleme sistemi tedavi planlamasına ve prognoz değerlendirmesine yardımcı oldu (Lenfoma – Wikipedia). Daha yakın tarihli gelişmeler arasında 1997 yılında NHL için rituksimab’ın onaylanması yer alır ve bu, monoklonal antikorlar gibi hedefli tedavilerin ortaya çıkmasını sağlayarak, belirli alt tiplerin sonuçlarını önemli ölçüde iyileştirir.
İleri Okuma
- Thomas Hodgkin (1832). On Some Morbid Appearances of the Absorbent Glands and Spleen. Medico-Chirurgical Transactions, 17, 68–114.
- Dorothy Reed Mendenhall (1902). On the Pathological Changes in Hodgkin’s Disease, with Special Reference to Its Relation to Tuberculosis. Johns Hopkins Hospital Reports, 10, 133–196.
- N.E. Brill, W. Symmers (1925). Multiple Tumors of Lymphoid Tissue. American Journal of Pathology, 1(1), 61–85.
- Denis Burkitt (1958). A Sarcoma Involving the Jaws in African Children. British Journal of Surgery, 46(197), 218–223.
- M.A. Epstein, B.G. Achong, Y.M. Barr (1964). Virus Particles in Cultured Lymphoblasts from Burkitt’s Lymphoma. The Lancet, 1(7335), 702–703.
- Harris, N. L., Jaffe, E. S., Stein, H., ve diğerleri. (1994). A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood, 84(5), 1361-1392.
- Isaacson, P. G., & Du, M. Q. (1994). MALT lymphoma: from morphology to molecules. Nature Reviews Cancer, 4(8), 644-653.
- E.S. Jaffe (1998). The molecular biology of lymphoma. Seminars in Oncology Nursing, 14(4), 292–300. https://doi.org/10.1016/s0749-2081(98)80006-5
- A.K. Gopal, O.W. Press (1999). The preclinical discovery of rituximab for the treatment of non-Hodgkin’s lymphoma. Seminars in Oncology, 26(5 Suppl 14), 3–6.
- Campo, E., Swerdlow, S. H., Harris, N. L., ve diğerleri. (2011). The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood, 117(19), 5019-5032.
- K. van Besien, H. Schouten (2007). Follicular lymphoma: a historical overview. Leukemia & Lymphoma, 48(2), 232–243. https://doi.org/10.1080/10428190601059746
- Tilly, H., Gomes da Silva, M., Vitolo, U., ve diğerleri. (2015). Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 26(suppl_5), v116-v125.
- Swerdlow, S. H., Campo, E., Harris, N. L., ve diğerleri. (2017). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4. Baskı, IARC, Lyon.

Yorum yazabilmek için oturum açmalısınız.