
Ters yönlü çalışan bir enzimin mekanizmasını inceleyen bilim insanları, DNA eşlenmesinin her zaman ileri yönde gerçekleşen bir biyolojik fenomen olduğu kanısına vardı. Burada bir kafa karışıklığına yer bırakmamak adına, DNA eşlenmesinin her iki zincirde de gerçekleştiğini ve 5′ (fosfat ucu) uçtan, 3′ uca (riboza bağlı hidroksil grubu) doğru gerçekleşmekte olduğunu belirtelim.
DNA ve RNA gibi nükleotitlerden oluşmuş olan zincirler, hali hazırda var olan zincirlerin kopyalarının üretilmesi yolu ile sentezlenir. Bu kopyalama olayı da her zaman ‘ileri’ yönde yani belirli bir uçtan diğer uca doğru gerçekleşir. DNA zincirleri birbirlerine zıt yönde dizili olduğundan, eşlenme sırasında tıpkı bir fermuar gibi bir uçtan açılarak her iki zincir için de ayrı eşlenme yani açılan karşı zinciri oluşturma süreci başlar.
Bu noktada DNA zincirlerinden birisi yani 3′ ucu açılmış olan zincire ard arda düzenli biçimde ve sırasıyla nükleotitler eklenerek o zincirin eşlenmesi gerçekleşirken; DNA zincirleri birbirine zıt yönlü olduğundan ayrılma sırasında 5′ ucu açılan zincire ise yine yönü 5′ – 3′ yönlü farklı nükleotit sayılarına sahip oligonükleotitler denen DNA parçaları bağlanarak eşlenir. Bu hali ile aslında her iki zincirde de 5′ yönden 3′ yöne doğru bir DNA eşlenmesi gerçekleşir. Asıl soru da burada ortaya çıkıyor: “Neden hücreler, iki zincirde de aynı verimlilikte DNA eşlenmesi sağlayacak ters-yönlü çalışan (3′ uçtan 5′ uca) bir enzime sahip değil?”
Son dönemde, Thg1-like proteins (TLPs) adı verilen ve ters yön olarak tanımlanan 3′ ucundan 5′ ucu yönüne doğru nükleotit ekleyen proteinler keşfedilmişti. Bu şekilde zıt yönlü nükleotit ekleyen moleküllerin son derece nadir olduğu biliniyor. TLP’ler de hasarlı RNA moleküllerinde zıt ucun ters yönde tamir edilmesini veya düzeltilmesini sağlayan proteinler olarak işlev görüyor.
Bu noktayı şöyle açıklayabiliriz; RNA molekülleri tek zincirli yapılar olduğu için normal düzende 5′ uçtan 3′ ucuna doğru nükleotitlerin eklenmesi ile sentezlenir. Ancak ilk eklenen nükleotitlerde yani 5′ uçtaki birimlerde hasar olduğu zaman RNA molekülleri TLP’ler gibi ters yönlü nükleotit ekleyen proteinlere ihtiyaç duyarlar. Aksi takdirde hata düzeltilemez veya sayısız hastalığa sebep olabilecek veya en iyi ihtimalle üretilen RNA’nın kullanılamamasına ve bozunmasına sebep olacaktır.
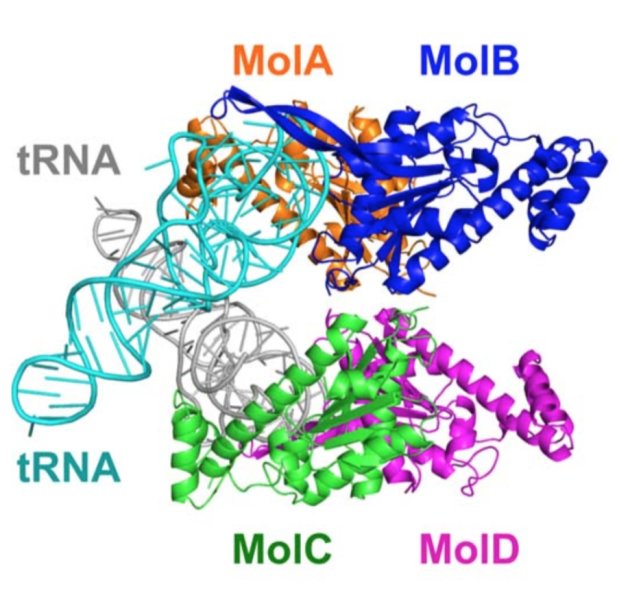
Çalışmada X-ışını kristalografi tekniği ile üç boyutlu yapıları ve birbirlerine göre konumları çözümlenen TLP kompleksi ve tRNA’lar-Telif : Kimura S. et al., Science Advances,
Science Advances’da yayımlanan yeni bir makalede Hokkaido University’den Min Yao ve ekibi, X ışını kristalografi (X-ray crystallography) tekniğinden yararlanarak TLP/RNA kompleksi yapılarını ve doğasını incelemeye koyuldu. Araştırmacılar bu yolla TLP’lerin ters yönde nükleotit ekleme görevini nasıl gerçekleştirdiğini ve belki de hücrelerde neden bu tip çalışan moleküllerin DNA eşlenmesi sırasında da çalışacak kadar yoğun bulunmadıklarını anlamayı hedefledi.
Yapılan yapısal analizler iki aşamalı bir sürecin varlığını ortaya koydu: enerji-verici moleküller işe dahil oluyor ve göreve başlıyor; daha sonra da nükleotit ekleniyor. Üstünkörü olarak bu şekilde özetlense de; ikinci aşama ‘ileri’ yönlü süreçte de mevcut. Ters yönlü sürece özel olarak yalnızca enerji ihtiyacının baştan karşılanması veya başka bir deyişle enerjinin işe başlaması bulunuyor. Belli ki enzim; bu enerji işe alımını, yönü ileriden ‘ters’e çevirmek üzere kullanıyor.
Araştırma ekibi, ulaştıkları sonuçlar üzerinden, DNA eşlenmesinin ters-yönlü enzimleri kullanamayacağını çünkü yapısal olarak çok daha karmaşık süreçleri barındırdığını ve de gerektirdiğini öne sürdü.
Ancak araştırmacılar, ileri ve ters yönlü olan mekanizmaların daha detaylı olarak incelenmesi ile DNA eşlenmesinin evrimsel kontekstini daha iyi anlaşılabileceğini öne sürüyor.
Kaynak :
- Bilimfili,
- Hokkaido University Web Sitesi, Uncovering the mystery of DNA replication, 13 Temmuz 2016 , https://www.oia.hokudai.ac.jp/blog/uncovering-the-mystery-of-dna-replication/
Makale Referans : S. Kimura, T. Suzuki, M. Chen, K. Kato, J. Yu, A. Nakamura, I. Tanaka, M. Yao. Template-dependent nucleotide addition in the reverse (3′-5′) direction by Thg1-like protein. Science Advances, 2016; 2 (3): e1501397 DOI: 10.1126/sciadv.1501397


 Genom değiştirme ( genetik değiştirme ) araçlarından CRISPR-bağıl sistem veya Cas ( DNA üzerindeki kümelenmiş ve aralarında boşluklar bulunan kısa palindromik nükleotit dizileri) olarak bilinen gen sistemlerii insan hücreleri, hayvan zigotları gibi model sistemlerde gen değiştirmek için sıkça kullanılıyor ve belirli klinik araştırmalar için de son derece kolay ve umut verici bir yöntem olarak yer alıyor. Bu DNA dizileri isteğe göre genleri değiştirmek üzere ilgili bölgeler hedef alınarak yerleştiriliyor ve genlerin işleyişi kontrol altında tutuluyor.
Genom değiştirme ( genetik değiştirme ) araçlarından CRISPR-bağıl sistem veya Cas ( DNA üzerindeki kümelenmiş ve aralarında boşluklar bulunan kısa palindromik nükleotit dizileri) olarak bilinen gen sistemlerii insan hücreleri, hayvan zigotları gibi model sistemlerde gen değiştirmek için sıkça kullanılıyor ve belirli klinik araştırmalar için de son derece kolay ve umut verici bir yöntem olarak yer alıyor. Bu DNA dizileri isteğe göre genleri değiştirmek üzere ilgili bölgeler hedef alınarak yerleştiriliyor ve genlerin işleyişi kontrol altında tutuluyor.

Yorum yazabilmek için oturum açmalısınız.