1. Tarihçe ve Geliştirme Süreci
- Droperidol ilk olarak 1960’lı yılların başında geliştirilmiştir.
- Antipsikotik ilaçlar sınıfında yer almakla birlikte, özellikle antiemetik ve sedatif etkileri nedeniyle öne çıkmıştır.
- Düşük dozlarda güçlü antiemetik özelliği, postoperatif bulantı ve kusma (PONV) tedavisinde yaygın kullanımına neden olmuştur.
- QT aralığı uzaması ve buna bağlı torsades de pointes gibi potansiyel kardiyak yan etkiler, özellikle 2001 yılından itibaren bazı ülkelerde düzenleyici uyarıların ve kullanıma sınırlamaların getirilmesine yol açmıştır.
2. Farmakodinamik Özellikler
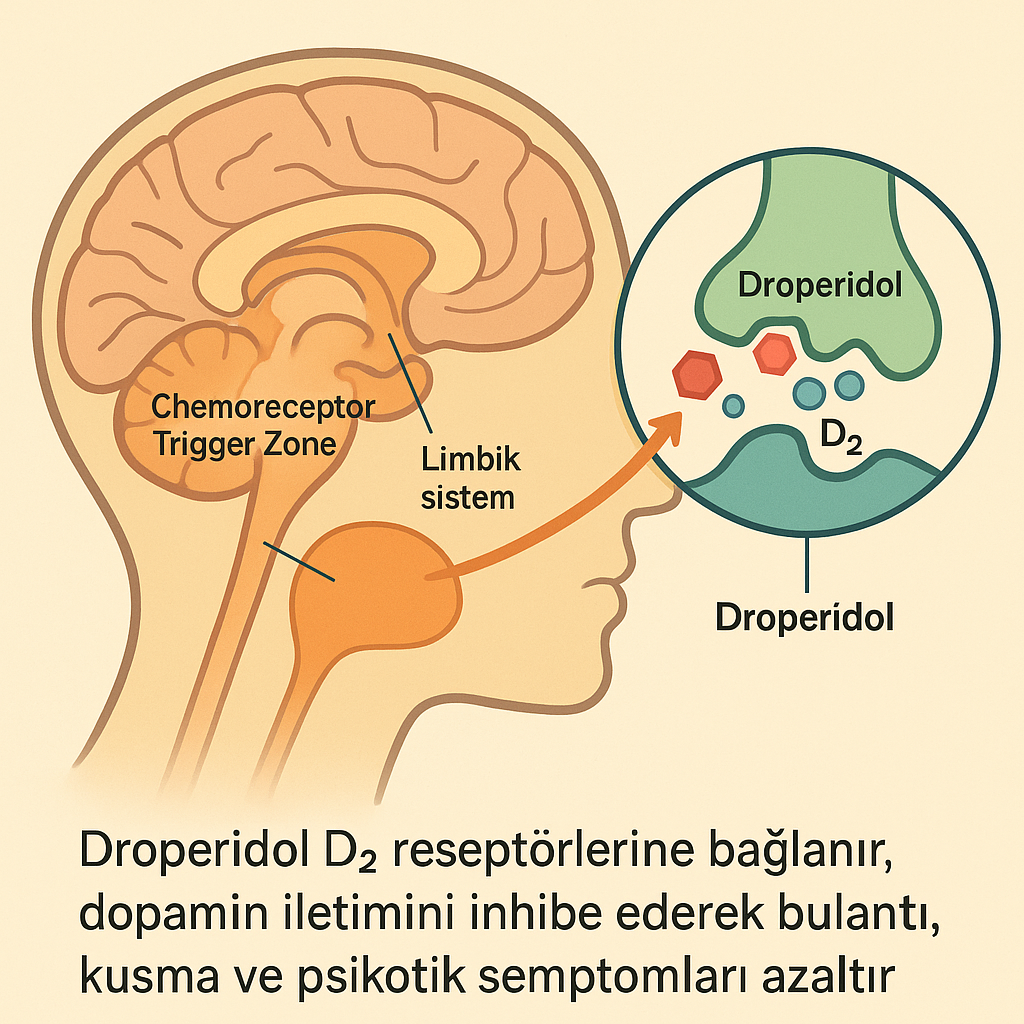
2.1. Dopamin D2 Reseptör Antagonizması
- Droperidol, beyinde dopamin D2 reseptörlerini bloke ederek dopaminerjik sinyallemeyi baskılar.
- Bu antagonizma sayesinde:
- Psikotik semptomların hafifletilmesine katkı sağlar.
- Kemoreseptör tetik bölgesinde (CTZ) dopaminin etkisini inhibe ederek bulantı ve kusmayı önler.
2.2. Alfa-adrenerjik Reseptörlere Etki
- α1-adrenerjik reseptörlere düşük ila orta dereceli afinite gösterir.
- Bu mekanizma üzerinden sedatif ve hipotansif etkiler ortaya çıkar.
2.3. Diğer Nörotransmitter Sistemleri
- Histamin, serotonin veya muskarinik reseptörler üzerinde anlamlı bir etkisi bulunmamakla birlikte, gabaerjik sistemle dolaylı etkileşimleri bildirilmektedir.
3. Farmakokinetik Özellikler
3.1. Emilim ve Dağılım
- İntravenöz yoldan uygulandığında hızlı bir başlangıç etkisi gösterir (etki başlangıcı: birkaç dakika).
- Vücutta geniş bir dağılım hacmine sahiptir; lipofilik özellikleri sayesinde santral sinir sistemine kolayca geçer.
3.2. Metabolizma
- Karaciğerde metabolize edilir; temel metabolik yol sitokrom P450 (özellikle CYP3A4) sistemidir.
- Etkin metabolitlere dönüşümü sınırlıdır.
3.3. Eliminasyon
- Metabolitleri öncelikle renal yolla atılır.
- Ortalama eliminasyon yarı ömrü 2–3 saat civarındadır.
- Sedatif etkisi genellikle 2–4 saat içinde sona erer; bu durum kısa süreli kullanımlarda avantaj sağlar.
4. Klinik Kullanım Alanları
4.1. Postoperatif Bulantı ve Kusma (PONV)
- Özellikle opioid bazlı anestezi protokolleri sonrası bulantı-kusmanın önlenmesinde etkilidir.
- Genellikle düşük dozlarda (0.625–1.25 mg IV) uygulanır.
4.2. Prosedürel Sedasyon
- Endoskopi, diş cerrahisi veya küçük cerrahi işlemler öncesinde hafif sedasyon amacıyla kullanılır.
- Midazolam veya opioidlerle kombine edilebilir.
4.3. Akut Ajitasyonun Yönetimi (Psikiyatrik Acil Durumlar)
- Psikotik kriz, manik atak veya ajitasyon gibi durumlarda hızlı sedasyon amacıyla intramüsküler veya intravenöz uygulanabilir.
- Bu kullanımda benzodiazepinlerle kombine protokoller sıklıkla tercih edilir.
5. Güvenlik Profili ve Kontrendikasyonlar
5.1. Kardiyak Yan Etkiler ve QT Uzaması
- En ciddi yan etki: QT intervalinin uzaması → torsades de pointes riskini artırabilir.
- Risk faktörleri:
- Hipokalemi, hipomagnezemi
- Diğer QT uzatan ilaçlarla birlikte kullanım
- Önceden var olan kardiyak hastalık
5.2. Diğer Yan Etkiler
- Sedasyon, hipotansiyon, ekstrapiramidal semptomlar (özellikle yüksek dozlarda)
- Nadiren: Disfori, huzursuzluk, anksiyete
5.3. Kontrendikasyonlar
- QT aralığı uzamış hastalar
- Ciddi elektrolit bozukluğu olan hastalar
- Parkinson hastalığı (dopaminerjik antagonizma nedeniyle kötüleşme riski)
5.4. Kullanım Önlemleri
- EKG izlemi önerilir, özellikle yüksek doz veya kardiyak risk faktörü olan hastalarda.
- Uygulama öncesi potasyum ve magnezyum düzeylerinin değerlendirilmesi gerekir.
6. Etkileşimler
- QT uzamasına yol açan ilaçlarla birlikte kullanım riski artırır (örn. sotalol, haloperidol, metadon).
- Santral sinir sistemi depresanlarıyla birlikte sedatif etkiler artabilir (örn. benzodiazepinler, alkol).
- CYP3A4 inhibitörleriyle birlikte droperidol düzeyleri artabilir (örn. ketokonazol, eritromisin).
7. Dozaj ve Uygulama Şekli
| Endikasyon | Doz Aralığı | Uygulama Yolu |
|---|---|---|
| PONV profilaksisi | 0.625–1.25 mg | IV |
| Sedasyon (prosedürel) | 2.5–10 mg | IV veya IM |
| Akut ajitasyon (psikiyatrik) | 5–10 mg | IM |
8. Güncel Klinik Kılavuzlarda Yeri
- Amerikan Anesteziyoloji Derneği ve Avrupa Anesteziyoloji Derneği, düşük doz droperidol kullanımını belirli durumlarda önermeye devam etmektedir.
- Kardiyak risk taşıyan hastalarda alternatif antiemetikler (örn. ondansetron, dexamethason) tercih edilmektedir.
Keşif
1. Tarihsel Arka Plan ve Geliştirme Süreci
1.1. Psikotrop İlaç Araştırmaları ve 1950’lerin Bilimsel Zemin Hazırlığı
1950’li yıllar, özellikle santral sinir sistemi üzerinde etkili ilk kuşak antipsikotik ilaçların keşfi açısından devrimsel bir dönemdir. Bu dönemde keşfedilen klorpromazin (1952), haloperidol (1958) ve diğer fenotiyazin türevleri, şizofreni ve psikotik bozuklukların semptomatik tedavisinde kullanılmaya başlandı. Ancak bu ajanların yaygın kullanımı, özellikle ekstrapiramidal semptomlar (EPS) ve sedasyon gibi belirgin yan etkilerle sınırlanıyordu.
Bu bağlamda, daha düşük toksisiteye sahip, ancak güçlü dopamin D2 reseptör antagonizması sağlayabilen yeni kimyasal yapıların geliştirilmesi, farmasötik araştırmaların öncelikli hedeflerinden biri hâline geldi.
1.2. Janssen Pharmaceutica ve Droperidol’ün Sentezi (1961)
Bu hedef doğrultusunda Belçika merkezli Janssen Pharmaceutica, 1959’dan itibaren bütirofenon türevleri üzerinde yoğunlaştı. 1961 yılında araştırmacı Paul Janssen liderliğindeki ekip tarafından sentezlenen droperidol, haloperidol ile benzer kimyasal yapı taşıyan, ancak bazı yapısal farklılıklar sayesinde farklı farmakokinetik ve farmakodinamik özelliklere sahip bir molekül olarak tanımlandı.
Droperidol’ün moleküler yapısı, haloperidol’le kıyaslandığında:
- Daha kısa etki süresi,
- Daha belirgin antiemetik etkiler,
- Sedatif özelliklerin daha ön planda olması gibi farklar sunuyordu.
İlk klinik çalışmalarda hem psikotik ajitasyon hem de ameliyat sonrası bulantı ve kusma üzerinde etkili olduğu gösterildi.
2. Klinik Öne Çıkış ve Yaygın Kullanım Dönemi (1960’lar–1990’lar)
2.1. Anesteziyoloji ve Cerrahi Kullanım Alanları
1960’ların ortalarında droperidol, Avrupa ve ABD’de intravenöz uygulama formu ile piyasaya sürüldü. Özellikle anestezi pratiğinde:
- Sakinleştirme ve anksiyolizis sağlamak,
- Opioidlerin ve uçucu anesteziklerin etkisini artırmak,
- Bulantı ve kusmayı önlemek amacıyla kullanılmaya başlandı.
Droperidol, sıklıkla fentanil ile kombine edilerek “neurolept-analjezi” adı verilen bir teknik içerisinde yer aldı. Bu kombinasyon, özellikle kardiyovasküler stabilitenin kritik olduğu cerrahi prosedürlerde (örn. kardiyotorasik cerrahi) tercih edildi.
2.2. Psikiyatride Kullanım
Ayrıca, akut psikotik tablolar, manik ataklar ve şiddetli ajitasyon durumlarında intramüsküler droperidol uygulaması, hastaların hızlı şekilde kontrol altına alınmasında etkili bulundu. Bu, özellikle psikiyatrik acil servisler ve ambulans hizmetleri gibi alanlarda droperidolün sık tercih edilmesine neden oldu.
2.3. Onkoloji ve Palyatif Bakım
Kemoterapiye bağlı bulantı ve kusmada (CINV), yüksek emetojenik ajanların kullanımında droperidol, diğer antiemetiklerle (örneğin metoklopramid) birlikte veya yerine tercih edildi.
3. Düzenleyici Zorluklar ve FDA Kara Kutu Uyarısı (2001)
3.1. QT Uzaması ve Torsades de Pointes Endişesi
1990’ların sonunda, çeşitli vaka raporları ve farmakovijilans verileri, droperidol’ün QT aralığını uzatma potansiyeline işaret etmeye başladı. Bu uzamanın, özellikle predispozisyonu olan hastalarda:
- Torsades de pointes (TdP),
- Ventriküler fibrilasyon gibi potansiyel olarak ölümcül aritmilere yol açabileceği bildirildi.
Bu gelişmeler üzerine ABD Gıda ve İlaç Dairesi (FDA), 2001 yılında droperidol için bir “black box warning” (kara kutu uyarısı) yayımladı. Bu uyarı, şu temel mesajları içeriyordu:
- 2.5 mg üzerindeki dozlarda ciddi kardiyak riskler gözlenebilir.
- Uygulama öncesi EKG ile QT aralığı ölçülmeli, gerekiyorsa monitörizasyon sağlanmalıdır.
3.2. Klinik Kullanımda Azalma
Kara kutu uyarısı, özellikle:
- Acil servislerde,
- Ameliyathanelerde,
- Onkolojik tedavi protokollerinde
droperidol kullanımında ani ve ciddi bir azalmaya yol açtı. Kullanıcılar, daha güvenli kabul edilen alternatiflere (örneğin ondansetron, granisetron, dolasetron) yöneldi.
4. Yeniden Değerlendirme ve Rehabilitasyon Süreci (2010’lar–Günümüz)
4.1. Klinik Kanıtların Güncellenmesi
2000’li yılların sonlarına doğru yapılan meta-analizler ve randomize kontrollü çalışmalar, droperidol’ün özellikle 0.625–1.25 mg gibi düşük dozlarda uygulandığında QT uzaması riskinin çok düşük olduğunu ortaya koydu. Bazı önemli bulgular:
- QT uzaması çoğu zaman doza bağımlı ve geçici niteliktedir.
- Yüksek riskli hastalar dışlandığında, anlamlı TdP riski oluşmaz.
- Ondansetron gibi diğer antiemetiklerin de benzer QT uzatma etkileri mevcuttur.
4.2. Kılavuzlara Geri Dönüş
Amerikan Anesteziyoloji Derneği (ASA) ve Avrupa Anesteziyoloji Derneği (ESA), droperidolün belirli doz aralıklarında ve izlem koşullarında güvenle kullanılabileceğini ifade eden öneriler yayımladı.
Bazı klinik kılavuzlarda droperidol:
- PONV profilaksisinde birinci veya ikinci basamak seçenek olarak,
- Ajitasyon yönetiminde düşük doz IM uygulama ile önerilmektedir.
5. Günümüzde Droperidol’ün Yeri ve Önemi
- Hızlı etki başlangıcı, çok yönlü klinik kullanımı ve kısa yarı ömrü, droperidol’ü hâlen bazı kritik durumlar için vazgeçilmez kılmaktadır.
- Güncel kullanımında odak noktası: Düşük doz, uygun hasta seçimi, EKG izlemi ile güvenli uygulamadır.
- Tarihçesi, ilaç güvenliği, farmakovijilans, klinik karar alma ve düzenleyici otoritelerin etkisi açısından öğretici bir örnek sunmaktadır.
İleri Okuma
- Janssen, P.A.J. (1962). The discovery of haloperidol and droperidol. Archiv der Pharmazie, 295(5), 433–436.
- De Wilde, R. (1970). Droperidol and its use in neuroleptanalgesia. British Journal of Anaesthesia, 42(9), 774–780.
- Reves, J.G., et al. (1981). Neurolept anesthesia: clinical pharmacology of droperidol. Anesthesiology, 54(4), 294–301.
- Reves, J. G., Fragen, R. J., Vinik, H. R., & Greenblatt, D. J. (1985). Midazolam: pharmacology and uses. Anesthesiology, 62(3), 310-324.
- McClellan, K.J., Spencer, C.M. (1998). Droperidol: a review of its use in the management of acute psychosis and aggression. Drugs, 56(6), 929–945.
- FDA (2001). Droperidol (Inapsine) labeling revision – boxed warning. U.S. Food and Drug Administration, Public Health Advisory.
- Gan, T. J. (2002). Risk factors for postoperative nausea and vomiting. Anesthesia & Analgesia, 94(5), 1160-1177.
- Gan, T.J. (2002). Postoperative nausea and vomiting—can it be eliminated? JAMA, 287(10), 1233–1236.
- White, P. F. (2002). Use of patient-controlled analgesia for management of acute pain. Journal of the American Medical Association, 287(14), 1868-1873.
- Habib, A.S., Gan, T.J. (2003). Droperidol for postoperative nausea and vomiting: is it really dangerous? CNS Drugs, 17(9), 629–638.
- Charbit, B., et al. (2005). Droperidol and QT interval prolongation: pharmacokinetic-pharmacodynamic modeling. Anesthesiology, 102(2), 416–425.
- White, P.F., et al. (2008). Use of low-dose droperidol as an antiemetic in outpatient surgery: efficacy and safety. Anesthesia & Analgesia, 106(2), 356–361.
- Nutt, D., King, L. A., & Phillips, L. D. (2010). Drug harms in the UK: a multicriteria decision analysis. The Lancet, 376(9752), 1558-1565.
- Muench, J., Hamer, A.M. (2010). Adverse effects of antipsychotic medications. American Family Physician, 81(5), 617–622.
- Apfel, C.C., et al. (2012). A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. New England Journal of Medicine, 366(7), 600–610.
- Kaye, A. D., et al. (2018). Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesthesia & Analgesia, 126(1), 411-418.
- Gillman, P.K. (2021). Droperidol and torsades de pointes: reappraisal of the black box warning. Australasian Psychiatry, 29(1), 89–91.







Yorum yazabilmek için oturum açmalısınız.