Tanım ve Genel Bakış
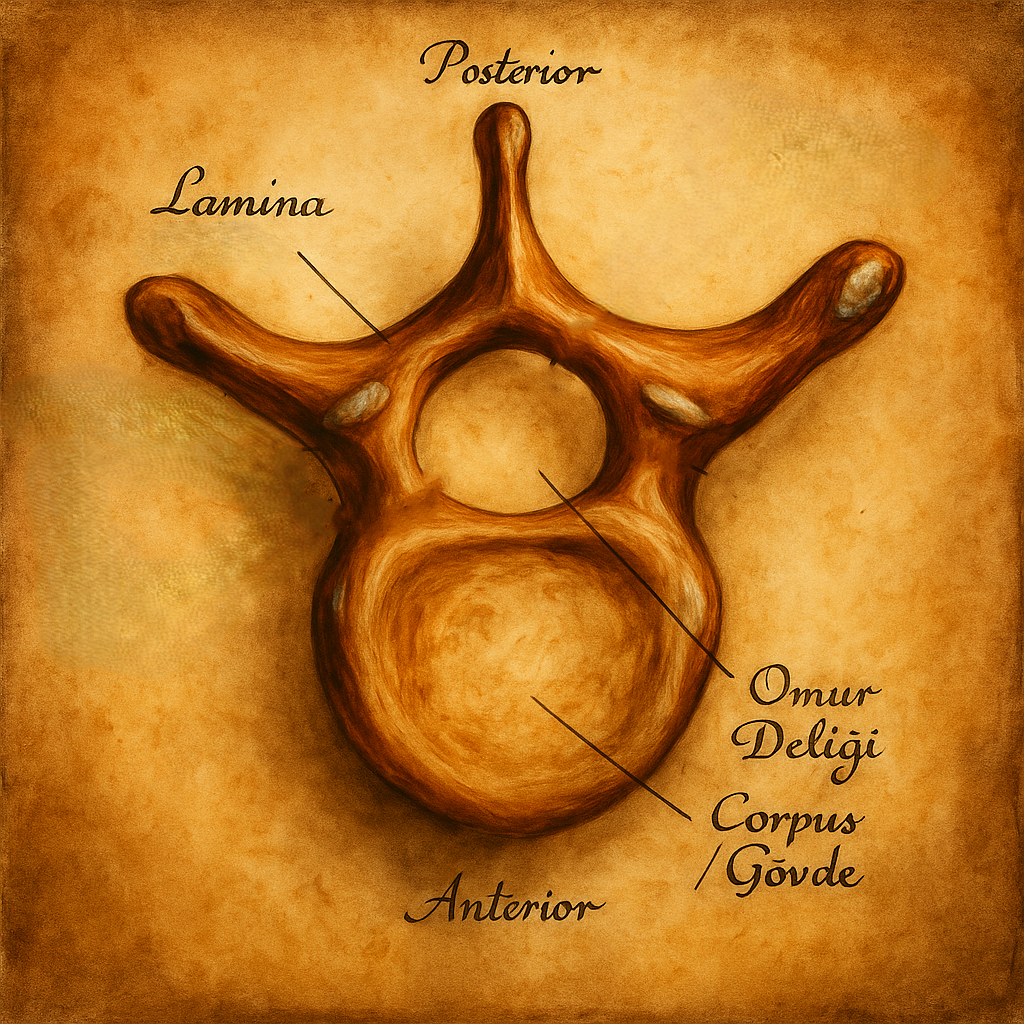
Omur deliği, tek bir omurun içinde, önde corpus vertebrae (omur gövdesi), yanlarda pediküller, arkada ise laminalar ve bu yapılara tutunan ligamentum flavum tarafından sınırlandırılan merkezi boşluktur. Komşu omurların omur delikleri üst üste geldiğinde spinal kanal (canalis vertebralis) oluşur. Bu kanal; medulla spinalis (omurilik), meninksler (pia, araknoid, dura mater), subaraknoid aralık ve BOS, epidural yağ dokusu, internal vertebral venöz pleksus (Batson pleksusu), segmental radikülomeningeal arterler ve spinal sinir kökleri (lumbosakral seviyelerde cauda equina ve filum terminale dahil) gibi yapıları barındırır.
Etimoloji
- Omur: Türkçede “vertebra” karşılığıdır; kökensel olarak Türk dillerinde “omurga” ile ilişkili anatomsal terim ailesinin parçasıdır.
- Foramen: Latince forare (“delmek, açmak”) fiilinden türeyen “açıklık/delik” anlamına gelir.
- Vertebra: Latince vertere (“dönmek, çevirmek”) kökünden; omurga segmentlerinin döner/oynar dizilimsel doğasına gönderme yapar.
- Canalis vertebralis: “Omurlara ait kanal” anlamındadır; ardışık foramina vertebralia’nın hizalanmasıyla meydana gelen tüneli tanımlar.
Gelişimsel (Embriyolojik) Temeller
Üçüncü–dördüncü haftalarda nöral tüp kapanırken, sklerotom hücreleri notokord ve nöral tüp çevresine göç eder. Sklerotomun kraniyal–kaudal yeniden segmentasyonu (resegmentasyon) ile üst segmentin kaudal yarısı ile alt segmentin kraniyal yarısı birleşerek omuru oluşturur. Böylece nöral tüpün dorsalinde ve çevresinde arkus vertebrae şekillenir; orta boşluk foramen vertebrale olarak kalır. Gövde (corpus) ventralde gelişirken, pedikül ve laminaların birleşmesiyle arkus kapanır. Arkusun kapanmasındaki kusurlar spina bifida spektrumuna, pedikül kısalığı gibi varyantlar ise doğuştan kanal darlığı fenotipine zemin hazırlayabilir.
Evrimsel Perspektif
Erken çenesiz omurgalılardan itibaren nöral dokuyu çevreleyen kemiksi ya da kıkırdak kılıf formunda nöral ark yapıları görülür. Balıklarda belirgin nöral arklar, kademeli olarak tetrapodlarda pedikül–lamina mimarisine evrilir. Kuşlarda servikal bölgede geniş ve üçgensi bir foramen, memelilerde ise bölgeye özgü (servikal–torakal–lumbal) morfometrik farklılaşmalar ortaya çıkar. İki ayaklı primatlarda (özellikle insan) baş ve gövde dengesine uyum için servikal kanal nispeten genişler; lumbal bölgede ise lokomosyon ve yük dağılımına bağlı olarak foramen şekli ve kesit alanı değişkenlik gösterir.
Bölgesel Morfoloji ve Sınırlar
- Servikal: Tipik olarak geniş ve üçgensi; omuriliğin kalınlaştığı intumescentia cervicalis seviyelerini barındırır. Ligamentum flavumun nispeten ince oluşu ve lordoz dinamiğiyle fleksiyonda genişleme belirgindir.
- Torakal: Çoğu zaman dairesel ve daha dar; kosta–transvers eklemlerinin stabilizasyonuna paralel olarak kanal hacmi görece küçüktür.
- Lumbal: Geniş üçgensi; intumescentia lumbalis ve kaudalinde cauda equina liflerini içerir. Fleksiyonla belirgin genişler, ekstansiyonda ligamentum flavumun “buckling”i ile daralma daha belirgindir.
- Sakral: Canalis sacralise dönüşerek hiatus sacralisten sonlanır; filum terminale externum ve sakral sinir kökleri burada seyreder.
Önemli sınırlar:
- Anterior: Omur gövdesinin posterior yüzü ve ligamentum longitudinale posterius
- Lateral: Pediküller
- Posterior: Laminae, ligamentum flavum ve ortada processus spinosusun tabanı
Mikroyapısal İlişkiler
- Epidural alan: Yağ dokusu, internal vertebral venöz pleksus (valvsiz), ince arteriyoller ve bağ dokusu.
- Dura mater: Kalın, kollajen ağırlıklı kılıf; kaudalde sakral kanalda incelir.
- Araknoid–pia: Subaraknoid aralıkta BOS dolaşır; ligamenta denticulata pia’dan çıkarak duraya tutunur.
- Ligamentum flavum: Elastik liften zengin; ekstansiyonda kalınlaşıp içe kıvrılarak kanalı daraltma eğilimi gösterir.
Biyomekanik ve Dinamikler
- Fleksiyon: Laminalar aralanır, posterior elemanlar gerilir, kanal çapı ve kesit alanı artar.
- Ekstansiyon: Laminalar yaklaşır, ligamentum flavum içe doğru kabarır, kanal daralır; bu özellikle lumbalde klinik belirti oluşturabilir.
- Aksiyel yük: Disk yüksekliği ve faset eklem biyomekaniği kanal şekline yansır; dejenerasyonla birlikte spondiloz, faset hipertrofisi ve spondilolistezis kanalı daraltabilir.
Morfometri ve Klinik Eşikler
- Servikal: Pavlov/Torg oranı (sagittal kanal çapı / korpus sagittal çapı) ≳ 0,8 genellikle normal; <0,7–0,75 nispi stenoz lehine kabul edilir. Mutlak sagittal çap ≤10 mm ciddi darlıkla ilişkilendirilir.
- Lumbal: Orta hat sagittal çap <10–11 mm mutlak, 10–12 mm arası nispi stenoz; transvers kesit alanı <75–100 mm² semptomatik stenozla sık ilişkilidir.
- Achondroplasia ve bazı doğuştan varyantlarda pedikül kısalığı kanalın anteroposterior çapını yaygın biçimde azaltır.
Varyasyonlar ve Anomaliler
- Konjenital kanal darlığı (yaygın dar çap)
- OPLL (posterior longitudinal ligamentin ossifikasyonu)
- OLF (ligamentum flavum ossifikasyonu; torakal bölgede)
- Epidural lipomatozis (steroid kullanımı/obezite ile ilişkili)
- Laminasyon kusurları ve ayrık omurga spektrumu
- Aksesuar venöz kanallar ve pleksus varyantları
Radyolojik Değerlendirme
- MRI: Yumuşak dokular ve omurilik patolojileri için altın standart; T2’de BOS hiperintens, stenozda “CSF bıçak sırtı” işareti kaybolur. Myelopati bulguları T2 hiperintensite ve kord sinyal değişiklikleri ile izlenebilir.
- BT/BT-myelografi: Kemik ayrıntı, ossifikasyon ve dar segmentlerin nicel analizi için üstündür; OPLL/OLF saptamada duyarlıdır.
- Ölçümler: Orta hat sagittal çap, çapraz alan planimetresi, Pavlov/Torg oranı, faset ve ligament kalınlıkları; dinamik fleksiyon–ekstansiyon görüntüleri fonksiyonel darlığı ortaya koyabilir.
Klinik İlişkilendirmeler
- Servikal spondilotik myelopati: Kronik kanal darlığı ve osteofitik kompleks sonucu omurilik disfonksiyonu; el becerilerinde bozulma, spastisite, yürüme ataksisi.
- Lumbal spinal stenoz: Nörojenik klaudikasyo; yürümeyle artan, fleksiyonla azalan bacak ağrısı/uyuşma; bisiklet testi tipik.
- Akut travma: Burst kırıklarında retropulsiyonla kanal işgal yüzdesi; lamina kırıkları ve epidural hematom ile akut kompresyon.
- Enfeksiyon: Spinal epidural apse; ateş, lokal hassasiyet, nörolojik defisit triadından biri veya birkaçı bulunabilir.
- Tümörler: İntradural–ekstramedüller (meningiom, schwannom), intramedüller (ependimom, astrositom), ekstradural metastazlar; venöz pleksus yolu ile yayılım mümkündür.
- Vasküler: Valvsiz Batson pleksusu pelvis–abdomen–toraks neoplazmlarından retrograd metastaza ve enfeksiyon yayılımına aracılık eder.
- Anestezi: Epidural uygulamalar ligamentum flavum geçişi sonrası epidural boşluğa; spinal anestezi L3–L4 veya L4–L5 seviyesinden subaraknoid aralığa yapılır—kanalın morfolojisi iğne ilerletme ve ilaç yayılım dinamiğini etkiler.
Cerrahi ve Girişimsel Boyut
- Laminektomi: Posterior elemanların (lamina) çıkarılmasıyla kanal dekompresyonu; yaygın stenoz veya tümör girişimlerinde.
- Laminoplasti: Özellikle servikal myelopatide kanal genişletme ve posterior elemanların korunması amacıyla.
- Minimal invaziv dekompresyon: Hemilaminektomi, interlaminar mikroskobik teknikler, unilateral laminotomi ile bilateral dekompresyon yaklaşımları.
- Eşlik eden işlemler: Foraminotomi (intervertebral foramen daralması için), disektomi, füzyon (instabilite varlığında).
- İntraoperatif nöromonitörizasyon (SSEP/MEP) ve navigasyon kemik/kanal ilişkilerini güvenle yönetmeye yardımcı olur.
Bölgeye Özgü Ölçüm ve Değerlendirme Notları
- Servikal: C3–C6 düzeylerinde doğal olarak geniş üçgensi kesit; doğuştan dar kanalda Pavlov oranı düşük olabilir ve travma sonrası defisit riski artar.
- Torakal: Göreli darlık ve kifoz, OLF ile birleştiğinde miyelopati oluşturabilir; manevralarda dikkat gerekir.
- Lumbal: L4–L5 en sık stenotik seviyedir; faset hipertrofisi, sarı ligament kalınlaşması ve disk bulging’i birlikte alanı daraltır.
Komşu Yapılarla İlişkiler
- Intervertebral foramen: Spinal sinir köklerinin lateral çıkış yolu; omur deliğiyle sürekli bir boşluk sistemidir. Disk-osteofit kompleksleri bu alanda radikülopati yapar.
- Posterior longitudinal ligament (PLL) ve anulus fibrozus: Anterior sınırla ilişkili; medyan/parasantral disk hernileri kanal içine uzanır.
- Ligamentum flavum: Posterior sınırın dinamik/degeneratif başlıca belirleyicisidir.
Türler Arası Karşılaştırma (Kısa Notlar)
- Karnivor memeliler: Servikal bölgede yüksek hareket açıklığına paralel daha geniş kanal.
- Otçul memeliler: Torakolumbal stabilite ön planda; kanal şekli daha uniform.
- Kuşlar: Uzun servikal seriler ve geniş foramen; baş hareketleriyle ilişkili adaptasyonlar.
- Sürüngenler/Balıklar: Kıkırdak/kemiğimsi nöral arklar; filogenetik olarak omur deliğinin temel formunun korunumu dikkat çekicidir.
Sık Kullanılan Terminoloji
- Foramen vertebrale: Omur deliği (tek omur)
- Canalis vertebralis: Spinal kanal (omurga boyunca)
- Arcus vertebrae: Omur kemeri
- Pediculus ve lamina: Lateral ve posterior sınır elemanları
- Ligamentum flavum, PLL: Posterior ve anterior bağ yapıları
- Pavlov/Torg oranı: Servikal kanal darlığının kaba tarama ölçütü
Keşif
Omur deliğinin hikâyesi, insanın sırtına ilk kez bilimsel bir gözle dönüp “burada yalnız kemik değil, içinden bir canlı tel geçiyor” dediği andan başlar. Antik İskenderiye’de Herophilos ile Erasistratos, bedenin yasak sayılan kapılarını aralayıp omurgayı kat kat açtıklarında, omur gövdesinin arkasında kemiksi bir kemerin bıraktığı boşluğun içinden süt beyazı bir kordonun uzandığını gördüler; bu kordonun “beynin devamı” olduğuna inanıp, onu koruyan tüneli de tarif ettiler. Yunan dünyasında Hippokrates geleneği daha temkinliydi; kemikler ve eklemler üzerine yazılan metinlerde omurların eklemleşmesi, arklarının kapanışı ve aradaki boşluğun travmayla nasıl daralıp genişlediği sezgisel biçimde betimlendi. Roma’da Galenos, gladyatör yaralanmalarından edindiği deneyimle, omur kemerinin içinden geçen “spinalis” kütlenin zedelenmesiyle ortaya çıkan felçleri sınıflandırdı; bu, omur deliğinin yalnız bir “delik” olmadığını, içine sığdırdığı dokularla anlam kazandığını gösteren ilk büyük klinik tablolardan biriydi.
Ortaçağ’da İslam tıbbının altın çağında İbn Sînâ ve Zehrâvî, hayvan disseksiyonlarından yola çıkarak omurganın bir tünel oluşturduğunu, bu tünelin koruyucu zarlarla sarılı içerik taşıdığını ayrıntılı el kitaplarına geçirdiler; cerrahî aletlerin ve yaklaşımın tariflerinde, kemik kemerin altında lifsi zarları hissetmenin inceliklerine dair satırlar, omur deliğinin sınırlarının dokunma duyusuyla öğrenildiğini gösterir. Avrupa Rönesansı’na gelindiğinde, anatomi tiyatrolarında ışık kemikleri yalarken, Vesalius insan omurgasını plaka plaka resmetti; pedikül, lamina, faset ve spinöz çıkıntıların geometrisini o kadar berrak çizdi ki, “foramen vertebrale” ifadesi daha resmî bir terminolojiye kavuşmadan önce bile, onun levhalarına bakanlar tek omurun iç merkezindeki boşluğu öne gövde, arkada laminalar, yanda pediküllerle sınırlı bir halke olarak görür oldu. Eustachio ile Falloppio omurga levhalarına damarları ve sinirleri ekledikçe, boşluğun “duvarları” belirginleşti; Fabricius ve Spigelius’un anatomi atölyelerinde arkusun kapanış hatları, bazen bir kemik dikiş gibi, bazen bir köprü kavisinde anlatıldı.
Erken modern çağda Albinus ve Morgagni, yalnız şekle değil varyasyona bakmayı öğretti. Bazı insanlarda pediküllerin kısalığı, bazılarında laminaların kalınlığı dikkat çekiyor; bu farklar ömür boyu hiçbir yakınma yaratmadan kalabildiği gibi, belli yaşlarda dar bir tünelin sessiz tehdidine dönüşebiliyordu. Soemmerring ve çağdaşları terminolojiyi cilalarken, “foramen vertebrale” tekil omurdaki boşluğu, “canalis vertebralis” ise bu boşlukların ardışık hizalanmasıyla oluşan büyük koridoru anlatır hale geldi. Vicq d’Azyr ve arkadaşları meninkslerin mimarisine odaklanınca, boşluğun yalnız kemik değil, bağ, zar ve damarla tamamlanan bir sınırlar sistemi olduğu anlaşılır oldu; epidural yağın süngerimsi yastığı ile dura arasındaki mesafe, cerrahın bıçağı açısından bir “hissedilebilir anatomi” dersi gibiydi.
X-ışınlarının keşfi, omur deliğini bir anda görünür kılmadı; düz grafide kemik net, boşluk ise yalnız “negatif bir izlenim”di. Fakat klinisyenler, sagittal çapın gövdeye oranla kaba ölçümüne dayanan ilk kurallarını bu gölgelerden çıkardı; “dar kanal” kavramı omurların kemik gövdeleriyle birlikte anılır oldu. Yirminci yüzyılın başında Sicard ve Forestier’nin myelografi denemeleri, boşluğun içini opak bir akışla doldurup sınır çizgilerini radyografiye düşürdüğünde, tünelin nerede kıvrıldığı, nerede daraldığı ilk kez canlı bir nehir gibi izlendi. Patoloji laboratuvarlarında Virchow ve Henle ekolü, sarı ligamentin elastik liflerinden daha sert bir dokuya dönüşmesini, faset ekleminin hipertrofisini ve disk-osteofit kompleksinin posterior uzanımlarını mikroskop camına koyarken, klinikte Verbiest bel kanal darlığının kendine özgü yürüyüş ve ağrı örüntülerini tanımladı; bir hasta düz yolda birkaç yüz adımda duruyor, ama öne eğilip bisiklete bindiğinde rahatça kilometrelerce gidebiliyorsa, tünelin dinamiği —fleksiyonla genişleyip ekstansiyonla büzülen duvarları— beden diliyle konuşuyordu.
Bilim, boşluğun yalnız “kemik içindeki bir delik” olmadığını gösterdikçe, çevresindeki akışkan ağlar da sahneye çıktı. Batson, valvsiz internal vertebral venöz pleksusun karın ve pelvisteki süreçlerle omurga arasında sessiz bir otoyol kurduğunu ortaya koydu; bu, omuriliği koruyan tünelin aynı zamanda dolaşım ve patoloji için bir geçit olduğuna dair keskin bir hatırlatmaydı. Japonya’da araştırmacılar, posterior longitudinal ligamentin ossifikasyonunu bir toplum biyolojisi gibi inceledi; OPLL’nin omur deliği içine doğru kazıklar çakarak kanalı daraltmasının öngörülebilir radyolojik işaretleri belirlendi. Benzer biçimde ligamentum flavumun hipertrofisini tetikleyen yaşlanma, mikrodejenerasyon ve düşük dereceli inflamasyon döngüleri tarif edildi; torakal bölgede OLF’nin miyelopatiye giden yolu nasıl daralttığı haritalandı.
Görüntüleme devrimi, tünelin hikâyesini üçüncü bir göze taşıdı. Bilgisayarlı tomografi kemik mimariyi sayılarla konuşur hale getirdi; pedikül uzunlukları, lamina kalınlıkları, faset açıları ve osseöz çıkıntılar üç boyutlu olarak ölçülürken, MRI boşluğun içindeki suyu—BOS’u—ışıldattı. Bir bakışta T2 ağırlıklı kesitte cord ile çevresindeki siyah halka arasındaki parlak hilalin incelmesi, “CSF bıçak sırtının” kaybolması, tünelin artık yalnız mimari değil, hemodinamik ve nörolojik olarak da daraldığını söylüyordu. Klinik ölçütler giderek rafine oldu: servikalde Pavlov/Torg oranı gövdeye kıyasla kanalı kaba ama pratik bir cetvelle değerlendirmeyi sağladı; lumbalde alan planimetresiyle 100 mm²’nin altına sarkan kesitler, semptomların olasılığını öngören eşiklere dönüştü. Dinamik MRI ve fonksiyonel radyografi, fleksiyon–ekstansiyon sırasında ligamentum flavumun içe doğru “buckling” davranışını ve laminaların ilişki değişimini gerçek zamanlı izlettirdi.
Cerrahî söylem, tüneli açmanın ve aynı zamanda korumanın sanatına evrildi. Laminektomi, içeride sıkışan sinir dokusuna geniş bir nefes alanı sağlarken, instabilite riskini beraberinde getirebiliyordu; bunun üzerine laminoplasti, özellikle servikal omurilik basılarında kanalı genişletirken arka elemanları bir kapak gibi korumayı öğretti. Minimal invaziv teknikler, tek bir tarafın lamina kenarından girip iki taraflı dekompresyon yapmanın yollarını tarif etti; mikroskobun soğuk ışığı altında, sarı ligamentin kalınlaşmış kıvrımının milim milim tıraşlandığı anlarda, omur deliği yeniden bir tünel değil, bir nefes borusu gibi davranmaya başladı. Anestezistlerin epidural ve spinal blok uygulamaları da bu mimariye kulak verdi; “loss of resistance” hissi, lamina-altı ligamentlerin ardışık katmanlarını bir enstrüman ustalığıyla ayırt etmeyi gerektiriyordu.
Evrim sahnesi, hikâyeye geniş bir zaman perspektifi ekledi. Kıkırdaklı balıklarda nöral arkların ilkel kılıfı, tetrapodlarda pedikül–lamina mimarisine, kuşlarda uzun servikal serilerin geniş tünellerine, memelilerde bölgeye özgü üçgensi–dairesel varyasyonlara dönüştü. İnsanda bipedal duruş, servikalde kord kalınlaşmasını barındıracak geniş bir koridora, lumbalde ise yük taşımaya uyumlu, fleksiyonla ferahlayan bir geçide ihtiyaç doğurdu; pedikül kısalığı gibi doğuştan özellikler veya akondroplazide görülen genel kanal daralması bu uyumun sınırlarını belirleyen natürmortlara dönüştü.
Yakın dönemde temel bilim laboratuvarları, omur deliğinin biyolojisini moleküler bir hikâyeye çevirdi. Elastin–kollajen oranlarının yaşla ve mekanik stresle nasıl değiştiği, ligamentum flavumda fibrozis ve kalsifikasyona giden sinyal yolları, PLL ossifikasyonunda genetik yatkınlık kümeleri ve metabolik etkiler —özellikle Asya popülasyonlarında— ağ örgüleriyle çözümleniyor. Epidural lipomatozisin obezite ve steroid kullanımı ile ilişkili yağ doku genişlemesi üzerinden kanalı işgal etme dinamikleri, metabolik cerrahî sonrası gerilemenin nicel ölçümleriyle birlikte raporlanıyor. Görüntülemede derin öğrenme, aksiyel kesitlerde kanalı otomatik planimetriyle ölçen ve stenoz derecesini semptom şiddetiyle eşleştiren modellerin klinik ön değerlendirmeye entegre edilmesini sağlıyor; cerrahî planlamada navigasyon ve nöromonitörizasyon, tünelin milimetrik coğrafyasını güvenlik haritalarına dönüştürüyor.
Klinikte bugün, foramen vertebrale artık bir “delik” değil, sınırlarının her bir çizgisi biyomekanik, nörolojik ve damar fizyolojisiyle anlam kazanan yaşayan bir hacim olarak ele alınıyor. Servikal spondilotik myelopatide el ince motorunun çizdiği titrek harfler, lumbal stenozda yürümenin ritmini bozan erken duruşlar, travmada retropulse kemik fragmanlarının aniden daralttığı koridor, enfeksiyonun epidural boşluğu ateşle dolduran absesi, metastazın valvsiz venöz yollardan sessizce gelip tünelin duvarına dayanan kütlesi —bunların her biri aynı mekânın farklı dramları. Terminoloji düzeyinde “foramen vertebrale”nin tekil omura, “canalis vertebralis”in omurganın bütününe işaret eden ayrımı, klinisyen ile anatomistin ortak dilinde yerini sağlamlaştırmış durumda; pedikül ve laminaların geometrisi, PLL ve ligamentum flavumun zamana bağlı davranışı, epidural boşluğun yağ–venöz bileşimi, meninkslerin zarif katmanları bu sözlüğün temel maddeleri haline geldi.
Ve hikâye hâlâ yazılıyor: hareketle genişleyen–daralan bir tünelin yorgun duvarlarını esnetmenin egzersiz temelli stratejileri; cerrahîde kemik çıkarımını minimize ederken sinir dokusuna maksimum alan açan geometriler; görüntülemede kanaat yerine nicel eşikler; genetik ve doku mühendisliğinde bağ dokusunu yeniden biçimlendirmenin yolları. Omur deliği, antik tiyatroların amfisinden bugünün manyetik tünellerine uzanan bu uzun yolculukta, bir boşluk olarak değil, içinden hayatın iletildiği koridor olarak anlatılmayı sürdürüyor.
İleri Okuma
- Batson, O. V. (1940). The Function of the Vertebral Veins and Their Role in the Spread of Metastases. Annals of Surgery, 112(1), 138–149.
- Verbiest, H. (1954). A Radicular Syndrome from Developmental Narrowing of the Lumbar Vertebral Canal. Journal of Bone and Joint Surgery (Br), 36-B(2), 230–237.
- Wiltse, L. L., & Rothman, R. H. (1976). Spondylolisthesis: Classification and Terminology. Clinical Orthopaedics and Related Research, 117, 23–29.
- Hirabayashi, K., et al. (1981). Expansive Open-Door Laminoplasty for Cervical Myelopathy. Spine, 6(4), 392–399.
- Romer, A. S., & Parsons, T. S. (1986). The Vertebrate Body (6th ed.). Saunders.
- Torg, J. S., et al. (1986). Cervical Spinal Stenosis with Cord Neuropraxia. Journal of Bone and Joint Surgery (Am), 68(9), 1354–1370.
- Weatherley, C. R., & Ransford, A. O. (1986). Laminoplasty: Indications and Long-term Results. Clinical Orthopaedics and Related Research, 208, 7–15.
- Modic, M. T., Steinberg, P. M., Ross, J. S., Masaryk, T. J., & Carter, J. R. (1988). Degenerative Disk Disease: Assessment of Changes in Vertebral Body Marrow with MR Imaging. Radiology, 166(1), 193–199.
- Benningfield, S. M., & Taveras, J. M. (1988). Myelography: Historical Review and Current Practice. Radiologic Clinics of North America, 26(5), 879–893.
- Panjabi, M. M., & White, A. A. (1990). Clinical Biomechanics of the Spine (2nd ed.). Lippincott Williams & Wilkins.
- Bogduk, N., & Twomey, L. (1991). Clinical Anatomy of the Lumbar Spine and Sacrum (2nd ed.). Churchill Livingstone.
- Hogan, Q. H. (1996). Lumbar Epidural Anatomy: A New Look by Cryomicrotome Sections. Anesthesiology, 85(5), 1060–1071.
- Marras, W. S., & Granata, K. P. (1997). Spinal Loading During Flexion and Extension. Spine, 22(24), 3032–3040.
- Fujiwara, A., et al. (2000). The Relationship between Facet Joint Osteoarthritis and Disc Degeneration. Spine, 25(23), 3036–3044.
- Zhou, S. H., et al. (2000). Morphometric Study of the Lumbar Pedicle and Vertebral Canal in a Chinese Population. Spine, 25(2), 218–224.
- Carter, D. R., & Beaupré, G. S. (2001). Skeletal Function and Form: Mechanobiology of Skeletal Development, Aging, and Regeneration. Cambridge University Press.
- Pfirrmann, C. W. A., et al. (2001). Magnetic Resonance Classification of Lumbar Intervertebral Disc Degeneration. Spine, 26(17), 1873–1878.
- Fardon, D. F., & Milette, P. (2001). Nomenclature and Classification of Lumbar Disc Pathology. Spine, 26(5), E93–E113.
- Jinkins, J. R. (2004). Imaging of Spinal Stenosis. Neuroimaging Clinics of North America, 14(1), 97–121.
- Kornblum, M. B., et al. (2004). Degenerative Lumbar Spinal Stenosis: Assessment with Upright Flexion–Extension MRI. Journal of Spinal Disorders & Techniques, 17(4), 284–293.
- Haughton, V. M., et al. (2005). Motion of the Spinal Cord During Flexion–Extension of the Cervical Spine. Radiology, 235(3), 912–917.
- Sairyo, K., et al. (2005). Pathomechanisms of Ligamentum Flavum Hypertrophy in Lumbar Spinal Canal Stenosis: A Review. Orthopedics, 28(10), 1009–1013.
- Matsunaga, S., & Sakou, T. (2006). Ossification of the Posterior Longitudinal Ligament of the Cervical Spine: Etiology and Natural History. Spine, 31(21), 2457–2464.
- Aebi, M., Arlet, V., & Webb, J. K. (Eds.). (2007). AO Spine Manual. Thieme.
- Larsen, W. J. (2009). Human Embryology (4th ed.). Churchill Livingstone.
- Genevay, S., & Atlas, S. J. (2010). Lumbar Spinal Stenosis. Best Practice & Research Clinical Rheumatology, 24(2), 253–265.
- Schizas, C., et al. (2010). Qualitative Grading of Lumbar Spinal Stenosis. Spine, 35(21), 1919–1924.
- Keorochana, G., et al. (2011). Factors Affecting the Clinical Outcomes of Decompressive Surgery for Degenerative Lumbar Spinal Stenosis. Spine, 36(21), 1870–1876.
- DePalma, M. J., Ketchum, J. M., & Saullo, T. R. (2011). Etiology of Chronic Low Back Pain in Patients Having Undergone Lumbar Fusion. Pain Medicine, 12(5), 732–739.
- Quek, S. T., et al. (2011). Quantitative Assessment of Lumbar Spinal Stenosis Using MR Planimetry. Clinical Radiology, 66(10), 901–907.
- Benzel, E. C. (2012). Spine Surgery: Techniques, Complication Avoidance, and Management. Elsevier.
- Bogduk, N. (2012). Clinical and Radiological Anatomy of the Lumbar Spine. Churchill Livingstone.
- Brant, W. E., & Helms, C. A. (2012). Fundamentals of Diagnostic Radiology (4th ed.). Lippincott Williams & Wilkins.
- Moore, K. L., Dalley, A. F., & Agur, A. M. R. (2013). Clinically Oriented Anatomy (7th ed.). Lippincott Williams & Wilkins.
- Moore, K. L., Persaud, T. V. N., & Torchia, M. G. (2013). The Developing Human: Clinically Oriented Embryology (9th ed.). Elsevier.
- Ho, C. P., et al. (2013). MR Imaging of the Spine: A Practical Approach. Radiologic Clinics of North America, 51(3), 507–523.
- Netter, F. H. (2014). Atlas of Human Anatomy (6th ed.). Elsevier.
- Ahn, Y. (2014). Endoscopic Spinal Decompression: Current Concepts and Future Trends. Asian Spine Journal, 8(4), 533–543.
- Panagiotopoulos, E., et al. (2014). Grading Systems for Cervical Canal Stenosis and Myelopathy. European Spine Journal, 23(1), 20–34.
- Machino, M., et al. (2014). Cervical Laminoplasty: Indications and Outcomes. Spine, 39(17), E1003–E1010.
- Yamauchi, T., et al. (2014). Ossification of the Ligamentum Flavum in the Thoracic Spine: Radiological Findings and Surgical Outcomes. Journal of Neurosurgery: Spine, 20(2), 208–217.
- Yoshimura, N., et al. (2014). Epidemiology of OPLL in the Japanese Population. Journal of Orthopaedic Science, 19(3), 405–411.
- Schneider, R., et al. (2015). Dynamic MR Imaging of the Lumbar Spine in Upright Position. European Spine Journal, 24(11), 2414–2421.
- Kawasaki, M., et al. (2015). Inflammation and Fibrosis in Hypertrophied Ligamentum Flavum. Spine, 40(7), E346–E352.
- Hasegawa, K., et al. (2015). Anatomical Study of Ligamentum Flavum Thickness in the Lumbar Spine. Spine, 40(9), E636–E641.
- Nakashima, H., et al. (2015). OPLL and Cervical Myelopathy. Neurosurgical Focus, 38(4), E6.
- Schroeder, G. D., & Kepler, C. K. (2016). The Role of the Posterior Longitudinal Ligament in the Cervical Spine. Seminars in Spine Surgery, 28(4), 230–238.
- Winn, H. R. (Ed.). (2017). Youmans and Winn Neurological Surgery (7th ed.). Elsevier.
- Rothman, R. H., & Simeone, F. A. (Eds.). (2018). Rothman–Simeone and Herkowitz’s The Spine (7th ed.). Elsevier.
- Jensen, R. K., et al. (2019). Lumbar Spinal Stenosis – Clinical and Imaging Correlates. Radiographics, 39(5), 1476–1495.
- Yoshii, T., et al. (2019). Cervical Spondylotic Myelopathy: Clinical Practice Guidelines. Spine Surgery and Related Research, 3(4), 278–293.
- Kovacs, F. M., et al. (2020). European Guidelines on the Diagnosis and Management of Lumbar Spinal Stenosis. European Spine Journal, 29(Suppl 3), 3–21.
- Standring, S. (Ed.). (2021). Gray’s Anatomy: The Anatomical Basis of Clinical Practice (42nd ed.). Elsevier.