Üretici ve Farmasötik Form
- Üretici Firma: ABBOTT, Ümraniye / İstanbul, Türkiye.
- Farmasötik Form: Modifiye salım formülasyonuna sahip kırmızı/kahverengi renkte oval film kaplı tabletler.
- Ambalaj: 14, 28 ve 56 tablet içeren blister ambalajlarda sunulur.
- Uygulama Yolu: Oral (ağız yoluyla alınır).
Etkin Maddeler
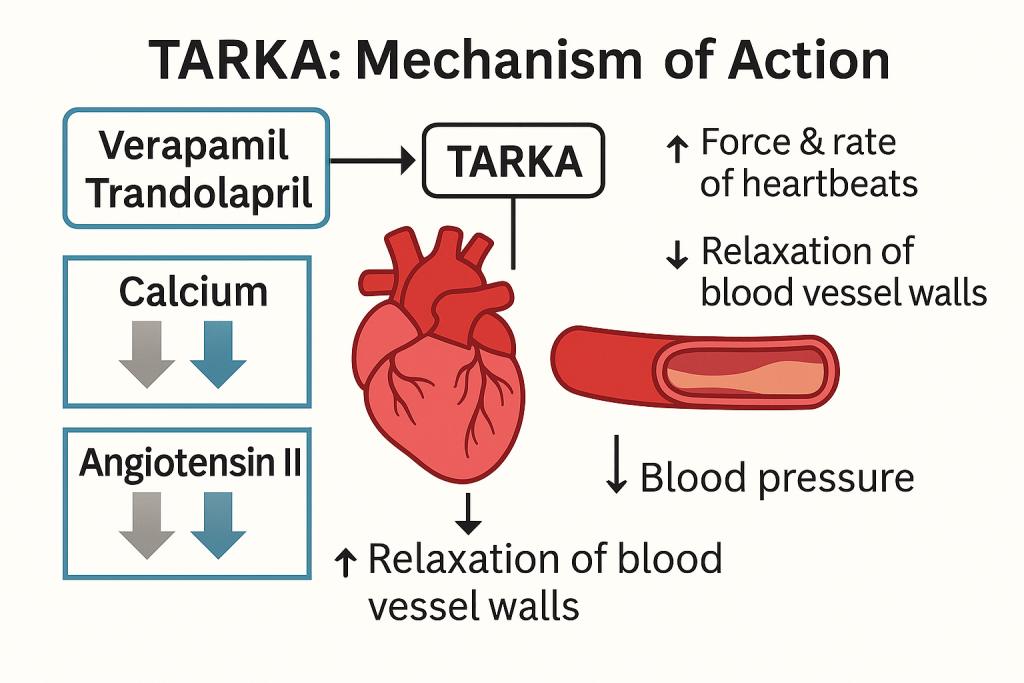
- Verapamil hidroklorür
- Doz: 240 mg (sürekli salım)
- Sınıf: Kalsiyum kanal blokeri (non-dihidropiridin)
- Etki Mekanizması: Kalp kası ve damar düz kaslarına giren kalsiyumu inhibe ederek kasılmayı azaltır, kalp atış hızını yavaşlatır ve damarları genişleterek kan basıncını düşürür.
- Trandolapril
- Doz: 4 mg
- Sınıf: Anjiyotensin Dönüştürücü Enzim (ADE) inhibitörü
- Etki Mekanizması: ADE enzimini inhibe ederek anjiyotensin II oluşumunu engeller; böylece damar gevşemesi ve dolaylı olarak aldosteron baskılanması ile kan basıncı düşer.
Yardımcı Maddeler
- Mısır nişastası
- Laktoz monohidrat
- Povidon
- Hipromelloz
- Sodyum stearil fumarat
- Mikrokristalize selüloz
- Sodyum aljinat
- Magnezyum stearat
Film Kaplama Maddeleri
- Hipromelloz
- Hidroksi propil selüloz
- Polietilen glikol 400 ve 6000
- Talk
- Kolloidal anhidr silika
- Dokusat sodyum
- Titanyum dioksit (E171)
- Kırmızı demir oksit (E172)
- Sarı demir oksit (E172)
- Siyah demir oksit (E172)
Endikasyon
- Endikasyon: Esansiyel hipertansiyon tedavisi
- Tedavi Stratejisi: Monoterapi yetersizliğinde iki farklı etki mekanizmasına sahip kombinasyon tedavisi olarak
Kontrendikasyonlar
TARKA® Forte aşağıdaki durumlarda kullanılmamalıdır:
- Etkin maddelere veya yardımcı maddelere karşı aşırı duyarlılık
- Önceden ADE inhibitörlerine karşı ağır alerjik reaksiyon
- Kalp kaynaklı şok
- Miyokard enfarktüsü sonrası komplikasyonlar
- veya 3. derece AV blok (pacemaker yoksa)
- Sinoatriyal blok, hasta sinüs sendromu
- Ağır kalp yetmezliği
- WPW sendromu
- Ciddi böbrek ve karaciğer yetmezliği
- Gebelik, emzirme dönemi
- 18 yaş altı çocuklar
- Hipertrofik kardiyomiyopati
- Enjeksiyon yoluyla beta-blokör tedavisi (acil durumlar hariç)
- Primer aldosteronizm
Uyarılar ve Önlemler
Aşağıdaki durumlarda dikkatli kullanılmalıdır:
- Yaş >65
- Diyabet
- Hafif-orta karaciğer ve böbrek yetmezliği
- Nöromüsküler hastalıklar
- Lityum tedavisi
- Kusma/ishal varlığı
- Yoğun diüretik tedavi veya tuz kısıtlaması
- Kalp yetmezliği, aort stenozu
- Düşük tansiyon, bradikardi
- Alerjik ödem öyküsü
- Lupus/skleroderma gibi otoimmün hastalıklar
- Ameliyat öncesi (anestezi etkisi artabilir)
- Goldflam hastalığı
- Laktoz intoleransı
- LDL aferezi sırasında ADE inhibitör reaksiyonları
Gıda ve İlaç Etkileşimleri
- Greyfurt suyu: Kaçınılmalı, verapamil metabolizmasını etkileyerek yan etkileri artırabilir.
- Alkol: Tolerans düşebilir, etkisi artabilir.
- Besin: Kahvaltıdan en az 30 dakika önce alınmalıdır. Aç/tok fark etmeden alınabilir.
İlaç Etkileşimleri
TARKA® Forte aşağıdaki ilaçlarla etkileşebilir:
- Digoksin, digitoksin
- Diüretikler, potasyum takviyeleri
- Trisiklik antidepresanlar, antipsikotikler
- Siklosporin, takrolimus
- NSAİİ (aspirin, ibuprofen)
- Simetidin, antasitler
- Karbamazepin, fenitoin
- Lityum
- Teofilin, almotriptan, simvastatin
- Steroidler, insülin ve oral antidiabetikler
- Kas gevşeticiler, anestezik ajanlar
Dozaj ve Uygulama Şekli
- Erişkinler: Günde 1 tablet (tercihen sabah kahvaltıdan önce)
- Yaşlılar: Düşük doz gerekebilir; renal fonksiyon kontrolü önerilir.
- Çocuklar/Ergenler: Kullanımı önerilmez.
- Böbrek yetmezliği: Orta derecede doz ayarlaması gerekebilir. Ciddi yetmezlikte kontrendike.
- Karaciğer yetmezliği: Hafif-orta düzeyde dikkatli kullanılmalı. Ciddi yetmezlikte kontrendike.
Yan Etkiler
- Çok Ciddi ve Seyrek:
- Alerjik ödem, anafilaksi
- Pankreatit
- Karaciğer bozuklukları
- Ciddi hipotansiyon
- Nötropeni, trombositopeni
- Sık Görülen (≥1/100, <1/10):
- Baş ağrısı, baş dönmesi
- Kabızlık, halsizlik
- Sıcak basması
- Öksürük
- Seyrek (≥1/1000, <1/100):
- Alerjik cilt reaksiyonları
- Karaciğer fonksiyon testlerinde anormallik
- Dispepsi, bulantı, ishal
- Çok Seyrek (<1/1000):
- Psikotik belirtiler, depresyon
- Bradykardi, kalp durması
- Gynaecomastia, libido azalması
- Deride pigmentasyon bozuklukları
Gebelik ve Emzirme
- Gebelik: Kullanımı kontrendikedir. Bebeğin gelişimini olumsuz etkileyebilir.
- Emzirme: Emzirme süresince kullanılmamalıdır; süt yoluyla geçiş mümkündür.
Araç ve Makine Kullanımı
Başlangıçta sersemlik, baş dönmesi görülebileceğinden dikkatli olunmalı; etkisi anlaşılana kadar araç/makine kullanılmamalıdır.
Depolama Koşulları
- 25°C’nin altında, ambalajında saklanmalıdır.
- Son kullanma tarihi geçmiş ürünler kullanılmamalıdır.
- Ambalajda bozukluk fark edilirse ürün kullanılmamalıdır.
Keşif
TARKA® Forte adlı sabit doz kombinasyon preparatının keşif ve geliştirilme süreci, içerdiği iki etkin madde olan verapamil ve trandolaprilin farmasötik olarak birleştirilmesiyle ilişkilidir. Bu kombinasyonun tıbbi olarak pazarlanması 1990’lı yılların ortalarında başlamıştır.
Etkin Maddelerin Keşif Tarihleri
Verapamil
- Keşif: 1960’ların başı
- Geliştiren Şirket: Knoll AG (daha sonra Abbott Laboratories tarafından devralındı)
- Klinik Kullanıma Giriş: 1964
- İlk Onay: Almanya ve daha sonra Amerika Birleşik Devletleri (FDA onayı: 1981, hipertansiyon için)
Trandolapril
- Keşif: 1980’lerin ortaları
- Geliştiren Şirket: Knoll AG (Abbott’un iştiraki)
- Klinik Kullanıma Giriş: 1993
- İlk Onay: Fransa (1993), ardından Amerika Birleşik Devletleri (FDA onayı: 1996)
TARKA® Forte Kombinasyonunun Gelişimi
- TARKA® ticari markası altında verapamil (sürekli salım formu) ve trandolapril kombinasyonu ilk olarak 1996 yılında ABD’de FDA tarafından onaylanmıştır.
- TARKA® Forte, bu kombinasyonun yüksek doz varyantı olarak geliştirilmiştir ve 240 mg verapamil / 4 mg trandolapril içerir.
- Avrupa’da ve Türkiye’de tescilli ürün olarak 2000’li yılların başında piyasaya sunulmuştur.
İleri Okuma
- Fleckenstein, A. (1964). Specific pharmacology of calcium in myocardium, cardiac pacemakers, and vascular smooth muscle. Annual Review of Pharmacology, 4, 19–30.
- Triebwasser, J. H., et al. (1967). Clinical pharmacology of verapamil. Circulation, 35(6), 1058–1064.
- Laubie, M., & Boissier, J. R. (1985). Angiotensin converting enzyme inhibition: pharmacological studies on trandolapril. Arzneimittelforschung, 35(5), 729–732.
- Meredith, P. A., & Elliott, H. L. (1993). Clinical pharmacokinetics of trandolapril. Clinical Pharmacokinetics, 24(6), 450–466.
- Epstein, M., et al. (1995). Pharmacokinetics and antihypertensive effects of verapamil sustained release and trandolapril combination. American Journal of Hypertension, 8(5 Pt 2), 93S–101S.
- FDA (1996). Approval of TARKA® (trandolapril/verapamil hydrochloride ER) tablets for hypertension. NDA #20-652.
- Meredith, P. A., & Elliott, H. L. (2004). Clinical pharmacokinetics of trandolapril. Clinical Pharmacokinetics, 43(14), 1049–1060.
- Weber, M. A. (2005). Combination therapy with calcium channel blockers and ACE inhibitors. Journal of Clinical Hypertension, 7(7), 371–378.
- Lacourcière, Y., & Asmar, R. (2006). A fixed-dose combination of trandolapril/verapamil SR in the treatment of hypertension. Vascular Health and Risk Management, 2(3), 217–224.
- Calhoun, D. A., et al. (2014). Resistant Hypertension: Diagnosis, Evaluation, and Treatment. Hypertension, 63(6), 1134–1147.

Yorum yazabilmek için oturum açmalısınız.