İçindekiler
Terminoloji ve Etimoloji
“Tüy hücresi” (İng. hair cell) terimi, apikal yüzeylerinden uzanan ince, saç benzeri çıkıntılar nedeniyle tarihsel olarak yerleşmiştir. Bu çıkıntıların çoğu stereosilyum (Yunanca stereos “katı” + Latince cilium “kirpik”) tipindedir ve aktin filamentlerinden oluşur; tek bir, mikrotübül içeren kinosilyum (kinein “hareket etmek”) gelişim sırasında kılavuz rol oynar. “Koklea” (Yun. kochlias, “salyangoz”) ve “vestibül” (Lat. vestibulum, “giriş holü”) terimleri, iç kulağın iki ana bölgesine işaret eder. Tıbbi literatürde Türkçe’de “tüy hücresi” ve “saç hücresi” eş anlamlı kullanılır; burada fizyolojik bağlamda özelleşmiş mekanoduyusal reseptörler kastedilmektedir.
- Duyusal giriş — Kokleada baziler membran hareketi, vestibülerde otokonial/kupal mekanik sapma, kalpte duvar gerilmesi.
- Birincil transdüksiyon — MET kanalı (TMC1/2) ↔ Piezo/TRP/TREK-1.
- Yerel modülasyon — OHC elektromotilitesi ve efferent inhibisyon ↔ otonom tonus ve miyokardiyal gerilme-duyarlı iletkenlik.
- Sinaptik/iletim — Şeritli sinaps ve glutamat ↔ iletim sistemi (SA/AV düğüm, Purkinje) ve elektrofizyoloji.
- Sistem çıktısı — İşitsel algı/denge ↔ atım hacmi, ritim stabilitesi.
- Arıza kipleri — Gürültü/ototoksisite/genetik ↔ aşırı gerilme, fibroz, iskemi, kanalopatiler.
Evrimsel ve Karşılaştırmalı Perspektif
Tüy hücreleri, tüm çeneli omurgalılarda korunmuş, yüksek derecede özelleşmiş mekanoduyusal transdüserlerdir. Balık ve amfibilerde su hareketlerini algılayan yan çizgi sistemi (neuromast organları) tüy hücreleri ile çalışır; bu yapı, kara omurgalılarında işitsel ve vestibüler organlara evrilmiştir. Kuşlar ve balıklar, destek hücresi kaynaklı proliferasyon ve transdiferansiasyon yoluyla tüy hücresi kaybını fonksiyonel olarak telafi edebilirken, memelilerde (özellikle kokleada) rejenerasyon kapasitesi son derece sınırlıdır. Bu evrimsel ayrışma, işitme keskinliğinin artışı ile doku yenilenmesi arasındaki biyolojik ödünleşimi düşündürür.
Gelişimsel Köken ve Doku Mimarisi
İç kulak, embriyogenezde otik plaktan türeyen otik vezikülden gelişir. Kokleada Corti organı boyunca bir bazal–apikal eksen üzerinde tonotopik düzen kurulur; vestibüler labirentte ise utrkül ve sakkülün makulaları ve yarım daire kanallarının kristaları oluşur. Koklear tüy hücreleri:
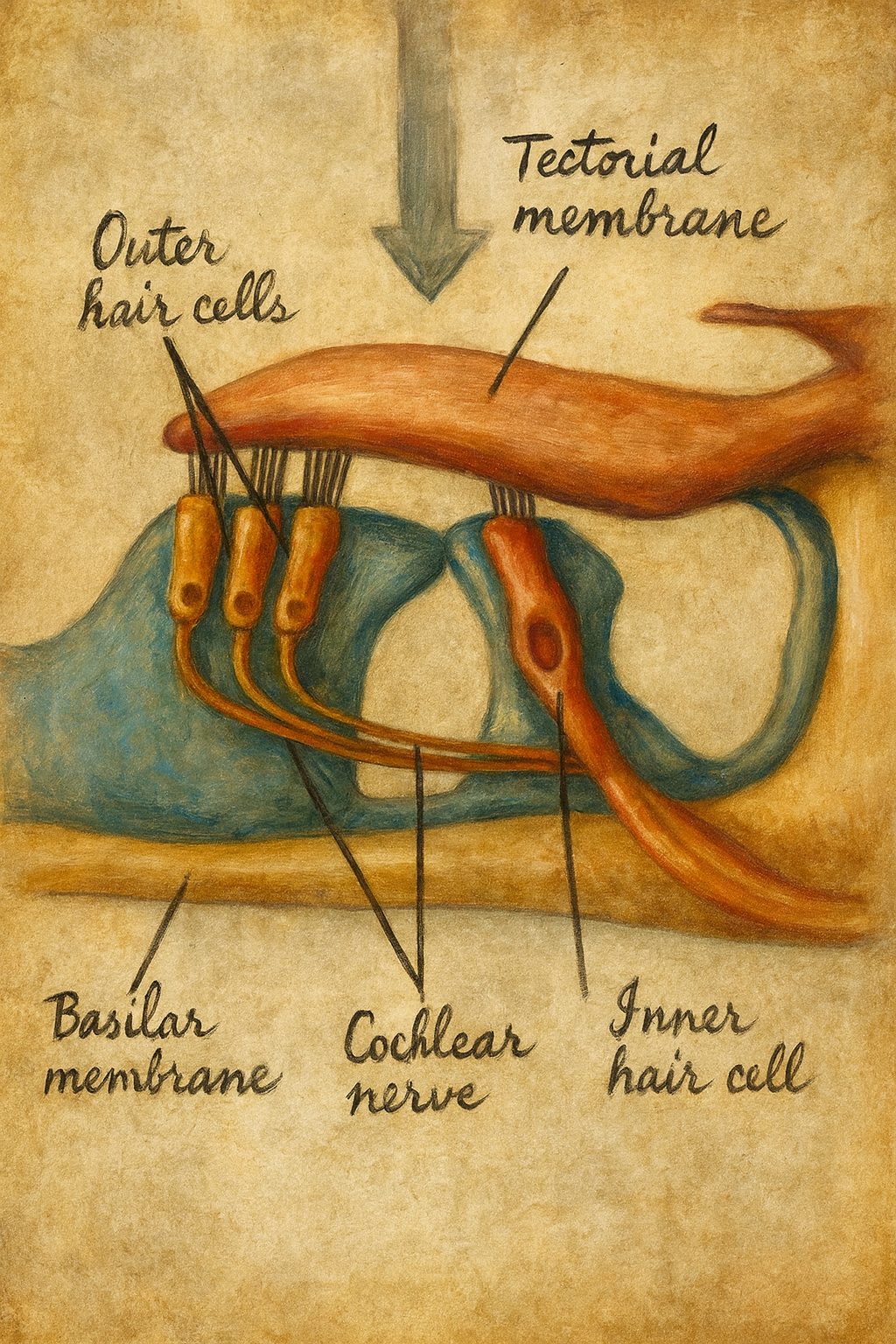
- İç Tüy Hücreleri (IHC’ler): Tek sıralı, sayıca daha az; mekanik uyarımı sinir sinyaline dönüştürmenin başlıca kaynağıdır.
- Dış Tüy Hücreleri (OHC’ler): Üç sıralı, sayıca fazla; koklear amplifikatörün motor elemanlarıdır ve hassasiyeti/frekans seçiciliğini belirginleştirir.
Vestibüler epitelyumda iki morfolojik tip vardır:
- Tip I tüy hücreleri: Kaliks tipi afferentlerle sarılır.
- Tip II tüy hücreleri: Bouton tipi afferentlerle temas kurar.
Bu hücreler Destek hücreleri (örn. Deiters, sütun hücreleri), retiküler lamina ve tektoryal membran (koklea) ile sıkı bir mikro-mekanik bütünlüğe sahiptir.
Ultra-Yapısal Özellikler
Stereosilyalar, artan uzunluklu kademeli bir merdiven şeklinde organize olur; komşu stereosilyaların uçlarını bağlayan uç-bağlantıları (tip links) başlıca cadherin-23 ve protocadherin-15’ten oluşur. Kokleada kinosilyum doğumdan sonra geriler; vestibüler epitelyumda ise erişkin dönemde de kalır. Bazolateral membranda gerilim kapılı iyon kanalları, ribon şeritli sinapslar ve IHC’lerde yoğun glutamaterjik iletim aparatı bulunur; OHC’lerde ise plazma membranına gömülü, anyon taşıyıcı ailesinden prestin (SLC26A5), somatik elektromotilitenin moleküler temelini oluşturur.
Mekanotransdüksiyonun Biyofiziği
Sıvı Kompartmanları ve Elektrokimya
Koklear kanalın skala mediası, yüksek potasyumlu endolenf ile doludur ve endokoklear potansiyel yaklaşık +80 mV’tur. Tüy hücresi içi ile birlikte düşünüldüğünde, stereosilyar uçta ~140–160 mV’luk güçlü bir elektro-kimyasal itici güç doğar.
MET Kanalı ve Uyum
Stereosilyaların uyarımla eğilmesi, uç-bağlantılarındaki gerilimi artırır ve mekanotransdüksiyon (MET) kanalı açılır; başlıca K⁺ (ve kısmen Ca²⁺) içeri girişiyle reseptör akımı oluşur. MET kanalının gözenek bileşenleri için TMC1/TMC2 başat adaylardır. Kalsiyum girişi, miyozin-1c aracılı moleküler motorlar üzerinden uç-bağlantı gerginliğini ayarlayarak hızlı/yavaş adaptasyon üretir.
Elektromotilite ve Koklear Amplifikatör
OHC’lerde membran potansiyelindeki küçük değişiklikler, prestin aracılı hızlı boy değişimleriyle baziler membran hareketini güçlendirir. Bu geri besleme, hem eşik yakınında yüksek kazanç sağlar hem de keskin frekans ayarı ve otoakustik emisyonların kaynağını oluşturur.
Sinaptik İletim ve Efferent Kontrol
IHC’ler, şeritli sinapslar üzerinden tip I spiral ganglion nöronlarına glutamat salar; sinaptik bantlar yüksek hızda sürekli iletime uyumludur. OHC’ler, medial olivokoklear liflerden gelen kolinerjik (α9α10 nAChR) girdilerle SK2 kanalları üzerinden hiperpolarize edilerek kazanç ayarlanır; bu sistem gürültüye karşı koruyucu olabilir.
Koklear Mekanik ve Tonotopi
Baziler membran, bazal ucunda dar/sert, apikalde geniş/gevşektir; seyahat eden dalga her frekans için farklı bir tepe lokalizasyonu oluşturur. Bu tonotopik harita, IHC çıkışının primer işitsel sinirde ve daha yukarıda (kohlear çekirdek—üst olivar kompleks—kolikulus inferior—MGN—primer işitsel korteks) korunur. Psikofizikte kritik bantlar, bu mekanik ve sinaptik seçiciliğin algısal izdüşümüdür.
Vestibüler Mekanik: Makulalar ve Kristalar
Utrkül/sakkül makulalarında stereosilyalar, kinosilyuma göre striola çevresinde düzenlenir; üzerlerini kaplayan otokoniyal jel (kalsiyum karbonat kristalleri) doğrusal ivmeyi ve yerçekimi vektörünü momentum farkıyla tüy hücrelerine iletir. Yarım daire kanallarında, kupayı bükerek açısal hız değişimleri algılanır. Afferent deşarj, vestibülo-oküler refleks aracılığıyla baş-göz stabilizasyonunu sağlar; klinikte VEMP testleri otolit fonksiyonunu, head impulse testleri kanal kazancını değerlendirir.
Klinik Nüanslar
Hasar Mekanizmaları
- Gürültüye bağlı işitme kaybı: MET kanalından aşırı Ca²⁺ girişi, oksidatif stres, sinaptik şerit kaybı (“koklear sinaptopati”) ve OHC hasarı.
- Presbiakuzi: Bazal turda OHC/IHC ve sinaptik dejenerasyon; yüksek frekanslardan başlayan eşik artışı ve konuşma ayrımında bozulma.
- Ototoksisite: Aminoglikozidler ve sisplatin başta olmak üzere, ROS üretimi ve mitokondriyal disfonksiyon yoluyla stereosilyar ve sinaptik hasar.
- Genetik etiyoloji: TMC1, MYO7A (Usher sendromu), CDH23/PCDH15, KCNQ4, DIAPH1 gibi genlerde varyantlar; kalıtım desenleri DFNB/DFNA spektrumunda.
- Vestibüler bozukluklar: BPPV (otokoninin kanal içine yer değiştirmesi), Menière (endolenfatik hidrops), vestibüler nörit ve iki taraflı vestibülopati.
Tanısal Yaklaşımlar
- Saf ses odyometri ve konuşma odyometrisi.
- DPOAE/TEOAE: OHC fonksiyonunun non-invaziv belirteçleri.
- ABR/ECochG: Beyin sapı düzeyi iletim ve koklear mikrofonik bileşenler.
- VEMP / video HIT / kalorik testler: Vestibüler alt sistemlerin ayrıntılı değerlendirilmesi.
Tedavi ve Korunma
- Önleyici: Gürültüden korunma, ototoksik ajanların doz/alternatif planlanması; çocuklarda sisplatine eşlik eden sodyum tiyosülfat belirli şemalarda otoprotektif olabilir.
- Cihazlar: Koklear implant (IHC/OHC bypass ederek spiral ganglionu uyarır), işitme cihazları (dijital yönlü mikrofonlar, frekans sıkıştırma).
- Gelişen yaklaşımlar: Atoh1 temelli gen terapileri, Notch/Wnt yolaklarının destek hücresinde yeniden programlanması; aminoglikozid bağlanmasını azaltan türevler ve antioksidan stratejiler üzerine deneysel çalışmalar.
“Alışılmadık Roller” Bağlamı: Kalpte Mekanosensörler ve Mechano-Elektrik Geri Besleme
Kalpte stereosilyalı tüy hücreleri yoktur; ancak kardiyak dokuda gerilme, kesme ve basınca duyarlı mekanosensitif iyon kanalları ve yapısal sensörler geniş bir mechano-elektrik geri besleme ağı oluşturur:
- İyon kanalı adayları: Piezo1/2, çeşitli TRP alt tipleri (TRPC6, TRPV4), iki gözenekli K⁺ kanalları (TREK-1) ve gerilme-aktive kanallar, membran gerilimini elektriksel aktiviteye çevirir.
- Hücresel sensörler: Sarkomer düzeyinde titin ve buna bağlanan protein kompleksleri, integrin-odaklı fokal adezyonlar ve çekirdek–sitoiskelet köprüleri (LINC kompleksi) mekanik sinyali biyokimyasal yanıta dönüştürür.
- Fizyolojik örnekler: Bainbridge refleksi (atriyal gerilme ile taşikardi), dolum basınçlarındaki artışın aksiyon potansiyeli süresine etkileri, egzersizde preload/afterload değişimlerinin atım dinamiklerini yeniden ayarlaması.
- Patofizyoloji: Komotio kordis gibi ani göğüs darbelerinde mekanik uyarının yeniden giriş odaklarını tetiklemesi; iskemi/fibrozda anormal matriks–mekanosensör etkileşimleriyle aritmojenez eğilimi.
Bu çerçeve, tüy hücrelerindeki mekanotransdüksiyon ile kavramsal bir benzerlik taşır: mekanik bilginin iyon kanalı düzeyinde elektriksel sinyale çevrilmesi. Ne var ki, kalpte stereosilyum-uç bağlantısı mimarisi veya prestin benzeri elektromotilite bulunmaz; dolayısıyla “tüy hücresi” terimi kardiyak doku için anatomik olarak yerinde değildir, benzetme yalnızca işlevsel–moleküler prensip düzeyinde anlamlıdır.
Moleküler–Sistemik Köprüler
- İşitsel sinaptopati kavramı (eşikler normal, gürültüde konuşma kötü) ile kardiyak subklinik elektriksel dengesizlikler arasında metodolojik paralellikler: klasik ölçütler normal iken yüksek dinamik zorluklarda bozulma görülebilir.
- İnflamasyon ve oksidatif stres: Her iki sistemde de mitokondriyal fonksiyon, ROS üretimi ve kalsiyum homeostazı hassas düğümlerdir.
- Nöral–efferent modülasyon: Olivokoklear sistemin kazanç kontrolü ile otonom sinir sisteminin kalp hız değişkenliğini ayarlaması, biyolojik kontrol kuramı açısından benzer geri besleme ilkeleri sergiler.
Keşif
İç kulağın “tüy hücreleri”nin hikâyesi, ince cam mercekler altında beliren belirsiz çizgilerle başlar ve günümüzde, tekil iyon kanallarının atomik benzetimlerine, kaybolan işitmenin geri kazanılmasını hedefleyen klinik denemelere kadar uzanır. Bu, aynı zamanda bilimin nasıl ilerlediğinin bir örneğidir: sezgisel gözlemler, yavaş yavaş daha keskin aletlerle doğrulanır; yanlış hipotezler, daha iyi olanlarla yer değiştirir; ve kavrayış, anatomiden fiziğe, fizikten moleküle doğru katman katman derinleşir.
1) Erken İzler: Ön-Odiyoloji Çağı (17.–18. yüzyıllar)
Hikâye, 17. yüzyılın ikinci yarısında, mikroskobinin doğum sancılarıyla başlar. Marcello Malpighi, ince kesitler ve ham optiklerle memeli iç kulağının kıvrımlarını betimler; onun notlarında, bugün bizim “stereosilya” diyeceğimiz saç benzeri çıkıntılara doğrudan göndermeler beklemek aşırı olur, fakat labirentin dokusal ayrıntılarının ilk sistematik tasvirlerine giden yolu açtığı tartışmasızdır. Birkaç on yıl sonra Antonio Valsalva, temporal kemiğin ve labirentin topografyasını klinik gözlemlerle birleştirir; Domenico Cotugno ise 18. yüzyılın ortasında labirentin sıvılarını –sonradan “endolenf” ve “perilenf” olarak adlandırılacak ayırtları– dikkat çekici bir berraklıkla tasvir eder. Henüz “tüy hücresi” terimi yoktur; fakat sahne kurulmuştur: katı kemik kapsül içinde akışkan bir dünya.
2) Mikroskobun Netleşmesi ve Organın Adını Bulması (19. yüzyılın ortası)
Modern anlamda keşif, 1851’de Alfonso Corti’nin tarihî çalışmasıyla görünür hâle gelir. Corti, memeli kokleasında baziler membran üzerinde uzanan sinir-epitelyal şeridi ayrıntılarıyla tanımlar; bugün “Corti organı” dediğimiz bu yapı, iç (tek sıra) ve dış (üç sıra) hücre dizilerinin anatominin omurgası olduğunu ortaya koyar. Aynı dönemde Otto Deiters destek hücrelerini, Victor Hensen ve Friedrich Matthias Claudius epitelin eşlikçi hücre tiplerini betimler; Albert von Kölliker ve diğer histologlar, kemik labirentin içinde benzersiz bir sensör-mekanik organizasyonun ipuçlarını resmeder. Burada “keşif” artık yalnız bir görme olayı değildir: farklı hücre tiplerinin düzeni ve muntazam dizilişi, bir işlevi ima eder.
3) “Nasıl Duyuyoruz?”: Kuramsal Sıçrama ve Vestibüler Kavrayış (19. yüzyıl sonu)
Hermann von Helmholtz, 1863’te yayımladığı ses duyumları kuramıyla, kokleanın frekanslara göre yerel olarak ayarlı bir rezonatörler dizisi olabileceğini ileri sürer. Bu fikir, henüz doğrudan ölçülemeyen bir şeyi –frekans seçiciliği– anatomik düzen ile uzlaştırır. Öte yandan Ernst Ewald’ın 1890’larda yarım daire kanalları üzerine yaptığı titiz deneyler, vestibüler sistemin yön-seçici ve dinamik yanıtlarını nicel hâle getirir; Robert Bárány’nın klinik denemeleri, termal uyarımla vestibüler reflekslerin ortaya çıkarılabileceğini gösterir ve 1914’te Nobel Ödülü’yle taçlanır. Bir yanda işitmenin mekaniği, öte yanda dengenin refleks fiziolojisi… her ikisi de aynı hücresel ailenin –tüy hücrelerinin– omuzlarında yükselir.
4) Optikten Elektrofizyolojiye: Dalgaların İzini Sürmek (20. yüzyıl başı–ortası)
Georg von Békésy, 1930’lardan 1950’lere uzanan bir dizi parlak deneyle, baziler membranda seyahat eden dalganın varlığını doğrudan gösterir: belirli bir frekans, kokleanın belli bir yerinde tepe yapar. Helmholtz’un sezgisi ölçüye dönüşür; 1961’de Nobel Ödülü gelir. Ancak Békésy’nin preparatları çoğu kez postmortem ve pasif dokulardır; bu, kokleanın yalnızca pasif bir filtre olmadığı düşüncesini filizlendirir. Thomas Gold, 1948’de “aktif” bir süreç öngörür; o gün için cesur bir hipotez olan bu fikir, ileride dev bir kapıyı aralayacaktır. Aynı yıllarda Rasmussen, beyin sapından kokleaya inen olivokoklear lifleri betimler; periferdeki kazanç kontrolünün merkezi sinir sistemi tarafından modüle edildiği anlaşılır.
5) Görünmeyeni Görmek: Elektron Mikroskopisi ve Tüy Hücresi Morfogenezi (1950–1970)
Ernst Ruska’nın açtığı yoldan ilerleyen elektron mikroskopisi, 1950’lerden itibaren iç kulağın ultra-yapısını görünür kılar. Torsten Wersäll, vestibüler epitelyumda Tip I ve Tip II tüy hücrelerini ayırt eder; Engström ve meslektaşları koklear stereosilya demetlerinin kademe düzenini, apikal “uç-bağlantıları”nın (tip links) varlığını ve sinaptik bantların örgüsünü tasvir eder. Artık “saç benzeri çıkıntılar” yalnızca mecaz değildir; aktin demetlerinin düzeni, kinosilyumun gelişimdeki kılavuz rolü ve retiküler laminanın mekanik bütünlüğü, yüksek çözünürlüklü görüntülerle somutlaşır.
6) Sesin Elektriğe Dönüştüğü An: Mekanotransdüksiyonun Doğrudan Kaydı (1970–1980)
Cam pipetler ve yüksek dirençli amplifikatörler, tüy hücrelerinin elektriksel dilini çözmeyi mümkün kılar. Robert Fettiplace ve çalışma arkadaşları, sürüngen papillasında tek tüy hücresinden akım kaydeder; David Corey ve A. James Hudspeth, kurbağa sakrusal organında mekanotransdüksiyon (MET) akımını doğrudan ölçer. Ian Russell ve meslektaşları, tüy demetlerine uygulanan en küçük sapmaların, milisaniyeler içinde iyon akımlarına dönüştüğünü gösterir. Aynı dönemde David Kemp, dış kulak yolundan otoakustik emisyonlar kaydeder; iç kulağın bir “mikrohoparlör” gibi de davranabildiği –yani aktif bir amplifikatöre sahip olduğu– şaşırtıcı biçimde doğrulanır.
7) Koklear Amplifikatörün Motoru: OHC Elektromotilitesi ve Prestin (1980–2000)
1985’te William Brownell, memeli dış tüy hücrelerinin membran potansiyelindeki küçük değişimlerle boylarını elektromekanik olarak anında değiştirdiğini keşfeder. Gold’un “aktif süreç” sezgisi, artık hücresel bir mekanizmaya kavuşur. Takip eden on yıllarda bu fenomenin moleküler temeli netleşir: OHC membranına gömülü bir anyon taşıyıcı ailesi üyesi olan prestin (SLC26A5), gerilimle konformasyon değiştirerek hücrenin boyunu değiştirir; prestinsiz fareler, keskin frekans ayarını ve hassasiyeti kaybeder. Koklear amplifikatörün bedeni dış tüy hücreleri, ruhu prestindir.
8) Uç-Bağlantılar, MET Kanalı ve Şeritli Sinaps: Moleküllerin Adını Koymak (1980–2015)
1984’te Andrew Pickles ve meslektaşları, komşu stereosilyaların uçlarını birleştiren “uç-bağlantıları” gösterir. 2000’lerin başında cadherin-23 ve protocadherin-15’in bu bağlantıların ana bileşenleri olduğu anlaşılır; böylece mekanik gerilimin kanala nasıl iletilebileceğine dair bir moleküler köprü kurulur. 2010’lara gelindiğinde, TMC1/TMC2 proteinleri vertebrat tüy hücrelerindeki MET kanalının gözenek oluşturucu adayları olarak öne çıkar; model organizmalar ve insan mutasyonları, bu adaylığı kuvvetlendirir. Aynı zamanda iç tüy hücrelerinin şeritli sinapslarında vezikül trafiğinin özgül düzenleyicileri –otoferlin gibi– belirlenir; afferent iletim kapasitesinin sürekliliği, sinaptik bant mimarisiyle ilişkilendirilir.
9) Rejenerasyon, Sinaptopati ve Genetik Çağ (1988–günümüz)
1988’de Edwin Rubel, Douglas Cotanche ve diğerleri, kuş kokleasında hasarlı tüy hücrelerinin destek hücrelerinden kaynaklanarak yenilenebildiğini gösterir; memelilerde ise bu kapasite şaşırtıcı biçimde sınırlıdır. 1990’lar ve 2000’lerde, kalıtsal işitme kayıplarını kodlayan onlarca gen –MYO7A, CDH23, PCDH15, KCNQ4, DIAPH1 ve daha niceleri– haritalanır; klinik fenotipler moleküler patikalarla eşleşir. 2009’dan itibaren “koklear sinaptopati” kavramı, eşikler normal iken gürültüde konuşma ayrımının bozulabileceğini, yani sinaptik bağlantıların sessizce zayıflayabileceğini gösterir. Böylece işitme kaybının yalnız “hücre ölümü”nden ibaret olmadığı, sinaptik ve nöral düzeylerde de başlayabileceği anlaşılır.
Bu arada klinik sahada bir başka devrim zaten yola çıkmıştır: 1960’lardan itibaren William House’un öncülük ettiği koklear implantlar, 1970’lerin sonlarında Graeme Clark’ın çok kanallı tasarımıyla olgunlaşır. Tüy hücreleri hasar gördüğünde, cihaz sinir liflerini doğrudan uyararak işitsel duyumu geri kazandırır; binlerce çocuğun dil edinimi ve eğitimi, bu teknoloji sayesinde kökten değişir.
10) Güncel Ufuklar: Tercüme Edilen Genler, Çözülen Yapılar, İncelen Duyumlar (2015–2025)
Son on yılda, üç doğrultu belirginleşir:
- Gen ve hücre tedavileri: Özellikle bialelik OTOF mutasyonları gibi iyi tanımlı hedeflerde, iç tüy hücresi sinapsının kalsiyum-duyarlı ekzositozunu onarmayı amaçlayan gen tedavileri klinik denemelere taşınır. Destek hücrelerinin yeniden programlanması (Atoh1, Notch/Wnt modülasyonu) ve vektör tasarımları, memeli kokleadaki rejenerasyon engelini aşmaya çalışır.
- Nano-ölçek yapısal biyoloji: Şeritli sinaps bileşenleri ve aday MET kanal kompleksleri, kriyo-EM ve gelişmiş görüntüleme ile daha çözünür hâle gelir; uç-bağlantı–kanal kavramı mekanik modellerle birleştirilir. Aktin çekirdeğinin kademeli mimarisi ile elastik bağlantıların frekans bağımlı davranışı, doğrudan ölçülür.
- Sistem nörobilimi ve davranış: Koklear amplifikatör kazancının beyin sapı olivokoklear demetleri ile dinamik kontrolü, dikkat ve dinleme çabası gibi bilişsel durumlarla ilişkilendirilir; tüy hücresi, artık yalnız periferik bir dönüştürücü değil, algısal ekosistemin ayarlanabilir bir düğümüdür.
11) Yan Yollarda Öğrendiklerimiz: Denge, Otoproteksiyon ve Klinik İnce Ayar
Vestibüler tarafta, otokoniyal jel ve kupulanın viskoelastikliği ile tüy demeti mekaniklerinin eşleşmesi, yaşlanma ve kalsiyum metabolizmasıyla bağlanır; benign paroksismal pozisyonel vertigonun biyofiziği anlaşılır. Otoakustik emisyon tabanlı taramalar, yeni doğan işitme kaybını erken yakalar. Ototoksisiteye –aminoglikozidler, sisplatin– karşı koruyucu stratejiler, farmakolojinin ince terazisinde tartılır; çocuk onkolojisinde duyuyu korumak artık gerçekçi bir hedef hâline gelir.
12) Dilin Kendisi: “Tüy” ve “Saç”ın Etimolojisi, Kavramın Evrimi
Türkçe’de “tüy/saç hücresi” denilen bu hücrelerin İngilizce karşılığı hair cell’dir; “saç” benzetmesi, apikal yüzeydeki stereosilya demetinin görünüşünden doğar. “Stereosilyum” Yunanca stereos (katı) ve Latince cilium (kirpik) köklerinden birleşir; vestibül (Lat. vestibulum, giriş holü) ve koklea (Yun. kochlias, salyangoz) terimleri, yapının hem biçimini hem de işlevsel topoğrafyasını dille mühürler. İlginç olan, “saç” benzetmesinin zamanla mecazdan moleküle dönüşmesidir: artık bu “saçların” aktin filamentlerinden örülü olduğu, uçlarının kadherin köprüleriyle gerilim algıladığı, açılan gözenekten potasyum ve kalsiyumun aktığı bilinir.
13) Keşiflerin Haritası: İsimler, Aletler, Kavramlar
- Malpighi – Valsalva – Cotugno: Labirentin bedenini tanımladılar.
- Corti – Deiters – Hensen – Claudius: Epitelin örgüsünü ve hücre tiplerini ayırdılar.
- Helmholtz: Frekans-seçiciliğin kuramsal iskeletini kurdu.
- Ewald – Bárány: Vestibüler fiziolojiyi deneysel ve klinik temele oturttu.
- Békésy: Seyahat eden dalgayı ölçtü; tonotopiyi kanıta çevirdi.
- Gold – Rasmussen: Aktif süreç ve efferent kontrol kavramlarını yerleştirdi.
- Engström – Wersäll: EM çağında tipoloji ve ultra-yapıyı görünür kıldı.
- Fettiplace – Corey – Hudspeth: MET akımını doğrudan kaydetti.
- Kemp: Otoakustik emisyonlarla amplifikatörü çevikçe doğruladı.
- Brownell – Zheng ve çalışma arkadaşları: OHC elektromotilitesi ve prestin ile motoru tanımladı.
- Pickles ve meslektaşları – cadherin-23/protocadherin-15: Uç-bağlantı mimarisini çözdüler.
- Genetikçiler ve sinaptik biyologlar: TMC1/TMC2, otoferlin ve onlarca sağırlık genini haritaladılar.
- House – Clark ve mühendisler: Koklear implantla klinikte yeni bir çağ açtılar.
- Rubel – Cotanche ve rejenerasyon biyolojisi: Memelilerle kuşlar arasındaki yenilenme farkını ortaya koydular.
- Klinik çeviri ekosistemi (2015–2025): Otof gen terapileri, rejenerasyon programları ve sinaptopatiyi hedefleyen stratejilerle umut veren bir eşiği yokluyor.
14) Bugünden Bakınca
Tüy hücrelerinin hikâyesi bitmiş bir öykü değil; yaşayan bir araştırma gündemidir. Bir yanda atomdan organa kadar çok katmanlı bir mekanodan elektrike dönüşüm şeması, diğer yanda klinikte ölçülebilir, tedavi edilebilir hedefler… Stereosilyanın ucundaki kadherin köprüsü gerildiğinde açılan birkaç nanometrelik gözenek, bir çocuğun ilk kez annesinin sesini işitmesine kadar uzanan bir zincirin ilk halkasıdır. Keşiflerin asıl anlamı, belki de budur.
İleri Okuma
- Helmholtz, H. von (1863). Die Lehre von den Tonempfindungen. Braunschweig: Vieweg.
- Retzius, G. (1884–1895). Das Gehörorgan der Wirbeltiere. Stockholm: Samson & Wallin.
- Békésy, G. von (1960). Experiments in Hearing. New York: McGraw–Hill.
- McCloskey, D. I. (1974). Mechanoreceptors in cardiovascular reflexes. Nature, 252(5478), 19–22. https://doi.org/10.1038/252019a0
- Kemp, D. T. (1978). Stimulated acoustic emissions from within the human auditory system. Journal of the Acoustical Society of America, 64(5), 1386–1391. https://doi.org/10.1121/1.382104
- Corey, D. P., & Hudspeth, A. J. (1983). Kinetics of the receptor current in bullfrog saccular hair cells. Journal of Neuroscience, 3(5), 962–976. https://doi.org/10.1523/JNEUROSCI.03-05-00962.1983
- Pickles, J. O., Comis, S. D., & Osborne, M. P. (1984). Cross-links between stereocilia in the guinea pig organ of Corti, and their possible relation to sensory transduction. Hearing Research, 15(2), 103–112. https://doi.org/10.1016/0378-5955(84)90031-8
- Brownell, W. E., Bader, C. R., Bertrand, D., & de Ribaupierre, Y. (1985). Evoked mechanical responses of isolated cochlear outer hair cells. Science, 227(4683), 194–196. https://doi.org/10.1126/science.3966153
- Lim, D. J. (1986). Structure and function of the tectorial membrane. Hearing Research, 22(1–3), 117–146. https://doi.org/10.1016/0378-5955(86)90089-4
- Hudspeth, A. J. (1989). How the ear’s works work. Nature, 341, 397–404. https://doi.org/10.1038/341397a0
- House, W. F. (1976). Cochlear implants. Annals of Otology, Rhinology & Laryngology, 85(4), 1–93. https://doi.org/10.1177/0003489476085004-601
- Ashmore, J. (2008). Cochlear outer hair cell motility. Physiological Reviews, 88(1), 173–210. https://doi.org/10.1152/physrev.00044.2006
- Zheng, J., Shen, W., He, D. Z. Z., Long, K. B., Madison, L. D., & Dallos, P. (2000). Prestin is the motor protein of cochlear outer hair cells. Nature, 405, 149–155. https://doi.org/10.1038/35012009
- Siemens, J., Lillo, C., Dumont, R. A., Reynolds, A., Williams, D. S., Gillespie, P. G., & Müller, U. (2004). Cadherin 23 is a component of the tip link in hair cells. Nature, 428, 950–955. https://doi.org/10.1038/nature02483
- Ahmed, Z. M., Riazuddin, S., Ahmad, J., Bernstein, S. L., Guo, Y., Sabar, M. F., et al. (2006). Mutations of the protocadherin 15 gene cause Usher syndrome type 1F. Nature Genetics, 38, 989–995. https://doi.org/10.1038/ng1860
- Kawashima, Y., Géléoc, G. S. G., Kurima, K., Labay, V., Lelli, A., Asai, Y., et al. (2011). Mechanotransduction in mouse inner ear hair cells requires transmembrane channel-like genes. Journal of Clinical Investigation, 121(12), 4796–4809. https://doi.org/10.1172/JCI60405
- Fettiplace, R., & Kim, K. X. (2014). The physiology of mechanoelectrical transduction channels in hearing. Physiological Reviews, 94(3), 951–986. https://doi.org/10.1152/physrev.00038.2013
- Quinn, T. A., Kohl, P., & Ravens, U. (2014). Cardiac mechano-electric coupling: physiology and pathophysiology. Progress in Biophysics and Molecular Biology, 115(2–3), 257–271. https://doi.org/10.1016/j.pbiomolbio.2014.06.002
- Ranade, S. S., Syeda, R., & Patapoutian, A. (2015). Mechanically activated ion channels. Neuron, 87(6), 1162–1179. https://doi.org/10.1016/j.neuron.2015.08.032
- Corey, D. P., & Holt, J. R. (2016). Are TMC proteins the mechanotransduction channels of vertebrate hair cells? Journal of Neuroscience, 36(43), 10921–10926. https://doi.org/10.1523/JNEUROSCI.1148-16.2016
- Liberman, M. C., & Kujawa, S. G. (2017). Cochlear synaptopathy in acquired sensorineural hearing loss: Manifestations and mechanisms. Hearing Research, 349, 138–147. https://doi.org/10.1016/j.heares.2017.01.003
- Michalski, N., & Petit, C. (2019). Genes involved in the development and function of the inner ear. Human Molecular Genetics, 28(R2), R229–R236. https://doi.org/10.1093/hmg/ddz164
- Santos-Sacchi, J. (2019). Prestin and outer hair cell electromotility. Pflügers Archiv – European Journal of Physiology, 471, 1–8. https://doi.org/10.1007/s00424-018-2214-1
- Dulon, D., Safieddine, S., & Petit, C. (2020). Otoferlin and exocytosis at auditory ribbon synapses. Hearing Research, 397, 108053. https://doi.org/10.1016/j.heares.2020.108053