İçindekiler
Tanım ve etimoloji
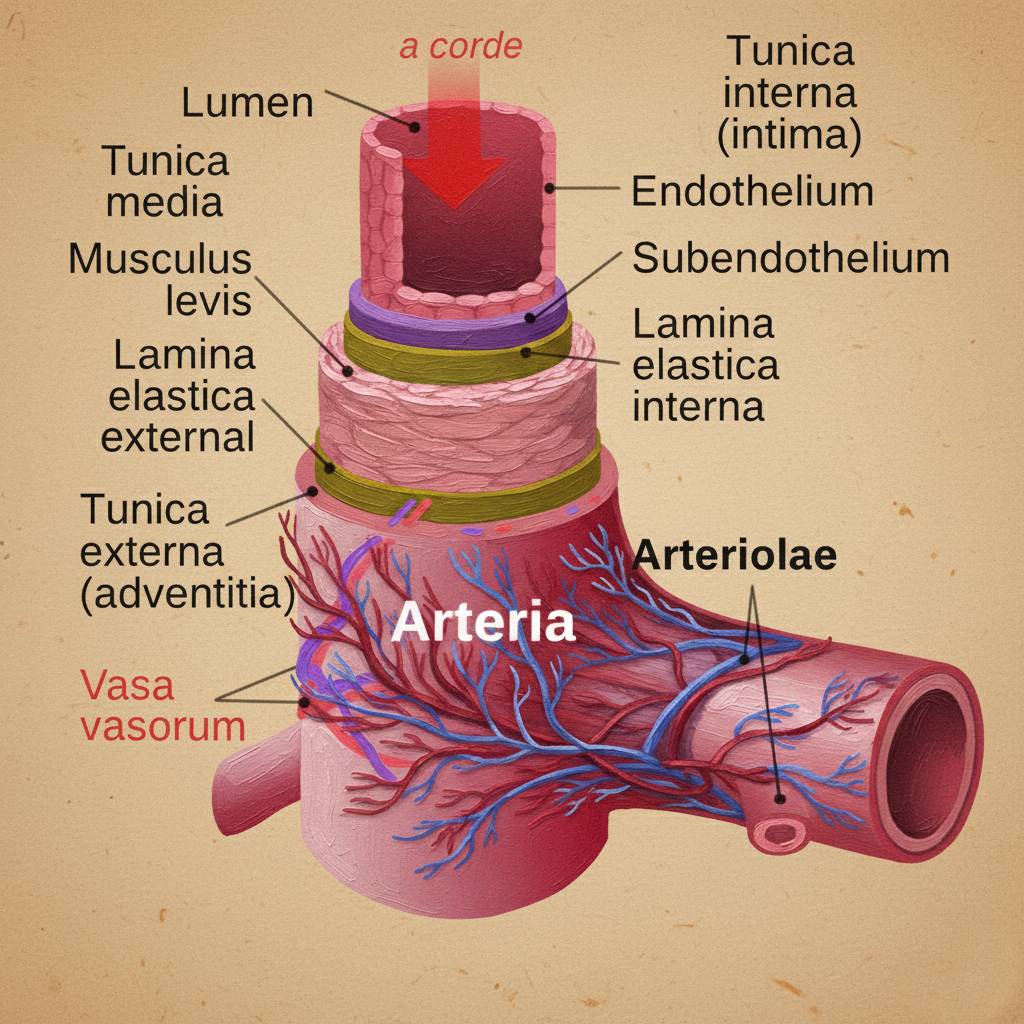
Vasa vasorum (“damarların damarları”), Latince vas (“kap, damar”) ve bunun çoğulu olan vasorumdan türeyen bir terimdir; büyük damarların duvarlarını besleyen ince damar ağına işaret eder. Elastik tip arterlerde (özellikle aort ve büyük dalları) ve kalın duvarlı büyük venlerde, yalnızca lümenden difüzyonla karşılanamayacak metabolik gereksinimleri karşılamak üzere gelişen, dıştan içe uzanan bir mikrodolaşım sistemidir.
Makroanatomik dağılım ve sınıflandırma
Vasa vasorum, çoğunlukla tunica adventitia (tunica externa) içinde başlar ve tunica media’nın dış kısımlarına doğru ilerler. Çoğu büyük damarda duvarın dış iki üçte birlik bölümü bu ağ tarafından beslenir; lümene yakın iç üçte birlik kısım ise kısmen doğrudan lümendeki kandan difüzyonla beslenir. Anatomik ve kaynak yönünden üç alt tipe ayrılabilir:
- Vasa vasorum externa: Komşu arter veya venlerden adventisyaya girer ve medyaya doğru uzanır.
- Vasa vasorum interna: Lümenden köken alıp damar duvarına penetre olan daha nadir dallar.
- Vasa venorum (venöz eşlikçiler): Damar duvarından köken alan ve duvarın venöz drenajını sağlayan ince venüller.
Venöz sistemde (özellikle oksijen içeriğinin zaten düşük olduğu derin ve kalın duvarlı venlerde) vasa vasorum çoğu zaman arterlere göre daha yoğun olabilir. Sistemik aorta, pulmoner arter, karotid ve femoral arterlerde zengin gelişim gösterirken, daha ince duvarlı ve düşük gerilimli segmentlerde seyrekleşir.
Histolojik mimari
Vasa vasorum, tipik olarak endotel hücreleri, perisitler ve ince düz kas katmanları içeren arteriol, kapiller ve venül ağlarından oluşur. Adventisiya stromasında kollajen ve elastik liflerle çevrili bu ağ, vasa nervorum (damar duvarını innerve eden sinirlerin damarları) ve lenfatik kapillerlerle yakın komşuluk içindedir. Bu üçlü (mikrodolaşım–sinir–lenfatik) birliktelik, damar duvarının immün ve nörovejetatif düzenlenmesinde işlevsel bir “adventisyal niş” oluşturur.
Fizyoloji: difüzyon sınırı ve metabolik gereksinim
İnce damarların duvar kalınlığı, lümendeki kandan difüzyonla O₂ ve besin taşınmasına elverişlidir. Ancak duvar kalınlığı yaklaşık birkaç yüz mikrometreyi aştığında difüzyon gradyenti yetersiz kalır; medyanın dış kısımları ve adventisya hipoksiye eğilim gösterir. Vasa vasorum bu bölgeleri perfuze ederek:
- Oksijen ve besin sağlar,
- Metabolit ve atıkları uzaklaştırır,
- Damar duvarı hücrelerinin (düz kas hücresi, fibroblast, immün hücre) homeostazını destekler.
Mekanik gerilme, transmural basınç, duvar kalınlığı, akım kaynaklı kayma gerilimi ve hiperlipidemi/iltihap gibi sistemik etkenler, vasa vasorum akımı ve yoğunluğunu dinamik olarak modüle eder. HIF-1α, VEGF ve angiopoietin ekseni hipoksik uyarıya yanıtla neovaskülarizasyonu artırır.
Gelişim ve adaptasyon
Embriyogenezde büyük damarlar inceyken lümenden difüzyon yeterlidir; büyüme ve duvar kalınlaşmasıyla birlikte adventisyal mikrodolaşım gelişir. Erişkin yaşamda vasa vasorum plastiktir: kronik hipoksi, inflamasyon ve hemodinamik yük artışıyla dallanma ve yoğunluk artışı (sprouting, intussusceptive angiogenesis) görülebilir; tersine, perfüzyon azlığı veya obliteratif süreçlerde gerileyebilir.
Patofizyoloji
Ateroskleroz ve intraplak süreçler
Aterogenezin orta–geç evrelerinde adventisyal taraftan neovaskülarizasyon gelişir. Bu genç, geçirgen mikrodamarlar:
- Plak içine eritrosit sızıntısı ve intraplak hemorajiye zemin hazırlar,
- Demir birikimi ve oksidatif stresi artırır,
- Monosit/makrofaj ve T hücresi infiltrasyonuna “giriş kapısı” olur,
- Lipid çekirdeğinin büyümesi, fibröz başlığın incelmesi ve sonuçta plak kırılganlığının artmasıyla ilişkilidir.
Dolayısıyla vasa vasorum yoğunluğu, bazı bölgelerde hastalık aktivitesinin belirteci olarak kabul edilir. Bununla birlikte, neovaskülarizasyonun nedensel mi yoksa ikincil bir yanıt mı olduğu bağlam ve evreye göre değişkenlik gösterebilir.
Anevrizma ve duvar iskemisi
Özellikle abdominal aort anevrizması patobiyolojisinde, vasa vasorum perfüzyonunun azalması ve medyada hipoksik stres; elastin/kollajen yıkımı, MMP aktivitesi ve adventisyal inflamasyonla birlikte duvar zayıflamasına katkıda bulunur. Uzun süreli sigara, hipertansiyon ve sistemik inflamasyon bu süreci hızlandırabilir.
Aort diseksiyonu ve intramural hematom
Bazı intramural hematom olgularında, intima yırtığı saptanmaksızın vasa vasorum rüptürü ile duvar içinde kanama başlayabileceği ileri sürülmüştür. Bu tablo, diseksiyonun başlangıcında adventisyal/mural mikrodamar kırılganlığının rolüne işaret eder.
Vaskülitler ve enfeksiyöz süreçler
Büyük damar vaskülitlerinde (ör. dev hücreli arterit, Takayasu arteriti) inflamasyon sıklıkla vasa vasorum çevresinde yoğunlaşır. Geç dönem sifilitik aortitte vasa vasorumda obliteratif endarterit gelişmesi, medyada iskemi ve elastik doku kaybı ile birlikte proksimal aort anevrizmalarına zemin hazırlar.
Venöz sistem bozuklukları
Kronik venöz yetmezlik ve variköz değişikliklerde, ven duvarındaki vasa vasorumda yeniden şekillenme, kalınlaşma ve inflamatuvar değişiklikler bildirilmektedir. Venöz duvarın oksijen sunumundaki kırılganlık, bu damar ağının göreli önemini artırır.
Görüntüleme ve niceliksel değerlendirme
Vasa vasorum doğrudan çıplak gözle görüntülenemeyecek kadar incedir; buna karşın pek çok modern yöntemle dolaylı veya yüksek çözünürlüklü olarak değerlendirilebilir:
- Kontrastlı ultrason (CEUS): Karotis gibi yüzeyel arterlerde adventisyal/plak içi mikrovaskülarizasyonun gerçek zamanlı takibi.
- Manyetik rezonans (siyah-kan/black-blood MR, DCE-MR): Damar duvarı kalınlaşması, ödem ve kontrast geçiş kinetikleri (K_trans vb.) üzerinden neovaskülarizasyon ve inflamasyonun kantifikasyonu.
- BT anjiyografi: Damar duvarı kalınlaşması ve anevrizma morfolojisi ile ilişkilendirilmiş işaretleri gösterir; doğrudan mikrodamar çözünürlüğü sınırlıdır.
- İntravasküler yöntemler (IVUS, OCT): Özellikle koronerlerde plak morfolojisi ve intraplak mikrovasküler işaretler için yüksek uzaysal çözünürlük.
- PET görüntüleme: FDG gibi inflamasyon belirteçleriyle veya integrin hedefli anjiyogenez ajanlarıyla neovaskülarizasyonun moleküler imajlaması.
- Mikro-CT ve histomorfometri (ek vivo): Araştırma amaçlı, vasa vasorum ağının üç boyutlu haritalanması ve mikrodamar yoğunluğu (MVD) ölçümü.
Düzenleyici faktörler ve sistemik etkiler
- Hipoksi–anjiyogenez ekseni: HIF-1α, VEGF, FGF ve angiopoietin/Tie2 sinyallemesi neovaskülarizasyonun temel sürükleyicileridir.
- Hemodinamikler: Yüksek duvar gerilimi ve kayma gerilimi gradyentleri, adventisyal taraflı damarlaşmayı etkiler.
- Metabolik/inflamatuvar durum: Hiperlipidemi, diyabet, sistemik inflamasyon sitokinleri (ör. TNF-α, IL-1β) ve sigara dumanı maruziyeti vasa vasorum fonksiyonunu bozabilir.
- İlaçlar ve yaşam tarzı: Lipid düşürücüler ve antihipertansifler, duvar inflamasyonu azaldıkça dolaylı olarak mikrovasküler yoğunlukta azalma ile ilişkilendirilebilir; bunun doğrudan anti-anjiyojenik bir etkiden ziyade risk faktörlerinin düzelmesi ile ortaya çıktığı düşünülmelidir.
Klinik önem ve kullanım alanları
- Risk belirteci: Karotid ve koroner arterlerde artmış adventisyal/plak içi mikrovaskülarizasyon, semptomatik hastalık ve gelecek olay riski ile ilişkilendirilebilir.
- Tedavi izlemi: Yoğunluk/metriklerdeki değişim, yoğun statin tedavisi veya antiinflamatuvar stratejilere verilen yanıtı yansıtabilir.
- Anevrizma izlemi: Aort duvarı sinyalleri (ör. DCE-MR kinetikleri) ve periaortik inflamasyon/petabolizma, büyüme hızı ve rüptür riski değerlendirmesinde yardımcı olabilir.
Bu bağlamda vasa vasorum, yalnızca bir “besleyici ağ” değil, aynı zamanda damar duvarı immünitesi, yeniden şekillenmesi ve onarımı için etkin bir arayüz olarak kabul edilmelidir.
Kavramsal ayrımlar
- Vasa vasorum damar duvarını, vasa nervorum ise sinir demetlerini besler; her ikisi de ilgili dokuların iskemik nöropati/vasopati süreçlerinde kritik rol oynar.
- Tunica adventitia ile tunica externa eş anlamlıdır; terminoloji kaynaklara göre farklılık gösterebilir.
Güncel araştırma alanları ve açık sorular
- Neovaskülarizasyonun nedensellik derecesi: Plak girişimlerinde mikrodamar hedeflemek olayları azaltır mı, yoksa bu ağ daha çok biyobelirteç midir?
- Standart ölçütler: CEUS, DCE-MR, PET ve intravasküler teknikler arasında vasa vasorum yoğunluğunu ölçmede uzlaşı ve kesme değerleri gereksinimi.
- Doku–mekanik etkileşim: Duvar mekanobiolojisi, hipoksi ve immün hücre trafiğinin çok ölçekli modellerle birleştirilmesi.
- Karşılaştırmalı anatomi: Arter–ven, sistemik–pulmoner ve türler arası farkların fonksiyonel sonuçları.
Özet niteliğinde sonuç yerine temel noktalar
- Büyük damar duvarının dış bölümleri için vazgeçilmez bir mikrodolaşım ağıdır.
- Yoğunluğu dinamiktir; hipoksi, inflamasyon ve mekanik yük ile artabilir.
- Ateroskleroz, anevrizma, diseksiyon ve vaskülit patofizyolojilerinde kilit roller üstlenir.
- Modern görüntüleme teknikleri, klinik risk katmanlamada ve tedavi izlemede yararlı bilgi sunar.
Keşif
İnsanoğlu damarın içinden geçen kana çok erken tarihlerde hayranlık duymayı öğrendi; fakat damar duvarının da kendi yaşamı olduğuna, dışarıdan gelen bir “ikinci dolaşım” ile beslendiğine dair sezgi çok daha geç olgunlaştı. Büyük damarların (aort gibi) duvarları kalınlaştıkça, yalnızca lümendeki kandan difüzyonla yetinemeyeceğini fark eden anatomi ve patoloji kuşakları, yüzyıllara yayılan bir merak zinciri kurdu. O zincirin halkaları, kavramın adlandırılmasından, damar duvarı biyolojisinin karmaşık patolojilerine ve bugün yüksek çözünürlüklü görüntülemelerin sayısal metriklerine kadar uzanıyor.
Terimin doğuşu: bir Latince buluş ve erken betimlemeler
18. yüzyılın ortalarında Almanya’da çalışan anatomist Christian Gottlieb Ludwig (1709–1773), büyük damarların duvarını besleyen bu ince damar ağını Latince “vasa vasorum” —“damarların damarları”— diye adlandırdı. Terimin isabeti yalnızca şiirselliğinde değil, aynı zamanda işlevi yalın biçimde tarif edişinde yatıyordu; sonraki yüzyıllar boyunca literatürde kök salmasının nedeni de bu berraklık oldu.
Fizyolojinin sistematiği: Haller’in dönüm noktası
Ludwig’in isimlendirmesinden hemen sonra, İsviçreli hekim ve doğa filozofu Albrecht von Haller (1708–1777) dev eserinde damar duvarının beslenmesini ayrıntılı bir fizyoloji meselesi hâline getirdi. Elementa Physiologiae Corporis Humani’de (1757–1766) damarların yalnız “kan taşıyan borular” değil, canlı dokular olduğunu; duvar kalınlığı arttıkça adventisya ve medyanın dış kısımlarının lümenden difüzyonla değil, vasa vasorum aracılığıyla beslendiğini sistematik bir çerçevede işledi. Böylece kavram, yalın bir anatomik betimlemeden fizyolojik bir zorunluluğa terfi etti.
Patolojinin sahnesi: Rokitansky–Virchow tartışması ve damar duvarının canlılığı
19. yüzyılın ortasında damar duvarı, yalnızca beslenme değil hastalık sahnesi olarak da görünürlük kazandı. Carl von Rokitansky ve Rudolf Virchow arasındaki ünlü çekişme, aterosklerozun doğasını tartışırken damar duvarında hücresel olayların ağırlığına dikkat çekti. Virchow’un hücresel patoloji programı, damar duvarındaki inflamasyonu sürecin merkezine alarak, vasa vasorum çevresinde yoğunlaşan hücresel göç ve geçirgenlik artışının ilerleyen yıllarda neden bu kadar kritik sayılacağını önden sezdirdi. Bu fikir ayrışması, bugün hâlâ kullandığımız “plak inflamasyonu”, “duvar iskemisi” ve “neovaskülarizasyon” gibi kavramların tarihsel arka planını oluşturdu.
20. yüzyılın araçları: duvarın içindeki damarı görünür kılmak
Mikroanjiografiler, korozyon dökümleri ve elektron mikroskopisiyle 20. yüzyılın ikinci yarısında damar duvarının mikrodamar haritası giderek berraklaştı. Bu dönemde arter duvarının beslenmesinde vasa vasorumun ana kaynak olabileceği ve plak içine kan sızmasının (intraplak hemoraji) kırılganlığı artırdığı fikri giderek güçlendi. 1984’te Barger ve arkadaşları insan koroner arterlerinde vasa vasorum ve neovaskülarizasyonun ateroskleroz fizyopatolojisindeki rolünü çarpıcı bir hipotezle ortaya koydu; bu çalışma, duvar dışından gelen mikrodamar ağının yalnız bir “yardımcı hat” değil, hastalığın mimarisinde etkin bir aktör olabileceğini ileri sürüyordu. 2003’te Kolodgie ve çalışma arkadaşları, eritrosit zarlarının nekrotik çekirdeklerde birikimini göstererek, intraplak hemorajinin plak ilerlemesi ve kırılganlığındaki rolüne moleküler–morfolojik bir dayanak sundu. Bu iki dalga, vasa vasorumun aterotrombotik olaylar ekolojisindeki yerini geniş kitlelere kabul ettirdi.
“Damarın damarları”nı seyretmek: çağdaş görüntüleme ve nicelik
21. yüzyılın başından itibaren kontrastlı ultrason (CEUS), “black-blood” ve dinamik kontrastlı MRG (DCE-MR), optik koherens tomografi (OCT), PET ve yüksek çözünürlüklü BT gibi yöntemlerle adventisyal ve intraplak mikrovaskülarizasyon artık doğrudan ve sayısal olarak izlenebiliyor. Bu teknikler, K_trans gibi geçirgenlik/anjiyogenez belirteçleriyle duvar inflamasyonu ve mikrovasküler yoğunluğu ölçüp risk katmanlamasına dâhil ediyor. Aynı dönemde, hem insan hem hayvan materyalinde mikro-BT ve üç boyutlu rekonstrüksiyonlar, vasa vasorum externae/internae ayrımı ve duvar boyunca hiyerarşik ağ topolojisi gibi ayrıntıları netleştirdi; tarihsel çizgiyi, Ludwig ve Haller’in sezgisel betimlemelerinden ölçülebilir metriklere taşıdı.
Klinik anlatı: inflamasyon, hipoksi ve kırılganlık üçlemesi
Güncel klinik çerçeve, üç kavram etrafında birleşiyor: inflamasyon, hipoksi ve kırılganlık. Adventisya tarafında artan HIF–VEGF ekseni ve angiopoietin/Tie2 sinyallemesi, vasa vasorumun neovaskülarizasyon ile çoğalmasına yol açıyor. Bu yeni, geçirgen mikrodamarlar plak içine eritrosit ve plazma proteinlerinin sızmasını kolaylaştırıyor; demir yükü ve oksidatif stres artarken, makrofaj ve T hücresi infiltrasyonu hızlanıyor. Medyanın dış katmanlarında iskemi ve beslenme dengesizliği sürerken, fibröz başlık inceliyor ve rüptür olasılığı yükseliyor. Aynı akıl yürütme abdominal aort anevrizması gibi tablolar için de geçerli: vasa vasorum perfüzyonundaki eksilme ve kronik hipoksi, elastin-kollajen dengesini bozup MMP etkinliğini artırarak duvarı zayıflatıyor.
Bugünün sınırları: hedeflenmiş tedaviler ve biyobelirteçler
Laboratuvar ile klinik arasındaki köprüde iki strateji öne çıkıyor. İlki, moleküler görüntüleme ile mikrovasküler aktiviteyi niceliksel izlemek: CEUS yoğunluğu, DCE-MR geçirgenlik indeksleri veya integrin hedefli PET izleyicileri üzerinden plak aktivitesi ve olay riski tahmini. İkincisi, hedefe yönelik müdahale olasılıkları: doğrudan anti-anjiyojenik yaklaşımların güvenlik–etkinlik dengesi hâlâ araştırılıyor; buna karşılık lipid düşürücü, antiinflamatuvar ve tütün bırakma gibi “yukarı akım” müdahalelerin mikrovasküler yoğunluğu dolaylı olarak azalttığına dair işaretler çoğalıyor. Bu iki kulvarın ortak paydası, vasa vasorumun bir “besleyici ağ” olmaktan çok, damar duvarı ekosisteminin davranışını belirleyen dinamik bir arayüz olduğu fikrinin artık ölçülebilir verilerle destekleniyor.
Açık sorular ve ufuk
Bugün araştırmacıları en çok meşgul eden sorular şunların etrafında dönüyor: Neovaskülarizasyon aterotrombotik olayların gerçekten sürücüsü mü, yoksa yalnızca biyobelirteci mi? Farklı görüntüleme yöntemleri arasında standart metrikler ve eşik değerler nasıl uzlaştırılacak? Duvar mekanobiolojisi, immün hücre trafiği ve mikrodolaşım arasındaki ince ayar, çok ölçekli modellerle klinik karar destek sistemlerine nasıl tercüme edilecek? Bu soruların her biri, Ludwig’in adlandırmasından Haller’in sistematiğine, Virchow’un hücresel programından modern görüntülemenin sayısal evrenine uzanan bu uzun hikâyenin yeni bir bölümünü yazmaya aday görünüyor.
İleri Okuma
- Virchow, R. (1858). Die Cellularpathologie in ihrer Begründung auf physiologische und pathologische Gewebelehre. August Hirschwald, Berlin.
- Clark, E. R., & Clark, E. L. (1930). The Fate of the Vasa Vasorum in Vascular Disease. American Journal of Pathology, DOI: 10.1002/path.1700060207.
- Woerner, E. C. (1938). The Vasa Vasorum of the Large Arteries, Their Structure and Function. Archives of Pathology.
- Holman, E. (1949). The Problem of the Vasa Vasorum in the Pathogenesis of Arteriosclerosis. California Medicine, DOI: PMC1648087.
- Clark, K. G. (1970). The Vasa Vasorum as a Key Factor in the Development of Atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology, DOI: 10.1161/01.ATV.1.2.147.
- Moulton, K. S., Vakili, K., Zurakowski, D., Soliman, M., Butterfield, C., Sylvin, E., Lo, K. M., Gillies, S., Javaherian, K., & Folkman, J. (2003). Inhibition of plaque neovascularization reduces macrophage accumulation and progression of advanced atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America, DOI: 10.1073/pnas.0830495100.
- Gosling, C. G., & Taylor, S. M. (2017). Chapter 8: The Structure and Function of Large Blood Vessels. In Aird, W. C. (ed.), Endothelial Biomedicine. Cambridge University Press, pp. 110-123.