- Bazı tip ß-hemolitik streptokoklar tarafından yapılır ve koroner arterlerdeki pıhtıların eritilmesinde t-PA’ya eşit bir etkinlik gösterir.
- Plasminojeni aktive eder.

Tissue plasminogen activator
- Endothel’den salgılanmış bir Serin Protease‘dir.
- t-PA bir kateter aracılığıyla thromboze bölgeye doğrudan verildiğinde plazminojenin plazmine dönüşümünü aktive eder ve plazmin de damar içi pıhtıyı eritir.

Emboli
- Kan pıhtısının kan akışı ile kopan parçası, serbest dolaşan pıhtı. (Bkz; Embol–i)
- Emboli genellikle dolaşım sisteminin dar bir noktasına gelinceye kadar dolaşımı durdurmaz. Bu nedenle, büyük arterlerden veya kalbin solundan kaynaklanan emboli beyin, böbrekler veya başka bir bölgedeki daha küçük sistemik arterler ve arteriyolleri tıkar.
- Venöz sistemden ve kalbin sağından kaynaklanan emboli ise akciğer damarlarına doğru sürüklenerek pulmoner arter embolizmine yol açar.

Kan pıhtısı ve emboli arasındaki fark nedir?
Trombüs, bir damarda oluşan kan pıhtısıdır. Emboli, geçmesine izin vermeyecek kadar küçük bir damara ulaşana kadar kan damarları boyunca hareket eden herhangi bir şeydir. Bu olduğunda, kan akışı emboli tarafından durdurulur.
Emboli sırasında ne olur?
Pulmoner emboli (PE), bir kan pıhtısının akciğerdeki bir arterde sıkışarak akciğerin bir kısmına kan akışını engellemesiyle ortaya çıkar. Kan pıhtıları çoğunlukla bacaklarda başlar ve kalbin sağ tarafından akciğerlere doğru ilerler. Buna derin ven trombozu (DVT) denir.

Emboli ile ne kadar süre yaşayabilirsiniz?
Son bulgular: Pulmoner emboli sonrası ölüm oranı, hastanın hemodinamik olarak stabil olması ve altta yatan önemli bir hastalığın bulunmaması koşuluyla, 3-6 aylık antikoagülan tedavi sırasında %5’ten azdır. Tekrarlayan tromboembolizm oranı antikoagülan tedavide %5’ten azdır ve 10 yıl sonra %30’a ulaşır.
Trombotik Trombositopenik Purpura (TTP)
Tanım ve Genel Bakış
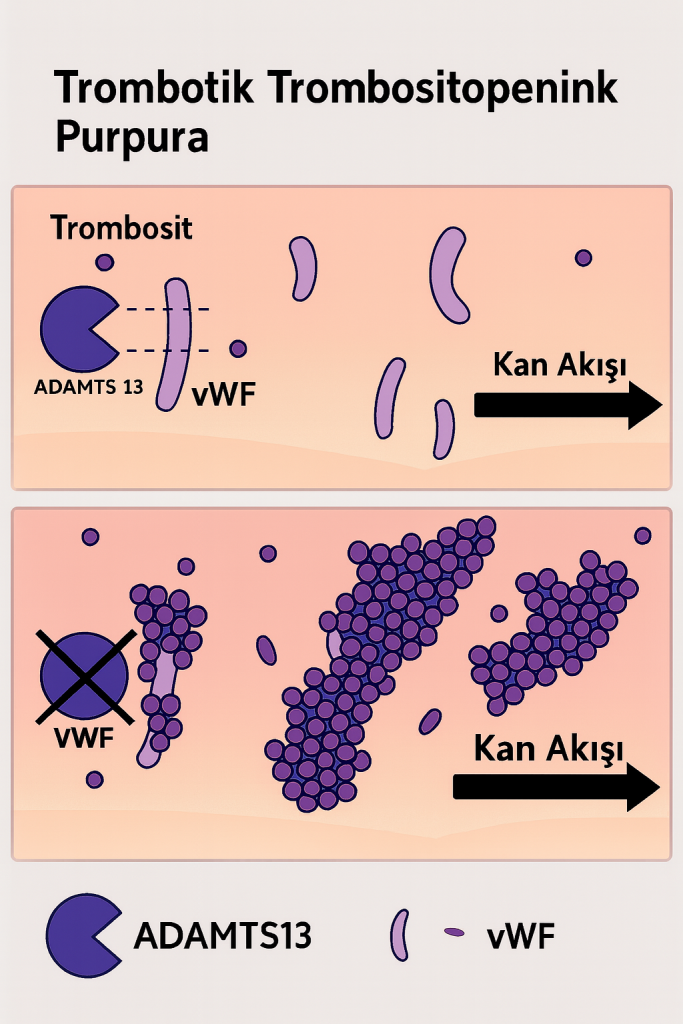
Trombotik Trombositopenik Purpura (TTP), nadir fakat potansiyel olarak yaşamı tehdit eden bir trombotik mikroanjiyopati alt tipidir. Hastalık, başta trombositopeni ve mikroanjiyopatik hemolitik anemi (MAHA) olmak üzere, çoklu organ tutulumu ile seyreden bir klinik tabloya neden olur. TTP’nin ayırt edici özelliği, küçük damar sisteminde (mikrovasküler yapılar) trombositlerin aşırı aktivasyonu ve agregasyonu sonucu gelişen mikrotrombus oluşumudur. Bu süreç, dolaşımda ultra büyük multimerik von Willebrand faktörü (UL-vWF) varlığında, ADAMTS13 enzim aktivitesinin ciddi oranda azalması ya da otoantikorlar ile inhibisyonu sonucu meydana gelir.
Patofizyoloji
TTP’nin temelinde, UL-vWF multimerlerinin proteolitik yıkımını gerçekleştiren bir metaloproteaz olan “A Disintegrin And Metalloprotease with Thrombospondin type 1 motif, member 13” (ADAMTS13) enziminin aktivitesinde belirgin bir azalma veya işlev kaybı yer alır. ADAMTS13 aktivitesi <%10 seviyelerine indiğinde, UL-vWF multimerleri dolaşımda birikerek trombositlerin spontan agregasyonunu indükler. Bu agregatlar, mikrovasküler yapılarda trombüs oluşumuna neden olurken, aynı zamanda eritrositlerin mekanik yıkımına yol açarak şistosit oluşumunu tetikler. Bu sürecin sonucunda:
- Trombositopeni: Trombositlerin mikrotrombus yapılarında tüketilmesi sonucu gelişir.
- Hemolitik Anemi: Mikrodamarlarda oluşan trombotik yapılar eritrositlerin parçalanmasına neden olur.
- Organ Hasarı: Beyin, böbrek ve kalp gibi yüksek perfüzyonlu organlarda iskemik hasarlar oluşabilir.
Etiyoloji
TTP, klinik olarak iki ana forma ayrılır:
1. Doğuştan (Konjenital) TTP (Upshaw-Schulman Sendromu)
- Nadir görülen otozomal resesif geçişli bir formdur.
- ADAMTS13 geninde meydana gelen bialelik mutasyonlar sonucu, enzimin miktarı ve/veya fonksiyonu yetersiz hale gelir.
- Genellikle çocukluk veya ergenlik döneminde başlar, enfeksiyon veya gebelik gibi tetikleyicilerle alevlenebilir.
2. Edinilmiş TTP
- En sık görülen formdur.
- ADAMTS13’e karşı gelişen otoimmün IgG antikorları enzimi inhibe eder.
- Kadınlarda daha sık görülür, sistemik lupus eritematozus (SLE), HIV, gebelik ve bazı ilaçlar (ör. ticlopidin, klopidogrel, kemoterapötikler) ile ilişkilendirilmiştir.
Klinik Belirti ve Bulgular
Klasik olarak “pentad” olarak adlandırılan tablo her hastada görülmeyebilir. Günümüzde TTP tanısı için trombositopeni ve MAHA varlığı çoğu zaman yeterlidir. Klinik özellikler şunlardır:
- Trombositopeni: Peteşi, purpura, kolay morarma, burun kanaması gibi kanama belirtileri.
- Mikroanjiyopatik Hemolitik Anemi (MAHA): Şistosit varlığı, yorgunluk, solukluk, taşikardi.
- Nörolojik Bulgular: Baş ağrısı, konfüzyon, geçici iskemik atak, nöbetler, koma.
- Renal Disfonksiyon: Hematüri, proteinüri, artmış serum kreatinini (TTP’de tipik olarak HÜS’ten daha hafiftir).
- Ateş: Klasik tanımda yer alsa da günümüzde nadir görülür ve özgül değildir.
Tanısal Yaklaşım
TTP tanısı acil bir durum olup, klinik şüpheyle birlikte tanısal süreç başlatılmalı ve tedavi gecikmeden uygulanmalıdır. Aşağıdaki testler tanı koymada yardımcıdır:
Laboratuvar Bulguları:
| Parametre | Bulgular |
|---|---|
| Trombosit sayısı | Düşük (<30.000/μL sıklıkla) |
| Hemoglobin | Düşük |
| LDH (Laktat Dehidrogenaz) | Yüksek – hemoliz ve doku hasarı göstergesi |
| Dolaylı Bilirubin | Artmış |
| Haptoglobin | Düşük (serbest hemoglobine bağlandığı için tükenir) |
| Retikülosit | Artmış |
| Periferik Yayma | Şistositler (fragmentositoz) |
| ADAMTS13 aktivite düzeyi | <%10 → tanı için yüksek özgüllük |
| ADAMTS13 inhibitörleri | Edinilmiş formlarda pozitif |
Ayırıcı Tanılar:
- HÜS (Hemolitik Üremik Sendrom): Özellikle çocuklarda; TTP’ye göre böbrek tutulumu daha belirgindir.
- DIC (Yaygın İntravasküler Koagülasyon): PT/aPTT uzaması ve D-dimer artışı tipiktir.
- HELLP Sendromu: Gebelikle ilişkili; hemoliz, karaciğer enzim yüksekliği, trombositopeni üçlüsüyle seyreder.
Tedavi Yaklaşımı
1. Plazmaferez (PEX – Plazma değişim tedavisi):
- TTP tedavisinin temelini oluşturur.
- Günde bir kez uygulanan tedavi ile hem inhibitör antikorlar temizlenir hem de ADAMTS13 replasmanı sağlanır.
- Tedavi, klinik düzelme ve laboratuvar parametrelerinin normale dönmesine kadar sürdürülür.
2. İmmünosupresyon:
- Edinilmiş TTP’de otoantikor üretiminin baskılanması hedeflenir.
- Kortikosteroidler (örn. prednizon 1 mg/kg/gün) ilk basamak tedavidir.
- Dirençli veya tekrarlayan olgularda:
- Rituksimab: Anti-CD20 monoklonal antikoru; B hücrelerini hedef alır.
- Siklofosfamid veya diğer immünsüpresif ajanlar da kullanılabilir.
3. Kaplacizumab:
- Anti-vWF nanomonomerik antikordur.
- vWF-trombosit etkileşimini bloke ederek mikrotrombus oluşumunu engeller.
- Klinik yanıt süresini kısaltır ve nüksü azaltır.
- EMA ve FDA onayı almıştır (2018, 2019).
4. Destekleyici Tedavi:
- RBC transfüzyonları: Semptomatik anemi varlığında.
- Trombosit transfüzyonu: Sadece hayatı tehdit eden kanamalarda (kanama riskini artırabilir).
- Organ fonksiyon takibi: Nefrolojik ve nörolojik izlem.
Prognoz ve Takip
- Uygun tedavi ile akut mortalite oranı <%10’a düşmüştür.
- Tedavi edilmeyen TTP’de ölüm oranı >%90 olarak bildirilmiştir.
- Edinilmiş formlarda nüks oranı %20–50 arasında değişebilir.
- Nüks riskine karşı ADAMTS13 düzeyleri ve inhibitör varlığı takiple izlenmelidir.
- Gebelik ve enfeksiyon gibi stresörler nüksü tetikleyebilir.
Keşif
İlk Olgu Bildirimi – 1924
- Eli Moschcowitz, 1924 yılında New York Mount Sinai Hospital’da 16 yaşındaki bir kız hastada görülen ani başlangıçlı hemolitik anemi, peteşi, nörolojik bozulma ve otopsi sonrası mikrovasküler trombüs bulgularını tanımlamıştır.
- Moschcowitz bu tabloyu “akut afibrinojenemik purpura” olarak adlandırmıştır. Ancak aslında tanımladığı klinik tablo, günümüzde TTP olarak adlandırdığımız hastalıktır.
2. Klinik Sendromun Netleşmesi – 1960’lar
- 1960’lı yıllarda, TTP artık klasik “pentad” olarak bilinen semptomlar bütünüyle tanımlanmaya başlanmıştır:
- Trombositopeni
- Mikroanjiyopatik hemolitik anemi
- Nörolojik bulgular
- Ateş
- Renal disfonksiyon
- Bu yıllarda, hastalığın farklı klinik formları ve atipik seyirli vakaları da tanımlanmıştır.
3. ADAMTS13’ün Keşfi – 2001
- 1990’ların sonlarından itibaren, hastalığın altında yatan moleküler mekanizmanın von Willebrand faktörü (vWF) ve onun düzenleyici enzimleriyle ilişkili olduğu fark edilmiştir.
- 2001 yılında, bağımsız araştırma ekipleri tarafından ADAMTS13 enzimi tanımlanmış ve TTP ile ilişkisi net olarak ortaya konmuştur:
- ADAMTS13’ün eksikliği veya inhibitör otoantikorlar tarafından etkisiz hale getirilmesi, UL-vWF multimerlerinin yıkılamamasına ve dolayısıyla mikrotrombus oluşumuna neden olmaktadır.
4. Edinilmiş ve Konjenital TTP’nin Ayrımı – 2000’li Yıllar
- ADAMTS13 testlerinin klinik pratikte yaygınlaşmasıyla birlikte, TTP’nin konjenital (Upshaw-Schulman sendromu) ve edinilmiş (otoimmün) formları net olarak ayrılmıştır.
- Edinilmiş TTP’de ADAMTS13’e karşı nötralizan otoantikorlar, konjenital TTP’de ise genetik mutasyonlar temel neden olarak belirlenmiştir.
5. Kaplacizumab ve Hedefe Yönelik Tedavi – 2017–2019
- 2017’de faz II HERCULES çalışmasıyla birlikte kaplacizumab, UL-vWF’ye karşı geliştirilen ilk hedefe yönelik biyolojik tedavi olarak tanıtılmıştır.
- 2018 yılında Avrupa İlaç Ajansı (EMA) ve 2019 yılında Amerikan Gıda ve İlaç Dairesi (FDA) tarafından onay almıştır.
İleri Okuma
- Tsai, H. M. (2003). Pathophysiology of thrombotic thrombocytopenic purpura. International Journal of Hematology, 77(1), 1–19.
- George, J. N., & Nester, C. M. (2014). Syndromes of thrombotic microangiopathy. New England Journal of Medicine, 371(7), 654–666.
- Scully, M. et al. (2019). Caplacizumab treatment for acquired thrombotic thrombocytopenic purpura. New England Journal of Medicine, 380(4), 335–346.
- Zheng, X. L. et al. (2020). International Working Group consensus: Diagnosis and treatment of TTP. Blood Advances, 4(23), 6250–6273.
- Sadler, J. E. (2021). Von Willebrand factor, ADAMTS13, and thrombotic thrombocytopenic purpura. Blood, 138(15), 1150–1160.
- Furlan, M., Robles, R., & Lämmle, B. (1998). “Partial purification and characterization of a protease from human plasma cleaving von Willebrand factor to fragments produced by in vivo proteolysis.” Blood, 91(12), 4736–4743.
- Tsai, H. M., & Lian, E. C. Y. (1998). “Antibodies to von Willebrand factor–cleaving protease in acute thrombotic thrombocytopenic purpura.” New England Journal of Medicine, 339(22), 1585–1594.
- Lämmle, B., Kremer Hovinga, J. A., & George, J. N. (2005). “Thrombotic thrombocytopenic purpura.” Lancet, 366(9482), 1487–1499.
- Scully, M., et al. (2019). “Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies.” British Journal of Haematology, 185(3), 460–478.
Von Willebrand Hastalığı
Patofizyoloji ve Genetik:
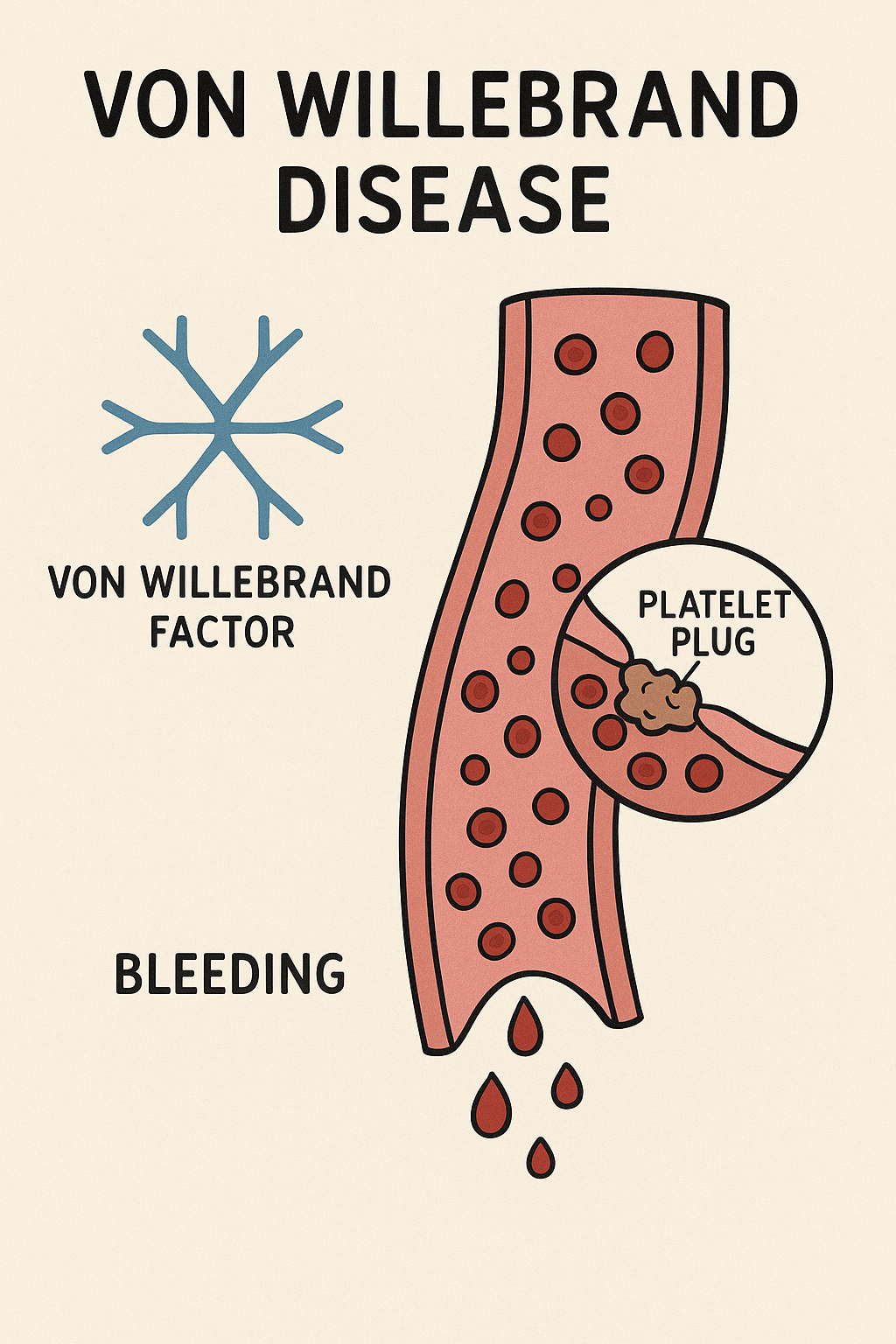
Von Willebrand faktörü (VWF), damar yaralanmasında damar altı subendoteline bağlanarak trombositlerin yapışmasını sağlar ve dolaşımdaki faktör VIII’i stabilize ederek yıkımını önler. VWF, endotelyal hücreler ve megakaryositlerden salgılanan büyük multimerik bir glikoproteindir; kanama durumunda trombositlerin GPIb reseptörü aracılığıyla yapışmasını kolaylaştırır. Faktör VIII ise karaciğerde sentezlenen, A1-A2-B-A3-C1-C2 dizilimli büyük bir koagülasyon ko-faktörüdür; aktif formu (FVIIIa), faktör IXa ile kompleks oluşturarak faktör X’in aktive olmasını sağlar (intrinsik yol). Faktör VIII, plazmada VWF ile sıkıca bağlı dolaşır ve VWF’den ayrıldığında aktif hale gelir.
VWD’nin moleküler temelini VWF genindeki mutasyonlar oluşturur. VWF geni, kromozom 12’nin kısa kolunda (12p13.2) yerleşiktir ve ~178 kb uzunluğunda 52 ekson içerir. Genin genişliğinden ötürü transkripsiyonu ve genetik analizleri zordur; 22q11.2’de VWF’e benzer bir psödogen de bulunmaktadır. VWF genindeki mutasyonlar tip 1’de miktarsal azalmaya yol açarken, tip 2 konformasyon bozuklukları (kalitatif bozukluk) oluşturur, tip 3 ise neredeyse tümüyle VWF eksikliğine (şiddetli kantitatif bozukluk) neden olur. Tip 2 alt grupları (2A, 2B, 2M, 2N) fenotipik teste dayalı sınıflandırma ile ayırt edilir. Örneğin 2A’da yüksek moleküler ağırlıklı multimerlerin eksikliği vardır; 2B’de VWF’ün GPIb bağlanması artarak trombositlerde ve retiküloendoteliyal sistemde çökme ve trombositopeni gelişir; 2M’de fonksiyon bozukluğu olmasına rağmen multimer dağılımı normaldir; 2N’da ise VWF ile FVIII bağlanması bozulmuştur, bu nedenle FVIII düzeyi düşüktür (klinik olarak hafif hemofili A benzeri tablo).
Kalıtım çoğunlukla otozomal dominant olup, tip 1 ile 2A/2B/2M vakalarında baskındır (fenotip penetransı yüksek). Buna karşılık tip 2N ve tip 3 reseptif geçişlidir; tip 3 vakalarının çoğu homozigot veya kompoze heterozigot mutasyonlardan kaynaklanır. Tip 1’de penetrans tamamlanmamış olabilir; tip 3’te vakaların ~%80’i nonsense, delesyon veya çerçeve kayması gibi null alleller içerir. ABO kan grubu da VWF seviyelerini modifiye eder (0 grubu bireylerde daha düşük temel VWF düzeyleri gözlenir).
Epidemiyoloji:
VWD, tüm popülasyonda görece yaygındır ancak çoğu hafif seyreder. Orphanet’e göre dünya genelinde genel popülasyonun %0.6–1.3’ünde VWD mevcuttur; semptomatik olgularda prevalans yaklaşık 10/100.000’dir. Yüksek gelirli ülkelerde kayıtlı hasta prevalansı hemofili merkez verilerine göre ~1.5/100.000 civarındadır. Örneğin İngiltere Ulusal Veri Bankası’nda tüm tipleri kapsayan referral-prevalans 16.5/100.000 bulunmuştur (tip 1: 7.2, tip 2: 2.5, tip 3: 0.3/100.000). Tip 1 VWD en yaygın türdür (~vakaların %70–80’i), tip 2 %15–25, tip 3 ise nadir (%5’in altında) görülür. Tip 3 VWD’nin görülme sıklığı genel popülasyonda yaklaşık 0.5–1/1.000.000 olup, akraba evliliğinin yaygın olduğu topluluklarda bu değer 6/1.000.000’a kadar çıkabilir. Hastalar arasında cinsiyet dağılımı eşit olmakla birlikte, kadınlar adet kanaması, doğum ve gebelik gibi durumlar nedeniyle daha sık belirti bildirir. CDC verilerine göre belgelenen VWD olguları erkek ve kadınlarda yaklaşık eşit oranda olup, popülasyonda en fazla %1’e kadar kanama riskini artırabilir.
Klinik Görünüm:
VWD’nin temel semptomu mukokütan kanamadır. Bunlar arasında kolay çürük (purpura), küçük yaralardan uzun süren kanama, burun kanaması (epistaksis), diş eti kanamaları, aşırı adet kanaması (menorrhagi), gastrointestinal kanamalar ve cerrahi/diş çekimi/çocuk doğumu gibi hemostaz gerektiren durumlarda kanama bulunur. Hastalar arasındaki fenotip değişkenliği yüksektir; aynı ailedeki bireylerde bile şiddet hafif ila ciddi arasında değişebilir. Tip 1 VWD genellikle hafif veya orta kanama eğilimi gösterir ve bazı bireylerde sadece hemostatik zorlama ile ortaya çıkar (örneğin cerrahi sonrası). Tip 2’lerde kanama genellikle tip 1’den daha belirgindir; örneğin tip 2B’de trombositopeniye bağlı trombositleri uyaran anormal platelet bağlanması nedeniyle burun kanaması ve ekimoz sık görülebilir. Tip 2N’da ise düşük FVIII nedeniyle ekimoz ve travmatik kanamalar tipik olup, kadınlarda menorrhaji belirgindir. Tip 3 VWD en şiddetli klinik tabloyu verir; neredeyse hiç VWF bulunmadığı için spontan hematomlar, hemartrozlar (eklem içi kanamalar), ciddi post-operatif kanamalar ve ağır menstrüasyon görülür. Şiddetli tip 3 olgularında osteoartropati gelişebilmekte, eklem hasarına yol açabilmektedir. VWD’li kadınlarda menorrhagi ve doğum sonrası kanamalar oldukça yaygındır.
Tanı:
VWD tanısı klinik değerlendirme ile başlar. Özellikle aile öyküsü ve ISTH-BAT gibi kanama değerlendirme araçları kullanılır. Laboratuvar ilk bakışta kompleks bir inceleme gerektirir; tek bir test tanıyı doğrulamaz. Öncelikle tam kan sayımı (TKH) normaldir, ancak kronik kanamalarda anemi görülebilir. Koagülasyon testleri genellikle normaldir (PT, fibrinojen normal; APTT şiddetli olgularda uzayabilir). Spesifik tanı için ölçülen başlıca parametreler şunlardır: faktör VIII koagülan aktivitesi (FVIII:C), von Willebrand faktör antijeni (VWF:Ag), VWF işlevi ölçen testler (en yaygını VWF ristoseptin ko-faktör aktivitesi, VWF:RCo) ve VWF multimer dağılım analizi. VWF:Ag ve VWF:RCo seviyeleri düşüktür (tip 1’de her ikisi orantılı azalır; tip 2’de orantısızlık bulunabilir). Kolajen bağlama (VWF:CB) testi, RIPA (ristoseptin-indüklenen platelet aglütinasyonu) testi gibi ek fonksiyonel ölçümler de kullanılır. Tanı şeması genellikle VWF:Ag, VWF aktivite, FVIII ve multimer analizini içerir. Örneğin, VWF:Ag ile VWF aktivitelerinden herhangi biri <%30 (0.30 IU/mL) ise VWD düşünülür; %30–50 düzeylerinde ise kanama semptomlarının eşlik etmesi tanıyı destekler. Ayırıcı tanıda hemofili A/B, Bernard-Soulier sendromu, primer platelet fonksiyon bozuklukları, antiplatelet ilaç kullanımı ve “psödo”/platelet-tipi VWD göz önünde bulundurulmalıdır. Genetik test özellikle tip 2B, 2N ve tip 3’ün ayırıcı tanısında yararlıdır. Tip 2N vakalarında VWF genindeki ilgili mutasyonların bulunması hemofili A ile karışmayı önler. Tip 1’lerde ise genetik test nadiren yardımcı olur (polimorfizm etkileri, penetrans değişkenliği çoktur).
Tedavi:
VWD tedavisi kanamayı durdurmaya ve önlemeye yöneliktir. Başlıca hemostatik ajanlar şunlardır: Desmopressin (DDAVP) ve VWF içeren faktör konsantreleri. Desmopressin, endojen VWF ve FVIII depolarından salgılatır; tip 1 ve çoğu tip 2 (2A, 2M) olgularında ilk seçenek tedavidir. DDAVP kolay uygulanması, maliyetinin düşüklüğü ve ek kan ürünü kullanımını azaltması nedeniyle tercih edilir. Ancak tip 2B’de trombositopeniyi kötüleştirebileceğinden dikkatli kullanılmalı, tip 3’te ise yeterli depolanan VWF olmadığından etkisizdir. Major kanamalarda veya cerrahi için VWF/FVIII içeren plazma kaynaklı konsantreler (VWF içerikli faktör VIII preparatları) kullanılır. Rekombinant VWF preparatları (FVIII içermeyen) da mevcuttur. Antifibrinolitik ajanlar (traneksamik asit, aminokaproik asit) mukozal kanamalar ve menorrhaji tedavisine destek olarak sıkça eklenir. Kadınlarda aşırı adet kanamalarında hormon replasmanı veya intrauterin sistem yöntemleri yardımcı olabilir. Kanama atakları dışındaki önleyici (profilaktik) tedavi, tekrar eden eklem veya ciddi kanamalarda düşünülür; özellikle tip 3 hastalarında düzenli VWF konsantresi infüzyonları hem birikimli eklem hasarını hem de kanama komplikasyonlarını azaltır. Ayrıca, cerrahi, dental çekim, doğum gibi invaziv girişimler öncesinde hemostatik profilaksi sağlamak için DDAVP veya VWF konsantreleri uygulanır. Tüm VWD hastaları, kanama semptomları ciddiye dönerse bir hematoloji merkezinde değerlendirilmelidir.
Keşif
Von Willebrand hastalığı (VWD), ilk kez 1926 yılında, Finli doktor Erik Adolf von Willebrand tarafından tanımlanmıştır. Bu hastalık, genetik bir kanama bozukluğudur ve ilk olarak, şiddetli kanamalarla tanı almış bir kadın hastanın vakası üzerinde yapılan araştırmalarla ortaya çıkmıştır. Von Willebrand, hastalığın, “kanama eğilimi” ile karakterize olduğunu ve özel bir kanama sendromu oluşturduğunu belirtmiştir. Bu araştırma, genetik ve klinik faktörlerin kanama bozuklukları üzerindeki etkisini ilk defa açıklığa kavuşturmuştur.
Erik von Willebrand, 1926 yılında yazdığı makalesinde, hastalığın Finlandiya’nın çeşitli bölgelerinde yaygın olduğuna dikkat çekmiş ve hemofili A ve B hastalıklarından farklı olduğunu belirtmiştir. Bu hastalığın, damarların iç yapısındaki bazı özel proteinlerin eksikliği veya fonksiyon bozukluğu ile ilişkili olduğunu ilk kez ileri sürmüştür. Bu durumu daha iyi anlamak için von Willebrand, hastaların kanama geçmişini inceledi ve damarların pıhtılaşma süreçlerinde önemli bir rol oynayan faktörleri tespit etmeye başladı.
Sonraki yıllarda, 1950’ler ve 1960’larda von Willebrand hastalığının patofizyolojisi ve genetik temelleri daha ayrıntılı bir şekilde incelenmeye başlandı. Ancak, hastalığın temel etiyolojik nedenleri ve biyokimyasal yönleri hakkında tam bir anlayış, 1970’ler ve 1980’ler boyunca genetik araştırmaların ve koagülasyon faktörlerinin daha iyi tanımlanması ile mümkün olabilmiştir.
Faktör VIII ve Von Willebrand Faktörü: Genetik ve Klinik Yansıması
Hastalığın moleküler temeli, 1950’lerde yapılan çalışmalarla hızla ilerlemeye başlamıştır. Bu dönemde, von Willebrand faktörünün (VWF) önemli bir koagülasyon faktörü olduğu anlaşılmıştır. VWF, faktör VIII’i taşıyarak onu stabilize eder ve aynı zamanda damar hasarı sonrası trombositlerin yapışmasını teşvik eder. Bunun yanı sıra, VWF’nin büyük boyutlu multimerik yapılarla kanama sırasında işlev gördüğü de belirlenmiştir.
Faktör VIII’in stabilitesi ve işlevi, VWF’ye bağımlıdır. Von Willebrand hastalığının ilk tanımları bu iki faktör arasındaki ilişkilerin anlaşılmasında önemli bir dönüm noktası yaratmıştır. 1970’lerde, faktör VIII ve von Willebrand faktörünün eksikliklerinin kanama bozukluklarına neden olduğu anlaşılmış, bu iki faktör arasındaki işlevsel ilişki moleküler düzeyde açıklığa kavuşmuştur.
Von Willebrand Hastalığının Genetik Yönü:
Von Willebrand hastalığının genetik temeli üzerine yapılan çalışmalar, 1980’lerde büyük bir hız kazandı. Von Willebrand faktörünün genetik yapısı, kromozom 12’de yer alan bir genin etkisiyle ortaya çıkar. Bu genetik yapı üzerinde yapılan araştırmalar, hastalığın kalıtım tarzlarını (otozomal dominant ve otozomal resesif) ve mutasyon türlerini ortaya koymuştur. Bu çalışmalar, hastalığın daha iyi anlaşılmasını sağlamış ve tanısal testlerin gelişmesine katkı sunmuştur.
Sonraki Keşifler:
1990’lar, von Willebrand hastalığının daha ayrıntılı genetik incelemelerine sahne olmuştur. VWF genindeki çeşitli mutasyonlar belirlenmiş, bu mutasyonların hastalığın şiddetini ve klinik seyrini nasıl etkilediği açıklığa kavuşmuştur. Ayrıca, hastalığın tipleri (tip 1, tip 2 ve tip 3) arasındaki farklar, daha hassas laboratuvar testleri ile netleşmiş ve klinik tanı daha güvenilir hale gelmiştir.
Genetik Bilgiler ve Tanı Yöntemleri:
Von Willebrand hastalığının tanısal aşamaları, özellikle genetik analizlerin gelişmesiyle önemli bir evrim geçirmiştir. 1990’ların sonlarına doğru, genetik testler ve mutasyon analizleri, hastalığın doğru şekilde sınıflandırılmasında önemli bir araç haline gelmiştir. Sonuç olarak, von Willebrand hastalığı, hemofili ile karışabilecek şekilde klinik bir tabloya sahipken, yapılan laboratuvar testleri sayesinde doğru şekilde tanımlanabilmektedir.
Sonuç olarak: Von Willebrand hastalığının keşfi ve patofizyolojik temellerinin anlaşılması, birkaç on yıl süren bir süreçtir. İlk tanımlamadan günümüze kadar olan süreçte, hastalığın moleküler biyolojisi, genetik temelleri ve klinik özellikleri hakkındaki anlayışımız büyük bir gelişim göstermiştir. Hem genetik hem de biyokimyasal düzeydeki ilerlemeler, tanı ve tedavi yaklaşımlarının daha hassas ve etkili hale gelmesini sağlamıştır.
İleri Okuma
- Cumming AM, Keeney S, Jenkins PV, Nash MJ, O’Donnell JS. Clinical utility gene card for: von Willebrand disease. Eur J Hum Genet. 2011;19(5).
- Roberts JC, Flood VH. Laboratory diagnosis of von Willebrand disease. Int J Lab Hematol. 2015;37 Suppl 1:11–17.
- Du P, Bergamasco A, Moride Y, et al. Von Willebrand Disease Epidemiology, Burden of Illness and Management: A Systematic Review. J Blood Med. 2023;14:189–208.
- James PD, Connell NT, Ameer B, et al. ASH ISTH NHF WFH 2021 guidelines on the diagnosis of von Willebrand disease. Blood Adv. 2021;5(1):280–300.
- Beltran A, Jaramillo AP, Vallejo MP, Acosta L, Parraga GCB. Desmopressin as a treatment in patients with von Willebrand disease: A systematic review. Cureus. 2023;15(8):e44310.
- GeneReviews®: Johnsen J. von Willebrand Disease. 1993–2024 (güncellenmiş 14 Kas 2024). Seattle: University of Washington; (erişim: NCBI Bookshelf).
Trombositopeni
- Trombositopeni, dolaşım sisteminde çok az sayıda Trombosit bulunmasıdır.(Bkz; Trombosit-o-peni)
- Trombositopenili kişilerde de hemofilideki gibi kanama eğilimi vardır. Fakat kanama genellikle hemofilidekinin aksine pek çok küçük venül ve kapillerlerden olur.Sonuçta tüm vücut dokularında küçük, noktasal hemorajiler oluşur.
- Bu kişilerin cildinde görülen çok sayıda küçük morumsu lekeler nedeniyle hastalığa trombositopenik purpura adı verilir.

- Thrombosit sayısı milimetre küpte 50.000’in altına düşmedikçe kanama görülmez.10.000 ‘nin altınaki düzeyler genellikle ölümcüldür.
- Thrombositopenili kişilerin çoğunda idiyopatik thrombositopeni denilen nedeni bilinmeyen bir hastalık vardır.
- Trombositopenili hastalara çok miktarda trombosit içeren taze tam kan transfüzyonu kanamayı 1-4 gün için durdurabilir. Splenektomi de genellikle oldukça yararlı ve hatta bazen tamamen tedavi edicidir, çünkü dalak çok miktarda trombositi ve özellikle hasarlanmış olanları kandan uzaklaştırır.
Nedenleri
Trombositopeni, lösemi gibi bir kemik iliği bozukluğunun veya bir bağışıklık sistemi sorununun sonucu olarak ortaya çıkabilir. Ya da bazı ilaçların alınmasının bir yan etkisi olabilir. Hem çocukları hem de yetişkinleri etkiler.
Trombositopeninin en yaygın nedeni nedir?
Trombositopeninin birçok nedeni vardır. Düşük trombositlerin en yaygın nedenlerinden biri immün trombositopeni (ITP) adı verilen bir durumdur. Eski adıyla, idiyopatik trombositopenik purpura olarak adlandırıldığını duyabilirsiniz.
Hangi eksiklik düşük trombositlere neden olur?
B-12 vitamini kan hücrelerinizin sağlıklı kalmasına yardımcı olur. B-12 eksikliği düşük trombosit sayısı ile ilişkilendirilmiştir.
Trombositopeninin en yaygın türü nedir?
Akut ITP, hastalığın en yaygın şeklidir. Kronik trombositopenik purpura. Hastalığın başlangıcı herhangi bir yaşta olabilir ve semptomlar en az 6 ay, birkaç yıl veya ömür boyu sürebilir. Yetişkinlerde bu form çocuklardan daha sık görülür, ancak ergenleri de etkiler.
Hangi ilaçlar trombositopeniye neden olabilir?
Bir kan inceltici olan heparin, ilaca bağlı immün trombositopeninin en yaygın nedenidir.
…
İlaca bağlı trombositopeniye neden olan diğer ilaçlar şunlardır:
- Furosemid.
- Artrit tedavisinde kullanılan altın.
- Nonsteroidal antienflamatuvar ilaçlar (NSAİİ’ler)
- Penisilin.
- Kinidin.
- Kinin.
- Ranitidin.
- Sülfonamidler.
Tortikolis
tortus döndü(←torquēre dönmek) + collum
- Başın hastalıklı tarafa yanal eğimde ters tarafa hafifçe dönerek, genellikle yüz skolyozunda yanlış hizalanması düzeltildi.
- Yenidoğanlar için tedavi başlangıçta konservatiftir, daha sonra cerrahi olarak tenotomi veya sternokleidomastoid kasın tamamen çıkarılması ve ayrıca antiinflamatuar ilaçlar ve kas gevşetici maddelerle akut tortikollis, muhtemelen lokal anestetiklerin infiltrasyonu ile yapılır.

Plazmin
plasma + -in (Biokimyasal madde eki; enzimler ve proteinler için yaygın olarak kullanılır) → plasmin
Tarihçe:
Plazmin ilk olarak 20. yüzyılın başlarında bazı enzimlerin pıhtı çözücü özelliklerini inceleyen bilim insanları tarafından keşfedilmiştir. 1933 yılında İsveçli bilim insanı Astrid Kjellbom, kan plazmasında fibrin pıhtılarını çözebilen bir protein tespit etti. Bu proteine plazmin adı verildi ve daha sonra bir serin proteaz enzimi olduğu keşfedildi.
Plazmin ve Fibrinoliz:
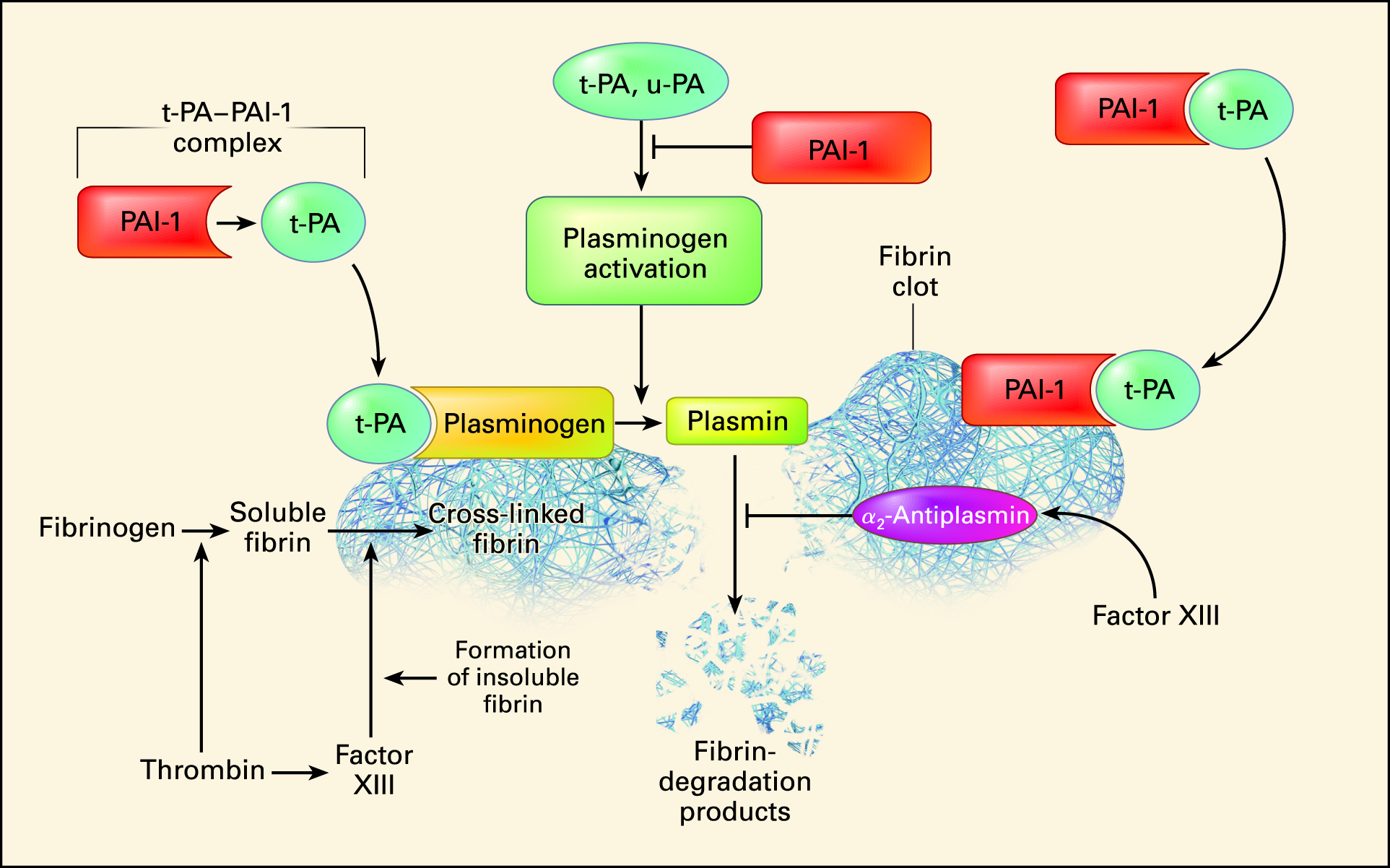
Plazminin birincil işlevi, kan pıhtılarının ağ benzeri yapısını oluşturan bir protein olan fibrini parçalamaktır. Fibrini parçalama işlemine fibrinoliz denir. Plazminin inaktif öncüsü olan plazminojen karaciğer tarafından üretilir ve kan dolaşımında bulunur. Bir kan pıhtısı oluştuğunda, doku plazminojen aktivatörü (t-PA) ve ürokinaz plazminojen aktivatörü (u-PA) salınır ve bunlar plazminojeni aktif plazmine dönüştürür. Plazmin daha sonra fibrini daha küçük parçalara ayırarak kan pıhtısını etkili bir şekilde çözer.
- Kan pıhtılarında fibrini çözen proteolitik bir enzim.
- Plazmin, pankreas salgısının en önemli proteolitik sindirim enzimi olan tripsine yapıca benzer. Bu enzim fibrin iplikçiklerinin yanısıra çevre kanda bulunan fibrinojen, fakötr V, faktör VIII, protrombin ve faktör XII gibi maddeleri sindirir.
Plazmin Aktivitesinin Düzenlenmesi:
Plazmin aktivitesi, en önemlisi α2-antiplazmin olan çeşitli inhibitörler tarafından düzenlenir. Bu inhibitör serbest plazmine bağlanır ve onu inaktive ederek aşırı fibrinolizi önler ve kan pıhtılarının yalnızca gerekli olduğunda çözülmesini sağlar.
- Kan pıhtısı içinde plazmin oluştuğunda, pıhtının erimesine ve pıhtılaşma faktörlerinin çoğunun haraplanmasına neden olur; hatta bazen kanın hipokoagülabilitesine yol açar.
- Yaralanan dokular ve damar endoteli çok yavaş olarak doku plazminojen aktivatörü (t-PA) adı verilen güçlü bir aktivatör salgılarlar ve bu madde pıhtı kanamayı durdurduktan bir gün ya da daha sonra, plazminojeni plazmine çevirir ve pıhtıyı ortadan kaldırır. t-PA, fibrinolizi sayesinde aktivitesi artar.
- Kan akımının pıhtılarla bloke edildiği birçok küçük kan damarları bu mekanizma ile tekrar açılırlar → plazmin sisteminin özellikle önemli bir işlevi, başka türlü temizlenmesi mümkün olmaya ve eninde sonunda milyonlarca küçük periferik damarı tıkayacak olan küçük pıhtıları uzaklaştırmaktır.
- Serin proteaz, plasmin için güçlü bir bağlanma özelliğine sahiptir.
- α2-antiplasmin tarafından inaktive olur. Fakat bağlanmış bir plasmini engelleyemez.
- Urokinaz ve streptokinaz Plasminojeni aktive eder.
Klinik Uygulamalar ve Araştırmalar:
Plazmin, pıhtı oluşumu ve çözünmesi arasındaki dengenin korunmasında çok önemli bir rol oynar. Plazmin aktivitesindeki anormallikler derin ven trombozu, pulmoner emboli ve inme gibi çeşitli pıhtılaşma bozukluklarına yol açabilir.
Önceki yanıtlarda belirtildiği gibi plazmin aktivitesinin ölçümü tipik olarak D-Dimer seviyelerinin tespiti yoluyla dolaylı olarak yapılır. Yüksek D-Dimer seviyeleri plazmin aktivitesinin arttığına ve pıhtılaşma bozukluklarının varlığına işaret edebilir.
Son yıllarda araştırmacılar, plazmin ve aktivatörlerinin pıhtılaşma bozukluklarının tedavisinde terapötik ajanlar olarak potansiyel kullanımını incelemektedir. Örneğin, doku plazminojen aktivatörü (t-PA) akut iskemik inme tedavisinde kan pıhtılarını çözmek ve beyne kan akışını yeniden sağlamak için kullanılır.
Özetle, plazmin kanın pıhtılaşması ve fibrinoliz sürecinde çok önemli bir enzimdir. Plazminin 20. yüzyılın başlarında keşfedilmesi, pıhtı oluşumu ve çözünmesinin daha iyi anlaşılmasına ve pıhtılaşma bozuklukları için potansiyel tedavilerin geliştirilmesine yol açmıştır.
Plasmin Belirlenmesi:
- Plasmin, plasmadan direkt olarak belirlenemez.
- Plasmini dolaylı olarak belirleyebilmek için, fibrinogen parçaları özellikle D-Dimer.
- D-dimer , FXIIIa lı çapraz fibrin parçalanınca oluşur. Aslında geri dönüşümü olmadan parçalanan bir pıhtının kanıtıdır.
- D-dimer sitralı plasmada belirlenir.(Plasmaya Aprotinin veya urin gibi fibrin parçalayacılar katılır.)
- Serbest plasminler, plasmin/ α 2-antiplasmin complex (PAP) içindeki α 2-antiplasmin leri sayesinde Plasmada belirlenir.
- Referans aralığı: fibrin parçaları <1 mg/l
D-dimer < 0.5 mg/l
- Plasminin, fibrini d-dimere parçalaması esnasında yeni bir antijen oluşur.Bu testte, bu antijen için özel bir antikor oluşur. D-dimer ise bu yeni antikorların yarattığı bir katman tarafından tutulur. D-dimerleri belirlemek için bu antikorlar kullanılır. Antikorlar renklendirilir ve rengin koyuluğu d-dimerin konsantrasyonu ile doğru orantılıdır.
- Fazla d-dimer fazlalığı:
- Venöz thromboz,
- Akciğer embolisi,
- DIC
- Postoperatif
- Trombolitik tedavi sırasında gözlemlenir.
proteoglikan
Proteoglikanlar, çokça glikozillenmiş olan özel bir glikoprotein sınıfını temsil eder. Bir veya daha fazla kovalent bağla eklenmiş glikozaminoglikan (GAG) zincirli bir çekirdek (core) proteinden oluşur. Bu glikozaminoglikan zincirleri, sülfat ve üronik asit gruplarının ortamda bulunmasıyla ilişkili fizyolojik koşullar altında negatif yüklü olan uzun, doğrusal/çizgisel karbonhidrat polimerleridir. Bu proteoglikanlar insan bağ dokusundaki zemin maddesinde bulunabilirler.




Yorum yazabilmek için oturum açmalısınız.