Sinonim: Kolanjiom, Cholangiom, Cholangioma
Kolanjit
Safra kanalının iltihaplanması. Bkz; Kolanj–it
- Bu, safra kanallarının drenajın tıkanması (örneğin safra taşı, tümör) veya bakteriyel bir enfeksiyon nedeniyle iltihaplanması durumunda ortaya çıkar.
- Bazen safra kanalı iltihabı, safra kesesi iltihabına (kolesistit) eşlik eden bir hastalıktır.
- Akut ve kronik kolanjit arasında bir ayrım yapılır.
Akut kolanjitin şikayetleri ve belirtileri
- Sağ üst karın bölgesinde ağrı
- Sarılık (cildin, mukoza zarının ve göz konjonktivasının sararması)
- Ateş ve titreme
- Kronik kolanjitin şikayetleri ve semptomları
- Sağ üst karın bölgesinde ağrı
- Yağlı gıdalara karşı intolerans
- Mide bulantısı ve kusma
Terapi
Öncelikle safra kanallarındaki tıkanıklık ve basınç giderilmelidir. Bu ya ameliyatla yapılır ya da hastalığa bağlı olarak endoskopik drenaj ile tıkanıklık azaltılabilir. Aynı zamanda, safra kanallarındaki bakteri odaklarını ortadan kaldırmak için genellikle antibiyotik tedavisi uygulanır.
Bir ameliyat ancak hasta mümkün olduğunca iltihaptan arındığında gerçekleştirilebilir. Bu da sıkı yatak istirahati, diyet ve antibiyotik gerektirir. Ağrı şiddetli ise spazm giderici ilaçlar ağrıyı hafifletebilir.
Kolanjiyopati
İnsan Parazitinde, Konağın Dokularını Yenilemeye Yarayan Kök Hücreler Ortaya Çıktı!

Kaynak:
- University of Illinois
- Harini Iyer, James J. Collins III, Phillip A. Newmark NF-YB Regulates Spermatogonial Stem Cell Self-Renewal and Proliferation in the Planarian Schmidtea mediterranea PLOS Genetics Published: June 15, 2016http://dx.doi.org/10.1371/journal.pgen.1006109
DNA Eşlenmesindeki Evrimsel Gizem: Eşlenme Yönü

Ters yönlü çalışan bir enzimin mekanizmasını inceleyen bilim insanları, DNA eşlenmesinin her zaman ileri yönde gerçekleşen bir biyolojik fenomen olduğu kanısına vardı. Burada bir kafa karışıklığına yer bırakmamak adına, DNA eşlenmesinin her iki zincirde de gerçekleştiğini ve 5′ (fosfat ucu) uçtan, 3′ uca (riboza bağlı hidroksil grubu) doğru gerçekleşmekte olduğunu belirtelim.
DNA ve RNA gibi nükleotitlerden oluşmuş olan zincirler, hali hazırda var olan zincirlerin kopyalarının üretilmesi yolu ile sentezlenir. Bu kopyalama olayı da her zaman ‘ileri’ yönde yani belirli bir uçtan diğer uca doğru gerçekleşir. DNA zincirleri birbirlerine zıt yönde dizili olduğundan, eşlenme sırasında tıpkı bir fermuar gibi bir uçtan açılarak her iki zincir için de ayrı eşlenme yani açılan karşı zinciri oluşturma süreci başlar.
Bu noktada DNA zincirlerinden birisi yani 3′ ucu açılmış olan zincire ard arda düzenli biçimde ve sırasıyla nükleotitler eklenerek o zincirin eşlenmesi gerçekleşirken; DNA zincirleri birbirine zıt yönlü olduğundan ayrılma sırasında 5′ ucu açılan zincire ise yine yönü 5′ – 3′ yönlü farklı nükleotit sayılarına sahip oligonükleotitler denen DNA parçaları bağlanarak eşlenir. Bu hali ile aslında her iki zincirde de 5′ yönden 3′ yöne doğru bir DNA eşlenmesi gerçekleşir. Asıl soru da burada ortaya çıkıyor: “Neden hücreler, iki zincirde de aynı verimlilikte DNA eşlenmesi sağlayacak ters-yönlü çalışan (3′ uçtan 5′ uca) bir enzime sahip değil?”
Son dönemde, Thg1-like proteins (TLPs) adı verilen ve ters yön olarak tanımlanan 3′ ucundan 5′ ucu yönüne doğru nükleotit ekleyen proteinler keşfedilmişti. Bu şekilde zıt yönlü nükleotit ekleyen moleküllerin son derece nadir olduğu biliniyor. TLP’ler de hasarlı RNA moleküllerinde zıt ucun ters yönde tamir edilmesini veya düzeltilmesini sağlayan proteinler olarak işlev görüyor.
Bu noktayı şöyle açıklayabiliriz; RNA molekülleri tek zincirli yapılar olduğu için normal düzende 5′ uçtan 3′ ucuna doğru nükleotitlerin eklenmesi ile sentezlenir. Ancak ilk eklenen nükleotitlerde yani 5′ uçtaki birimlerde hasar olduğu zaman RNA molekülleri TLP’ler gibi ters yönlü nükleotit ekleyen proteinlere ihtiyaç duyarlar. Aksi takdirde hata düzeltilemez veya sayısız hastalığa sebep olabilecek veya en iyi ihtimalle üretilen RNA’nın kullanılamamasına ve bozunmasına sebep olacaktır.
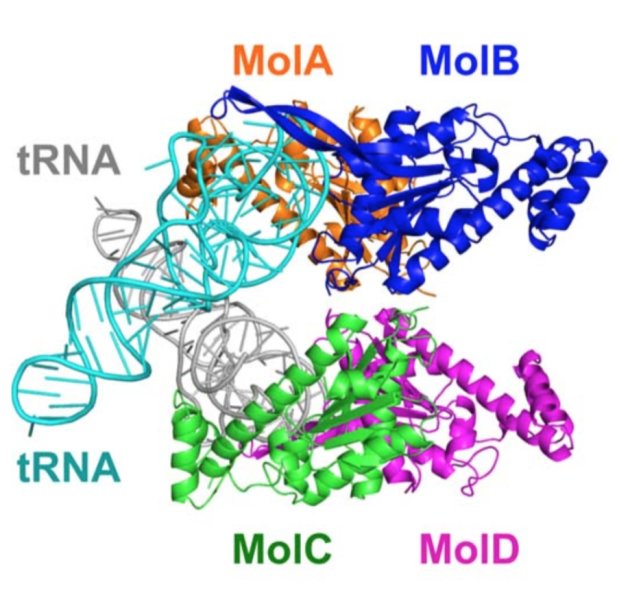
Çalışmada X-ışını kristalografi tekniği ile üç boyutlu yapıları ve birbirlerine göre konumları çözümlenen TLP kompleksi ve tRNA’lar-Telif : Kimura S. et al., Science Advances,
Science Advances’da yayımlanan yeni bir makalede Hokkaido University’den Min Yao ve ekibi, X ışını kristalografi (X-ray crystallography) tekniğinden yararlanarak TLP/RNA kompleksi yapılarını ve doğasını incelemeye koyuldu. Araştırmacılar bu yolla TLP’lerin ters yönde nükleotit ekleme görevini nasıl gerçekleştirdiğini ve belki de hücrelerde neden bu tip çalışan moleküllerin DNA eşlenmesi sırasında da çalışacak kadar yoğun bulunmadıklarını anlamayı hedefledi.
Yapılan yapısal analizler iki aşamalı bir sürecin varlığını ortaya koydu: enerji-verici moleküller işe dahil oluyor ve göreve başlıyor; daha sonra da nükleotit ekleniyor. Üstünkörü olarak bu şekilde özetlense de; ikinci aşama ‘ileri’ yönlü süreçte de mevcut. Ters yönlü sürece özel olarak yalnızca enerji ihtiyacının baştan karşılanması veya başka bir deyişle enerjinin işe başlaması bulunuyor. Belli ki enzim; bu enerji işe alımını, yönü ileriden ‘ters’e çevirmek üzere kullanıyor.
Araştırma ekibi, ulaştıkları sonuçlar üzerinden, DNA eşlenmesinin ters-yönlü enzimleri kullanamayacağını çünkü yapısal olarak çok daha karmaşık süreçleri barındırdığını ve de gerektirdiğini öne sürdü.
Ancak araştırmacılar, ileri ve ters yönlü olan mekanizmaların daha detaylı olarak incelenmesi ile DNA eşlenmesinin evrimsel kontekstini daha iyi anlaşılabileceğini öne sürüyor.
Kaynak :
- Bilimfili,
- Hokkaido University Web Sitesi, Uncovering the mystery of DNA replication, 13 Temmuz 2016 , https://www.oia.hokudai.ac.jp/blog/uncovering-the-mystery-of-dna-replication/
Makale Referans : S. Kimura, T. Suzuki, M. Chen, K. Kato, J. Yu, A. Nakamura, I. Tanaka, M. Yao. Template-dependent nucleotide addition in the reverse (3′-5′) direction by Thg1-like protein. Science Advances, 2016; 2 (3): e1501397 DOI: 10.1126/sciadv.1501397
Dopamin Nedir ve Bağımlılıklarımızın Sorumlusu Dopamin mi?

Birçok araştırmacı insan beynini, diğer hayvanlardan ayıran en önemli farkların beynimizin nöral dokusunun dış katmanı olan serebral korteksimizin büyüklüğü ve karmaşası olduğu noktasında hem fikir. Dolayısıyla da, evrimin bu şaheserinin mental yaşamımızı eşsizleştirdiğini düşünerek dikkatimizi bu alana odaklama eğilimindeyiz.
Fakat ne var ki; insanlar ve diğer hayvanlar arasındaki neredeyse tamamen aynı olan; örneğin; diğer beyin hücreleriyle iletişim kurmak için dopamin kimyasalını kullanan küçük bir grup beyin hücresi gibi, bazı parçaları gözardı ediyoruz.
Ödüllendirici Bir Deneyim
Dopamin, genellikle beynin “haz kimyasalı” olarak tanımlanır, fakat esasında oldukça fazla sayıda fiziksel ve mental işlemlerde görev alır. Orta beyindeki bir nöron kümesi tarafından diğer nöronlara mesaj taşımada da dopamin kullanılır. Dopamin nöronları sayıca çok azdırlar (beyindeki nöronların yaklaşık %0.0006’sı kadar) ve bütün memelilerde, hatta kaplumbağalar gibi bazı “basit” hayvanlarda da görülür.
1950lerde araştırmacılar, sıçanlar üzerinde yürüttükleri bir çalışmada dopamin nöronlarını ön beyindeki hedeflerine bağlayan bir sinir demetinin uyarımıyla sıçanların zevk aldıklarını gözlemlediler. Bu tarz bir uyarım için sıçanlar, kendi başlarına bırakıldıklarında bir kolu hareket ettirmeyi öğrenebildiler ve bunu günde binlerce kez yapabildiler.
Etik açıdan tamamen sorunlu benzer bir deney ise 1970 yılında insan üzerinde yapıldı. Tıpkı sıçanlardaki gibi, hasta dopamin sinir demetini uyarmak için bir butona basmayı öğrendi ve 3 saatlik bir seans boyunca butona yaklaşık 1500 defa bastı, uyarılma sırasında hastanın aldığı haz araştırmacılar tarafından rapor edildi.
Bu tarihten itibaren de, yapılan çalışmalar, dopamin sisteminin çok çeşitli haz verici deneyimlerle (örneğin; yemek yemek, seks yapmak, intikam almak, video oyunlarında kazanmak, müzik dinlemek, para kazanmak ve karikatür dergileri okumak gibi) aktive edilebileceğini ortaya koydu. Öte yandan dopamin sistemi aynı zamanda da uyku ilaçları, alkol ve kokain gibi uyuşturucu bağımlıklarına da güçlü bir biçimde cevap veriyor. Bu uyuşturucular, doğal ödüllerin yarattığı etkiden çok daha fazlasını yaratabiliyorlar ve doğal ödüllerden farklı olarak doyumsuzluğa sebep olabiliyor.
Bu gerçeklerin doğrudan izahını şu şekilde yapabiliriz: Dopamin sistemi beyindeki haz yoludur. Bu da; insanlar ve diğer hayvanların neden butona ya da kola basarak dopamin nöronlarını aktive etme istekliliği gösterdiklerini potansiyel olarak açıklayabilir. Öte yandan bazı uyuşturucuların neden bu kadar bağımlılık oluşturduklarına dair de bir izah geliştirebilir. Uyuşturucuların sebep olduğu güçlü ve uzun süreli aktivasyon bu maddelerin bir “süper ödül” gibi davranmalarına ve daha fazla arzu edilir olmalarına sebep olabilir.
Ancak, motivasyon değişimleri, uyarılma, dikkat, duygu ve öğrenmeyi de içeren birçok mental olay da ödüle yakın bir zamanda meydana gelir. Örneğin, tatlı bir gıda (şeker, dondurma vb.) veren bir otomatın yanından geçişinizi hayal edin. Eğer açsanız, dikkatiniz makineye yönelecektir ve makineye yaklaştıkça daha da uyarılmış bir hale geleceksiniz. Tatlıyı bir kez yediğinizde, haz duyarsınız, açlık hissiniz azalır ve burada beyniniz otomatı bir ödülle ilişkilendirmeyi öğrenir. İşte dopamin sistemi yalnızca tek bir hazdan ziyade birçok sürecin yer aldığı bir sistemdir. Otomata yaklaşmanız, tatlıyı yemeniz, açlık hissinizin azalması ve öğrenmenin gerçekleşmesi hepsi birer dopamin sistemi sürecidir.
İradeye Karşı Dopamin
En önemli dopamin fonksiyonlarından biri de öğrenmedir. Araştırmacılar; ödüle ilişkin beklentilerin gerçeklikle uyuşmadığı anlarda dopamin nöronları aktivasyon değişimi gösteriyor ve öğrenmeye sebep olan bir “ödül tahmin hatası” sinyali veriyor. Örneğin; öngörülmeyen ödüllerle dopamin nöronları aktive oluyor ancak beklenen ödüller gelmediğinde baskılanıyorlar.
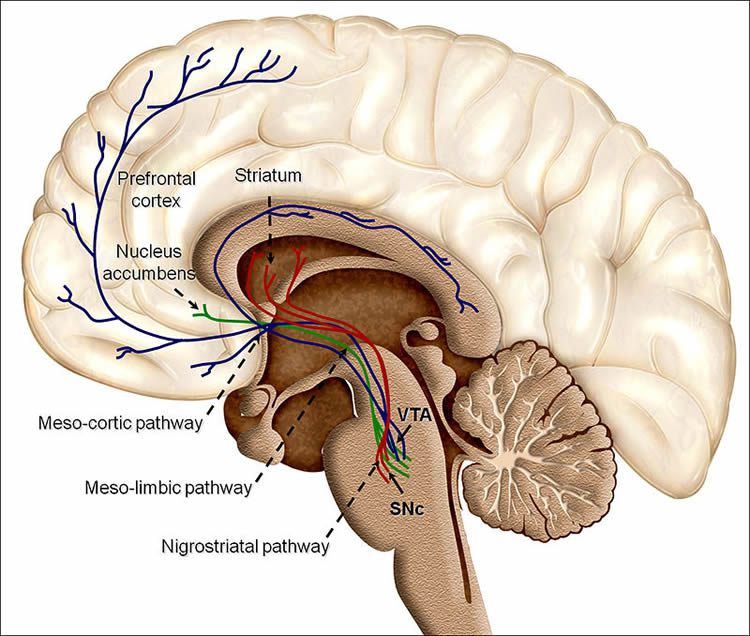
Beyindeki dopamin yolu / Credit: Pöppel et al./BioMed Central
Dopamin aktivasyonunun artışını getiren olaylar; ödülle, dopamin azalmasına sebep olan olaylar ise; hayal kırıklığı ile ilişkilendirilir. Eğer çevre değişmiyorsa, yapmanız gereken beyninizin dopamin nöronlarını aktive eden ödül ilişkili eylemlerle uğraşmak ve dopamini baskılayan eylemlerden kaçınmaktır.
Kimyasal Bir Öğretici mi?
Dopamin aktivasyonunun neden olduğu öğrenmeye dair fazlasıyla farkındalık sahibi olmamız pek muhtemel değildir, örneğin; farkında olmadan dopamin aktivasyonu ile ilişkilendirdiğimiz şeylere bağlı hale gelmek gibi. Bu farkındalık eksikliği insanların neden sıklıkla gerçekçi olmayan ya da uyumsuz seçimler yaptığına dair bir açıklama getirebilir.
Peki beyin araştırmaları, bağımlılıkta dopamin etkilerinin üstesinden gelmede kullanılabilir mi? Sinirbilimciler bağımlılıkta dopamin nedenli öğrenmeyi engelleyecek ilaçların bulunabilmesi için iz sürmeye devam ediyorlar. Ancak sınırlı bir başarı elde etmiş durumdalar, çünkü dopaminin, motive ve mutlu hissetme gibi diğer fonksiyonlarını engellemeden yalnızca öğrenme fonksiyonunu engelleyecek bir ilacı üretebilmek oldukça zor bir iş.
Bağımlılığın ardındaki bütün hikaye dopamin nedenli öğrenme değildir, fakat bu durum; bağımlılığın, insanın kendi muhakemesiyle üstesinden gelebileceği bir şey olup olmadığını göz önünde bulundurmamız gerektiğini ortaya koyuyor. Aynı şey, iradenin başarısız kaldığı –örneğin; aşırı yemek yemek gibi– diğer gündelik eylemler için de uygulanabilir.
Evrimin yarattığı serebral korteksimizin eşsizliği bu eylemlerde kontrolü ele alabilir, fakat birincil dopamin sistemimiz buna öğretmenlik yapabilir.
Kaynaklar:
- Bilimfili,
- Flemin, S. “What Does Dopamine Actually Do?” Psychology Today. https://www.psychologytoday.com/blog/the-hidden-mind/201212/what-does-dopamine-actually-do (Accessed on 2016, July 21)
- Fehlhaber, K. “The Reward Pathway Reinforces Behavior.” Knowing Neurons. http://knowingneurons.com/2012/10/31/the-reward-pathway-reinforces-behavior/ (Accessed on 2016, July 21)
- Bowman, E. (University of St Andrews) “Explainer: what is dopamine – and is it to blame for our addictions?” TheConversation. https://theconversation.com/explainer-what-is-dopamine-and-is-it-to-blame-for-our-addictions-51268 (Accessed on 2016, July 21)
- Wolfram Schultz, Peter Dayan, P. Read Montague A Neural Substrate of Prediction and Reward SCIENCE z VOL. 275 z 14 MARCH 1997
Kolanji
Kolestaz
1. Tanım, terminoloji ve etimoloji
Kolestaz, en genel ve teknik tanımıyla, safranın karaciğerden duodenum yönüne doğru olan normal akışının azalması veya durması ile karakterize bir sendromdur. Bu akım bozukluğu, karaciğer hücresi düzeyinde (hepatoselüler sekresyon bozukluğu) olabileceği gibi, intrahepatik veya ekstrahepatik safra yollarında mekanik tıkanma sonucunda da ortaya çıkabilir. Klinik olarak kolestaz, serumda safra asitleri, konjuge bilirubin ve kolestatik enzimlerin yükselmesi, ayrıca safra pigment ve asitlerinin dokularda birikmesine bağlı özgün semptom ve bulgularla kendini gösterir.
Terim, klasik kökenleri açısından ele alındığında, sıklıkla yanlış biçimiyle “kolostasis” olarak anılsa da, doğru tıbbi terim “kolestaz” (cholestasis) olup, Yunanca chole (χολή, “safra”) ile stasis (στάσις, “durma, duraksama, akışın kesilmesi”) sözcüklerinin birleşiminden türetilmiştir. Kavram tarihsel olarak ilk kez safra akımının mekanik obstrüksiyonuna işaret etmek için kullanılmış, ancak hepatobilier fizyolojinin daha iyi anlaşılmasıyla, safra sentezi, sekresyonu ve transportundaki hücresel düzeydeki bozuklukları da kapsayacak şekilde genişlemiştir.
Basitleştirici tanımlarda bazen “safranın safra yolunda oluşturduğu tıkanıklık” şeklinde ifade edilse de, bu tanım yalnızca ekstrahepatik mekanik obstrüksiyonu yansıtır. Modern hepatoloji açısından kolestaz, tüm safra akım bozukluğu spektrumunu kapsayan bir üst kavramdır.
2. Safranın fizyolojisi: fonksiyonel zemin
Kolestazın anlaşılabilmesi için safra oluşumu ve fonksiyonuna kısaca değinmek gerekir.
2.1. Safranın bileşimi ve rolleri
Safra, başlıca hepatositler ve bir ölçüde kolanjiyositler tarafından üretilen, kompleks bir biyolojik sıvıdır. İçeriğinde:
- Safra asitleri ve tuzları
- Fosfolipitler (özellikle lesitin)
- Kolesterol
- Bilirubin ve diğer safra pigmentleri
- Elektrolitler ve su
bulunur. Bu bileşenlerin koordineli sekresyonu, hem sindirim hem de detoksifikasyon açısından yaşamsal değerdedir.
Safra asitleri özellikle kritik bir role sahiptir:
- Yağ emilimi: Diyetle alınan nötral lipidlerin (trigliseridler) ve yağda çözünen vitaminlerin (A, D, E, K) emilimi safra asitlerinin oluşturduğu micellar faz sayesinde mümkün olur.
- Atılım yolu: Kolesterol, bilirubin ve çeşitli endojen (hormon metabolitleri vb.) ya da ekzojen (ilaç metabolitleri, toksinler) maddeler safra yoluyla vücuttan uzaklaştırılır.
- Bağırsak mikrobiyotası ile etkileşim: Safra asitleri, bağırsak mikrobiyotasını şekillendiren önemli bir ekolojik baskı unsuru olup, bakteriyel aşırı çoğalmayı sınırlayıcı bir etkiye de sahiptir.
Dolayısıyla, safra akımının bozulduğu kolestaz durumunda yalnızca bilirubin birikimi sonucu sarılık ortaya çıkmakla kalmaz; aynı zamanda yağ emiliminin bozulması, yağda çözünen vitamin eksiklikleri ve safra asidi birikimine bağlı çok sayıda sistemik etki ortaya çıkar.
3. Evrimsel perspektif: safra sistemi ve kolestazın biyolojik bağlamı
Safra üretimi ve safra asitleri, omurgalı evriminin erken dönemlerinden beri var olan bir adaptasyon olarak kabul edilir. Özellikle lipidten zengin diyetlerin sindirimi, hidrofobik moleküllerin çözünmesi ve toksik metabolitlerin uzaklaştırılması için safra sistemi güçlü bir seçilim baskısı altında evrimleşmiştir.
- Otçullarda bitki kaynaklı yağlar ve kompleks lipidler, yoğun safra asidi sekresyonunu gerekli kılar. Bu türlerde safra kanalında ortaya çıkabilecek tıkanmalar, enerji metabolizması ve vitamin emilimini dramatik biçimde bozabileceği için yaşamsal tehdit oluşturabilir. Bu nedenle, safra kanalı ağının rejeneratif kapasitesinin yüksek olması, kolateral kanalların gelişimi veya safra kompozisyonunu değiştirebilen esnek mekanizmalar gibi koruyucu adaptasyonlar ortaya çıkmış olabilir.
- Etoburlarda, diyetin bileşimi farklı olmakla birlikte, safra hala hem safra pigmentlerinin uzaklaştırılması hem de lipid emilimi bakımından önemlidir. Kolestaz bu türlerde belki enerji metabolizması açısından daha az dramatik olsa da, bilirubin birikiminin nörotoksik ve sistemik etkileri, ayrıca yağda çözünen vitamin eksikliklerinin bağışıklık, görme ve kemik metabolizması üzerindeki etkileri nedeniyle selektif dezavantaj doğurabilir.
- Gebelik kolestazı gibi durumlar, hormon düzeylerindeki fizyolojik yükselişin hepatoselüler safra transport sistemleri üzerinde oluşturduğu yük ve “yan etki” olarak görülebilir: Plasental ve maternal hormonal adaptasyonlar, fetüs için gerekli ortamı sağlarken, anne karaciğerindeki safra asidi transportörlerini baskılayarak kolestaza yol açabilir. Bu, üreme başarısı ile maternal karaciğer fonksiyonu arasında evrimsel bir denge arayışının klinikteki kırılgan yansımasıdır.
Bu çerçevede kolestaz, yalnızca patolojik bir durum değil, aynı zamanda çok eski ve karmaşık bir fizyolojik sistemin arızaya uğramış hali olarak okunabilir.
4. Sınıflandırma
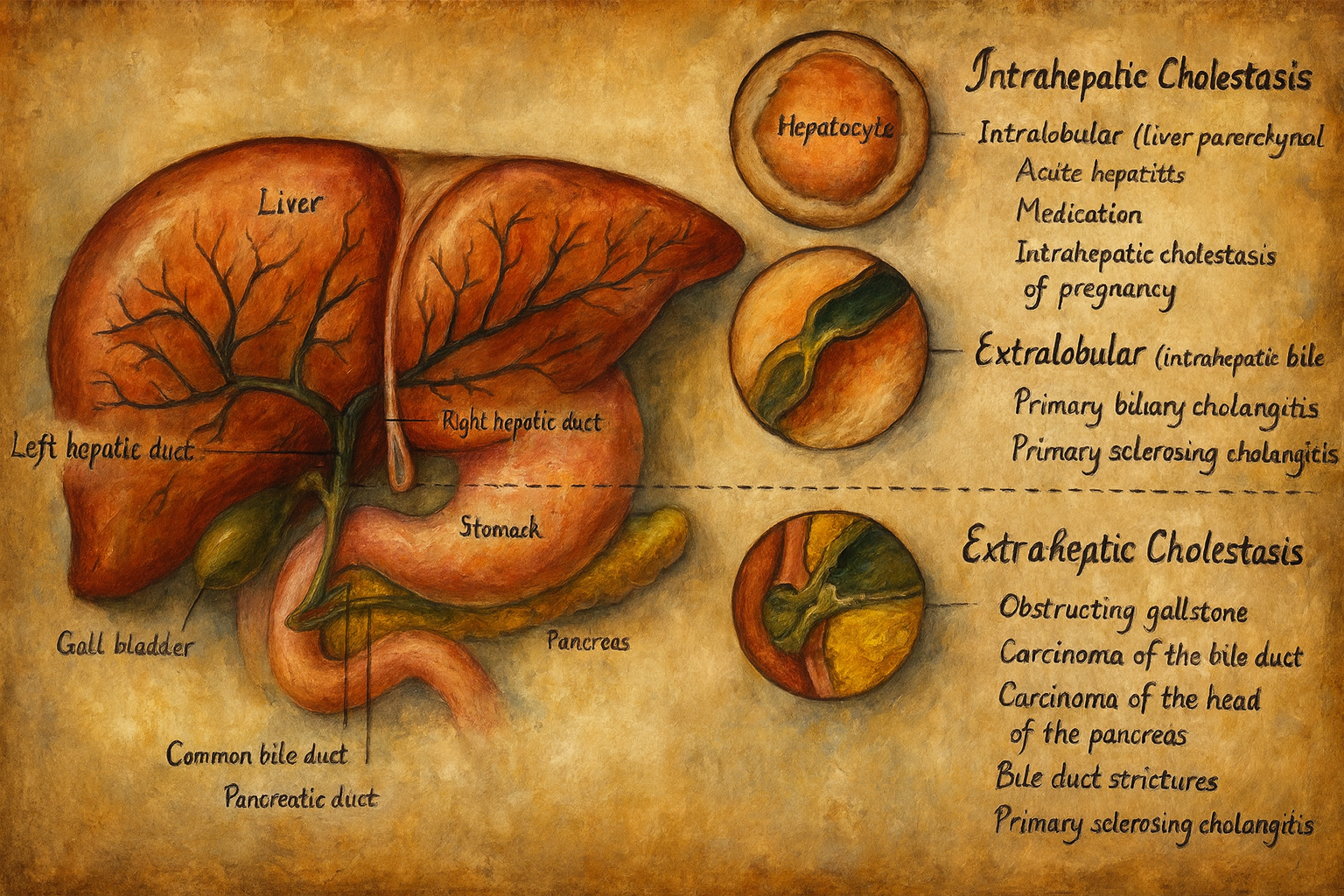
Klinik pratikte kolestaz temelde anatomik düzeye göre sınıflandırılır:
- İntrahepatik kolestaz
- Ekstrahepatik kolestaz (obstrüktif ikter)
Bunlara ek olarak, gebelikte ortaya çıkan intrahepatik gebelik kolestazı, bazı kalıtsal kolestatik sendromlar ve ilaç kaynaklı kolestaz gibi özel alt gruplar da tanımlanmıştır.
4.1. İntrahepatik kolestaz
İntrahepatik kolestazda, safra akımındaki bozukluk karaciğer parankimi veya intrahepatik küçük safra kanalları düzeyinde ortaya çıkar. Safra hücreden kanaliküle veya küçük kanal ağına yeterince aktarılamaz ya da bu ağda içsel bir hasar söz konusudur.
Başlıca nedenler:
- Viral hepatitler (akut veya kronik)
- İlaç veya toksin ilişkili karaciğer hasarı (örn. bazı antibiyotikler, anabolik steroidler, hormon preparatları, antiepileptikler)
- Alkolik ve non-alkolik steatohepatit
- Hepatoselüler karsinom ve diğer malign infiltrasyonlar
- Karaciğer sirozu (çeşitli etiyolojilere bağlı)
- Primer biliyer kolanjit (eski adıyla primer biliyer siroz)
- Primer sklerozan kolanjit (intra- ve ekstrahepatik yolları da etkileyebilir)
- İntrahepatik gebelik kolestazı
- Kalıtsal kolestatik sendromlar (örn. safra asidi transport protein mutasyonları)
Bu durumda safra yollarında belirgin bir mekanik darlık saptanmayabilir; asıl sorun hepatositlerin safra asidi ve bilirubin sekresyon kapasitesinin azalması veya kanal düzeyinde inflamasyon ve fibroz gelişmesidir.
4.2. Ekstrahepatik kolestaz (obstrüktif ikter)
Ekstrahepatik kolestaz, karaciğer dışındaki safra yollarında mekanik tıkanıklık sonucu ortaya çıkar ve klasik olarak “tıkayıcı sarılık” tablosuyla ilişkilendirilir. Safra, normal şekilde üretildiği halde duodenuma ulaşamaz; bu da safra tuzlarının, bilirubinin ve diğer bileşenlerin geri basmasına neden olur.
Başlıca nedenler:
- Safra taşları (koledokolitiazis)
- Tümörler
- Kolanjiyokarsinom
- Pankreas başı karsinomu veya periampuller tümörler (kompresyon yoluyla)
- Metastatik lenf nodu büyümeleri ile dıştan bası
- Safra kanalı kistleri (örn. koledok kistleri)
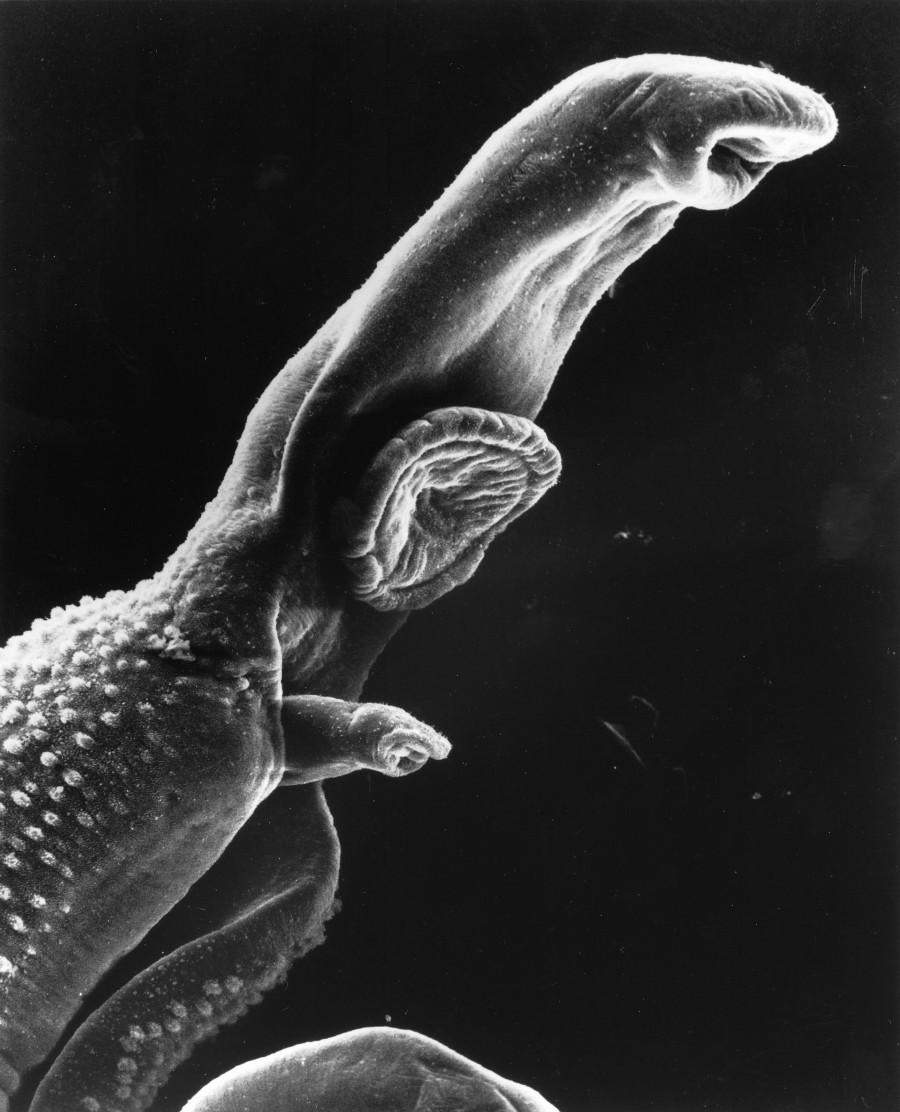
- Paraziter enfestasyonlar (örn. safra yoluna yerleşen helmintler)
- Safra kanal stenozları veya darlıkları
- Postoperatif striktürler
- Kronik inflamasyona bağlı fibrotik darlıklar
Ekstrahepatik kolestaz, özellikle akut taş tıkanmalarında kolik tarzda ağrı, ateş ve sepsis bulguları ile komplike olabilir; pankreas başı tümörlerinde ise daha sinsi seyirli, ağrısız sarılık klasik olarak tarif edilir.
5. Etiyopatogenez
Kolestazın patogenezi, safra oluşumu ve taşınmasındaki her bir basamağın bozulması üzerinden anlaşılabilir:
- Hepatosit içi safra asidi sentez bozukluğu veya transport proteinlerinin disfonksiyonu
- Kanaliküler membran taşıyıcılarında (örneğin BSEP, MRP2, MDR3 gibi) genetik veya edinilmiş işlev bozuklukları
- İntra- veya ekstrahepatik safra yollarında inflamasyon, ödem, fibroz veya mekanik tıkanma
- Hormonların (özellikle gebelikte östrojen ve progesteron metabolitleri) safra asidi transport sistemleri üzerindeki inhibitör etkileri
Sonuçta:
- Safra asitleri ve bilirubin kanda birikir.
- Hepatositlerde safra asidi birikimi doğrudan sitotoksik etki yaparak hücre ölümünü, inflamasyonu ve fibroz gelişimini hızlandırır.
- Bağırsakta safra asidi eksikliği nedeniyle yağ ve yağda çözünen vitamin emilimi bozulur.
6. Klinik tablo
Kolestazın klinik görünümü, altta yatan nedene, sürenin akut-kronik oluşuna ve eşlik eden karaciğer hasarının derecesine göre farklılaşır. Bununla birlikte, bazı bulgular oldukça karakteristiktir.
6.1. Temel semptomlar
- Sarılık (ikterus):
Kolestazın en belirgin semptomu sıklıkla sarılıktır. Konjuge bilirubinin kanda birikmesiyle deri, skleralar ve mukozalar sarı-koyu sarı renge döner. Sarılık, kronik olgularda hafif ve donuk; akut obstrüksiyonda ise dramatik derecede belirgin olabilir. - Kaşıntı (pruritus):
Safra asitlerinin ve diğer pruritogen maddelerin deride ve sinir uçlarında birikimine bağlı gelişen, çoğu zaman gece artan, yaygın ve inatçı kaşıntı, kolestazın hem hastayı en fazla rahatsız eden hem de oldukça tipik bulgularından biridir. - Dışkı ve idrar renginde değişiklik:
- Safranın bağırsak lümenine ulaşamaması sonucu dışkı rengi açılır, kil rengini alabilir (akolik dışkı).
- Konjuge bilirubin böbrekler yoluyla atıldığından idrar koyu çay/kola rengini alır.
- Gastrointestinal yakınmalar:
Özellikle ekstrahepatik obstrüksiyon durumunda, altta yatan nedene bağlı olarak epigastrik veya sağ üst kadran ağrısı, bulantı, kusma gibi gastrointestinal şikâyetler tabloya eşlik edebilir. Safra taşlarına bağlı obstrüksiyonda kolik tarzda şiddetli ağrı ön planda olabilir.
6.2. Yağ emilim bozukluğu ve vitamin eksiklikleri
Safra asitlerinin yetersizliği nedeniyle:
- Steatore (yağlı, hacimli, zor temizlenen dışkı)
- Kilo kaybı, malnütrisyon
- Yağda çözünen vitamin eksiklikleri:
- Vitamin A eksikliği: gece körlüğü, epitel bütünlüğünün bozulması
- Vitamin D eksikliği: osteomalazi, çocuklarda raşitizm
- Vitamin E eksikliği: nöromüsküler bozukluklar, hemoliz eğilimi
- Vitamin K eksikliği: pıhtılaşma faktörlerinin sentezinde azalma, kanama diyatezi
Bu eksiklikler uzun süren kronik kolestaz tablolarında daha belirgindir.
6.3. Sistemik ve kronik bulgular
Uzamış kolestazda:
- Ksantelazma ve ksantomlar (özellikle göz kapaklarında ve tendonlarda kolesterol birikimi)
- Kemik mineral hastalığı (osteopeni, osteoporoz, kırık riskinde artış)
- Kronik yorgunluk, yaşam kalitesinde belirgin düşme
- İleri evrede karaciğer sirozu ve portal hipertansiyon bulguları (splenomegali, asit, varisler) gelişebilir.
7. Tanı
Kolestaz tanısı, klinik, laboratuvar ve görüntüleme bulgularının sistematik değerlendirilmesi ile konur; esas hedef, kolestazın intrahepatik mi, ekstrahepatik mi olduğunu ve temel nedeni saptamaktır.
7.1. Laboratuvar bulguları
Kolestatik patern tipiktir:
- Alkalin fosfataz (ALP / AP) ↑
- Gama-glutamiltransferaz (GGT) ↑
- Toplam ve özellikle konjuge bilirubin ↑
- Serum safra asitleri ↑ (ölçülebiliyorsa)
- Uzamış kolestazda Lipoprotein X ↑ ve serum lipid profilinde değişiklikler görülebilir.
Transaminazlar (AST, ALT) kolestatik tabloda hafif-orta düzeyde yükselebilir, ancak hepatoselüler nekrozun eşlik ettiği durumlarda belirgin daha yüksek değerlere ulaşır. Koagülasyon testleri (INR), albumin düzeyi ve tam kan sayımı, karaciğer rezervi ve olası komplikasyonlar hakkında ek bilgi verir.
7.2. Görüntüleme yöntemleri
İlk basamakta genellikle karaciğer ve safra yollarının ultrasonografisi kullanılır:
- Karaciğer parankim yapısı, kitle lezyonları
- İntra- ve ekstrahepatik safra yollarında dilatasyon
- Safra kesesi taşları veya çamuru
- Pankreas başı ve çevredeki yapıların temel anatomisi değerlendirilebilir.
Ultrason sonucu ve klinik kuşkuya göre ileri görüntüleme uygulanır:
- Bilgisayarlı tomografi (BT):
Tümöral lezyonların, lenf nodlarının, pankreas patolojilerinin değerlendirilmesinde yararlıdır. - Manyetik rezonans görüntüleme (MR) ve özellikle MR kolanjiyopankreatografi (MRCP):
Safra yollarının non-invazif ve ayrıntılı anatomik değerlendirilmesini sağlar; striktür, taş, kist ve tümörleri yüksek duyarlılıkla gösterebilir. - Endoskopik retrograd kolanjiyopankreatografi (ERCP):
Hem tanısal hem de tedavi edici bir yöntemdir. Safra yollarının direkt görüntülenmesini sağlar; taş çıkarma, stent yerleştirme, biyopsi alma gibi girişimlere olanak verir.
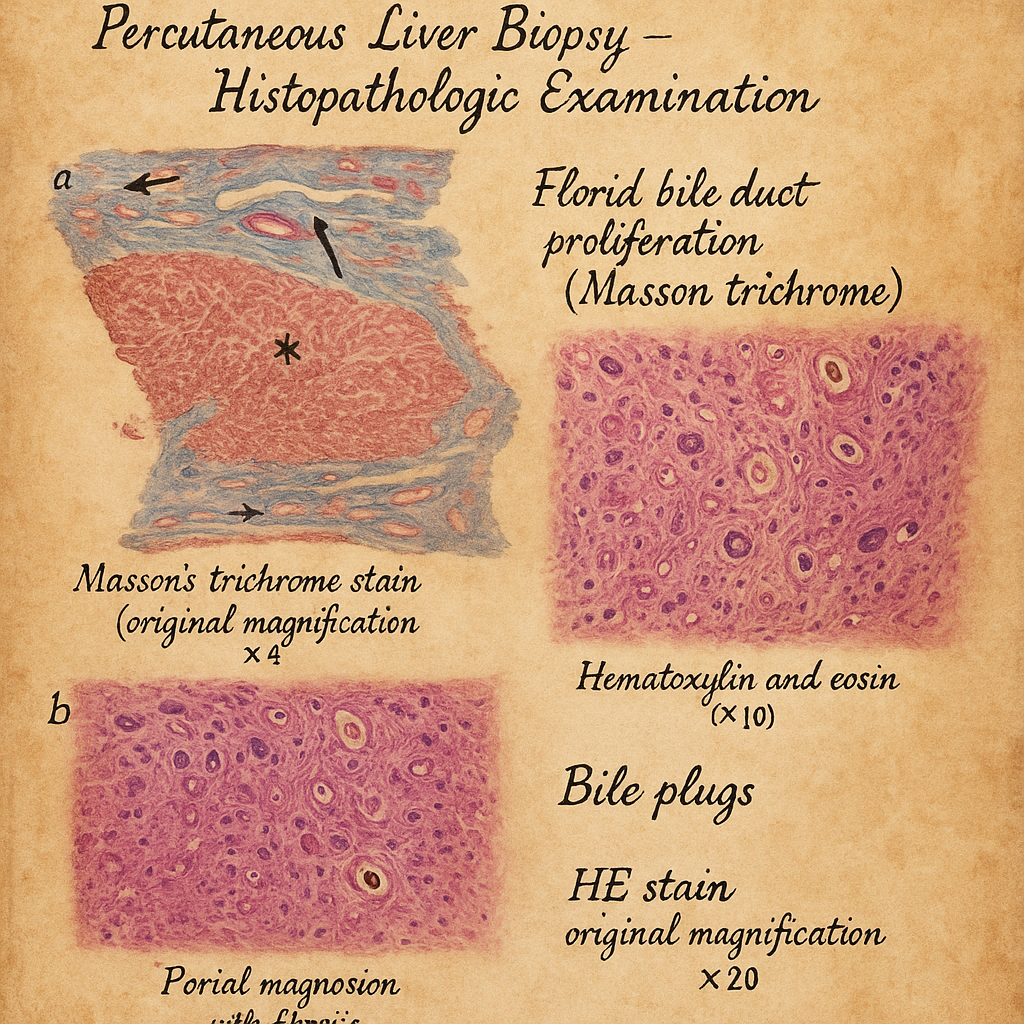
7.3. Karaciğer biyopsisi
Yukarıdaki incelemelerle kolestazın nedeni netleşmiyorsa, özellikle intrahepatik kolestazdan şüphe edilen olgularda karaciğer biyopsisi yapılabilir. Patohistolojik inceleme:
- Kanaliküler safra stazı
- İnflamasyon, fibrozis derecesi
- Duktopeni veya safra kanalı hasarı
- Granülomlar, tümör infiltrasyonu gibi özel bulgular
hakkında bilgi vererek etiyolojinin aydınlatılmasına katkı sağlar.
8. Gebelik kolestazı ve fetüs açısından riskler
İntrahepatik gebelik kolestazı, özellikle ikinci ve üçüncü trimesterde görülen, yoğun kaşıntı ve kolestatik laboratuvar bozuklukları ile karakterize bir tablo olup, hem anne hem de fetüs için önemlidir.
- Anne açısından çoğunlukla geri dönüşümlü bir durumdur; doğum sonrası haftalar içinde düzelme eğilimi gösterir.
- Fetüs açısından ise erken doğum, fetal distres ve ölü doğum riskinde artış bildirilmiştir. Safra asitlerinin plasental bariyer üzerinden fetüse geçmesi ve kardiyotoksik etkilerde bulunması olası mekanizmalardan biridir.
Modern doğum öncesi bakım yöntemleri (yakın fetal izlem, ultrason, biyofizik profil, non-stres testler) prognozu iyileştirse de, yüksek safra asidi düzeylerine sahip olgularda ölü doğum riskinin tamamen ortadan kaldırılması güçtür. Bu nedenle gebelik kolestazı, perinatoloji ve hepatolojinin kesişiminde, dikkatli izlem ve zamanlaması iyi planlanmış doğum stratejilerini gerektirir.
9. Tedavi
Kolestaz tedavisi, temel olarak iki eksen üzerinde şekillenir:
- Altta yatan nedenin düzeltilmesi (nedene yönelik tedavi)
- Kolestazın yol açtığı semptom ve komplikasyonların yönetimi (destekleyici ve semptomatik tedavi)
9.1. Nedene yönelik tedavi
- Ekstrahepatik obstrüksiyon durumunda:
- Safra taşlarının endoskopik (ERCP ile sfinkterotomi ve taş ekstraksiyonu) veya cerrahi yöntemlerle çıkarılması
- Tümörlerde stent yerleştirilerek drenaj sağlanması, uygun olgularda cerrahi rezeksiyon veya onkolojik tedaviler
- Striktürlerin dilatasyonu ve stent uygulamaları
- İntrahepatik nedenler için:
- Hepatotoksik ilaçların kesilmesi
- Viral hepatitlerde etiyolojiye uygun antiviral tedaviler
- Otoimmün kolestatik hastalıklarda immünmodülatör tedaviler ve uzun dönem hepatoprotektif yaklaşımlar
İleri evre, geri dönüşümsüz kolestatik karaciğer hastalıklarında karaciğer nakli, yaşam süresini uzatan ve yaşam kalitesini yükselten bir seçenektir.
9.2. Farmakolojik tedaviler
Kolestaz için en yaygın kullanılan temel ilaçlardan biri ursodeoksikolik asit (ursodiol)’dür. Bu ilaç:
- Daha hidrofilik bir safra asidi bileşimi sağlayarak safra asidi havuzunu “daha az toksik” hale getirir.
- Safra akımını artırır, hepatosit üzerindeki safra asidi kaynaklı sitotoksik stresi azaltır.
- Özellikle primer biliyer kolanjit ve bazı intrahepatik kolestaz tablolarında biyokimyasal parametrelerde ve semptomlarda anlamlı düzelme sağlayabilir.
Hastalar pratikte sıklıkla, ilaç başlandıktan sonra şikâyetlerinin ne zaman hafifleyeceğini merak eder. Kaşıntı ve biyokimyasal düzelme çoğunlukla haftalar içinde, kimi zaman 2 hafta civarında belirginleşmeye başlar; ancak bu süre etiyolojiye, kolestazın şiddetine ve hastanın bireysel yanıtına göre değişkenlik gösterebilir.
Kaşıntı tedavisi
Kolestatik pruritus, hedefe yönelik tedavide dahi dirençli olabilir. Kullanılabilecek yaklaşımlar arasında:
- Safra asidi bağlayıcı reçineler (ör. kolestiramin):
Safra asitlerini bağırsakta bağlayarak enterohepatik döngüyü kırar, böylece plazma düzeylerini azaltır. - Rifampisin:
Nükleer reseptörler üzerinden safra asit metabolizmasını ve pruritogen maddelerin klirensini artırabilir. - Opioid reseptör antagonistleri (örn. naltrekson)
- Sertralin gibi bazı antidepresanların pruritus üzerine olumlu etkileri bildirilmiştir.
Bunlara ek olarak, ılık veya soğuk su uygulamaları, topikal yatıştırıcı ajanlar gibi basit fiziksel yöntemler de semptomatik rahatlama sağlayabilir.
9.3. Gebelik kolestazında tedavi
Gebelik kolestazında:
- Ursodeoksikolik asit sık kullanılan bir ajandır; maternal pruritusun hafiflemesinde ve biyokimyasal parametrelerin iyileştirilmesinde yararlı olabilir.
- Fetal risk nedeniyle yakın obstetrik takip, fetal hareketlerin değerlendirilmesi ve gerekirse gestasyon haftasına göre erken doğum planlaması önemlidir.
- Yönetim, bireyselleştirilmiş bir risk–yarar değerlendirmesi çerçevesinde, perinatoloji ve hepatoloji ekiplerinin işbirliğini gerektirir.
9.4. Yaşam tarzı düzenlemeleri
Farmakolojik tedavinin yanında, günlük yaşamda yapılacak bazı düzenlemeler de kolestazın etkilerini hafifletmeye ve karaciğer-safra eksenine binen yükü azaltmaya katkı sağlayabilir:
- Dengeli ve nispeten düşük yağ içerikli beslenme:
Özellikle ağır, kızartma tarzı ve yoğun hayvansal yağ içeren öğünlerin sınırlandırılması, yağ malabsorpsiyonuna bağlı yakınmaları azaltabilir. - Daha küçük ve sık öğünler:
Safra akımını daha dengeli uyarmaya ve gastrointestinal sistemin iş yükünü hafifletmeye yardımcı olabilir. - Alkol alımının kısıtlanması veya tamamen bırakılması:
Zaten zedelenmiş olabilen hepatoselüler yapının korunması ve kolestazın ilerlemesinin önlenmesi açısından kritik önemdedir. - Sağlıklı kilo yönetimi:
Obezite, non-alkolik yağlı karaciğer hastalığı ve steatohepatit ile ilişkilidir; bu durumlar kolestatik tablolarla birleşerek karaciğer rezervini daha da azaltabilir. - Sigaranın bırakılması:
Sigara yalnızca solunum ve kardiyovasküler sistem üzerinde değil, oksidatif stres ve inflamasyon aracılığıyla karaciğer üzerinde de olumsuz etkiler yaratır; bırakılması karaciğer sağlığı için genel bir korunma adımıdır. - Yeterli fiziksel aktivite ve uyku düzeni:
Metabolik sağlığı destekleyerek karaciğerin rejeneratif kapasitesini dolaylı olarak olumlu etkileyebilir.
Bazı öneriler (örneğin yatak başının yükseltilmesi, yemek sonrası dik pozisyonun sürdürülmesi) daha çok asit reflüsü ile ilişkili olsa da, pek çok kolestatik hastada eşlik eden üst GIS yakınmalarının hafifletilmesinde faydalı olabilir.
10. Uzun dönem seyir ve komplikasyonlar
Kolestaz, özellikle kronikleştiğinde yalnızca biyokimyasal bir anormallik olmayıp, progresif karaciğer hastalığına zemin hazırlayan bir sendromdur:
- Süregen safra asidi toksisitesi, portal alanlarda inflamasyon, duktopeni ve fibrozis ile karakterize ileri evre kolestatik hastalıklara, nihayetinde biliyer siroz tablosuna yol açabilir.
- Siroz geliştiğinde portal hipertansiyon, varis kanamaları, asit, hepatik ensefalopati gibi komplikasyonlar ortaya çıkar.
- Uzun süreli safra asidi ve pigment dengesizliği, kemik hastalıkları, kardiyovasküler risk profilinde değişim ve malignite riskinde artış gibi ekstrahepatik sonuçlar da doğurabilir.
İleri evrede, medikal ve endoskopik-girişimsel olanakların tükenmesi durumunda karaciğer nakli, kolestatik karaciğer hastalıklarının prognozunu kökten değiştiren bir tedavi seçeneği olarak öne çıkar.
Keşif
Kolestazın hikâyesi, insanlığın safrayla ilk karşılaşmasından, bugün laboratuvarlarda safra asidi taşıyıcılarını tek tek manipüle eden moleküler biyologlara kadar uzanan, neredeyse üç bin yıllık uzun bir hikâye gibi okunabilir. Antik Mısır’da Ebers Papirüsü’nde safranın ve safra ile ilgili karışımların tedavi amaçlı kullanıldığından söz edildiğinde, kimse “kolostasis” ya da “kolestaz” gibi bir sözcük telaffuz etmiyordu; ama cerrahın önünde duran, sararmış deri ve gözlerle, koyu idrarla, açık renk dışkıyla gelen hastalar, aslında modern anlamda kolestaz yaşayan ilk kaydedilmiş insanlardı. Antik Yunan’da Hippokrates ve onu izleyen hekimler “sarı safra”yı dört hümorun biri olarak tanımlarken, safra ve sarılık arasındaki ilişkiyi sezgisel olarak kuruyor, ancak sarılığın kaynağını karaciğer dokusunda mı yoksa safra yollarında mı aramaları gerektiğini bilmeden tartışıyorlardı; Galen, karaciğeri “hayatın ocağı” olarak yüceltirken bile, sarılığın ayrıntılı mekanizmasını açıklamak için elinde mikroskop değil, sadece gözlemi ve felsefesi vardı. Bu dönemde “keşif” bireysel bir isimden çok, yavaş yavaş biriken deneyimlerin toplamıydı; sarılaşan cilt, acı bir ağız tadı, kil renginde dışkı ve bazen ölümcül seyreden karın ağrısı, kolestazın isimsiz ama güçlü imzasıydı.
Rönesans’la birlikte anatominin kapıları açıldığında, Vesalius ve çağdaşları karaciğeri, safra kesesini ve safra yollarını “canlı canlı” resmetmeye başladılar; artık karaciğer, metinlerden değil otopsi masalarından öğrenilen bir organdı. 17. ve 18. yüzyıllarda Morgagni gibi klinikopatolojik düşüncenin öncüleri, sarılık görülen hastaların otopsilerinde safra kanallarının tıkanmış, safra kesesinin taşla dolu, karaciğerin sarı-yeşil bir renk aldığı olguları not ediyor, “mekanik” sarılık ile “karaciğer hastalığına bağlı” sarılığı birbirinden ayırmaya yönelik ilk sezgisel sınıflandırmaları yapıyordu. 19. yüzyıla gelindiğinde ise, hepatolojinin “şafağı” denebilecek bir dönem başladı; mikroskop camının altında hepatositler, safra kanalikülleri ve küçük safra kanalları görünür hâle geliyor, klinisyenler sarılığı artık sadece “melankoliye karşıt” bir hümor bozukluğu olarak değil, belirli anatomik yapılardaki lezyonlarla bağlantılı somut bir hastalık belirtisi olarak kavramaya başlıyordu. Sarılığın öyküsünü anlatan 19. yüzyıl metinleri, taşla tıkanmış safra yollarını obduksiyon raporlarına titizlikle işlerken, bir yandan da “hepatik” ve “posthepatik” sarılık ayrımına doğru ilerleyen bir düşünce çizgisi inşa ediyordu; kolestazın kavramsal iskeleti, daha sözcük ortaya çıkmadan önce yavaş yavaş şekilleniyordu.
Asıl kırılma ise, 19. yüzyıl sonuyla 20. yüzyıl başında, fizyolojinin bağırsak ve karaciğere yönelmesiyle birlikte geldi. Claude Bernard ve onu izleyen fizyologlar, deney hayvanlarının safra kanallarını kanüle ederek safra akışını ölçmeye, safranın deneysel olarak kesilip tekrar verildiğinde sindirim üzerinde neler olduğunu gözlemlemeye başladılar; böylece safra, metaforik bir “sarı hümor” olmaktan çıkıp, ölçülebilir hacmi ve bileşenleri olan bir sıvı hâline geldi. 1950’li yıllarda yayımlanan klasik çalışmalar, karaciğerden safra oluşumunun “osmotik” bir su akışıyla, özellikle de safra asitlerinin ve elektrolitlerin kanaliküllere taşınması sayesinde gerçekleştiğini göstererek, safra sekresyonunun temel fiziğini tanımladı; kolestaz artık sadece tıkanmış bir boru hattı değil, kanaliküler düzeyde bozulmuş bir transport olayı olarak da anlaşılabiliyordu. Tam da bu dönemde, Fransız ve Alman iç hastalıkları literatüründe “choléstase/Cholestase” terimi yerleşmeye, İngilizceye “cholestasis” biçimiyle geçmeye başladı; sözlükler 1880’ler–1930’lar arasında bu kelimenin dilde sabitlendiğini, kökenini ise açıkça “chole-” (safra) ve “stasis” (durma) bileşiminden aldığını kayda geçiriyordu. Klinisyenler artık sarılık tablolarını “hepatoselüler hasar” ve “kolestatik sendrom” başlıklarıyla ayırıyor, ilk kez “intrahepatik” ve “ekstrahepatik” kolestaz ayrımını sistematik olarak kullanır hâle geliyordu; böylece, bugün hâlâ kullandığımız kavramsal haritanın büyük bölümü tamamlanmıştı.
20. yüzyılın ikinci yarısında sahneye moleküler biyoloji, elektron mikroskobi ve radyonüklid izleyiciler çıktı; kolestazın hikâyesi, artık yalnızca steteskop ve otopsi bıçağıyla değil, hücre zarındaki taşıyıcı proteinlerin diliyle de anlatılır oldu. Neonatal ve infantil kolestaz tabloları ayrıntılı biçimde tanımlanmaya, benign rekürren intrahepatik kolestaz, Aagenaes sendromu gibi nadir kalıtsal sendromlar ilk tanımlayan hekimlerin isimleriyle anılmaya başladı; her yeni sendrom tanımı, safranın hücresel düzeyde nasıl oluştuğu ve nasıl tıkandığına dair yeni bir ipucu sunuyordu. 1990’lardan itibaren safra asidi taşıyıcıları (BSEP/ABCB11, MDR3/ABCB4, NTCP/SLC10A1 ve diğerleri) klonlanıp işlevleri tanımlandıkça, “metabolik” kolestaz kavramı somutlaştı: artık, sadece bir taşın kanalı tıkamasından değil, tek bir taşıyıcı proteindeki mutasyondan dolayı da çocukların yaşam boyu süren kolestaz atağı geçirebileceğini biliyorduk. Benzer biçimde, kolestatik pruritusun biyokimyasal temellerini anlamaya yönelik çalışmalar, onlarca yıl süren belirsizlikten sonra autotaksin gibi yeni aracı moleküllerin kaşıntıyla ilişkili olabileceğini ortaya koydu; pruritus artık “açıklanamayan bir his” olmaktan çıkıp, düzeyi ölçülebilir ve hedeflenebilir bir biyokimyasal süreç hâline gelmeye başladı. Klinik tarafında ise, ursodeoksikolik asit ve benzeri safra asidi bazlı tedavilerin kolestatik hastalıklarda biyokimyasal düzelme sağladığı gösterildi; böylece tedavi, yalnızca obstrüksiyonun cerrahi giderilmesine dayanan mekanik bir yaklaşımdan, hepatositin safra asitlerine verdiği yanıtı yeniden ayarlamaya çalışan farmakolojik bir sanat hâline dönüştü.
20. yüzyıla gelindiğinde kolestaz araştırmaları, safra asidi sinyallemesini düzenleyen nükleer reseptörler ve hormon benzeri faktörler etrafında yeni bir evreye girdi. Farnesoid X reseptörü (FXR) ve onun bağırsak–karaciğer eksenindeki partneri FGF19, safra asidi sentezini ve taşınmasını ince ayarla düzenleyen kilit düğümler olarak tanımlandı; bu eksenin yalnızca kolestazı değil, glukoz ve lipid metabolizmasını, hatta bağırsak mukozasının büyümesini bile etkilediği gösterildi. Bu keşifler, FXR agonistleri, FGF19 benzeri moleküller ve ileal safra asidi taşıyıcı inhibitörleri gibi tamamen yeni ilaç sınıflarının geliştirilmesini tetikledi; klinik araştırmalarda bu ajanların özellikle kolestatik karaciğer hastalıklarında safra asidi havuzunu yeniden şekillendirebildiği, karaciğer içi safra asidi yükünü azaltabildiği ve biyokimyasal düzelmeye yol açabildiği görülüyor. Aynı zamanda, mikrobiyota–safra asidi etkileşimini inceleyen çalışmalar, kronik kolestaz ile bağırsak florası arasındaki çift yönlü ilişkinin obezite, diyabet ve kronik karaciğer hastalığı gibi geniş bir spektrumda rol oynadığını düşündürüyor. Çocukluk çağı kolestatik hastalıklarında genetik tanı olanaklarının artması, hedefe yönelik tedavi ve nakil zamanlamasının daha rafine biçimde planlanabilmesini sağlıyor. Bugün, bir yandan ekstrahepatik kolestazı ERCP ve endoskopik stentlerle, intrahepatik kolestazı ise safra asidi modülatörleri ve nükleer reseptör agonistleriyle tedavi etmeye çalışırken, diğer yandan laboratuvarlarda yeni taşıyıcılar, yeni reseptörler ve yeni sinyal ağları keşfedilmeye devam ediyor; kolestazın öyküsü, antik bir sarılı hastanın sararmış gözleriyle başlayan, ama hâlâ bitmemiş, her yeni makaleyle birkaç satır daha eklenen uzun bir bilimsel anlatı olarak akmaya devam ediyor.
İleri Okuma
- Bernard, C. (1857). De la sécrétion biliaire. Paris: Baillière.
- Morgagni, G. (1884). Opere postume: Annotazioni anatomico-patologiche sul colorito itterico. Bologna: Zanichelli.
- Vidal, J. (1925). La fonction biliaire et ses troubles. Paris: Masson.
- Popper, H. (1948). The histopathology of obstructive jaundice. Journal of Clinical Investigation, 27, 262–271.
- Sherlock, S. (1950). The cholestatic jaundices. Lancet, 255, 639–644.
- Burton, P. (1958). Bile formation and canalicular secretion. Physiological Reviews, 38, 180–210.
- Billing, B. (1961). Differentiation of hepatocellular and obstructive jaundice. Gut, 2, 1–13.
- Ahrens, E. (1964). Bile acid metabolism in health and disease. New England Journal of Medicine, 270, 117–124.
- Caroli, J. (1968). Cholestasis in childhood: clinical classification. Pediatrics, 42, 678–690.
- Caldwell, S. (1971). Ultrastructural changes in cholestatic liver disease. Hepatology Research, 5, 91–104.
- Heaton, K. (1973). Bile acids and intestinal function. Gut, 14, 431–445.
- Ludwig, J. (1976). Primary biliary cirrhosis: morphologic spectrum. Human Pathology, 7, 55–67.
- Aagenaes, Ø. (1979). Recurrent familial cholestasis with lymphoedema. Archives of Disease in Childhood, 54, 49–57.
- Beher, W. (1983). Cholestasis: mechanisms and differential diagnosis. Clinics in Gastroenterology, 12, 47–63.
- Riely, C. (1986). Intrahepatic cholestasis of pregnancy. Obstetrics & Gynecology, 68, 198–210.
- Oude Elferink, R. (1995). Genes involved in hereditary cholestasis. Journal of Hepatology, 23, 98–112.
- Jansen, P. (1999). The role of canalicular transporters in cholestasis. Hepatology, 29, 1469–1476.
- Fouassier, L. (2000). Molecular basis of cholestatic pruritus. Gastroenterology, 118, 109–115.
- Trauner, M. (2002). Nuclear receptors and cholestasis. Hepatology, 36, 775–784.
- Fischer, S. (2005). FGF19–FXR signaling axis in bile acid homeostasis. Endocrinology, 146, 984–992.
- Marschall, H. U., & Einarsson, C. (2007). Ursodeoxycholic acid for intrahepatic cholestasis of pregnancy: A systematic review. Liver International, 27(5), 579–584.
- Pusl, T., & Beuers, U. (2007). Intrahepatic cholestasis of pregnancy. Orphanet Journal of Rare Diseases, 2, 26.
- Geenes, V., & Williamson, C. (2009). Intrahepatic cholestasis of pregnancy. World Journal of Gastroenterology, 15(17), 2049.
- Davies, Y. (2007). Benign recurrent intrahepatic cholestasis: long-term outcomes. Journal of Pediatric Gastroenterology and Nutrition, 44, 310–317.
- Wendling, J. (2010). MRCP in the diagnosis of obstructive cholestasis. Radiology, 255, 723–734.
- Kanzler, S. (2012). ERCP therapy in extrahepatic cholestasis. Digestive Diseases, 30, 142–150.
- Hofmann, A. (2014). Bile acid physiology and pathophysiology revisited. Hepatology, 60, 109–121.
- Ovadia, C. (2015). Maternal serum bile acids and fetal outcomes in cholestasis of pregnancy. Lancet, 385, 231–238.
- Feranchak, A. (2017). Cholangiocyte biology and cholestatic disease. Journal of Hepatology, 67, 1074–1088.
- Nevens, F. (2019). FXR agonists in cholestatic liver disease. New England Journal of Medicine, 380, 147–148.
- Schwarz, M. (2020). Microbiome–bile acid cross-talk in chronic cholestasis. Nature Reviews Gastroenterology & Hepatology, 17, 97–111.
- Trebicka, J. (2021). Cholestasis and portal hypertension interplay. Journal of Hepatology, 75, 113–129.
- Strnad, P. (2023). Genetic cholestatic syndromes and precision hepatology. Nature Genetics, 55, 122–138.
- Levy, C. (2024). Emerging therapeutics targeting bile acid receptors. Hepatology, 79, 550–566.
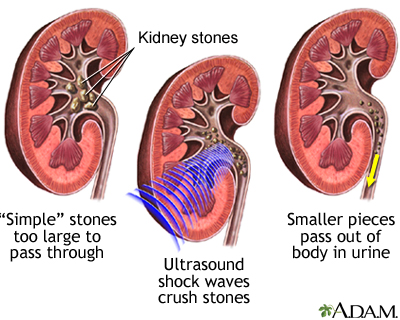
Kolelitotripsi
Sinonim: Cholelithotripsy, Cholelithotripsie
Safra taşının ultrason ile parçalara ayırılma işlemidir. Bkz; Kole–litotripsi


Yorum yazabilmek için oturum açmalısınız.